苯酞类化合物重排反应的研究-3-位烷基取代苯酞的重排反应
+++有机化学重排反应-总结
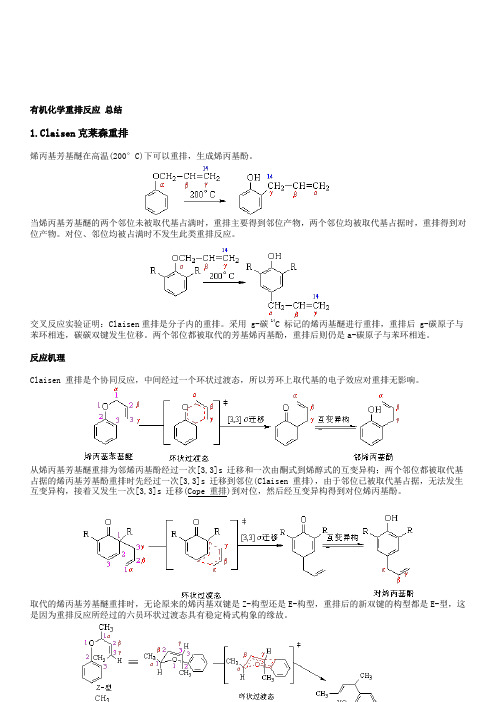
有机化学重排反应总结1.Claisen克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用 g-碳 14C 标记的烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
反应实例Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
2.Beckmann贝克曼重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例3.Bamberger,E.重排苯基羟胺(N-羟基苯胺)和稀硫酸一起加热发生重排成对-氨基苯酚:在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基(或甲氧基)苯胺:其他芳基羟胺,它的环上的o-p位上未被取代者会起类似的重排。
苯酞可研报告

苯酞可研报告1. 引言苯酞可(化学式:C13H10O3)是一种有机化合物,分子中含有苯环和酞环,是一种深红色结晶固体。
苯酞可在化工、制药、染料等行业具有广泛的应用前景。
本报告将从分子结构、制备方法、应用领域等方面对苯酞可进行研究和探讨。
2. 分子结构苯酞可的分子结构由一个苯环和一个酞环组成。
苯环是由六个碳原子和六个氢原子组成的环状结构,而酞环则是由一个苯环和三个氧原子组成的结构。
这种特殊的分子结构使得苯酞可具有一些独特的化学性质和应用特点。
3. 制备方法3.1 方法一苯酞可的制备方法一是通过苯酚和酞酸之间的酯化反应得到。
具体步骤如下:1.将苯酚和酞酸按一定的摩尔比例混合;2.加入酯化剂(如硫酸)进行酯化反应;3.反应结束后,通过蒸馏、结晶等工艺步骤,得到苯酞可产物。
3.2 方法二方法二是通过苯酚和苯酞之间的氧化反应得到苯酞可。
具体步骤如下:1.将苯酚和苯酞按一定的摩尔比例混合;2.加入氧化剂(如过氧化氢)进行氧化反应;3.反应结束后,通过过滤、洗涤等工艺步骤,得到苯酞可产物。
4. 应用领域苯酞可在许多领域具有广泛的应用。
以下列举了几个主要的应用领域:4.1 染料苯酞可作为一种合成染料,广泛应用于纺织、印刷等行业。
其深红色的颜色稳定性良好,能够在纤维上具有良好的染色效果。
4.2 制药苯酞可也被应用于制药领域,用于合成某些药物的中间体。
其特殊的分子结构和化学性质使其在药物合成过程中具有一定的优势。
4.3 化工苯酞可在化工领域具有一定的应用价值。
它可以作为反应媒介或催化剂的配体,参与到一些有机合成反应中,促进化学反应的进行。
4.4 光电子学由于苯酞可具有较好的光学性质,如吸收光谱范围广、荧光发射强度高等特点,使其在光电子学领域具有一定的应用潜力。
5. 结论苯酞可是一种具有广泛应用前景的有机化合物。
它的分子结构独特,制备方法多样,应用领域广泛。
未来随着科技的进步和需求的增长,苯酞可的应用前景将进一步拓展,为相关行业带来更多的发展机遇。
有机化合物的重排反应官能团位置的重排变化

有机化合物的重排反应官能团位置的重排变化有机化合物的重排反应是有机化学中一种重要的变化方式,通过此种反应,官能团的位置可被重新排列。
这种重排的变化可以在不改变分子中原子的相对位置的情况下,改变官能团的位置。
在本文中,我们将探讨有机化合物的重排反应及官能团位置的重排变化。
一、重排反应的概述重排反应是指有机分子中的官能团或官能团中的基团,通过化学反应,改变它们在分子结构中的位置,从而得到新的有机化合物的过程。
重排反应可以是热力学或动力学控制下进行的。
热力学控制下的重排反应是指使化合物能量最低的路径,而动力学控制下的重排反应则是指在较高的能垒下形成的反应产物。
重排反应的种类繁多,包括烷基迁移、炔基迁移、脱氢重排等等。
其中,官能团位置的重排变化是一种常见的重排反应,下面将详细探讨官能团位置的重排变化的相关内容。
二、官能团位置的重排变化1. 羟基重排羟基重排是指分子中的羟基官能团发生位置变化的重排反应。
例如,1-丙醇在酸性条件下可以发生重排反应,生成丙醇的异构体2-丙醇。
这种重排反应常见于糖类化合物的代谢过程中,也是一种常见的有机化学反应。
2. 酮基重排酮基重排是指分子中的酮基官能团发生位置变化的重排反应。
例如,2-戊酮在碱性条件下可以发生重排反应,生成3-戊酮。
这种重排反应常见于β-酮酸的合成中,也是一种常见的有机化学反应。
3. 醇醚重排醇醚重排是指分子中的醇醚官能团发生位置变化的重排反应。
例如,1-甲醇醚可以经过重排反应生成2-甲醇醚。
这种重排反应常见于醇醚的合成中,也是一种常见的有机化学反应。
4. 羰基重排羰基重排是指分子中的羰基官能团发生位置变化的重排反应。
例如,γ-巴胺酸在酸性条件下可以发生重排反应,生成δ-巴胺酸。
这种重排反应常见于氨基酸的合成中,也是一种常见的有机化学反应。
三、重排反应的应用和意义重排反应在许多领域都有着广泛的应用和意义。
首先,通过重排反应可以合成出一些在天然产物中难以获得的有机化合物,从而为有机合成提供了新的途径。
有机化学中的重排反应

有机化学中的重排反应重排反应是有机化学中常见的一类反应,并且在有机合成、药物合成和天然产物合成等领域中应用广泛。
重排反应是指由于分子内部的原子或基团的重新排列,导致化合物结构发生变化的反应。
本文将介绍几种有机化学中常见的重排反应及其应用。
一、烷基重排反应烷基重排反应是指有机化合物中烷基的重新排列反应。
最常见的烷基重排反应是烷基氢转位反应。
该反应可以通过催化剂的作用,将烷基的氢原子迁移到相邻碳原子上,从而形成新的骨架结构。
烷基重排反应在有机合成中具有重要的地位,可用于合成具有特定结构的有机化合物,如烷基甲基化合物和烷基化合物等。
二、羟基重排反应羟基重排反应是指有机化合物中羟基的重排反应。
最典型的羟基重排反应是震荡重排反应和羟基迁移反应。
震荡重排反应是指在酸催化下,醇分子内部羟基的氢原子通过替代反应发生迁移,形成醚化合物或碳碳双键等。
羟基迁移反应是指在酸催化下,醇分子中的羟基通过迁移反应,形成酯、醚或醛等产物。
羟基重排反应在有机合成中也具有广泛的应用,可用于制备具有特定功能团的有机化合物。
三、碳原子重排反应碳原子重排反应是指有机化合物中碳原子的重新排列反应。
最常见的碳原子重排反应是氧杂环分子中的羟基或氧原子的转位反应。
该反应通过酸或碱作用,将羟基或氧原子从一个位置迁移到另一个位置,从而形成新的环境。
碳原子重排反应在天然产物的合成和药物合成中具有重要作用,可用于合成具有特定生物活性的化合物。
四、杂环重排反应杂环重排反应是指含有杂环结构的有机化合物中原子或基团的重新排列反应。
最常见的杂环重排反应是氮杂环中的原子或基团转位反应。
该反应可以通过温度和催化剂的作用,将氮杂环中的原子或基团重新排列,从而形成新的杂环结构或环外结构。
杂环重排反应在有机合成中也具有广泛应用,可用于制备具有特定杂环结构的化合物。
综上所述,有机化学中的重排反应是一类重要的反应类型。
烷基重排反应、羟基重排反应、碳原子重排反应和杂环重排反应是其中常见的几种类型。
关于苯酞类的文献综述

文献综述3-烃基苯酞类成分的研究进展专业年级07应用化学学院环生学院学生姓名胡艳学号2007124135 指导教师汪程远职称博士日期2011年3月3日3-烃基苯酞类成分的研究进展摘要:苯酞(Phthalide)类小分子化合物广泛存在于传统中药及天然植物中,并且很多具有很好的生理活性,是一种极具开发价值的化合物。
特别是3-烃基苯酞类成分,其典型代表是3-正丁基苯酞( 3-n-butylphthalide , 简称丁苯酞或记NBP),又名芹菜甲素,其结构见(I),是芹菜及其籽中的主要有效成分,在当归、川芎、藁本、茶芎等活血中药中也大量存在。
以下是对一些特别的苯酞类化合物的化学成分、来源、药理成分及其产品的应用作的一些概括。
关键词:苯酞,丁苯酞,化学成分,来源,药理,产品应用;1.化学成分苯酞类成分(Phthalides)是指具有苯酞母核的结构的一类化合物,又系内酯类化合物。
苯酞类成分大致分为三类——简单苯酞类、烃基苯酞类、二聚苯酞类简单苯酞类:油状物,个别为晶状,熔点较低【1】;烃基苯酞类:油状物,少数有晶形【2-3】,如C12H12+2n O3(n=0,1,2);二聚苯酞类:结晶性,多为藁本内酯的二聚物;3-丁烯基苯酞是从当归等药用植物中分离得到的化合物,系苯酞类似物,具有五元环内酯结构。
3-丁烯基苯酚及其类似物3-乙烯基苯酞、3-丙烯基苯酞、3-异丁烯基苯酞和3-正丁基苯酞对动物气管平滑肌均具有显著的松弛作用,3-丁烯基苯酞的带羟基的类似物也有明显的生物活性【17】。
由于在现实生活中合成分离得到丁苯酞较其它3-烃基苯酞容易,故我们接触到3-正丁基苯酞(丁苯酞)较为常见一些。
3-正丁基苯酞(丁苯酞)与藁本内酯的理化性质较相似【4】,稳定性也比较差,特别是在室温下放置极易发生异构化。
丁苯酞和藁本内酯(Ligustilide)一典型代表3-烃基苯酞[结构见(II)]结构相似,,3-烃基苯酞是当归、川芎等两种传统活血中药的主要指标成分,其含量高达1%以上。
有机化学基础知识芳香化合物的重排反应和异构化反应

有机化学基础知识芳香化合物的重排反应和异构化反应有机化学基础知识之芳香化合物的重排反应和异构化反应芳香化合物是有机化学中重要的一类化合物,具有独特的芳香香味和稳定的分子结构。
在有机合成和药物研发领域,芳香化合物的合成和转化是非常重要的。
本文将讨论芳香化合物的重排反应和异构化反应,以及它们在有机合成中的应用。
一、芳香化合物的重排反应1. 环移重排反应环移重排反应是芳香环上原子或基团的重新排列,形成新的芳香环的反应。
主要有酚的甲基或烷基的Meisenheimer重排反应、羧酸的重排反应、苯酚的Claisen重排反应等。
例如,酚的甲基重排反应如下:[化学反应方程式]2. 氢迁移重排反应氢迁移重排反应是芳香环中氢原子或基团的迁移,生成新的芳香化合物的反应。
常见的有1,2-氢迁移、1,3-氢迁移和1,4-氢迁移等。
例如,1,2-氢迁移重排反应如下:[化学反应方程式]二、芳香化合物的异构化反应芳香化合物的异构化反应是指同一分子内芳香环中原子或基团的位置改变,形成不同结构的芳香化合物。
1. 互变异构反应互变异构反应是在特定条件下,同一个分子内两个相邻的芳香环中的原子或基团进行位置交换,形成异构体的反应。
例如,酚醛的互变异构反应如下:[化学反应方程式]2. 氢化异构反应氢化异构反应是芳香环中芳香基与氢气反应,发生氢化和异构化的反应。
例如,苯的氢化异构反应如下:[化学反应方程式]三、重排反应和异构化反应的应用1. 药物合成重排反应和异构化反应在药物合成中具有重要的应用价值。
通过利用这些反应,可以合成具有特定药效的化合物,并提高合成效率。
2. 功能材料合成重排反应和异构化反应在功能材料合成方面也起着关键作用。
通过合理设计反应路径,可以合成具有特定功能的材料,如光电材料、催化剂等。
3. 天然产物合成许多天然产物的结构复杂且具有重要的药理活性。
利用重排反应和异构化反应,可以模拟天然产物的合成路径,从而合成具有类似活性的人工合成天然产物。
有机化学重排反应,总结

有机化学重排反应,总结有机化学重排反应总结1.Claisen克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用g-碳14C 标记的烯丙基醚进行重排,重排后g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
反应实例Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
2.Beckmann贝克曼重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例3.Bamberger,E.重排苯基羟胺(N-羟基苯胺)和稀硫酸一起加热发生重排成对-氨基苯酚:在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基(或甲氧基)苯胺:其他芳基羟胺,它的环上的o-p位上未被取代者会起类似的重排。
丹参-川穹药对代谢研究进展

丹参-川穹药对代谢研究进展摘要在中医方面,丹参益于心脏及肝脏,能够清心、凉血,保护机体心血管,增强机体抵抗力,改善脏器的微循环,促进细胞再生功能;川穹能够活血化瘀,防辐射、抗病菌、镇静、镇痛。
综上所述,两者结合在一起可治疗及预防多种疾病。
丹参与川穹是两味药材,两种药材结合在一起有活血化瘀,保护机体的心血管,降血脂,镇静镇痛等作用。
本文主要总结了丹参与川穹药的药理作用,归纳了相关人员在丹参川穹药对于代谢的影响方面的研究资料,做以下综述。
关键词:川穹;丹参;药理;代谢1 绪论1.1选题意义/背景及目的丹参(英文名称SalviamiltiorrhizaBunge),在我们国家,是传统中草药中使用最为广泛的一种药材。
其能够推动血液循环。
让气虚得到缓解,能够用于制剂的生产中,可以对心脑血管的疾病起到治疗的作用。
丹参酮不仅具备安神养心,止痛祛瘀,平静神经和活血化瘀的功效,最近几年,深入研究还发现其新的药理作用,包括抗肿瘤,对心脑血管的疾病进行治疗,抗炎,抗菌及抗氧化等功能,所以,丹参应用前景尤其广阔。
现阶段,已经有大量科学报道是关于提取丹参内脂溶性的成分,也就是分离丹参酮类制备的方法,不过使用不同的方法进行制备分离,让其丹参酮的物质在纯度和质量方面层次不齐。
川芎嗪(英文名称tetramethylpyrazine,英文简写TMP,也叫作天然的四甲基吡嗪),属于川芎药材内主要的成分,其功能较多,包括祛瘀活血,器官缺血,抗心肌,降血压以及扩张血管等。
最近几年,许多报道指出川芎嗪能够让肿瘤细胞抑制增殖,推动癌细胞的凋亡,让化疗的效果增强,并且可以让多耐药逆转。
再者川芎嗪从川芎内提出,属于生物碱,也就是四甲基吡嗪。
这个药物作用广泛,包括抗纤维化,拮抗钙离子,抗氧化,让微循环改善,抗血栓的形成,使小动脉扩张,抗血小板的凝聚及活血化瘀的作用等,现阶段治疗中,以各类血管性的疾病治疗为主。
1.2国内外研究现状分析丹参(tiorrhizaBunge)也可以叫做大红袍,红根及血参等,是多年生的唇形科(英文名称Lamiaceae)的鼠尾草属的植物,在2023年时学者王辉等提出,产地以河北省,山东,四川,安徽,浙江及江苏省等为主[1]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
打开形成碳正离子[A],然后进行氢迁移形成8一碳 正离子[B],[B]向苯环亲电进攻环台得到产物1b。 为了进一步探明该反应的历程,研究重排规律。 我们设计了3一位取代基为不同碳数的直链烷烃, 支链烷烃,环烷烃和螺环取代的苯酞,以三氯化铝催
经m,脚,1H
NMR,13C
NMR,DEPT谱确证所得产物
为l一甲基一5一羧基四氢萘(1b)。从反应结果分 析,苯酞在此反应中已发生了重排,推测可能的反应 历程为,3一正丁基苯酞在三氯化铝作用下,内酯环
Stlldy伽the Rea唧IIlg咖蚰t R船c廿叫of Phthalid嚣一 The R鼢rr锄geⅡlent Ikac矗on of 3一灿时lphtllaHd鹤 ⅫB丑i—U119,PANG
SIl—Hua,GUO zong—Ru+,UANG Xia0一TiaIl
(础妇∥砌莉朋如础,佩妇eA以哪矿胁也耐&妇蹦删船岖肼咖肘删僦砾,J凸伽聊昭)
万 方数据
郭宗儒等
C№e鸵m】n试0fO增砌c
C岫时
775
电反应关环得8b。推测其可能的反应历程如
大,难以稳定存在的缘故。
Sch∞e 2所示:1’一甲基一3一正丙基苯酞在三氯
化铝作用下,C—O键断裂,形成a一碳正离子[c], 经连续1,2一氢迁移形成7一仲碳正离子[E],然后 再经l。2一氢迁移和1,2一烷基迁移形成更稳定的 7一叔碳正离子[G],向苯环亲电进攻环合得化合物
cll
methyl
胁s
weIe
iⅡadiated.
H12 02,计算值:c,74.98;H,6.86。实测值:
2b,白色固体,产率77.8%,m.p.93—95℃。 c1出16Q,计算值:c,76.44;H,7.90。实测值:c,
76.60;H,8.05。h:O 94(3H,t,J=7.2m,cH3),
(1H,dd,Jl=7.5比,止=1.2}Iz,m一心),7.81
(1H,dd,,1_7.5№,如=I.2也,Ar一心)08c: 19.8(t),23.2(q),28.3(t),30.3(t),33.O(d),125.2 (d),128.9(s),129.O(d),133.3(d),139.6(s).143.6 (8),174.1(s)。m/=:190(M+,loo),175(M—CH3, 78),172(M一心O,30),157(M—cH3一H20,40), 145(M—COOH,72)。NOE:AⅡeIlll且ncemellt
776
有机化学
vol
20.2000
结果如下:
l
Ci3H1602,计算值:c,76.44;H,7.90。实测值:c, 76,64;H,7.80。h:1.09(3H,d,,=6.O也,CH3), 1.30(3H,2d,,=6.O№,AIcHCH3),l,52一1.90(3H,
m,CH,CH2),2.40一2.77(1H,m,AIcH),2.86~3.51 (2H,m,ArCH2),7.12—7.48(2H,m,ArH),7.85(1H,
表1
T幽.1
No
3一取代苯酞产物的结构 PhtIlalide8且nd山e produ山
4
ne
2
subsⅡat鹧of 3一sllbsdtLIted
3
l
反
应 物
(a)
礴O 磷幽l 礴一¨
9
o
O
∥ 搜抄 莳
O 0 O
…
5
6
产
物 (b)
狰
≮/上、cooH
地醍 “醍 投… 砭。 晟
O
辞 文
CooH
7 oN 8 9 1011 12 反
c,75.05;H,7.01。占H:1.32(3H,d,J=7.2比, cH3),1.7l,2.73(2H,two m。cH2),3.30(3H,m, ArCH,ArcH2),7.24(1H,t,J1=7.2Hz,Ar一心)。
1.54(6H,m,cH2),2.70(1H,m,ArcH),3.10(2H,m, AIcH2),7.12(1H,t,^=7.2 Hz,Ar—H7),7,35(1H,
in‘em畸0f AI’一H8
w鹊obBeⅣed when t}Ie of山e
pIo一
7.2也,血~H3),7.48(1H,dd,Jl=7.211z,J2=1.8
m,时~H4),7.84(1H,dd,,1-7.2比,如=1.8}Iz, Ar—H2)。m儿:216(M+,70),180(100)。 7b,白色固体,产率59.3%,m.p.119一120℃。
应
物
(n)
婶 0 。 O崂 心≯罴>厂岛凡 ∞q地 心f
O 0
产 菸
物
(b)
№e:髓and蛐m妇8aIne∞删
1结果与讨论
文… 硬咖。 蔽㈣。
孵
。 。 O
嘏
分子图形学研究表明:6b中,Ha和Hc的两面
3一位取代基结构对重排反应的影响 当3一位取代基为直链或支链烷烃且碳原子数 n≥4时1a一5a,发生氢迁移形成a一碳正离子,进 而向苯环发生亲电取代反应,环合得到取代的四氢 萘化合物1b一5b。 当3一位取代基为正丙基(7a),即碳原子数n= 3时,氢迁移形成8一末端碳正离子不稳定,则氢迁 移形成较稳定的7一碳正离子向苯环进攻、环合得 到l一甲基一4一羧基二氢茚(7b)。 3一环己基苯酞反应30 h得一稠环化合物。可 能形成8一碳正离子向苯环亲电进攻而得化合物 6b,也可能形成7一碳正离子向苯环亲电进攻得化 合物6c。本文从ArCH2中两个氢的偶合常数与两 面角(电h一№,电|b—Hc)的关系中确定为6b。
2肿。年第20卷 第5期∞一甘O口ic凸cllll日町
v01.20.2000 No 5.773~7_玎
研究论文・
苯酞类化合物重排反应的研究一3一位烷基取代苯酞的重排反应
徐柏玲 庞素华 郭宗儒+ 梁晓天
(中国医学科学院、协和医科大学药物研究所北京100050) 摘要发现了3一正丁基苯酞在三氯化铝作用下进行重排反应生成1一甲基一5一羧基四氢萘,并提出了氢迁移的重排反 应机制。研究了3一位不同烷基取代的苯酞类化合物在三氯化铝作用下的重排反应。在重排过程中,既有氢迁移,也会有烷 基迁移,这取决于形成的碳正离子的稳定性。 关键词苯酞类化合物,三氧化铝,重排反应,氢迁移
2.2
3一位取代苯酞化台物的重排反应—化合物 以l一甲基一5一羧基四氢萘(1b)的合成为例:
将取代苯酞(1.0
lO
g,5,3
HM0le)溶于2 mL二硫化碳
g,16 mmole)的
中,滴加到冰浴搅拌的三氯化铝(2.1
rnL二硫化碳悬浮液中,反应液为棕色。加毕,室
温放置24 h,倾人到20 g冰和40Ⅱ儿5%的稀盐酸混 合物中并搅拌,冰溶解后,分出二硫化碳层,水层用 乙醚萃取三次,合并有机相,水洗,饱和食盐水洗,无 水硫酸钠干燥。浓缩得黄色固体,用石油醚重结晶 或vLc分离(石油醚/乙酸乙酯洗脱)得产物。实验
d,J=8.0
b,白色固体,产率88%,m,p.136~137℃。
c12H14 02,计算值:c,75.76;H,7.42。实测值:c,
7
5.75;H,7.51。占H:1.3(3H,d,J=7.2m,CH3), 1.60,1.80(2H,twom,c2一CH2),1.95(2H,m,岛一
CH2),3.02(1H,m,Ar—cH),3.12,3.”(2H.two
叫
、
∥一避泌婕
ScheIm
2
I』quid‰吡掣aphy,简称Ⅵ上)。m,1H
1b一12b的合成
NMR,培c
NMR(占,CDa3,,/}王z),MS(m/:)。
3,3一二乙基苯酞(9a)烷基侧链不能形成可环 合的稳定的碳正离子,预想9a可能发生l,2一氢迁 移形成8一碳正离子得重排产物9c,但是却得到了 重排产物9b。推测由9a重排生成9b的过程中,也 发生了类似8a的重排历程,经连续多步的氢迁移和 烷基迁移,形成7一叔碳正离子后,环合得9b。 3~乙基、3,3一螺戊基和3,3一螺己基苯酞 (10a—12a)均发生氢迁移形成B一碳正离子,得扩环 产物一即异香豆素类化合物10b~12b,其中 1lb和12b的收率很低,大部分为回收原料(11a, 61.5%,12a,45.O%)。我们未能分到重排环合产物 nc和12c。这可能是由于化合物11c和12c的张力 万 方数据
Abs咖ct
A
reaⅡ锄学锄咖t
reac廿锄0f 3一bu聊pht}Ialide
to
l—InetlIyl一5一ca出。叫1一tetrahyd】:D naph血alene
un—
der dle catalysis ofAIa3 by
eit}埘b幽de t工甜妇0I aIkyl_【Ian《er w叫ld tak8
m,
m,ArH)。m/z:204(M+,100),189(M—
Ar—CH2),7.20(1H,t,Jl=7.5也,Ar—H7),7.37
c屿,80),171(M—CH3一H20,90),159(M— C00H,70),145(M—C00H—CH2,40)。 6b,白色固体,产率9.1%,m.p.172~174℃。 占H:1.35~2.04(9H,m,4cH2,cH),2.62(1H,m, mcH),3.01~3.34(2H,m,mcH2),7.18(1H,t,J=
化进行反应,分别得到了重排产物一取代的四氢萘,
二氢茚或异香豆素类化合物(T曲.1)。
峨一心一@一提。
1b
Sche“le
l
_R蒯ved 2000一04—05;胁sd
万 方数据
2000—05—29;Accepfed 2000—06—12
国家自然科学基金(批准号:29572086)。
