chapter1_原子的位形
合集下载
新教材高中化学 第一章 原子结构与性质 第1节 原子结构(第3课时)课件 新人教版选择性必修2

。 2.提示:A。B中电子排布不符合洪特规则,即电子排布在同一能 级的不同轨道时,总是优先单独占据一个轨道,而且自旋状态相同。 3.提示:(1)错误,违反了洪特规则。 (2)错误,违反了泡利原理。
新知预习
一、电子云与原子轨道 1.电子云 (1)概念:电子云是处于一定空间运动状态的电子在原子核外空间的 ____概__率__密__度______ 分 布 的 形 象 化 描 述 。 小 黑 点 越 密 , 表 示 概 率 密 度 _____越__大_____。由于核外电子的概率密度分布看起来像一片云雾,因而 被形象地称为_____电__子__云_____。
4.下面关于硅原子的核外电子排布表示式中,错误的是 ( C ) A.1s22s22p63s23p2 B.[Ne]3s23p2
C.
D. 解析:A和B两项都是电子排布式,C和D两项都是电子排布图,其 中C项违背了洪特规则。
5.下面是s能级、p能级的原子轨道图,试回答问题:
(1)s电子的原子轨道呈_____球_____形,每个s能级有_____1____个原 子轨道;p电子的原子轨道分别相对于x、y、z轴_____对__称_____,每个p 能级有_____3____个原子轨道。
倍”,支撑这一结论的理论是
( B)
A.能量最低原理
B.泡利不相容原理
C.洪特规则
D.能量最低原理和泡利不相容原理
解析:根据泡利不相容原理,每个原子轨道上最多只能容纳两个自 旋状态相反的电子,因此各电子层最多容纳该电子层原子轨道数目二倍 的电子;洪特规则是电子在能量相同轨道排布时尽可能分占不同轨道且 自旋状态相同;能量最低原理是指电子总是先占据能量低的轨道,再依 次进入能量高的轨道。
核心素养
新课情境呈现 课前素能奠基 课堂素能探究 名师博客呈现 课堂达标验收
新知预习
一、电子云与原子轨道 1.电子云 (1)概念:电子云是处于一定空间运动状态的电子在原子核外空间的 ____概__率__密__度______ 分 布 的 形 象 化 描 述 。 小 黑 点 越 密 , 表 示 概 率 密 度 _____越__大_____。由于核外电子的概率密度分布看起来像一片云雾,因而 被形象地称为_____电__子__云_____。
4.下面关于硅原子的核外电子排布表示式中,错误的是 ( C ) A.1s22s22p63s23p2 B.[Ne]3s23p2
C.
D. 解析:A和B两项都是电子排布式,C和D两项都是电子排布图,其 中C项违背了洪特规则。
5.下面是s能级、p能级的原子轨道图,试回答问题:
(1)s电子的原子轨道呈_____球_____形,每个s能级有_____1____个原 子轨道;p电子的原子轨道分别相对于x、y、z轴_____对__称_____,每个p 能级有_____3____个原子轨道。
倍”,支撑这一结论的理论是
( B)
A.能量最低原理
B.泡利不相容原理
C.洪特规则
D.能量最低原理和泡利不相容原理
解析:根据泡利不相容原理,每个原子轨道上最多只能容纳两个自 旋状态相反的电子,因此各电子层最多容纳该电子层原子轨道数目二倍 的电子;洪特规则是电子在能量相同轨道排布时尽可能分占不同轨道且 自旋状态相同;能量最低原理是指电子总是先占据能量低的轨道,再依 次进入能量高的轨道。
核心素养
新课情境呈现 课前素能奠基 课堂素能探究 名师博客呈现 课堂达标验收
第一章 原子的结构与键合
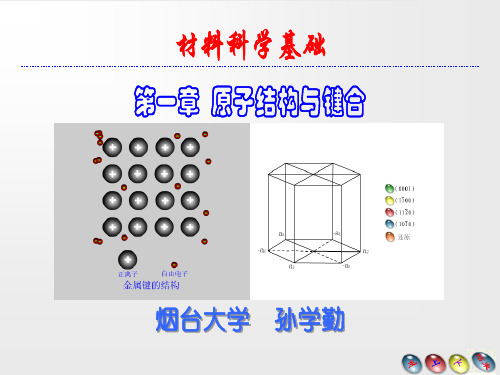
由于金属键即无饱和性又无方向
性,因而每个原子有可能同更多
的原子结合,并趋于形成低能量 的密堆结构,当金属受力变形而 改变原子之间的相互位置时不至 于破坏金属键,这就使金属具有 良好的延展性。
金属变形时,由金属键结 合的原子可变换相对位置
(3)金属键型晶体的特征
良好的导电、导热性: 自由电子定向运动(在电场作用下)导电、(在热场作 用下)导热。 正的电阻温度系数: 金属正离子随温度的升高,振幅增大,阻碍自由电子的 定向运动,从而使电阻升高。 不透明,有光泽: 自由电子容易吸收可见光,使金属不透明。自由电子吸 收可见光后由低能轨道跳到高能轨道,当其从高能轨道跳回 低能轨道时,将吸收的可见光能量辐射出来,产生金属光泽。 具有延展性: 金属键没有方向性和饱和性,所以当金属的两部分发生 相对位移时,其结合键不会被破坏,从而具有延展性。
B Al Ga In Tl
C Si Ge Sn Pb
N P As Sb Bi
O S Se Te Po
F Cl B r I At
Sc Y La Ac
Ti Zr Hf Rf
V Nb Ta Db
Cr Mo W Sg
Mn Tc Re Bh
Fe Ru Os Hs
Co Rh Ir Mt
Ni Pd Pt Uun
Cu Ag Au Uuu
范德瓦尔斯键没有方向性和饱和性。 比化学键的键能少1~2个数量级。
图
分子键
静电力:极性分子—极性分子 诱导力:极性分子—非极性分子 色散力:非极性分子—非极性分子
物质性质特点:强度、硬度、熔点、密度较低,热膨胀系 数大。
它是一种特殊的分子间作用力,表达为:X—H—Y。它是由氢
左图 NaCl离子晶体 上图 离子键材料导电性
性,因而每个原子有可能同更多
的原子结合,并趋于形成低能量 的密堆结构,当金属受力变形而 改变原子之间的相互位置时不至 于破坏金属键,这就使金属具有 良好的延展性。
金属变形时,由金属键结 合的原子可变换相对位置
(3)金属键型晶体的特征
良好的导电、导热性: 自由电子定向运动(在电场作用下)导电、(在热场作 用下)导热。 正的电阻温度系数: 金属正离子随温度的升高,振幅增大,阻碍自由电子的 定向运动,从而使电阻升高。 不透明,有光泽: 自由电子容易吸收可见光,使金属不透明。自由电子吸 收可见光后由低能轨道跳到高能轨道,当其从高能轨道跳回 低能轨道时,将吸收的可见光能量辐射出来,产生金属光泽。 具有延展性: 金属键没有方向性和饱和性,所以当金属的两部分发生 相对位移时,其结合键不会被破坏,从而具有延展性。
B Al Ga In Tl
C Si Ge Sn Pb
N P As Sb Bi
O S Se Te Po
F Cl B r I At
Sc Y La Ac
Ti Zr Hf Rf
V Nb Ta Db
Cr Mo W Sg
Mn Tc Re Bh
Fe Ru Os Hs
Co Rh Ir Mt
Ni Pd Pt Uun
Cu Ag Au Uuu
范德瓦尔斯键没有方向性和饱和性。 比化学键的键能少1~2个数量级。
图
分子键
静电力:极性分子—极性分子 诱导力:极性分子—非极性分子 色散力:非极性分子—非极性分子
物质性质特点:强度、硬度、熔点、密度较低,热膨胀系 数大。
它是一种特殊的分子间作用力,表达为:X—H—Y。它是由氢
左图 NaCl离子晶体 上图 离子键材料导电性
chapter1原子结构与结合键

1.2.3 共价键 Covalent bonding
原子间通过共用电子对形成的化学键
IIIA-VIIA同族元素和电负性相差不大的元素结合
钻石晶体及其结构
特点:材料强度高,熔点高,脆性大。其导电性取决于共 价键的强弱,弱共价键的Sn是导体,Si是半导体,金刚石 就是绝缘体。
PROPERTIES FROM BONDING: TM
• Melting Temperature, Tm
Tm is larger if Eo is larger.
• Elastic modulus, E
Elastic modulus
F L =E Ao Lo
• E ~ curvature at ro
刚球模型(hard sphere model):原子认定为具有
一定直径的固态球,并同最临近的原子相接触。
atomic packing
1.1.5 电负性 Electronegativity of Atoms
影响原子间结合的定量化的物理量
1932年,莱纳斯· 鲍林(Linus Pauling)综合考虑了电离能 和电子亲合能提出“电负性”的概念,它以一组数值的相对 大小表示原子在分子中对成键电子的吸引能力,称为相对电 负性,简称电负性。 “电负性”代表原子获得电子的能力,这种电子是其元素原 子自身以外的电子,而这种能力决定于原gth ro
r
E is larger if Eo is larger.
smaller Elastic Modulus
larger Elastic Modulus
16
• Coefficient of thermal expansion, a
coeff. thermal expansion
课件:第一章第一节课时2原子轨道与电子排布原理高中化学人教版选择性必修2

1.化学与环境、材料、能源等关系密切。下列说法正确的是
A. c(H+):①>②
【分析】
解析:选B。2s轨道能量低于3p轨道,A项错误;p能级所含
原子轨道数只有3个,与能级序数多少无关,C项错误;n=4
时,最多可容纳2×42=32个电子,D项错误。
泡利原理 洪特规则 能量最低原理
泡利原理:也称泡利不相容原 理,在一个原子轨道里,最多 只能容纳__2_个电子,而且它们 的自旋状态_相__反___。
解析:选C。电子云是用小黑点表示电子在原子核外空间出现的概率,小 黑点不代表电子,小黑点的疏密表示电子出现概率的大小,A项错误;基 态氢原子的电子云是球形的而不是圆形的,B项错误;3d3表示第三能层d 能级有3个电子,d能级有5个原子轨道,D项错误。
例题.下列有关原子轨道的叙述中正确的是( )
A.氢原子的2s轨道能量较3p轨道高
比较可知Cr的外围电子中未成对电子数最多,故选D。 D.若反应生成AB为液态,吸收的热量小于(a-b)kJ
1s22s22p63s23p4
简化电子排布式
[Ne]3s23p4
电子排布图
D. 在该条件下M点X平衡转化率为9/11 ④比色分光光度计可以用于测量化学反应速率 A. 原子半径:rW>rZ>rY
故选:D。
【详解】1s22s22p63s1为第三周期第IA族的Na,1s22s22p2为第二周期第IVA的C,1s22s22p3为第二周期第VA族的N,1s22s22p63s2为第
原子结构示意图 三周期第IIA族的Mg,根据“层多径大,序大径小”,原子半径由大到小的顺序为Na>Mg>C>N,原子半径最大的是A,故选A。
B.锂原子的2s与5s 轨道均为球形
第一章:原子结构

n 光谱符号
1 K
2 L
3 M
4 N
5 O
· · · · · ·
对氢原子来说,电子能量完全由n决定:
2.181018 Z 2 E J 2 n
四 个 量 子 数
B:角量子数:l 取值:0、1,2,3,. n-1
它表示原子轨道和电子云的形状 ,l与能级或称电子亚层对应。
(也是决定能量高低的因素)
自然界的物质种类繁多,性质各异,但它们都是由种类不同的原子组成,
原子以不同的种类.数目和方式结合,形成了无数的物种,因此,原子结构的
知识是了解物质结构和性质的基础。 化学变化包含着旧的化学键断裂和新的化学键的形成,化学变化一般 只涉及核外电子运动状态的变化,所以研究原子结构时,主要研究核外电子
的运动状态。
∴|ψ|2 ∝电子的几率密度
电子云角度分布图表示出电子在空间不同角度所出现的几率密度大小。
三、波函数的空间图象
B:电子云角度分布图 ︱Y(θ.φ) ︱2
z
+
→ θ.φ 作图,就得到电子云角度分布图
z y
+
z
+
x
-
x
+ -
x
pz z
x
s px z z x s px x x pz x py y
py
三、波函数的空间图象
E 光子 E E 2 E1 h 2.18 10
18
Z n 2n 2 2 1
2
1
←波长
青
氢原子光谱的一部分
课堂小结
玻尔理论最大贡献:建立微观粒子量子化特性,成功地解释了氢
原子光谱是线状光谱,为化学键理论奠定了基础。
高中化学第一章原子结构与元素的性质第1节第1课时原子的诞生、能层、能级和构造原理3化学

12/10/2021
第二十三页,共三十页。
(2)确定VSEPR模型(价层电子对立体构型) 根据(gēnjù)中心原子A的价层电子对数,找出对应的VSEPR模型
价层电子对数(n) VSEPR模型名称
2 直线形
3 平面三角形
4 四面体形
(3)确定分子或离子(lízǐ)的立体构型 ①若中心原子A无孤电子对,则分子或离子的立体构型为价层电子对的立体构型(VSEPR 模型)。 ②若中心原子A有孤电子对,则分子或离子的立体构型为略去中心原子孤电子对后的成键电子 对的立体构型。
分子类型
键角
180°
AB2 <180°
120° AB3
<120°
AB4
109°28′
12/10/2021
立体构型名称 直线形 V形
平面三角形 三角锥形
正四面体形
第十五页,共三十页。
实例 CO2、BeCl2、CS2
H2O、H2S BF3、BCl3 NH3、H3O+、PH3 CH4、NH4+、CCl4
【典题例证(lìzhèng)1】 下列分子的立体结构模型正确的是( )
3.用价层电子对互斥模型(móxíng)预测下列粒子的立体结构。
(1)H2Se (2)OF2 (3)BCl3 (4)PCl3 (5)CO2 (6)SO2 (7)H3O+ (8)SO24-
12/10/2021
第十页,共三十页。
答案 (1)V形 (2)V形 (3)平面三角形 (4)三角(sānjiǎo)锥形 (5)直线形 (6) V形 (7)三角锥形 (8)正四面体形
BeCl2
,SCl2
,BF3
,
PF3
,NH+ 4
,SO23-
。
