酸碱盐专题之离子共存
酸碱盐之间的离子反应及应用
酸碱盐之间的离子反应及应用湖北省南漳县高级中学秦兴忠化学是一门实验科学,是中学阶段的必修课,学生通过初中的化学学习不仅能提高自己的观察能力、思维能力、实验能力和自学能力,也为今后学习高中化学及其他科学技术打下良好的基础。
酸碱盐一章可以说是对整个初中化学知识的运用和综合,它在化学概念、化学基本理论的基础上,通过对酸、碱、盐基本性质的讲解,总结出学习无机化学的规律,这对我们学习知识,尤其是学习化学这门课程有着很好的启迪作用。
在中考题中,大部分的知识点要靠酸、碱、盐知识的有机结合才能解决。
由于酸碱盐溶液都是由离子构成的,离子的性质就决定了物质的性质,所以从离子角度去学习酸碱盐是根本,也是一个捷径。
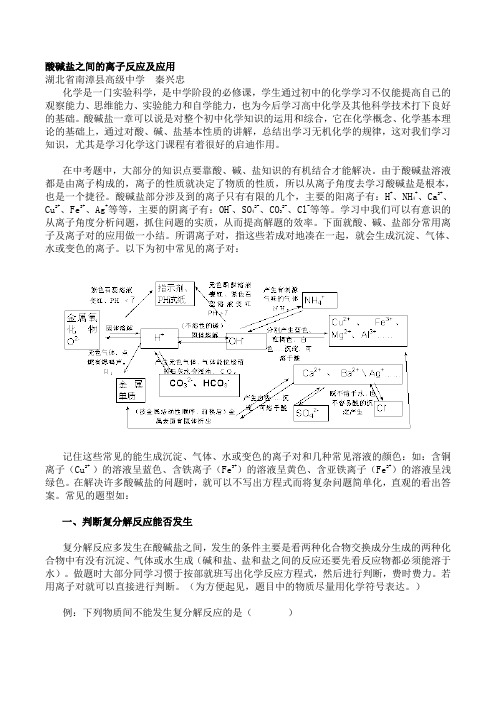
酸碱盐部分涉及到的离子只有有限的几个,主要的阳离子有:H+、NH4+、Ca2+、Cu2+、Fe3+、Ag+等等,主要的阴离子有:OH-、SO42-、CO32-、Cl-等等。
学习中我们可以有意识的从离子角度分析问题,抓住问题的实质,从而提高解题的效率。
下面就酸、碱、盐部分常用离子及离子对的应用做一小结。
所谓离子对,指这些若成对地凑在一起,就会生成沉淀、气体、水或变色的离子。
以下为初中常见的离子对:记住这些常见的能生成沉淀、气体、水或变色的离子对和几种常见溶液的颜色:如:含铜离子(Cu2+ )的溶液呈蓝色、含铁离子(Fe3+)的溶液呈黄色、含亚铁离子(Fe2+)的溶液呈浅绿色。
在解决许多酸碱盐的问题时,就可以不写出方程式而将复杂问题简单化,直观的看出答案。
常见的题型如:一、判断复分解反应能否发生复分解反应多发生在酸碱盐之间,发生的条件主要是看两种化合物交换成分生成的两种化合物中有没有沉淀、气体或水生成(碱和盐、盐和盐之间的反应还要先看反应物都必须能溶于水)。
做题时大部分同学习惯于按部就班写出化学反应方程式,然后进行判断,费时费力。
若用离子对就可以直接进行判断。
(为方便起见,题目中的物质尽量用化学符号表达。
)例:下列物质间不能发生复分解反应的是()A、盐酸和硝酸钾B、硫酸钠和氯化钡C、碳酸钠和氢氧化钙D、氢氧化钠和硝酸镁分析:先写成化学式,然后找出离子对。
化学人教版九年级下册酸碱盐溶解性与离子共存

《附录I 部分酸、碱、盐溶解性与离子共存》导学案
导学目标:1 引导学生认识酸碱盐溶解性与常见沉淀;
2 了解离子共存与不共存问题。
导学重点:酸碱盐溶解性及简单应用
导学难点:常见酸碱盐溶解性的记忆规律及简单应用
导学过程:
●同学们初学复分解反应的时候,对于复分解反应发生条件,即生成水、
沉淀、气体,在判断反应能否发生的时候,存在很多困惑:哪些离子相
互结合会生成气体,哪些离子相互结合会生成沉淀等。
这其实是离子是
否能共存的问题。
今天,让我们从探究“附录I:部分酸、碱和盐的溶
解性表(室温)”入手,一起来探究溶液中离子共存的问题。
●幻灯展示常见酸碱盐溶解性表,并引导学生记忆酸碱盐溶解性。
●出示记忆口诀并要求学生落实课堂笔记
●酸碱盐溶解性
全都溶硝酸根
盐酸盐不溶银
硫酸盐钡不行
碳酸溶盐钾钠铵
钾钠钡碱中清
●小结离子间不能大量共存的几种情况(详见PPT)
●结合典型例题巩固本节内容。
(详见PPT)。
离子共存及离子推断.

离子共存及离子推断1.离子共存问题(1)“不共存”情况归纳①离子之间相互结合呈沉淀析出时不能大量共存。
如形成BaS04、CaS04、H2Si03、Ca(OH)2、MgS03、MgC03、PbCl2、H2S04、Ag2S04等。
②离子之间相互结合呈气体逸出时不能大量共存,如:H+与S2-、HCO3-、SO32-、HSO3-和OH-与NH4+等,由于逸出H2S、C02、S02、NH3等气体或S2-变成HS-,CO32-变成HCO3-而不能大量共存。
③离子之间相互结合成弱电解质时不能大量共存。
如:H+与CH3COO-、OH-、PO43-等离子,由于生成 CH3COOH、H20、HPO42-、H2PO4-、H3P04而不能大量共存。
④离子之间发生双水解析出沉淀或逸出气体时不能大量共存,如Al3+与AlO2-、Fe3+与HCO3-、Al3+与HS-、S2-、HCO3-、CO32-等离子。
⑤离子之间发生氧化还原反应时不能大量共存,如:Fe3+与S2-、Fe3+与I-等。
⑥离子之间相互结合成络离子时不能大量共存。
如Fe3+与SCN-生成[Fe(SCN)]2+,Ag+、NH4+、OH-生成[Ag(NH3)2]+,Fe3+与C6H5OH也络合等(2)离子在酸性或城性溶液中存在情况的归纳。
①某些弱碱金屑阳离子,如:Zn2+、Fe3+、Fe2+、 Cu2+、Al3+、NH4+、Pb2+、Ag+等。
在水溶液中发生水解,有OH-则促进水解生成弱碱或难溶的氢氧化物。
故上述离子可和H+(在酸性溶液中)大量共存,不能与OH-(在碱性溶液中)共存。
但有NO3-存在时的酸性溶液, Fe2+等还原性离子不与之共存。
②某些弱酸的酸式酸根离子,如HCO3-、HS-等可和酸发生反应,由于本身是酸式酸根,故又可与碱反应,故此类离子与H+和OH-都不能共存。
③某些弱酸的阴离子,如:CH3COO-、S2-、CO32-、PO43-、AlO2-、SO32-、ClO-、SiO32-—等离子在水溶液中发生水解,有H‘则促进其水解,生成难电离的弱酸或弱酸的酸式酸根离子。
离子共存知识点总结

离子共存问题离子在溶液中能否大量共存,涉及到离子的性质及溶液酸碱性等综合知识。
凡能使溶液中因反应发生使有关离子浓度显着改变的均不能大量共存。
如生成难溶、难电离、气体物质或能转变成其它种类的离子(包括氧化一还原反应).一般可从以下几方面考虑1.弱碱阳离子只存在于酸性较强的溶液中.如Fe3+、Al3+、Zn2+、Cu2+、NH4+、Ag+ 等均与OH-不能大量共存.2.弱酸阴离子只存在于碱性溶液中。
如CH3COO-、F-、CO32-、SO32-、S2-、PO43-、AlO2-均与H+不能大量共存.3.弱酸的酸式阴离子在酸性较强或碱性较强的溶液中均不能大量共存.它们遇强酸(H+)会生成弱酸分子;遇强碱(OH-)生成正盐和水. 如:HSO3-、HCO3-、HS-、H2PO4-、HPO42-等4.若阴、阳离子能相互结合生成难溶或微溶性的盐,则不能大量共存.如:Ba2+、Ca2+与CO32-、SO32-、PO43-、SO42-等;Ag+与Cl-、Br-、I- 等;Ca2+与F-,C2O42- 等5.若阴、阳离子发生双水解反应,则不能大量共存.如:Al3+与HCO3-、CO32-、HS-、S2-、AlO2-、ClO-、SiO32- 等Fe3+与HCO3-、CO32-、AlO2-、ClO-、SiO32-、C6H5O-等;NH4+与AlO2-、SiO32-、ClO-、CO32-等6.若阴、阳离子能发生氧化一还原反应则不能大量共存.如:Fe3+与I-、S2-;MnO4-(H+)与I-、Br-、Cl-、S2-、SO32-、Fe2+等;NO3-(H+)与上述阴离子;S2-、SO32-、H+7.因络合反应或其它反应而不能大量共存如:Fe3+与F-、CN-、SCN-等;H2PO4-与PO43-会生成HPO42-,故两者不共存。
有关初中化学离子共存问题的小结

有关初中化学离子共存问题的小结武冈市邓家铺镇黄塘中学戴宏稳关键词:溶液离子共存我们学习了第十、十一单元酸碱盐之后,就出现了溶液中的离子共存问题,纵观近几年的中考试题,几乎每年都要涉及,但由于比较零散,学生很难系统地掌握,现就本人在平时教学中的体会总结如下:一、离子共存的实质溶液中的化学反应,实质就是离子之间的相互反应,即各离子相互反应生成了沉淀、气体或水等难电离的物质。
因此,要想使溶液中的各离子能共存,就必须各离子相互之间不发生反应,即不生成沉淀、气体或水。
二、常见题型举例1、不加任何限制的离子共存:例(1)下列各组离子能大量共存于同一溶液中的是(A)A、K+ Cl- NO3- Ca2+B、Ag+ Ba2+ Cl-NO3-C、H+Na+ OH- SO42-D、H+ CO32- Na+ Cl-例(2)下列不能在同一种溶液中大量共存的一组离子是(B)A、H+ Cl- NO3- Ba2+B、Na+ Cu2+ OH-NO3-C、Fe3+K+ Cl- SO42-D、NH4+ CO32- Na+ Cl-2、加有限制条件的离子共存:(1)溶液颜色(透明)的限制例(3)下列各组离子能大量共存于同一无色透明溶液中的是(D)A、Cu2+ SO42- NO3- K+B、Na+ Ba2+ SO42-NO3-C、Fe3+K+ Cl- SO42-D、Mg2+ SO42- Na+ Cl-(2)溶液酸性与碱性的限制例(4)下列各组离子能大量共存于PH=0的溶液中的是(D)A、Na+ SO42- CO32- K+B、Ca2+ Ba2+ SO42-OH-C、Fe3+Na+ OH- SO42-D、Mg2+ NO3- K+ SO42-(3)多种条件的限制例(5)能共存于PH=13且溶液颜色为无色透明的溶液的离子组是(D)A、H+ Cl- NO3- Ba2+B、Na+ Cu2+ Cl-NO3-C、Fe3+K+ Cl- SO42-D、Ba2+ NO3- Na+ Cl-3、结合实验现象推断并检验离子(或物质)的存在例(6)向硫酸铜溶液中加入一定量的铁粉,发现有少量金属析出,过滤,往得到的金属中加入过量的稀硫酸,发现金属部分溶解,并有气泡产生,由此推断(C)A、金属是Fe、Cu ,滤液中有Cu2+、Fe2+B、金属是Cu ,滤液中有Fe2+C、金属是Fe、Cu ,滤液中有Fe2+D、金属是Cu ,滤液中有Cu2+、Fe2+例(7)有一固体混合物,可能由Na2CO3、CuCl2、Na2SO4、CuSO4、NaCl、AgNO3等物质中的一种或几种组成,为鉴别它们做了如下实验:(1) 将固体混合物溶于水,搅拌得无色溶液;(2) 在此溶液中滴加氯化钡溶液,有白色沉淀生成;(3) 过滤,然后向白色沉淀中加入足量稀硝酸,沉淀最后完全消失,由此可以推知:固体混合物中肯定有Na2CO3;肯定没有Na2SO4、CuSO4、AgNO3、CuCl2;可能有NaCl 。
初中酸碱盐反应总结

初中酸碱盐反应总结所谓离子共存,实质上就是看离子间是否发生反应的问题。
若在溶液中发生反应,就不能共存。
看能否发生反应,不仅是因为有沉淀、气体、水、难电离的物质产生,还涉及到溶液酸碱性、有色、无色,能否进行氧化还原反应等。
•判断离子是否共存的方法:复分解反应的实质就是两种化合物相互交换成分,生成两种新的化合物,所以同一溶液中的离子之间如符合下列条件之一就会发生反应,即离子不能在溶液中大量共存。
(1)生成沉淀:如Ag+和Cl-,Ba2+和SO42-,Ca2+和CO32-,Cu2+和OH-等不能大量共存。
(2)生成气体:如H+和CO32-,HCO3-,NH4+和OH-等不能大量共存。
(3)生成水:如H+和OH-不能大量共存。
(4)可能会有附加条件,如溶液无色透明、pH=l (酸性溶液)、pH=14(碱性溶液)等。
判断离子能否共存时,应先看清试题的前提条件再分析离子间的相互反应情况。
判断离子是否共存的几种情况:①由于发生复分解反应,离子不能大量共存。
A.有气体产生。
如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
B.有沉淀生成。
如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;Mg2+、Fe2+、Ag+、Al3+、Z n2+、Cu2+、Fe3+等不能与OH-大量共存;Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
C.一些酸根离子如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;NH4+与OH-不能大量共存。
②由于发生氧化还原反应,离子不能大量共存。
A.具有较强还原性的离子不能与具有较强氧化性的离子大量共存。
如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
B.在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。
如MnO4-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;SO32-和S2-在碱性条件下可以共存,但在酸性条件下则由于发生2S2- +SO32- +6H+=3S+3H2O反应不能共在。
初三科学 专题一:离子共存(学生版)
专题一离子共存【基础知识】一、基础知识1.物质在水中的溶解性(1)口诀:钾钠铵硝溶,盐酸除银汞,再看硫酸盐,不溶钡和铅,微溶有三种,钙银和亚汞。
(2)酸、碱、盐溶解性表(20℃)2.复分解反应的特点与条件复分解反应:AB+CD→AD+CB(相互交换成分)发生条件:有水生成或气体生成或沉淀生成(三者至少一种)3.物质共存与离子共存所谓离子共存,实质上就是看离子间是否发生反应(复分解反应)的问题。
若在溶液中发生反应,就不能共存。
初中部分只需掌握复分解反应中的离子共存问题,以及在酸(H+)、碱(H¯)溶液中离子的共存问题。
(1)在溶液中不能共存的:①能反应的酸碱盐;②活泼的金属和酸;③活泼的金属和不活泼的金属的盐溶液。
(2)常见离子共存问题小结:①生成难溶物或微溶物:如:SO42-与Ba2+、Ag+;OH-与Cu2+、Fe3+、Mg2+、Al3+;Ag+与Cl-、CO32-、SO32-、S2-;Mg2+、Ba2+、Ca2+与CO32-、SO32-、PO43-等不能大量共存。
②生成气体或挥发性物质:如:NH4+与OH-;H+与CO32-、HCO3-等不能大量共存。
③生成水:OH-与H+不能大量共存。
(3)附加隐含条件的应用规律:①溶液无色透明时,则溶液中肯定没有有色离子。
常见的有色离子是Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄棕色)、MnO4-(紫色)。
②碱性溶液中肯定不存在与OH-起反应的离子;酸性溶液中肯定不存在与H+起反应的离子。
酸性溶液:pH<7的溶液、能使pH试纸变红的溶液、使石蕊试液变红等,在分析各选项组的离子时,还需考虑H+的存在;碱性溶液:pH>7的溶液、能使pH试纸变蓝的溶液,使石蕊试液变蓝或使酚酞试液变红的溶液等,在分析各选项组的离子时,还需考虑OH-的存在。
③能与金属反应产生H2的溶液、在分析各选项组的离子时,还需考虑H+或OH-的存在。
注意:①分析问题时还要看清楚题目要求回答的是能大量共存还是不能大量共存,不要选出相反的答案。
离子共存问题总结
1.复习重点(1)增加限制条件,如强酸性、无色透明、碱性、pH=1、甲基橙呈红色、发生氧化还原反应等。
(2)定性中有定量,如“由水电离出的H+或OH-浓度为1×10-10mol/L的溶液中,……”。
2.难点聚焦(一)、由于发生复分解反应,离子不能大量共存。
1、有气体产生。
如CO32-、HCO3-、S2-、HS-、SO32-、HSO3-等易挥发的弱酸的酸根与H+不能大量共存,主要是由于发生CO32-+2H+=CO2↑+H2O、HS-+H+=H2S↑等。
2、有沉淀生成。
如Ba2+、Ca2+、Mg2+等不能与SO42-、CO32-等大量共存,主要是由于Ba2++CO32-=BaCO3↓、Ca2++SO42-=CaSO4↓(微溶);Mg2+、Al3+、Cu2+、Fe2+、Fe3+等不能与OH-大量共存是因为Cu2++2OH-=Cu(OH)2↓,Fe3++3OH-=Fe(OH)3↓等;SiO32-、AlO2-、S2O32-等不能与H+大量共存是因为SiO32-+2H+=H2 SiO3↓、AlO2-+H++H2O=Al(OH)3↓、S2O32-+2H+=S↓+SO2↑+H2O 3、有弱电解质生成。
如OH-、ClO-、F-、CH3COO-、HCOO-、PO43-、HPO42-、H2PO4-等与H+不能大量共存,主要是由于OH-+H+=H2O、CH3COO-+H+=CH3COOH等;一些酸式弱酸根及NH4+不能与OH-大量共存是因为HCO3-+OH-=CO32-+H2O、HPO42-+OH-=PO43-+H2O、NH4++OH-=NH3·H2O等。
4、一些容易发生水解的离子,在溶液中的存在是有条件的。
如:AlO2-、S2-、HS-、CO32-、HCO3-、SO32-、HSO3-、ClO-、F-、CH3COO-、HCOO-、PO43-、SiO32-、C6H5O-等必须在碱性条件下才能在溶液中大量存在;Mg2+、Al3+、Cu2+、Fe2+、Fe3+、NH4+等必须在酸性条件下才能在溶液中大量存在。
最新中考化学专项复习溶液中离子的共存(共10张PPT)教育课件
•
•
学习重要还是人脉重要?现在是一 个双赢 的社会 ,你的 价值可 能更多 的决定 了你的 人脉, 我们所 要做的 可能更 多的是 专心打 造自己 ,把自 己打造 成一个 优秀的 人、有 用的人 、有价 值的人 ,当你 真正成 为一个 优秀有 价值的 人的时 候,你 会惊喜 地发现 搞笑人 脉会破 门而入 。从如 下方 面改进 :1、专 心做可 以提升 自己的 事情; 2、学 习并拥 有更多 的技能 ;3、成 为一个 值得交 往的人 ;4学 会独善 其身, 尽量少 给周围 的人制 造麻烦 ,用你 的独立 赢得尊 重。
•
•
在当今社会,大家都生活得匆匆忙忙, 比房子 、比车 子、比 票子、 比小孩 的教育 、比工 作,往 往被压 得喘不 过气来 。而另 外总有 一些人 会运用 自己的 心智去 分辨哪 些快乐 或者幸 福是必 须建立 在比较 的基础 上的, 而哪些 快乐和 幸福是 无需比 较同样 可以获 得的, 然后把 时间花 在寻找 甚至制 造那些 无需比 较就可 以获得 的幸福 和快乐 ,然后 无怨无 悔地生 活,尽 情欢乐 。一位 清洁阿 姨感觉 到快乐 和幸福 ,因为 她刚刚 通过自 己的双 手还给 路人一 条清洁 的街道 ;一位 幼儿园 老师感 觉到快 乐和幸 福,因 为他刚 给一群 孩子讲 清楚了 吃饭前 要洗手 的道理 ;一位 外科医 生感觉 到幸福 和快乐 ,因为 他刚刚 从死神 手里抢 回了一 条人命 ;一位 母亲感 觉到幸 福和快 乐,因 为他正 坐在孩 子的床 边,孩 子睡梦 中的脸 庞是那 么的安 静美丽 ,那么 令人爱 怜。。 。。。 。
全
没
有
用
他
会
不
开
心
。
•
■
电
:
一轮复习必背知识点:离子共存问题
一轮复习必背知识点:离子共存问题离子在溶液中能否少量共存,触及到离子的性质及溶液酸碱性等综合知识。
凡能使溶液中因反响发作使有关离子浓度清楚改动的均不能少量共存。
如生成难溶、难电离、气体物质或能转变成其它种类的离子(包括氧化一恢复反响)。
普通可从以下几方面思索:1.弱碱阳离子只存在于酸性较强的溶液中。
如Fe3+、Al3+、Zn2+、Cu2+、NH4+、Ag+等均与OH-不能少量共存。
2.弱酸阴离子只存在于碱性溶液中。
如CH3COO-、F-、CO32-、SO32-、S2-、PO43-、AlO2-均与H+不能少量共存。
3.弱酸的酸式阴离子在酸性较强或碱性较强的溶液中均不能少量共存。
它们遇强酸(H+)会生成弱酸分子;遇强碱(OH-)生成正盐和水。
如:HSO3-、HCO3-、HS-、H2PO4-、HPO42-等。
4.假定阴、阳离子能相互结合生成难溶或微溶性的盐,那么不能少量共存。
如:Ba2+、Ca2+与CO32-、SO32-、PO43-、SO42-等;Ag+与Cl-、Br-、I-等;Ca2+与F-,C2O42-等。
5.假定阴、阳离子发作双水解反响,那么不能少量共存。
如:Al3+与HCO3-、CO32-、HS-、S2-、AlO2-、ClO-、SiO32-等;Fe3+与HCO3-、CO32-、AlO2-、ClO-、SiO32-、C6H5O-等;NH4+与AlO2-、SiO32-、ClO-、CO32-等。
6.假定阴、阳离子能发作氧化一恢复反响那么不能少量共存。
如:Fe3+与I-、S2-;MnO4-(H+)与I-、Br-、Cl-、S2-、SO32-、Fe2+等;NO3-(H+)与上述阴离子;S2-、SO32-、H+7.因络合反响或其它反响而不能少量共存如:Fe3+与F-、CN-、SCN-等;H2PO4-与PO43-会生成HPO42-,故两者不共存。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.分别把下列各组中的物质加入水中,最终可能得到无色澄清溶液的是 ( )
A.MgCl2 NaOH H2SO4 B.Ba(NO3)2 K2SO4 HCI
C.KOH CuS04 H2SO4 D.AgNO3 KCI HN03
3.某PH值小于7的溶液中,含有钡离子(Ba2+)和氯离子(Cl-),则下列哪种离子还能大量共
存于该溶液中( )
A.碳酸根离子 B.氢氧根离子 C.硝酸根离子 D.硫酸根离子
6、下列各组物质能在同一溶液中大量共存的是( )
A、Na2SO4、BaCl2、NaOH B、Na2SO4、CuCl2、HNO3
C、Na2SO4、CuCl2、NaOH D、Na2CO3、CuSO4、H2SO4
8.下列离子能在pH=13的水溶液中大量共存的是( )
A.SO42-、Cl-、Na+、H+ B.K+、SO42-、Cu2+、N0
3
-
C.Cl-、K+、SO42-、Na+ D. Ca2+、Cl-、CO32-、Na+
10、下列各组物质能在pH=1的溶液中大量共存,且得到无色透明溶液的是( )
A、BaCl2 NaNO3 KOH MgCl2 B、Cu(NO3)2 NaCl H2SO4 KNO3
C、Na2CO3 NaCl KNO3 NH4Cl D、ZnSO4 Mg(NO3)2 NaNO3 KCl
12.下列各组溶液混合(酸均过量),最终无沉淀的是: ( )
A、Na2SO4、Ba(OH)2、H2SO4 B、Na2CO3、AgNO3、HCl
C、AgNO3、CaCl2、HNO3 D、 NaOH、MgCl2、H2SO4
2.在强碱性溶液中,下列各组离子能共存的是( )
A. Na+、Cu2+、SO42-、Cl- B. Na+、H+、Fe2+、Cl-
C. K+、Al3+、Br-、NO3- D. Na+、Ba2+、Cl-、NO3-
4.在鉴定某蓝色透明溶液的组成时,不同的实验者得出不同的结论,其中正确的是( )
A. Cu2+、NO3-、Ba2+、Cl-、Na+、H+
B. Cu2+、Na+、Ag+、Cl-、SO42-、NO3-
C. Cu2+、Ba2+、H+、SO42-、NO3-、Cl-
D. Cu2+、Ba2+、Na+、NO3-、OH-、Cl
-
5. 已知某无色溶液中,可能含有H+、Ag+、Cu2+、Na+、OH-、Cl-、NO3-、CO32-等八种离子
中的几种,取该溶液少许,滴入几滴石蕊试液,石蕊试液变红,则原溶液中大量存在的离子
可能是 。
