电离平衡和沉淀平衡实验报告
电离平衡特例实验报告

一、实验目的1. 深入理解电离平衡的概念,掌握电离平衡常数的计算方法。
2. 通过实验验证电离平衡的存在,观察电离平衡的移动。
3. 掌握弱电解质电离度的测定方法。
二、实验原理电离平衡是指在一定条件下,弱电解质在水溶液中部分电离,达到一个动态平衡状态。
电离平衡常数(Ka)表示弱电解质在平衡状态下的电离程度,其值越小,表示电离程度越低。
本实验以醋酸(CH3COOH)为例,通过测定其电离平衡常数,验证电离平衡的存在,并观察电离平衡的移动。
三、实验仪器与试剂1. 仪器:酸度计、移液管、容量瓶、滴定管、锥形瓶、烧杯、玻璃棒、滤纸等。
2. 试剂:0.1000 mol/L 醋酸溶液、0.1000 mol/L 氢氧化钠溶液、酚酞指示剂、蒸馏水。
四、实验步骤1. 配制0.1000 mol/L 醋酸溶液:准确移取10.00 mL 醋酸溶液于100 mL 容量瓶中,用蒸馏水定容至刻度。
2. 测定醋酸溶液的pH值:用酸度计测定配制好的醋酸溶液的pH值,记录数据。
3. 配制醋酸溶液的标准溶液:准确移取10.00 mL 醋酸溶液于100 mL 容量瓶中,用蒸馏水定容至刻度。
4. 滴定:向锥形瓶中加入10.00 mL 醋酸溶液,加入2-3滴酚酞指示剂,用0.1000 mol/L 氢氧化钠溶液进行滴定,直至溶液颜色由无色变为浅红色,记录消耗的氢氧化钠溶液体积。
5. 计算电离平衡常数:根据滴定结果,计算醋酸溶液的浓度、氢氧化钠溶液的浓度和消耗的氢氧化钠溶液体积,代入公式计算电离平衡常数。
五、实验数据与处理1. 醋酸溶液的pH值:pH = 4.742. 滴定数据:- 醋酸溶液的浓度:C(醋酸) = 0.1000 mol/L- 氢氧化钠溶液的浓度:C(氢氧化钠) = 0.1000 mol/L- 消耗的氢氧化钠溶液体积:V(氢氧化钠) = 20.00 mL3. 计算电离平衡常数:- 醋酸溶液的浓度:C(醋酸) = 0.1000 mol/L- 氢氧化钠溶液的浓度:C(氢氧化钠) = 0.1000 mol/L- 消耗的氢氧化钠溶液体积:V(氢氧化钠) = 20.00 mL- 醋酸的电离平衡常数:Ka = 1.8 × 10^-5六、实验结果与分析1. 醋酸溶液的pH值为4.74,说明醋酸为弱酸,电离程度较低。
沉淀酸碱平衡实验报告

一、实验目的1. 了解沉淀酸碱平衡的基本概念及其影响因素。
2. 掌握沉淀酸碱平衡实验的基本操作。
3. 通过实验验证沉淀酸碱平衡的原理。
二、实验原理沉淀酸碱平衡是指在溶液中,难溶电解质与其离子之间存在的动态平衡。
在一定条件下,当溶液中离子浓度乘积等于该难溶电解质的溶度积时,溶液达到沉淀酸碱平衡。
该平衡受多种因素影响,如离子浓度、温度、pH值等。
三、实验仪器与试剂1. 仪器:烧杯、玻璃棒、漏斗、滤纸、电子天平、pH计、移液管、容量瓶等。
2. 试剂:氯化钠(NaCl)、氯化银(AgCl)、硝酸银(AgNO3)、氢氧化钠(NaOH)、硫酸铜(CuSO4)、氢氧化钠(NaOH)等。
四、实验步骤1. 配制饱和氯化钠溶液:称取5.0g氯化钠,加入50mL去离子水,搅拌溶解后,转入100mL容量瓶中,用去离子水定容至刻度线。
2. 配制饱和硝酸银溶液:称取5.0g硝酸银,加入50mL去离子水,搅拌溶解后,转入100mL容量瓶中,用去离子水定容至刻度线。
3. 配制氢氧化钠溶液:称取10.0g氢氧化钠,加入50mL去离子水,搅拌溶解后,转入100mL容量瓶中,用去离子水定容至刻度线。
4. 配制硫酸铜溶液:称取5.0g硫酸铜,加入50mL去离子水,搅拌溶解后,转入100mL容量瓶中,用去离子水定容至刻度线。
5. 沉淀酸碱平衡实验:(1)取10mL饱和氯化钠溶液,加入10mL饱和硝酸银溶液,观察沉淀的形成及颜色变化。
(2)向上述溶液中加入少量氢氧化钠溶液,观察沉淀的变化。
(3)向上述溶液中加入少量硫酸铜溶液,观察沉淀的变化。
6. 数据记录与分析。
五、实验结果与分析1. 沉淀酸碱平衡实验结果:(1)向饱和氯化钠溶液中加入饱和硝酸银溶液,观察到白色沉淀形成,说明氯化钠和硝酸银发生反应,生成氯化银沉淀。
(2)向上述溶液中加入少量氢氧化钠溶液,观察到沉淀溶解,说明氢氧化钠与氯化银发生反应,生成可溶性的氢氧化银。
(3)向上述溶液中加入少量硫酸铜溶液,观察到沉淀颜色变为蓝色,说明硫酸铜与氢氧化钠发生反应,生成氢氧化铜沉淀。
沉淀平衡实验报告

沉淀平衡实验报告
实验目的:
本次实验的目的是通过实验观察和记录物质的沉淀过程,并通过实验数据计算出物质的溶解度,以深入了解物质物理性质的变化。
实验材料:
本次实验采用的材料为硫酸银、氯化钠、已经煮沸的蒸馏水。
实验步骤:
1.首先,将20毫升的蒸馏水倒入一只100毫升的烧杯中,加入少量的氯化钠,并用玻璃棒轻轻搅拌,直到氯化钠完全溶解在蒸馏水中;
2.再将5毫升的硫酸银溶液加入上述溶液中,并用玻璃棒轻轻搅拌,直到溶液充分混合;
3.观察溶液变化,并等待沉淀形成;
4.一旦沉淀形成,用滤纸将上层液体滤掉,并将沉淀留在筛上;
5.将沉淀在筛上连同筛一起置于电子秤上称重,并记录称量数据;
6.用5毫升的蒸馏水将筛上的沉淀冲洗几次,使筛上完全不剩
有硫酸银的痕迹;
7.将剩余的沉淀放入一只烧杯中,并用火燃烧,使沉淀转变为
硫酸银;
8.观察化学反应,并仍将观察数据记录下来。
实验结果:
本次实验的最终结果为,实验数据表明溶液中可出现的硫酸银
最大量为0.0098g/L。
结论:
通过本次实验结果数据,我们可以发现溶液中硫酸银的溶解度相对较小,硫酸银很容易形成沉淀并凝结在一起,这进一步说明了硫酸银的物理性质比较复杂,需要更深入地研究其物性行为。
电离平衡实验报告

电离平衡实验报告简介:电离平衡实验是一种重要的实验手段,用于研究物质中的电离现象和平衡状态。
本文通过对一次电离平衡实验的结果进行分析和总结,来探讨电离平衡在化学领域中的应用和意义。
实验目的:本次实验的主要目的是测定氨水(NH3)和硫酸(H2SO4)溶液的电离平衡常数,并通过对实验结果的分析,了解电离平衡对溶液酸碱性质的影响。
实验原理:氨水溶液中的NH3可以发生如下电离反应:NH3 + H2O ↔ NH4+ + OH-而硫酸(H2SO4)溶液中的H2O和H2SO4也会发生电离:H2O ↔ H+ + OH-H2SO4 ↔ 2H+ + SO42-实验步骤:1. 准备浓度分别为0.1 mol/L的氨水溶液和硫酸溶液。
2. 取一定量的氨水溶液,用酚酞指示剂进行初始酸碱滴定,记录滴定所需的硫酸溶液体积。
3. 再取一定量的氨水溶液,加入已知量的硫酸溶液,使得溶液体系呈现酸性,通过滴定测定酸量。
4. 根据实验结果计算溶液中NH3和H2O的电离平衡常数。
实验结果与分析:根据实验数据计算得到NH3的电离平衡常数Kb为1.8×10^-5,H2O的电离平衡常数Kw为1.0×10^-14。
结论:1. 由实验结果可知,氨水溶液中NH3的电离平衡常数较大,说明氨水具有较强的碱性。
2. 氨水和硫酸反应生成NH4+和OH-离子,使氨水溶液呈现碱性。
3. 水分子自身也发生电离,形成H+和OH-离子,因此水溶液呈现中性。
4. 通过对实验结果的分析可以得出,水在化学反应中起到了重要的催化和调节作用,维持了溶液的酸碱平衡。
实验误差与改进:1. 在实验过程中,可能会存在称量和体积读数误差,这些误差会直接影响到实验结果的准确性。
2. 实验中使用的酚酞指示剂在过量硫酸滴定过程中,易出现颜色持续变化的问题,这也可能会导致实验结果的偏差。
3. 为了提高实验结果的准确性,可以采取多次实验取平均值的方法,并且在实验操作过程中尽量减小误差来源。
电离平衡与沉淀溶解平衡所有实验现象
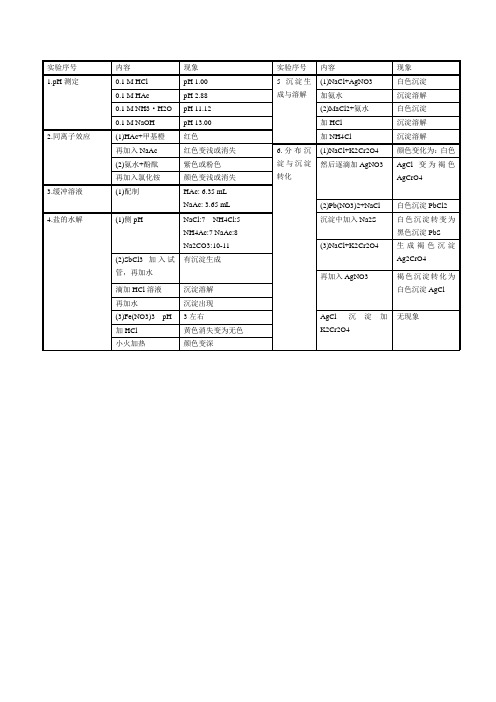
白色沉淀PbCl2
4.盐的水解
(1)侧pH
NaCl:7 NH4Cl:5
NH4Ac:7 NaAc:8
Na2CO3:10-11
沉淀中加入Na2S
白色沉淀转变为黑色沉淀PbS
(3)NaCl+K2Cr2O4
生成褐色沉有沉淀生成
再加入AgNO3
(1)HAc+甲基橙
红色
加NH4Cl
沉淀溶解
再加入NaAc
红色变浅或消失
6.分布沉淀与沉淀转化
(1)NaCl+K2Cr2O4
颜色变化为:白色
(2)氨水+酚酞
紫色或粉色
然后逐滴加AgNO3
AgCl变为褐色AgCrO4
再加入氯化铵
颜色变浅或消失
3.缓冲溶液
(1)配制
HAc: 6.35 mL
NaAc: 3.65 mL
实验序号
内容
现象
实验序号
内容
现象
1.pH测定
0.1 M HCl
pH 1.00
5沉淀生成与溶解
(1)NaCl+AgNO3
白色沉淀
0.1 M HAc
pH 2.88
加氨水
沉淀溶解
0.1 M NH3·H2O
pH 11.12
(2)MaCl2+氨水
白色沉淀
0.1 M NaOH
pH 13.00
加HCl
沉淀溶解
2.同离子效应
褐色沉淀转化为白色沉淀AgCl
滴加HCl溶液
沉淀溶解
再加水
沉淀出现
(3)Fe(NO3)3 pH
3左右
AgCl沉淀加K2Cr2O4
单多相离子平衡实验报告格式参考模板

实验 电离平衡与沉淀平衡一、实验目的1.理解弱酸与弱碱的电离平衡移动,认识盐类水解反应及其水解平衡的移动。
2.学会缓冲溶液的配置方法和试验其性质。
3. 掌握沉淀生成、溶解及转化的条件及混合离子的分离方法。
4.掌握离心分离操作和离心机、pH 试制的使用。
5. 引导学生准确观察实验现象,善于思考分析,提高实验效果。
二.实验原理1. 弱电解质在溶液中的电离平衡及其移动 AB(aq) ⇔ A+(aq) + B-(aq)电离常数 2.同离子效应在已建立平衡的弱电解质中,加入与其含有相同离子的另一种强电解质时,会使弱电解质电离度降低的效应称为同离子效应。
3.缓冲溶液(1) 基本概念:在一定程度上能抵抗外加少量酸、碱或稀释,而保持溶液pH 值基本不变的作用称为缓冲作用。
具有缓冲作用的溶液称为缓冲溶液。
(2)缓冲溶液组成及计算公式:缓冲溶液一般是由共轭酸碱对组成的,例如弱酸和弱酸盐,或弱碱和弱碱盐。
缓冲溶液计算公式4.盐类的水解盐类的水解是酸碱中和的逆反应,水解后溶液的酸碱性决定于盐的类型。
5. 难溶电解质的沉淀生成和溶解根据溶度积规则可以判断沉淀的生成和溶解: 浓度积J > Ksp θ , 过饱和状态,将有沉淀生成 J = Ksp θ , 处于动态平衡J < Ksp θ , 不饱和状态,无沉淀析出()/()/()/c A c c B cK c AB c θθθθ+-⋅=a ()/pH=pK lg()/c c c c θθθ+弱酸盐弱酸三、实验内容·1.电离平衡(1)强电解质和弱电解质(2)同离子效应2.缓冲溶液的配制和性质(1)缓冲溶液的配制(2)缓冲溶液的性质3.盐类的水解(4)分步沉淀Ag+ + Cl-→AgCl ↓(白)Ag++ CrO42-→Ag2CrO4↓(砖红色)Ksp(AgCl) > Ksp(Ag2CrO4)S(AgCl) <S(Ag2CrO4)故:在和的混合溶液中滴加,先生成白色沉淀,后转化为砖红色沉淀。
电离平衡实验报告

电离平衡实验报告电离平衡实验报告引言:电离平衡是化学中一个重要的概念,它描述了溶液中酸、碱和盐的离子浓度之间的关系。
本次实验旨在通过测定不同浓度的酸溶液的电离度,探究电离平衡的原理和影响因素。
实验方法:1. 实验材料:测量烧杯、酸溶液、pH计、蒸馏水等。
2. 实验步骤:a. 准备一系列浓度不同的酸溶液,如HCl、H2SO4等。
b. 将每种酸溶液倒入烧杯中,并使用pH计测定其酸性。
c. 记录每种酸溶液的初始体积和pH值。
d. 加入适量的蒸馏水稀释酸溶液,再次测定pH值。
e. 重复步骤d,直至酸溶液的pH值接近中性。
f. 记录每次稀释后的体积和pH值。
实验结果与讨论:通过实验测定得到的数据,我们可以绘制出酸溶液浓度与pH值的关系曲线。
实验结果显示,随着酸溶液浓度的增加,pH值呈现下降的趋势。
这是由于酸溶液中的酸性离子浓度增加,导致溶液中H+离子的浓度增加,从而使溶液呈酸性。
进一步分析发现,酸溶液的电离度与其浓度成正比。
当酸溶液浓度较低时,电离度较小,溶液呈弱酸性;而当酸溶液浓度较高时,电离度较大,溶液呈强酸性。
这说明在电离平衡中,酸溶液中的酸性离子浓度起着决定性的作用。
除了浓度外,温度也是影响电离平衡的重要因素。
实验中我们可以通过改变酸溶液的温度来观察其对电离度的影响。
实验结果显示,温度升高会导致酸溶液的电离度增加。
这是因为在高温下,分子的热运动加剧,使得酸分子更容易解离为离子,从而增加了溶液中的离子浓度。
结论:通过本次实验,我们深入了解了电离平衡的原理和影响因素。
实验结果表明,酸溶液的电离度与其浓度和温度有着密切的关系。
浓度越高,电离度越大;温度越高,电离度越大。
这些发现对于我们理解溶液中离子浓度的变化以及酸碱中和反应等都具有重要的指导意义。
在今后的实验中,我们可以进一步探究其他因素对电离平衡的影响,如压力、溶剂极性等。
通过深入研究电离平衡的机制,我们可以更好地理解和应用化学知识,为实际应用提供更多的理论依据。
沉淀溶解平衡的实验报告

一、实验目的1. 了解沉淀溶解平衡的基本概念和原理。
2. 掌握沉淀溶解平衡的计算方法。
3. 探究不同因素对沉淀溶解平衡的影响。
二、实验原理沉淀溶解平衡是指在一定条件下,难溶电解质在溶液中溶解和沉淀的速率相等,达到动态平衡状态。
该平衡可用溶度积(Ksp)表示,即难溶电解质的离子浓度乘积等于其溶度积常数。
三、实验仪器与试剂1. 仪器:烧杯、电子天平、移液管、滴定管、锥形瓶、磁力搅拌器等。
2. 试剂:氯化银(AgCl)、硝酸钾(KNO3)、硝酸钠(NaNO3)、硫酸钠(Na2SO4)、硝酸(HNO3)、氢氧化钠(NaOH)等。
四、实验步骤1. 配制饱和溶液:取一定量的AgCl固体,加入适量的蒸馏水,用磁力搅拌器搅拌至溶解,待溶液达到饱和状态。
2. 测定离子浓度:取一定量的饱和溶液,用移液管移取适量溶液,加入滴定管,滴定至一定颜色变化,计算离子浓度。
3. 计算溶度积:根据实验数据,计算AgCl的溶度积Ksp。
4. 探究不同因素对沉淀溶解平衡的影响:a. 温度对沉淀溶解平衡的影响:改变溶液温度,观察沉淀溶解平衡的变化。
b. 溶剂对沉淀溶解平衡的影响:用不同溶剂配制饱和溶液,观察沉淀溶解平衡的变化。
c. 添加化学物质对沉淀溶解平衡的影响:向饱和溶液中加入不同化学物质,观察沉淀溶解平衡的变化。
五、实验结果与分析1. 溶度积计算结果:AgCl的溶度积Ksp为1.77×10^-10。
2. 温度对沉淀溶解平衡的影响:随着温度的升高,沉淀溶解平衡向溶解方向移动,沉淀物逐渐溶解。
3. 溶剂对沉淀溶解平衡的影响:在不同溶剂中,沉淀溶解平衡的移动方向和程度不同,可能与溶剂的极性有关。
4. 添加化学物质对沉淀溶解平衡的影响:向饱和溶液中加入化学物质,会影响沉淀溶解平衡的移动方向和程度,如加入NaOH,沉淀溶解平衡向沉淀方向移动;加入KNO3,沉淀溶解平衡向溶解方向移动。
六、实验结论1. 沉淀溶解平衡是指难溶电解质在溶液中溶解和沉淀的速率相等,达到动态平衡状态。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电离平衡和沉淀平衡实验报告
实验目的,通过实验,掌握电离平衡和沉淀平衡的原理和实验方法,加深对化
学平衡的理解。
实验仪器和试剂,电离平衡实验装置、沉淀平衡实验装置、盐酸、硫酸、氢氧
化钠、氯化银溶液等。
实验原理:
1. 电离平衡,在电离平衡中,当电解质溶液中的正负离子浓度达到一定比例时,离子的生成速度与反应速度相等,达到动态平衡。
2. 沉淀平衡,在沉淀平衡中,当溶液中的阳离子和阴离子的浓度达到一定比例时,形成的沉淀物溶解速度与沉淀速度相等,达到动态平衡。
实验步骤:
1. 电离平衡实验,将电解质溶液倒入电离平衡实验装置中,接通电源,观察电
导率的变化,记录数据。
2. 沉淀平衡实验,将阳离子和阴离子的溶液混合,观察是否生成沉淀,记录生
成沉淀的时间和观察结果。
实验结果与分析:
1. 电离平衡实验结果显示,在一定浓度下,电解质溶液的电导率达到稳定值,
表明离子生成速度与反应速度相等,达到了电离平衡。
2. 沉淀平衡实验结果显示,在一定浓度下,生成的沉淀物溶解速度与沉淀速度
相等,达到了沉淀平衡。
实验结论,通过本次实验,我们成功掌握了电离平衡和沉淀平衡的原理和实验
方法,加深了对化学平衡的理解,为进一步学习化学平衡提供了基础。
实验中遇到的问题及解决方法,在实验过程中,遇到了电离平衡实验装置电极接触不良的问题,我们及时清洗电极并重新接通电源,解决了这一问题。
实验的局限性,本实验只是在一定条件下对电离平衡和沉淀平衡进行了简单的观察和记录,实验条件和数据量有限,无法覆盖所有情况。
实验的意义,本次实验不仅加深了我们对电离平衡和沉淀平衡的理解,还培养了我们的实验操作能力和数据分析能力,为我们今后的学习和科研工作打下了良好的基础。
总结,通过本次实验,我们对电离平衡和沉淀平衡有了更深入的认识,同时也意识到实验中的问题和局限性,希望在今后的学习和实验中不断提高自己的能力,为科学研究做出更大的贡献。
参考文献:
1. 《化学实验教程》。
2. 《化学平衡原理与实验》。
3. 《电离平衡与沉淀平衡实验指导书》。
