纳米微粒的化学特性优秀课件
纳米微粒的基础理论课件

沉淀法是通过化学反应使溶液中的离子形成沉淀,再 经过洗涤、干燥得到纳米微粒的方法。
化学法是通过化学反应制备纳米微粒的方法, 主要包括化学气相沉积法、溶胶-凝胶法、沉淀 法等。
溶胶-凝胶法是利用溶胶中的胶体粒子相互聚结 形成凝胶,再通过干燥和热处理得到纳米微粒的 方法。
生物法
1
生物法是利用生物体系中的酶、微生物等生物分 子进行催化或合成纳米微粒的方法,主要包括生 物合成法和生物提取法。
根据应用需求选择合适的制备方法, 如根据所需纳米微粒的尺寸、形貌、 化学成分等特性选择合适的制备方法 。
03
纳米微粒的性质与应用
纳米微粒的物理性质
小尺寸效应
由于纳米微粒的尺寸在纳米级别,其电子能级发 生分裂,导致新的光学、电学和磁学等性质。
表面效应
纳米微粒的巨大表面积与体积比使其表面原子活 性增加,影响其化学反应活性。
量子效应
在纳米尺度上,电子的运动受到限制,表现出显 著的量子效应,影响材料的导电性和磁性。
纳米微粒的化学性质
01
02
03
高反应活性
纳米微粒具有高表面能, 使其在化学反应中表现出 高反应活性。
催化性能
纳米微粒可作为高效的催 化剂,应用于许多化学反 应中。
稳定性与相容性
通过表面修饰,纳米微粒 可以改善其在不同介质中 的稳定性和相容性。
研究和评估。
跨学科合作
纳米微粒的研究和应用涉及多 个学科领域,需要加强跨学科 的合作和交流,促进创新发展 。
技术瓶颈
目前纳米微粒的制备、表征和 应用技术还存在一些瓶颈,需 要加强技术研发和创新。
法规和伦理问题
随着纳米微粒的广泛应用,相 关的法规和伦理问题也逐渐凸 显,需要建立相应的规范和标
纳米粒子的特性ppt课件
(i)纳米金属和合金与常规材料金属与合金电
导(电阻)行为是否相同?
(ii)纳米材料电导(电阻)与温度的关系有什
么差别?
(iii)电子在纳米结构体系中的运动和散射有什
么新的特点?
精选ppt
27
纳米金属与合金的电阻
Gleiter等对纳米金属Cu,Pd,Fe块体的电 阻与温度关系,电阻温度系数与颗粒尺寸的关 系进行了系统的研究表明:随颗粒尺寸减小, 电阻温度系数下降,与常规粗晶基本相似.其 差别在于纳米材料的电阻高于常规材料,电阻 温度系数强烈依赖于晶粒尺寸.当颗粒小于某 一临界尺寸(电子平均自由程)时,电阻温度 系数可能由正变负。
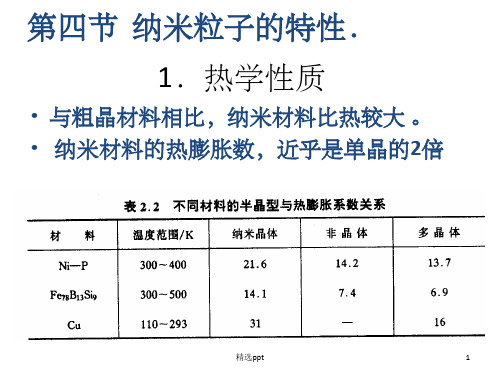
第四节 纳米粒子的特性.
1.热学性质
• 与粗晶材料相比,纳米材料比热较大 。 • 纳米材料的热膨胀数,近乎是单晶的2倍
精选ppt
1
• 纳米微粒的熔点、开始烧结温度和晶化温 度均比常规粉体低得多。
• 例如,平均粒径为40nm的纳米铜粒子的熔 点由l 053℃降到750℃,降低了300℃左右;
• 块状的金的熔点l 064℃,当颗粒尺度减到 10nm时,则降低为1037℃,降低了27℃, 2nm时变为327℃;
•
1988年法国科学家Fert小组在[Fe/Cr]周期性多层
膜中,观察 到当施加外磁场时,其电阻下降,变化
率高达50%。因此称之为巨磁电阻效应
(giant magnetoresistance, GMR)。
❖ 1995年,人们以绝缘层Al2O3代替导体Cr,观察 到很大的隧道磁电阻(TMR)现象。 基于GMR和TMR的发现,一个新的学科分支— —磁电子学的概念被提出了。 从那时起,科技人员 一直坚持不懈地努力,将上述创新性发现转化为信息 技术(IT)产业化。
纳米材料物理化学性质

第四章纳米材料的物理化学性能纳米微粒的物理性能第一节热学性能※1.1. 纳米颗粒的熔点下降由于颗粒小,纳米颗粒的表面能高、比表面原子多,这些表面原子近邻配位不全,活性大以及体积远小于大块材料的纳米粒子熔化时所需要增加的内能小得多,这就使纳米微粒熔点急剧下降。
金的熔点:1064o C;2nm的金粒子的熔点为327o C。
银的熔点:960.5o C;银纳米粒子在低于100o C开始熔化。
铅的熔点:327.4o C;20nm球形铅粒子的熔点降低至39o C。
铜的熔点:1053o C;平均粒径为40nm的铜粒子,750o C。
※1.2. 开始烧结温度下降所谓烧结温度是指把粉末先用高压压制成形,然后在低于熔点的温度下使这些粉末结合成块,密度接近常规材料的最低加热温度。
纳米颗粒尺寸小,表面能高,压制成块材后的界面具有高能量,在烧结中高的界面能成为原子运动的驱动力,有利于界面中的孔洞收缩,空位团的湮灭,因此,在较低的温度下烧结就能达到致密化的目的,即烧结温度降低。
※1.3. NPs 晶化温度降低非晶纳米颗粒的晶化温度低于常规粉末,且纳米颗粒开始长大温度随粒径的减小而降低。
※熔点降低、烧结温度降低、晶化温度降低等热学性质的显著变化来源于纳米材料的表(界)面效应。
第二节电学性能2.1 纳米金属与合金的电阻特性1. 与常规材料相比,Pd纳米相固体的比电阻增大;2. 比电阻随粒径的减小而逐渐增加;3. 比电阻随温度的升高而上升4. 随粒子尺寸的减小,电阻温度系数逐渐下降。
电阻的温度变化规律与常规粗晶基本相似,差别在于温度系数强烈依赖于晶粒尺寸。
随着尺寸的不断减小,温度依赖关系发生根本性变化。
当粒径为11nm时,电阻随温度的升高而下降。
5. 当颗粒小于某一临界尺寸时(电子平均自由程),电阻的温度系数可能会由正变负,即随着温度的升高,电阻反而下降(与半导体性质类似).电子在晶体中传播由于散射使其运动受阻,而产生电阻。
※纳米材料的电阻来源可以分为两部分:颗粒组元(晶内):当晶粒大于电子平均自由程时主要来自晶内散射界面组元(晶界):晶粒尺寸与电子平均自由程相当时,主要来自界面电子散射•纳米材料中大量的晶界存在,几乎使大量电子运动局限在小颗粒范围。
纳米微粒的特性-

非牛顿流体:包括假塑性流体、塑性流体和胀流体。假塑性
流体和塑性流体都属于剪切变稀的流体,但塑性流体具有屈 服值。胀流体 属于剪切变稠的流体。 黏度η:是流体内部抵抗流动的阻力,用对流体的剪切应力 与剪切速率之比表示。
ηred为胶乳浓度(体积分数) ,Φ为粒子的形状因子,等 于2.5,K为静电引力常数(约1.35)。随胶乳粒径减小黏度的增加 是由于粒径愈小,胶乳比表面增大,胶乳间静电引力增大, Mooney式中的K变大所致。
三、流变学
流体
牛顿流体
非牛顿流体
假塑性流体
塑性流体
胀流体
1.基本概念
流体:流体是由大量的、不断地作热运动而且无固定平衡位
置的分子构 成的,它的基本特征是没有一定的形状和具有流动 性。流体都有一定的可压缩性,液体可压缩性很小,而气体的可 压缩性较大。流体的流变形态分为牛顿流体和非牛顿流体。 牛顿流体:剪切应力τ与剪切速率 成正比的流体。
② 作新的润滑剂。
通常润滑剂易损耗、易污染环境。磁性液体中的磁性
颗粒尺寸仅为10单位,因此,不会损坏轴承,而基液亦可用润 滑油,只要采用合适的磁场就可以将磁性润滑油约束在所需的 部位。
③ 增进扬声器功率。
在音圈与磁铁间隙处滴入磁性液体,由于液体的导热系数 比空气高5~6倍,从而使得在相同条件下功率可以增加1倍。磁性 液体的添加对频响曲线的低频部分影响较大,通常根据扬声器的 结构,选用合适粘滞性的磁性液体,可使扬声器具有较佳的频响 曲线。
例如,纳米尺寸的黏土小颗粒在碱或碱土类金属的电解 液中的吸附(这是一种物理吸附过程,它是有层次)。吸 附层的电学性质也有很大的差别. 紧密层:靠近纳米微粒表面的一层属于强物理吸附,称为 紧密层,它的作用是平衡了超微粒子表面的电性 分散层:离超微粒子稍远的离子形成较弱吸附层,称为 分散层。
纳米科学与技术-纳米微粒的结构与物理化学特性

(4) 热稳定性
从传统的晶粒长大理论中可知,晶粒长大驱动力 Δμ 与晶粒尺寸 d 的关系可由 Gibbs-thompson 方程 描述: 4 d Ω为原子体积;γ为界面能。 当晶粒尺寸 d 细化到纳米量级时,颗粒表面能高, 为颗粒长大提供动力,纳米晶通常处于亚稳态, 晶粒长大的驱动力很高,容易长大 。 通常,细晶粒在加热时易于长大,但需达到一定 的临界温度。
e E E C p 3 R 2 T Βιβλιοθήκη E E e 1 2
E
Debye定律 1912年,P. Debye建立了另一个关于固体比 热容的量子论。认为振动(声子)是以一个 连续的光谱频率而非单一频率在固体的连续 介质中传播。
T3 C v 9 R D
(i)多晶材料的比热容
(a)中高温度的情况 1819年,P. Dulong和A. Petit发现室温下不同固体的 摩尔比热容几乎相同,接近26J.mol-1K-1。
一些物质如钻石、锗、硅等比热容的实际值比预 测的较小,除此之外,杜隆-帕替定律在室温下是十 分准确的。 另外,随着温度的降低,固体的比热容迅速减小, 在绝对零度时消失,只能用量子论解释。 爱因斯坦定律 1907年,爱因斯坦建立了比热容的第一量子论。假 定固体中的每一个原子以一定的频率振荡,振荡产 生的能量是造成比热容的原因。
(3 )热膨胀系数的增加
固体材料受热后晶格振动加剧而引起的容积 膨胀的现象------热膨胀。 由固体物理可知:热膨胀的本质在于材料晶 格点阵的非简谐振动,当晶格作非线性振动, 就会有热膨胀发生。
V V0 E p V0 KV K
K 体积弹性模量,γ 格林艾森常数。
纳米晶体在温度发生变化时,非线性振动包括: 晶体内的非线性热振动 晶界组分的非线性热振动 往往后者的非线性振动较为显著。 纳米晶界占体积百分数较大,故对热膨胀起着主 导作用。
纳米材料与技术-纳米微粒的基本特性

第三章纳米微粒的基本特性一、纳米微粒的结构二、纳米微粒的基本特性热学、磁学、光学、动力学、表面活性、光催化性能一、纳米微粒的结构纳米态:物质的第?态!区别于固、液、气态,也区别于“等离子体态”(物质第四态)、地球内部的超高温、超高压态(物质第五态),与“超导态”、“超流态”也不同。
纳米态的物质一般是球形的。
物质在球形的时候,在等体积的条件下,它的界面最小、能量最低、自组织性最强、对称性也最高,有着很好的强关联性。
超微颗粒的表面与大块物体的表面是十分不同的,若用高倍率电子显微镜对金超微颗粒(直径为2nm)进行电视摄像,实时观察发现这些颗粒没有固定的形态,随着时间的变化会自动形成各种形状(如立方八面体、十面体、二十面体等),它既不同于一般固体,又不同于液体,是一种准固体。
在电子显微镜的电子束照射下,表面原子仿佛进入了“沸腾”状态。
尺寸大于10纳米后才看不到这种颗粒结构的不稳定性,这时微颗粒具有稳定的结构状态。
纳米微粒一般为球形或类球形,可能还具有其他各种形状(与制备方法有关)。
纳米微粒的结构一般与大颗粒的相同,内部的原子排列比较整齐,但有时也会出现很大的差别:高表面能引起表层(甚至内部)晶格畸变。
二、纳米微粒的基本特性1. 纳米微粒的热学性质固态物质在其形态为大尺寸时,其熔点是固定的;超细微化后发现其熔点将显著降低,当颗粒小于10纳米量级时尤为显著。
➢大块Pb的熔点为600K,而20nm的的球形Pb微粒熔点降低288K。
➢ Ag的熔点:常规粗晶粒为960︒C;纳米Ag粉为100︒C ➢ Cu的熔点:粗晶粒为1053︒C;粒度40nm时为750︒C纳米微粒的熔点降低:由于颗粒小,纳米微粒的表面能高、比表面原子数多,这些表面原子近邻配位不全、活性大,因此纳米粒子熔化时所需增加的内能比块体材料小得多,使纳米微粒的熔点急剧下降。
✍应用:降低烧结温度。
纳米微粒尺寸小,表面能高,压制成块材后的界面具有高能量,在烧结中高的界面能成为原子运动的驱动力,有利于界面中的孔洞收缩,空位团的湮没,因此,在较低的温度下烧结就能达到致密化的目的,即烧结温度降低。
纳米微粒的物理特性公开课一等奖优质课大赛微课获奖课件

10/10/
1,8 nm; 2,15 nm;3,35 nm 10
第10页
4.2磁学性能
纳米微粒小尺寸效应,量子尺 寸效应,表面效应等使它含有常规 晶粒材料所不含有磁特性,归纳一 下有:
10/10/
11
第11页
⑴超顺磁性
顺磁体:指磁化率是数值较小正数 物体,它随温度T成正比关系。
10/10/
发生蓝移
发生红移
38
第38页
这是由于光吸取带位置是由影响峰位蓝 移原因和红移原因共同作用结果。
假如蓝移影响不小于红移影响,吸取带 蓝移。
反之红移。
10/10/
39
第39页
❖ 伴随粒径减小,量子尺寸效应会造成吸 取带蓝移 但是粒径减小同时,颗粒内部内应力会 增长。 内应力 p = 2γ/r
纳米SiC颗粒红外吸取频率较大块固体蓝移了 20cm-1。
纳米Si3N4颗粒红外吸取频率峰值为:949cm-1 大块Si3N4固体为:935cm-1
相对移动了14cm-1。
10/10/
33
第33页
②可见光光区吸取蓝移
❖ 不同粒径CdS纳米微粒吸取光谱
由图能够看出: 伴随微粒尺寸变小吸 取边向短波方向移动 (即蓝移)。
10/10/
35
第35页
对纳米微粒吸取带“蓝移”解释有几种说法, 归纳起来有两个方面:
⑴ 量子尺寸效应:由于颗粒尺寸下降能隙变宽, 这就造成光吸取带移向短波方向。
Ball等对这种蓝移现象给出了普适性解释:已被 电子占据分子轨道能级与未被占据分子轨道能级 之间宽度(能隙)随颗粒直径减小而增大,这是 产生蓝移主线原因。
10/10/
第二章-纳米微粒的物理化学性质-2012

1990年,日本佳能研究中心的Tabagi发现,粒径小 于6nm的硅在室温下可以发射可见光.
(4)纳米微粒的发光
图示为室温下,紫外光激发引起的纳米硅的发光谱.可以看 出,随粒径减小,发射带强度增强并移向短波方向.当粒径 大于6nm时,这种光发射现象消失.
(4)纳米微粒的发光
Tabagi认为,硅纳米微粒 的发光是载流子的量子限 域效应引起的.
(5)纳米微粒分散物系的光学性质
(i)散射光强度(即乳光强度)与粒子的体积平方成正比.对低分子 真溶液分子体积很小,虽有乳光,但很微弱.悬浮体的粒子大 于可见光,故没有乳光,只有反射光,只有纳米胶体粒子形成 的溶胶才能产生丁达尔效应. (ii)乳光强度与入射光的波长的四次方成反比,故人射光的波长愈 短,散射愈强.例如照射在溶胶上的是白光,则其中蓝光与紫 光的散射较强.故白光照射溶胶时,侧面的散射光呈现淡蓝色, 而透射光呈现橙红色.
(iii)散相与分散介质的折射率相差愈大,粒子的散射光愈强.所以 对分散相和介质问没有亲和力或只有很弱亲和力的溶胶 (憎液 溶胶),由于分散相与分散介质间有明显界限,两者折射率相差 很大,乳光很强,丁达尔效应很明显.
(iV)乳光强度与单位体积内胶体粒子数N成正比。
2.2.3
纳米微粒的电学性能
1.纳米晶金属的电导
4
下图为金的熔点与金纳米粒子的尺度关系图。随金粒 子尺寸的减小,熔点降低。金的常规熔点为1064℃, 当颗粒尺寸减小到2nm时,熔点仅为500℃左右。
纳米材料基础与应用
5
表2-2
物质种类
几种材料在不同尺度大小下的熔点
颗粒尺寸:直径(nm)或 总原子数(个) 熔 点(K)
金(Au)
锡(Sn) 铅(Pb) 硫化镉 (CdS)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
§4.2纳米微粒的分散和团聚
4.2.1分散
2防止小颗粒团聚采用的方法:
A、加入反絮凝剂形成双电层 反絮凝剂的选择可 依纳米微粒的性质、带电类型等来定。即:选择 适当的电解质作分散剂,使纳米粒子表面吸引异 电离子形成双电层,通过双电层之间库仑排斥作 用使粒子之间发生团聚的引力大大降低,实现纳 米微粒分散的目的。
例子 如,纳米氧化物SiO2,Al2O3和TiO2等在 水中的pH高低不同(带正电或负电),因此可选 Na+,NH4+或Cl-,NO3-异电离子作反絮凝剂,使 微粒表面形成双电层,从而达到分散的目的。
§4.2纳米微粒的分散和的纳米粒 子团聚也可加入表面活性剂,使其吸附在粒子表面, 形成微胞状态,由于活性剂的存在而产生了粒子间的 排斥力,使得粒子间不能接触,从而防止团聚体的产 生。对于磁性纳米微粒,由于颗粒之间磁吸引力,很 容易团聚,加入界面活性剂(如油酸)使其包裹在磁 性粒子表面,造成粒子间排斥作用,避免了团聚体的 生成。
4、不同种类的纳米微粒吸附性质有很大差别。
§4.1吸附
4.1.1非电解质的吸附
一、概念
非电解质是指电中性的分子,它们可通 过氢键、范德瓦耳斯力、偶极子的弱静电引 力吸附在粒子表面。其中主要是以氢键形成 而吸附在其它相上。
二、吸附的典型例子
例如:氧化硅粒子对醇、酰胺、醚的吸 附过程中氧化硅微粒与有机试剂中间的接触 为硅烷醇层,硅烷醇在吸附中起着重要作用。
§4.1吸附
4.1.2电解质吸附
一、吸附的机理:电解质在溶液中以离子形 式存在,其吸附能力大小由库仑力来决定。 纳米微粒在电解质溶液中的吸附现象大多数 属于物理吸附。 1缘由:由于纳米粒子的大的比表面常常产生键的
不饱和性,致使纳米粒子表面失去电中性而带电 (例如纳米氧化物,氮化物粒子),而电解质溶液中 往往把带有相反电荷的离子吸引到表面上以平衡其 表面上的电荷,这种吸附主要是通过库仑交互作用 而实现的。
pH值处于中间值,则纳米氧化物表 面形成M—OH键,粒子呈电中性。
§4.2纳米微粒的分散和团聚
4.2.1分散
一、面临的问题
在纳米微粒制备过程中,纳米微粒表 面的活性使它们很容易团聚在一起从而形 成带有若干弱连接界面的尺寸较大的团聚 体,这给纳米微粒的收集带来很大的困难。
二、解决的方案
用物理方法或化学方法制备的纳米粒 子经常采用分散在溶液中进行收集。
由上述例子可知
受吸附相的性质影响
说明 :即使吸附相是相同的,但由于溶剂种类不 同吸附量也不一样。例如,以直链脂肪酸为吸附 相,以苯及正己烷溶液为溶剂,结果以正己烷为 溶剂时直链脂肪酸在氧化硅微粒表面上的吸附量 比以苯为溶剂时多,这是因为在苯的情况下形成 的氢键很少。从水溶液中吸附非电解质时,受pH 值影响很大,pH值高时,氧化硅表面带负电,水 的存在使得氢键难以形成,吸附能力下降。
例子 如, PaPell在制备Fe3O4的磁性液体时就采用 油酸防止团聚,达到分散的目的。
§4.1吸附
4.1.2电解质吸附
2实例列举:例如,纳米尺寸的黏土小颗粒在碱
或碱土类金属的电解液中的吸附(这是一种物理 吸附过程,它是有层次的)。吸附层的电学性质 也有很大的差别.
二、吸附层的电学性质
1靠近纳米微粒表面的一层属于强物理吸 附,称为紧密层,它的作用是平衡了超微 粒子表面的电性。 2离超微粒子稍远的离子形成较弱吸附层, 称为 分散层。
§4.1吸附
4.1.2电解质吸附
上述两层构成双电层。 双电层中电位分布可用 一表示式来表明,例如把Cu离子—黏土粒子之间 吸附当作强电解质吸附来计算,以粒子表面为原 点,在溶液中任意距离x的电位可用下式表示:
Z为原子价,NA为阿伏伽德罗常数, C为强电解质的摩尔浓 度 ,k 表示双电层的扩展程度.1/ k称为双电层的厚度.由式 看出, 1/ k反比于Z和C1/2,这表明高价离子、高电解质浓度下, 双电层很薄。
耳斯力之类较弱的物理力结合
化学吸附 吸附剂与吸附相之间是以化学键强
结合
§4.1吸附
纳米微粒吸附性特点
1、纳米微粒由于有大的比表面和表面原子配 位不足,与相同材质的大块材料相比较,有较强 的吸附性。
2、纳米粒子的吸附性与被吸附物质的性质、 溶剂的性质以及溶液的性质有关。
3、电解质和非电解质溶液以及溶液的pH值等 都对纳米微粒的吸附产生强烈的影响。
§4.2纳米微粒的分散和团聚
4.2.1分散
1分散机理:
A现象 尺寸较大的粒子容易沉淀下来,当粒径在 纳米级(1—100nm),由于布朗运动等因素阻止它 们沉淀而形成一种悬浮液,纳米微粒称为胶体。 由于小微粒之间库仑力或范德瓦耳斯力团聚现象 仍可能发生。
B方法 通常用超声波将分散剂(水或有机试剂)中 的团聚体打碎。
纳米微粒的化学特性优秀课件
§4.1吸附
吸附的概念
吸附是相接触的不同相之间产生的结合现象
吸附的分类
物理吸附 吸附剂与吸附相之间是以范德瓦
耳斯力之类较弱的物理力结合
化学吸附 吸附剂与吸附相之间是以化学键强
结合
§4.1吸附
吸附的概念
吸附是相接触的不同相之间产生的结合现象
吸附的分类
物理吸附 吸附剂与吸附相之间是以范德瓦
§4.1吸附
4.1.2电解质吸附
三、纳米氧化物随pH值可带不同的电荷
纳米氧化物的粒子,如石英、氧化铝 和二氧化钛等根据它们在水溶液中的pH值 不同可带正电、负电或呈电中性。
图4.2 pH值对氧化物带电 状况的影响
pH比较小时,粒子表面形成M—O H2(M代表金属离子,如Si,Al,Ti 等),导致粒子表面带正电。 pH高时,粒子表面形成M—O键, 使粒子表面带负电。
§4.1吸附
4.1.1非电解质的吸附
作用机制:上述有机试剂中的O或N与硅烷醇的羟基 (OH基)中的H形成O—H或N—H氢键,从而完成SiO2微 粒对有机试剂的吸附,如图4.1所示。
图4.1 在低pH下吸附于氧化硅表面的醇、酰胺、醚分子。
§4.1吸附
4.1.1非电解质的吸附
三、影响吸附的因素
受粒子表面性质的影响
