高一化学—《化学键》测试题
专题1.3 化学键--高一化学人教版(必修2)

第一章 物质结构 元素周期律第三节 化学键一、离子键和离子化合物1.离子键 (1)定义:________________________之间的________________。
(2)成键粒子:____________和____________。
(3)成键元素:一般是________________元素和____________________元素。
(4)存在:离子化合物。
(5)表示:电子式。
如 NaCl: 2.离子化合物;MgCl2:;NaOH:。
(1)定义:______________________________________________________________________。
(2)形成过程①电子式:在元素符号周围用“·”或“×”来表示__________________________的式子。
如:原子:Na__________、Mg__________、Cl____________、S____________。
阳离子:Na+___________、Mg2+_____________。
阴离子:Cl−____________、S2−______________。
②形成过程如 NaCl:________________________________。
【 特 别 提 醒 】 NH4Cl 是 离 子 化 合 物 而 不 是 共 价 化 合 物 , 电 子 式 是。
二、共价键和共价化合物1.共价键 (1)定义:原子间通过____________________所形成的________________。
(2)成键粒子:________。
,而不是(3)成键元素:同种或不同种____________元素化合时能形成共价键。
(4)存在 ①非金属单质(除稀有气体),如 H2、O2、N2、O3。
②共价化合物,如____________________________________________________________。
高一化学(下)化学键离子共价化合物综合练习题(附答案)

高一化学(下)化学键离子共价化合物综合练习题一、单选题1.我国科学家通过测量2SiO 中2610Al Be 和两种元素的比例来确定“北京人”的年龄,这种测量方法叫铝铍测年法。
下列关于2610Al Be 和的说法不正确的是( ) A .5.2g 263+A1中所含的电子数约为1.204×1024 B .109Be Be 和是中子数不同、质子数相同的不同原子 C .263+262+A1Mg 和的质子数、中子数和核外电子数都不相同 D .10Be 原子核内的中子数比质子数多2.原子序数为83的元素位于: ① 第五周期; ② 第六周期; ③ ⅣA 族; ④ ⅤA 族; ⑤ ⅡB 族,其中正确的组合是( ) A.① ④B.② ③C.② ④D.① ⑤3.我国稀土资源丰富。
下列有关稀土元素14462Sm 与15062Sm 的说法正确的是( ) A. 14462Sm 与15062Sm 互为同位素 B. 14462Sm 与15062Sm 的质量数相同C. 14462Sm 与15062Sm 是同一种核素D. 14462Sm 与15062Sm 的核外电子数和中子数均为624.运用元素周期律,判断下列语句,其中正确的组合是( ) ①碱金属单质的熔点随原子序数的增大而降低 ②砹(At )是第ⅦA 族,其氢化物的稳定性大于HCl ③硒(Se )的最高价氧化物对应水化物的酸性比硫酸弱④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 ⑤铊(Tl )与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应⑥第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱 A.①③④ B.①③⑥ C.③④⑤ D.②④⑥ 5.下列说法不正确的是( ) A. 氢氧化钠晶体熔化时只破坏了离子键 B. HCl 、HBr 、HI 均是强酸C. BF 3分子中所有原子的最外层都达到8电子稳定结构D.碘升华只克服了分子间作用力6.若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。
第2章《化学键 化学反应规律》检测题-高一下学期鲁科版(2019)必修第二册

第2章《化学键化学反应规律》检测题一、单选题(共13题)1.化学与生产、生活密切相关,下列说法错误的是A.高纯硅晶体可用于制作太阳能电池B.稀土永磁材料是电子通讯技术中的重要材料,稀土元素都是金属元素C.生活中制作油条的口诀是“一碱、二矾、三钱盐”,其中的“碱”是烧碱D.干电池低汞化、无汞化,有利于减少废电池造成的土壤污染2.对于反应Fe(s)+H2SO4(aq)=FeSO4(aq)+H2(g),下列叙述错误的是()A.通过反应过程中溶液温度变化判断该反应过程是否放热B.改变Fe的表面积会改变反应的速率C.通常用H2体积的变化情况表示该反应的速率D.若将该反应设计成原电池,正极材料应为铁3.下列物质中,既含有非极性共价键又含有极性共价键是A.NaOH B.H2O2C.Na2O2D.H2S4.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的,如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化。
则下列说法正确的是A.通常情况下,NO比N2稳定B.通常情况下,N2(g)和O2(g)混合能直接生成NOC.1molN2(g)和1molO2(g)反应吸收的能量为180kJD.1molN2(g)和1molO2(g)具有的总能量大于2molNO(g)具有的总能量5.下列关于物质结构和化学用语的说法正确的是A.BF3、CCl4中所有原子均达到8电子稳定结构B.78gNa2O2晶体中所含离子数目为3N AC.18gH2O或D2O的质子数均为10N AD.34gH2O2含有极性键的数目为3N A6.大多数有机物分子中的碳原子与其他原子的结合方式是A.全部通过非极性键结合B.形成4对共用电子C.通过2个单键结合D.通过离子键和共价键结合7.下列叙述不正确的是A.HF、HCl、HBr、HI的沸点逐渐增大B.在周期表中金属与非金属的分界处,可以找到半导体材料C.Li、Na、K原子的电子层数依次增多D.X元素最高价氧化物对应的水化物为HXO3,它的气态氢化物为H3X8.在容积为4 L的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)⇌2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率υ(正)、υ(逆)与时间t的关系如图。
第18讲 化学键-新高一化学暑假课(人教版2019必修第一册)(原卷版)
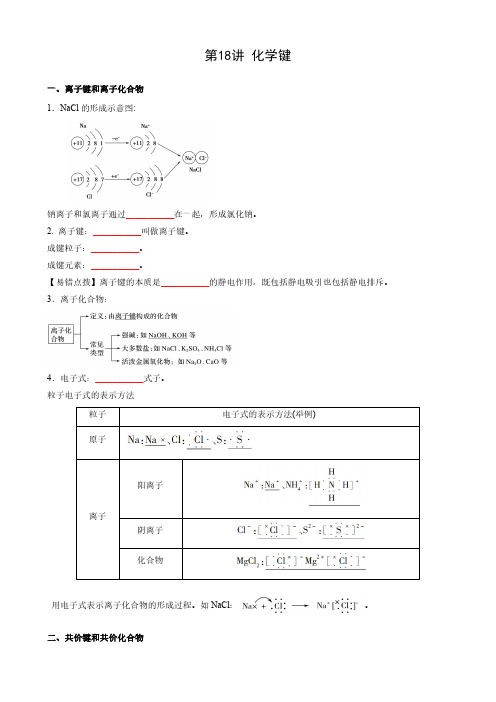
第18讲化学键一、离子键和离子化合物1.NaCl 的形成示意图:钠离子和氯离子通过___________在一起,形成氯化钠。
2.离子键:___________叫做离子键。
成键粒子:___________。
成键元素:___________。
【易错点拨】离子键的本质是___________的静电作用,既包括静电吸引也包括静电排斥。
3.离子化合物:4.电子式:___________式子。
粒子电子式的表示方法粒子电子式的表示方法(举例)原子离子阳离子阴离子化合物用电子式表示离子化合物的形成过程。
如NaCl :。
二、共价键和共价化合物形成过程(以Cl2的形成为例):定义:____________________________________________。
成键粒子:___________。
成键元素:____________________________________________。
2.分类3.共价化合物4.电子式(1)非金属单质:Cl2:,N2:。
(2)共价化合物:H2O:,CO2:。
(3)用电子式表示形成过程:HCl:。
5.结构式:___________如H2O:H—O—H。
6.以共价键形成的分子的表示方法分子电子式结构式分子结构模型分子空间构型H2H—H直线形HCl H—Cl直线形CO2O===C===O直线形H2O V形CH4正四面体形1.概念:____________________________________叫做化学键。
2.分类【判断物质中所含化学键类型的思路】(1)首先___________。
只含有共价键的物质有非金属单质(稀有气体除外)、非金属氧化物、酸、大部分有机物;只含有离子键的物质有大多数金属氧化物、简单的盐(如NaCl)、金属氢化物等;既含共价键又含离子键的物质有碱、含复杂离子的盐(如NH4Cl)、含活泼金属的特殊化合物(如Na2O2)。
(2)其次___________。
化学键(第1课时离子键)(备作业)2021-2022学年高一化学系列(人教版必修2)(解析版)

第一章物质结构元素周期律1.3.1离子键一、选择题(共12小题,每小题只有一个正确答案)1.下列物质中属于离子化合物的是Cl C.HCl D.HClOA.NaCl B.2【答案】ACl是非金属单质,B项错误;HCl只含共价键,【解析】NaCl含有离子键,属于离子化合物,A项正确;2属于共价化合物,C项错误;HClO只含共价键,属于共价化合物,D项错误。
答案选A。
2.下列叙述错误的是A.带相反电荷的离子之间的相互作用称为离子键B.某主族元素原子最外层只有一个电子,它与卤素原子结合时所形成的化学键不一定是离子键C.金属元素与非金属元素化合时,不一定形成离子键D.只由非金属元素形成的化合物中不可能含有离子键【答案】D【解析】带相反电荷的离子,就是阴、阳离子,相互作用就是静电作用,A项正确;主族元素原子最外层只有一个电子,可以是氢原子,它和卤素原子结合,如HF、HCl、HBr、HI,所形成的化学键为共价键,如主族元素是Li、Na、K,则和卤素原子结合所形成化学键为离子键,B项正确;金属元素与非金属元素化合时可能形成离子键,如NaCl、MgCl2等,也可能形成共价键,如AlCl3等,C项正确;非金属元素形成的化合物中可能含有离子键,如铵盐等,D项错误。
答案选D。
3.有关离子化合物的说法正确的是A.离子都具有8电子结构B.离子化合物内一定存在离子键C.盐酸中存在H+、Cl-,因此HCl是离子化合物D.任何非金属原子都可以形成简单阴离子【答案】B【解析】离子不一定都具有8电子结构,如Li+为2电子结构,A项错误;含有离子键的化合物为离子化合物,故离子化合物内一定存在离子键,B项正确;盐酸中存在H+、Cl-,但是HCl是共价化合物,C项错误;不是任何非金属原子都可以形成简单阴离子,如Si原子最外层4个电子,不易得电子也不易失电子,不易形成简单阴离子,D项错误。
答案选B。
4.下列结构示意图中,表示带两个单位负电荷的离子的是A .B .C .D .【答案】A【解析】核外电子数比质子数多2个,故带2个单位负电荷,A 项符合题意;核外电子数等于质子数,故不带电,B 项不合题意;核外电子数等于质子数,故不带电,C 项不合题意;核外电子数比质子数少2个,故带2个单位正电核,D 项不合题意。
高一化学化学键与分子间作用力试题答案及解析

高一化学化学键与分子间作用力试题答案及解析1.下列说法不正确的是A.化学反应中一定有化学键断裂,同时也有化学键形成B.含有共价键的化合物必是共价化合物C.含有阴离子的化合物一定含有阳离子D.金属元素和非金属元素形成的化合物不一定是离子化合物【答案】B【解析】A.化学反应的过程就是反应物的化学键断裂和生成物中的化学键形成的过程,因此在化学反应的过程中一定有化学键断裂,同时也有化学键形成,正确;B.含有共价键的化合物可能是共价化合物,也可能是离子化合物,错误;C.含有阴离子的化合物中根据电荷守恒一定含有阳离子,正确;D.金属元素和非金属元素形成的化合物可能是离子化合物,也可能是共价化合物,因此不一定是离子化合物,正确。
【考点】考查化合物与化学键的关系的知识。
2.下列化合物中,既含有离子键又含有共价键的是A.BaCl2B.H2O C.Ca(OH)2D.Na2O【答案】C【解析】A、氯化钡中只含有离子键,错误;B、水中只含有共价键,错误;C、氢氧化钙中钙离子与氢氧根离子之间是离子键,O与H之间是共价键,既含共价键又含离子键,正确;D、氧化钠中只含有离子键,错误,答案选C。
【考点】考查物质中化学键的判断3.按要求回答下列问题:(1)有下列六种物质:①碳60(C60)晶体②硼晶体③Na2O晶体④ CaF2晶体⑤P4O10晶体⑥碳化硅晶体。
其中属于离子晶体的是,属于分子晶体的是,属于原子晶体的是____。
(2)有下列分子:HCN、P4、SO3、PCl3、BF3,其中属于非极性分子的是。
(3)有下列离子:SO32-、SO42-、CO32-,其中VSEPR模型为正四面体形的是,中心原子的杂化轨道类型属于sp2杂化的是。
(4)CaO晶胞如右图所示,CaO晶体中Ca2+的配位数为______;与每一个钙离子距离最近并且距离相等的钙离子有____个;CaO晶体和NaCl晶体的晶格能分别为:CaO:3 401 kJ/mol、NaCl:786 kJ/mol。
高一下册第一章化学键

戴氏教育精品堂培训学校名校冲刺温馨提醒:态度决定成败,一份良好积极的心态,将有助于提升你的学习效率,提高你的考试成绩。
戴氏教育助你成功!高一化学——化学键一、考点、热点回顾一.化学键定义:在原子结合成分子时,相邻的原子之间强烈的相互作用,叫化学键。
1.离子键:定义:之间强烈的相互作用叫做离子键。
相互作用:静电作用(包含吸引和排斥)离子化合物:的化合物叫做离子化合物。
(1)活泼金属与活泼非金属形成的化合物。
如NaCl、Na2O、K2S等(2)强碱:如NaOH、KOH、Ba(OH)2、Ca(OH)2等(3)大多数盐:如Na2CO3、BaSO4(4)铵盐:如NH4Cl小结:一般是含金属元素的物质(化合物)和铵盐。
(一般规律)注意:a、酸不是离子化合物。
b、离子键只存在离子化合物中,离子化合物中一定含有离子键。
2.共价键:定义:原子间通过所形成的相互作用叫做共价键。
共价化合物:以共用电子对形成分子的化合物叫做共价化合物。
共价键的存在:非金属单质:H2、X2、N2等(稀有气体除外)共价化合物:H2O、CO2、SiO2、H2S等复杂离子化合物中:强碱、铵盐、含氧酸盐共价键的分类:非极性键:在的原子间形成的共价键为非极性键。
共用电子对不发生偏移。
极性键:在的原子间形成的共价键为极性键。
共用电子对偏向吸引能力强的一方。
3、化合物离子化合物共价化合物化合物中不是离子化合物就是共价化合物4、化学反应的实质:一个化学反应的过程,本质上就是过程。
①离子键与共价键的比较离子键共价键概念阴、阳离子间通过静电作用所形成的化学键原子间通过共用电子对(电子云重叠)所形成的化学键成键微粒离子(存在阴阳离子间和离子晶体内)原子(存在分子内、原子间、原子晶体内)作用本质阴、阳离子间的静性作用共用电子对(电子云重叠)对两原子核产生的电性作用形成条件活泼金属和活泼非金属化合时形成离子键非金属元素形成的单质或化合物形成共价键决定键能大小因素①离子电荷数越大,键能越大;②离子半径越小,键能越大①原子半径越小,键能越大;②键长越短,键能越大影响性质离子化合物的熔沸点、硬度等分子的稳定性,原子晶体的熔沸点、硬度等实例②极性共价键与非极性共价键的比较共价键极性共价键非极性共价键定义的原子形成的共价键,共用电子对(电子云重叠)发生偏移的共价键的原子形成共价键,共用电子对(电子云重叠)不发生偏移原子吸引电子能力不相同相同影响性质极性分子或非极性分子非极性分子实例H—Cl H—H、Cl—Cl ③离子键、共价键与离子化合物、共价化合物的关系化学键的种类实例非金属单质无化学键稀有气体分子(单原子分子)He、Ne非极性共价键O=O、Cl—Cl、H—H(均为非极性分子)共价化合物只有共价键特例:AlCl3极性分子:非极性分子:离子化合物只有离子键、离子键、极性共价键离子键、非极性共价键离子键、极性共价键、配位键金属键与范德华力、氢键存在范围作用本质作用强弱决定键能大小因素影响性质金属键金属阳离子和自由电子之间及金属晶体内静电作用强①离子电荷数越大,键能越大;②离子半径越小,键能越大金属晶体的熔沸点、硬度等范德华力分子间和分子晶体内电性引力弱结构相似的分子,其式量越大,分子间作用力越大。
高中化学(二十七)化学键与分子间作用力高一化学试题

实蹲市安分阳光实验学校课时跟踪检测(二十七)化学键与分子间作用力A级—学业水平考试达标练1.能证明氯化氢是共价化合物的现象是( )A.HCl极易溶于水B.液态HCl不能导电C.HCl在水溶液中完全电离D.HCl是无色有刺激性气味的气体解析:选B 液态HCl不能导电说明没有游离态的离子存在,故H原子和Cl原子之间的相互作用是共价键,因此HCl为共价化合物。
2.下列说法中不正确的是( )A.共价化合物中没有离子键B.离子化合物中不一没有共价键C.共价化合物中可以有离子键D.离子键只能存在于离子化合物中解析:选C 离子键只能存在于离子化合物中,共价化合物中只能有共价键。
3.下列物质中,含共价键的离子化合物是( )A.MgCl2B.N2C.HCl D.Na2O2解析:选D Na2O2中既含共价键又含离子键,属于离子化合物。
4.下列有关化学键的叙述正确的是( )A.离子化合物中一含有离子键B.单质分子中均存在化学键C.由不同种非金属的原子形成的共价化合物一只含极性键D.含共价键的化合物一是共价化合物解析:选A 由离子键形成的化合物是离子化合物,A项正确;稀有气体单质分子(如氖)不存在化学键,B项错误;由不同种非金属元素的原子形成的共价化合物如H2O2含极性键和非极性键,C项错误;氢氧化钠含共价键,但氢氧化钠是离子化合物,D项错误。
5.下列说法中正确的是( )A.HF、HCl、HBr、HI的热稳性依次减弱,沸点却依次升高B.熔融状态下能导电的化合物一含离子键;金属与非金属元素形成的化合物一是离子化合物C.NCl3分子中所有的原子均为8电子稳结构D.NaHSO4溶于水时发生NaHSO4===Na++H++SO2-4,此时破坏的只有离子键解析:选C HF可以形成分子间氢键,所以沸点高;金属与非金属形成的化合物不一是离子化合物,离子化合物是由活泼金属和活泼非金属形成的;NaHSO4溶于水时破坏了离子键和共价键。
6.下列说法不正确的是( )A.H2O、H2S、H2Te分子间作用力依次增大B.石墨转化为石,既有化学键的断裂,也有化学键的形成C.碘单质升华克服的是分子间作用力D.KClO3分解生成KCl和O2的过程中有离子键和共价键的断裂和形成解析:选A H2O分子间存在氢键,H2S、H2Te分子间不存在氢键,H2Te的相对分子质量大于H2S,所以H2Te的分子间作用力大于H2S,因此分子间作用力大小顺序为H2O>H2Te>H2S,A错误;石墨转化为石是化学变化,既有化学键的断裂,又有化学键的形成,B正确;碘是分子晶体,碘单质升华克服的是分子间作用力,C正确;KClO3分解生成KCl和O2的过程中有离子键和共价键的断裂(K+与ClO-3形成的离子键、Cl—O共价键)和形成(K+与Cl-形成的离子键、O===O共价键),D正确。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中学生学科素质训练高一化学同步测试—化学键说明:本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试用时90分钟.第Ⅰ卷(选择题,共48分)一、选择题(本题包括6小题,每小题3分,共18分。
每小题只有一个选项符合题意) 1.下列物质中属于离子化合物的是 ( )A .苛性钠B .碘化氢C .硫酸D .醋酸2.下列有关化学键的描述正确的是 ( )A .一种万有引力B .相邻的两个或多个原子之间的强烈的相互作用C .一种静电引力D .相邻的两个原子间的相互作用力3.能形成离子键的是( )A .任何金属元素与非金属元素间的化合B .只限于VIIA 族元素与IA 族元素之间的化合C .任意两种元素间的化合D .活泼金属元素与活泼非金属元素间的化合4.下列关于电子式的说法正确的是( )A .电子式中的小黑点表示原子核外电子B .简单阳离子的电子式与它的离子符号相同C .阴离子的电子式与它的离子符号相同D .电子式就是表示核外电子排布的式子 5.下列化合物中阴离子半径和阳离子半径之比最大的是 ( )A .LiIB .NaBrC .KClD .CsF6.下列表示电子式的形成过程正确的是( )A .H Cl H Cl ⨯+⋅→⎡⎣⎢⎤⎦⎥+⋅⨯-..:..:....B .Na Br Na Br ⨯++⋅→⋅..:..:....C .Mg F Mg F F ⨯⨯+⋅⨯-⋅⨯-+⋅→⎡⎣⎢⎤⎦⎥⎡⎣⎢⎤⎦⎥22..:..:..:......D .O C O O C O..::....::..........++→⨯⨯⨯⨯⨯⨯⨯⨯二、选择题(本题包括10小题,每小题3分,共30分。
每小题有一至二个选项符合题意,少选扣1分,多选、错选均不给分)7.下列化合物中,含有共价键的离子化合物是()A.NaOH B.MgBr2C.NH4Cl D.HCl8.下列性质中,可以证明某化合物内一定存在离子键的是()A.可溶于水B.有较高的熔点C.水溶液能导电D.熔融状态能导电9.下列反应过程中,同时有离子键,极性共价键和非极性共价键的断裂和形成的反应是()A.NH4Cl NH3↑+ HCl↑B.2Na2O2+2 CO22Na2 CO3+O2C.2NaOH+Cl2NaCl+NaClO+H2O D.NH3+CO2+H2O NH4HCO310.近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80Mpa下合成出金刚石,具有深远意义。
下列说法不正确...的是()A.由二氧化碳合成金刚石是化学变化B.金刚石是碳的一种同位素C.钠被氧化最终生成碳酸钠D.金刚石中只含有非极性共价键11.对于X—O—H型化合物而言,X是除H、O外的其他元素时,下列说法中正确的是()A.当X是活泼金属时,它一定是强碱B.当X是非金属性很强的元素时,X—O—H一定是强酸C.X—O—H的水溶液不能导电D.X—O—H一定是共价化合物12.下列叙述中正确的是()A.离子化合物中可能含有共价键B.共价化合物中可能含有离子键C.金属离子都一定满足最外电子层2或8电子结构D.共价化合物中各原子都一定满足最外层8电子结构13.碱金属与卤素所形成的化合物大都具有的性质是()①高沸点②能溶于水③水溶液能导电③低熔点④熔融状态不导电A.①④⑤B.③④⑤ C.①②③D.②③⑤14.同主族元素的性质相似,往往可以形成结构和性质相似的化合物,试根据你学过的知识判断。
下列有关PH4I(碘化磷)的结构和性质推测结果不正确的是()A.PH4I可由PH3和HI化合而得B.PH4I在物质分类中属于正盐C.PH4I对热不稳定,受热时产生有色气体。
D.PH4I属于共价化合物15.离子键的强弱主要决定于离子半径和离子电荷数,一般规律是:离子半径小,离子所带电荷值大,则离子键越强。
①K 2O ②MgO ③CaO 三种物质离子键由强到弱的顺序是( )A .K 2O 、MgO 、CaOB .MgO 、CaO 、K 2OC .MgO 、K 2O 、CaOD .CaO 、K 2O 、MgO16.甲、乙、丙、丁四位学生对发现H 3分子的认识,正确的是 ( )A .甲认为发现H 3分子是不可能的,因为违背了共价键理论B .乙认为宇宙中还存在另一种氢单质,理由是氢有三种同位素,必然有三种同素异形体C .丙认为上述发现的存在,证明传统的价键理论有一定的局限性,理论有待于进一步发展D .丁认为H 3分子实质上是H 2分子与H +以配位键形式结合的产物,应该写成H 3+第Ⅱ卷(共52分)三、填空题(共7小题,计52分)17.(5分)在NaCl 、NaOH 、Na 2O 2、O 2、H 2S 、H 2O 2、NH 4Cl 、HCl ,只含有离子键的是 ,只含有极性键的是 ,含有非极性键的是 ,既含有离子键又含有极性键的是 ,既含有离子键又含有非极性键的是 。
18其中可以形成离子化合物的一组是________,可以形成共价化合物的一组是_______,元素化学性质十分相似的一组是_______,均属于非金属元素的一组是________。
19.(8代表原子序数从1到10的原子的原子实(原子实是原子除最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键(示例:F2: )。
A B C D 根据各图表示的结构的特点,写出该分子的化学式:A_______________B______________C____________ D_________________20.(9分)W 、X 、Y 、Z 为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素。
Y和W的最外层电子数相等。
Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。
由此可知:(1)写出元素符号:W为_________,X为________,Y为_________,Z为__________。
(2)W2Z是由___________键组成的分子,其电子式为______________。
(3)由Y、X、W组成的物质中有_______键和_______键组成的_______化合物。
21.(7分)A、B、C三种元素为短周期元素。
A元素的阴离子不能被任何氧化剂氧化,则A 离子的结构示意图为___________,它是_____离子。
1 mol B单质能从盐酸中置换出3 g 氢气,此时B转变为与Ne原子具有相同电子层结构的离子,则B元素是_______;B 的最高价氧化物的对应水化物的化学式为____________。
C元素有3个电子层,且最外电子层比L电子层少2个电子,则C元素是__________;C与Na反应后生成物的电子式为________,化合物中的化学键属于____________。
22.(8分)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。
键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
请回答下列问题:(1)比较下列两组物质的熔点高低(填“>”或“<”)SiC Si;SiCl4SiO2(2)右图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。
●23.(11分)有两种气态单质A m和B n,已知2.4g A m和2.1g B n所含的原子个数相同,分子个数比是2:3,又知A和B的原子核内质子数都等于中子数,A原子内的L电子层所含电子数是K层电子数的3倍,则:(1)A和B的元素符号分别是A_________ B__________(2)A m中的m值是________,A m的同素异形体是__________。
(3)B的气态氢化物与B的最高价氧化物的对应水化物反应生成的化合物的化学式为_ _______________。
(4)写出B元素与氢元素形成的10电子阳离子及B n单质的电子式__________、_________。
●● ●●●参考答案一、选择题1.A 2.B 3.D 4.B 5.A 6.D 二、选择题7.AC 8.D 9.B 10.B 11.AB 12.A 13.C 14.D 15.B 16.C 三、填空题17.NaCl , H 2S 、HCl , O 2 、H 2O 2、 Na 2O 2,NaOH 、NH 4Cl , Na 2O 2。
18.(4),(3),(2),(3)19.A :NH 3 B :HCN C :CO(NH 2)2 D :BF 320.(1)H ,O ,Na ,S ;(2)共价,H S H ⨯⨯......;(3)共价,离子,离子 21. +9 ,氟,Al ,Al OH ()3,S ,Na S Na +⨯⨯-+⎡⎣⎢⎤⎦⎥......2,离子键22.(1)> < (2)如图23.(1)O 、N (2)3 O 2(3)NH 4NO 3(4)● ●● ●●x H x H+。
