傅献彩第五版物理化学ppt课件08章 电解质溶液分解
傅献彩《物理化学》第五版课件及习题答案_10电解与极化作用
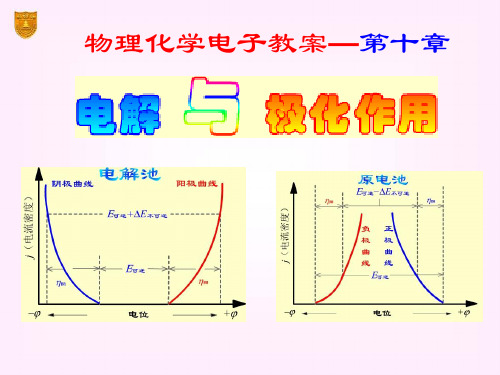
§10.2 极化作用
例如电解一定浓度的硝酸银溶液 阴极反应
Ag + (mAg+ ) e Ag(s)
可逆
电解时
RT 1 Ag |Ag ln F aAg+
阴
可逆 > 不可逆 阳极上有类似的情况,但 可逆 < 不可逆
动势达极大值 Eb,max。
电 流 I
3
再增加电压,使I 迅速增 加。将直线外延至I = 0 处, 得E(分解)值,这是使电解
2 1
池不断工作所必需外加的 最小电压,称为分解电压。
E分解
电压E
测定分解电压时的电流-电压曲线
实际分解电压
要使电解池顺利地进行连续反应,除了克服作
为原电池时的可逆电动势外,还要克服由于极化在
生消耗氧的还原反应:
O2 (g)+4H+ 4e 2H2O
(O2 |H2O,H+ )
RT 1 ln 4 4F aO2 aH +
1.229 V
设 aO2 1, aH+ 107 , 则 (O2 |H2O,H+ ) 0.816V
这时与 E(Fe2+ |Fe) (-0.617V)阳极组成原电池的电动 势为 1.433 V 显然耗氧腐蚀比析氢腐蚀严重得多。
所以铁很快腐蚀形成铁锈。
CO2 SO2
Fe2+
H 2或 H 2O
O2
O2
H
Cu
+
H2 O
Fe
2e-
H2 O
H+
Cu
电化学腐蚀示意图
物理化学上册绪论课件PPT

20
【例】
求2mol理想气体,在压力为101.325 kPa下,体积为 0.0448 m3时的温度(R=8.3145 J· mol-1· K-1)。 解:
6
绪 言
物理化学的建立与发展
1887年德国科学家奥斯特瓦尔德和荷兰科学家范特霍 夫合办的《物理化学杂志》(德文)创刊。
俄国科学家罗蒙诺索夫最早使用“物理化学”这一术语。
7
物理现象
化学现象
物理化学
应用物理学的实验方法
物质的性质和结构的关系 化学反应过程中的普遍性规律
8
物理化学课程的基本内容
在通常温度和压力下,将一定量的氢气和氧气按照
pV 2 RT
pV 2 8.3145J K 1 T
101.325 103 0.0448 T K 2 8.3145 T 273 K
22
第1章 化学热力学基础
1.0 化学热力学理论的基础和方法
热力学第一定律(能量守恒)
热力学第二定律(物质变化过程的方向与限度)
热力学第一定律和第二定律都是经验规律。
热力学第三定律(化学平衡计算)
23
1.0 化学热力学理论的基础和方法
pV nRT
3
101.325 103 0.0448 2 8.3145 T 101.325 10 0.0448 2 RT / K
101.325 103 0.0448 2 8.3145 T / K
21
求2mol理想气体,在压力为101.325 kPa下,体积为 0.0448 m3时的温度(R=8.3145 J· mol-1· K-1)。 解:
(NEW)傅献彩《物理化学》(第5版)笔记和课后习题(含考研真题)详解

目 录第1章 气 体1.1 复习笔记1.2 课后习题详解1.3 名校考研真题详解第2章 热力学第一定律2.1 复习笔记2.2 课后习题详解2.3 名校考研真题详解第3章 热力学第二定律3.1 复习笔记3.2 课后习题详解3.3 名校考研真题详解第4章 多组分系统热力学及其在溶液中的应用4.1 复习笔记4.2 课后习题详解4.3 名校考研真题详解第5章 相平衡5.1 复习笔记5.2 课后习题详解5.3 名校考研真题详解第6章 化学平衡6.1 复习笔记6.2 课后习题详解6.3 名校考研真题详解第7章 统计热力学基础7.1 复习笔记7.2 课后习题详解7.3 名校考研真题详解第8章 电解质溶液8.1 复习笔记8.2 课后习题详解8.3 名校考研真题详解第9章 可逆电池的电动势及其应用9.1 复习笔记9.2 课后习题详解9.3 名校考研真题详解第10章 电解与极化作用10.1 复习笔记10.2 课后习题详解10.3 名校考研真题详解第11章 化学动力学基础(一)11.1 复习笔记11.2 课后习题详解11.3 名校考研真题详解第12章 化学动力学基础(二)12.1 复习笔记12.2 课后习题详解12.3 名校考研真题详解第13章 表面物理化学13.1 复习笔记13.2 课后习题详解13.3 名校考研真题详解第14章 胶体分散系统和大分子溶液14.1 复习笔记14.2 课后习题详解14.3 名校考研真题详解第1章 气 体1.1 复习笔记一、气体分子动理论1.理想气体理想气体:在任何压力、任何温度下都符合理想气体状态方程pV=nRT 的气体。
理想气体状态方程中,p为气体压力,单位是Pa;V为气体的体积,单位是m3;n为物质的量,单位是mol;T为热力学温度,单位是K;R是摩尔气体常数,。
2.气体分子动理论的基本公式(1)气体分子运动的微观模型①气体是大量分子的集合体;②气体分子不断地作无规则的运动,均匀分布在整个容器之中;③分子彼此的碰撞以及分子与器壁的碰撞是完全弹性的。
南京大学物理化学下册 第五版傅献彩 复习题及解答

第八章 电解质溶液第九章1.可逆电极有哪些主要类型?每种类型试举一例,并写出该电极的还原反应。
对于气体电极和氧化还原电极在书写电极表示式时应注意什么问题?答:可逆电极有三种类型:(1)金属气体电极 如Zn(s)|Zn2+ (m) Zn2+(m) +2e- = Zn(s)(2)金属难溶盐和金属难溶氧化物电极 如 Ag(s)|AgCl(s)|Cl-(m), AgCl(s)+ e- = Ag(s)+Cl-(m)(3)氧化还原电极 如: Pt|Fe3+(m1),Fe2+(m2) Fe3+(m1) +e- = Fe2+(m2)对于气体电极和氧化还原电极,在书写时要标明电极反应所依附的惰性金属。
2.什么叫电池的电动势?用伏特表侧得的电池的端电压与电池的电动势是否相同?为何在测电动势时要用对消法?答:正、负两端的电势差叫电动势。
不同。
当把伏特计与电池接通后,必须有适量的电流通过才能使伏特计显示, 这样电池中发生化学反应, 溶液浓度发生改变, 同时电池有内阻,也会有电压降,所以只能在没有电流通过的情况下才能测量电池的电动势。
3.为什么Weslon标准电池的负极采用含有Cd的质量分数约为0.04~0.12的Cd一Hg齐时,标准电池都有稳定的电动势值?试用Cd一Hg的二元相图说明。
标准电池的电动势会随温度而变化吗?答:在Cd一Hg的二元相图上,Cd的质量分数约为0.04~0.12的Cd一Hg齐落在与Cd一Hg固溶体的两相平衡区,在一定温度下Cd一Hg齐的活度有定值。
因为标准电池的电动势在定温下只与Cd一Hg齐的活度有关,所以电动势也有定值,但电动势会随温度而改变。
4.用书面表示电池时有哪些通用符号?为什么电极电势有正、有负?用实验能测到负的电动势吗?答:用“|”表示不同界面,用“||”表示盐桥。
电极电势有正有负是相对于标准氢电极而言的。
不能测到负电势。
5.电极电势是否就是电极表面与电解质溶液之间的电势差?单个电极的电势能否测量?如何用Nernst方程计算电极的还原电势?5.电极电势是否就是电极表面与电解质溶液之间的电势差?单个电极的电势能否测量?如何用Nernst 方程计算电极的还原电势?答:电极电势不是电极表面与电解质溶液之间的电势差。
《傅献彩 物理化学 第5版 笔记和课后习题 含考研真题 详解》读书笔记思维导图

012
第12章 化学动力学 基础(二)
014
第14章 胶体分散系 统和大分子溶液
傅献彩主编的《物理化学》(第5版)是我国高校化学类广泛采用的权威教材之一,也被众多高校(包括科 研机构)指定为考研考博专业课参考书目。为了帮助参加研究生招生考试指定参考书目为傅献彩主编的《物理化 学》(第5版)的考生复习专业课,我们根据该教材的教学大纲和名校考研真题的命题规律精心编写了傅献彩《物 理化学》(第5版)辅导用书(均可免费试读,阅读全部内容需要单独购买):1.傅献彩《物理化学》(第5版) 笔记和课后习题(含考研真题)详解2.傅献彩《物理化学》(第5版)(上册)配套题库【名校考研真题+课后 习题+章节题库+模拟试题】3.傅献彩《物理化学》(第5版)(下册)配套题库【名校考研真题+课后习题+ 章节题库+模拟试题】本书是傅献彩主编的《物理化学》(第5版)的配套电子书,主要包括以下内容:(1)梳 理知识脉络,浓缩学科精华。本书每章的复习笔记均对该章的重难点进行了整理,并参考了国内名校名师讲授该 教材的课堂笔记。因此,本书的内容几乎浓缩了该教材的所有知识精华。(2)详解课后习题,巩固重点难点。本 书参考大量相关辅导资料,对傅献彩主编的《物理化学》(第5版)教材的课后习题进行了详细的分析和解答,并 对相关重要知识点进行了延伸和归纳。(3)精选考研真题,培养解题思路。本书精选详析了部分名校近年来的相 关考研真题,这些高校大多以该教材作为考研参考书目。所选考研真题基本涵盖了每章的考点和难点,考生可以 据此了解考研真题的命题风格和难易程度,并检验自己的复习效果。(4)免费更新内容,获取最新信息。本书定 期会进行修订完善,补充最新的考研真题和答案。对于最新补充的考研真题和答案,均可以免费升级获得。本书 特别适用于参加研究生入学考试的考生,也可供各大院校师生学习参考。
物理化学第五版课件

Ω –1 Ω –1 . m –1 Ω –1 . m2 . mol –1
c
GK K c R c
二、电导的测定: ①惠斯通 Wheatstone 交流电桥:
D Rs A R1 C Rx R2 B
C、D 间电流为 0,电位相等 电桥达到平衡:
Rs R AC 1 Rx R2 CB
Gx
1 1 AC Rx Rs CB
②电导(率)仪: 完全不同于交流电桥,它是基于电阻分 压原理的一种不平衡测量方法。稳压器输出稳定的直流电 压,供振荡器和放大器使用。振荡器输出的电压不随电导池 电阻 Rx 的变化而改变,从而为电阻分压回路(由电导池 Rx 和 测量电阻箱 Rs 串联而成)提供一个稳定的音频标准电压 E。
二、离子强度 ionic strength
在稀溶液中,影响 γ± 的因素主要是浓度和价型。
I
1 bi zi2 2 i
lg
I
(P17)例: 试分别求算下列溶液的离子强度I和质量摩尔浓度b之间的关系:KCl、 MgCl2、FeCl3、ZnSO4、Al2(SO4)3。 (P18)例: 同时含0.1 mol . kg –1 KCl和0.01 mol . kg –1 BaCl2的水溶液,其离子强 度是多少?
三、德拜—休克尔极限公式 Debye-Hückel’s limiting law
(P19)例: 用德拜—休克尔极限公式计算25℃时 b = 0.005 mol . kg –1 ZnCl2 水溶液中,ZnCl2的γ±、b±、a±、a、γ。
例: 试用德拜—休克尔极限公式计算25℃时BaSO4在 (1)纯水;(2)0.01 mol . dm –3 ZnCl2;(3)0.01 mol . dm –3 Na2SO4中的溶解度。 已知BaSO4在水中的溶度积Ksp = 0.916×10 –10 。 例: 试比较AgCl在下列液体中的溶解度: (a)H2O (b)0.1cø NaNO3 (c) 0.1cø NaCl (d) 0.1cø Ca(NO3)2
傅献彩第五版物理化学ppt课件06章化学平衡
对于沉淀MA,Ksp=[M][A];对于沉 淀AB,Ksp=[A]^2[B]^3;对于沉淀 AB2,Ksp=[A]^3[B]^2。
03
影响因素
内因是难溶物质本身的性质;外因是 温度,大部分固体物质的溶解度随温 度的升高而增大。
沉淀生成与溶解条件
沉淀生成条件
Qc>Ksp,改变离子浓度(如 稀释、加沉淀剂等)使Qc减
当Qc>Ksp时,溶液中有沉淀生成;当 Qc=Ksp时,溶液处于沉淀溶解平衡状态 ;当Qc<Ksp时,溶液中的沉淀会溶解。
氧化还原平衡
氧化还原反应的定义
01
有电子得失或共用电子对偏移的化学反应,即氧化剂和还原剂
之间的反应。
氧化还原平衡常数
02
表示氧化剂和还原剂在溶液中达到氧化还原平衡时,各物质浓
度幂的乘积与反应商的比值,是一个常数。
氧化产物与还原产物
还原剂在反应中失去电子后被氧化 的产物称为氧化产物;氧化剂在反 应中获得电子后被还原的产物称为 还原产物。
原电池与电极电势
原电池
将化学能转变为电能的装置。
电极电势
电极与溶液之间的电势差,用符号 “E”表示,单位为V。
标准电极电势
在标准状态下,电极反应中各物种的活 度(或浓度)均为1 mol/L时的电极电 势。
小。
沉淀溶解条件
Qc<Ksp,改变离子浓度(如 加酸、加热等)使Qc增大。
溶度积规则
当溶液中的离子浓度幂的乘 积等于溶度积时,则溶液是 饱和的;若小于溶度积,则 溶液是不饱和的;若大于溶 度积,则会有沉淀析出。
分步沉淀与共沉淀现象
分步沉淀
在含有多种难溶物的溶液中,当改变条件使其中一种难溶物 沉淀析出时,其他难溶物可能随之析出的现象。分步沉淀的 次序与难溶物的溶度积常数和溶液中相应离子的浓度有关。
南京大学物理化学下册(第五版傅献彩)复习题及解答
第八章电解质溶液第九章1.可逆电极有哪些主要类型?每种类型试举一例,并写出该电极的还原反应。
对于气体电极和氧化还原电极在书写电极表示式时应注意什么问题?答:可逆电极有三种类型:(1)金属气体电极如Zn(s)|Zn2+ (m) Zn2+(m) +2e- = Zn(s)(2)金属难溶盐和金属难溶氧化物电极如Ag(s)|AgCl(s)|Cl-(m), AgCl(s)+ e- = Ag(s)+Cl-(m)(3)氧化还原电极如:Pt|Fe3+(m1),Fe2+(m2) Fe3+(m1) +e- = Fe2+(m2)对于气体电极和氧化还原电极,在书写时要标明电极反应所依附的惰性金属。
2.什么叫电池的电动势?用伏特表侧得的电池的端电压与电池的电动势是否相同?为何在测电动势时要用对消法?答:正、负两端的电势差叫电动势。
不同。
当把伏特计与电池接通后,必须有适量的电流通过才能使伏特计显示,这样电池中发生化学反应,溶液浓度发生改变,同时电池有内阻,也会有电压降,所以只能在没有电流通过的情况下才能测量电池的电动势。
3.为什么Weslon标准电池的负极采用含有Cd的质量分数约为0.04~0.12的Cd一Hg齐时,标准电池都有稳定的电动势值?试用Cd一Hg的二元相图说明。
标准电池的电动势会随温度而变化吗?答:在Cd一Hg的二元相图上,Cd的质量分数约为0.04~0.12的Cd一Hg齐落在与Cd一Hg固溶体的两相平衡区,在一定温度下Cd一Hg齐的活度有定值。
因为标准电池的电动势在定温下只与Cd一Hg齐的活度有关,所以电动势也有定值,但电动势会随温度而改变。
4.用书面表示电池时有哪些通用符号?为什么电极电势有正、有负?用实验能测到负的电动势吗?答:用“|”表示不同界面,用“||”表示盐桥。
电极电势有正有负是相对于标准氢电极而言的。
不能测到负电势。
5.电极电势是否就是电极表面与电解质溶液之间的电势差?单个电极的电势能否测量?如何用Nernst方程计算电极的还原电势?5.电极电势是否就是电极表面与电解质溶液之间的电势差?单个电极的电势能否测量?如何用Nernst 方程计算电极的还原电势?答:电极电势不是电极表面与电解质溶液之间的电势差。
南京大学物理化学下册(第五版傅献彩)复习题及解答
第八章电解质溶液第九章1.可逆电极有哪些主要类型?每种类型试举一例,并写出该电极的还原反应。
对于气体电极和氧化还原电极在书写电极表示式时应注意什么问题?答:可逆电极有三种类型:(1)金属气体电极如Zn(s)|Zn2+ (m) Zn2+(m) +2e- = Zn(s)(2)金属难溶盐和金属难溶氧化物电极如Ag(s)|AgCl(s)|Cl-(m), AgCl(s)+ e- = Ag(s)+Cl-(m)(3)氧化还原电极如:Pt|Fe3+(m1),Fe2+(m2) Fe3+(m1) +e- = Fe2+(m2)对于气体电极和氧化还原电极,在书写时要标明电极反应所依附的惰性金属。
2.什么叫电池的电动势?用伏特表侧得的电池的端电压与电池的电动势是否相同?为何在测电动势时要用对消法?答:正、负两端的电势差叫电动势。
不同。
当把伏特计与电池接通后,必须有适量的电流通过才能使伏特计显示,这样电池中发生化学反应,溶液浓度发生改变,同时电池有内阻,也会有电压降,所以只能在没有电流通过的情况下才能测量电池的电动势。
3.为什么Weslon标准电池的负极采用含有Cd的质量分数约为0.04~0.12的Cd一Hg齐时,标准电池都有稳定的电动势值?试用Cd一Hg的二元相图说明。
标准电池的电动势会随温度而变化吗?答:在Cd一Hg的二元相图上,Cd的质量分数约为0.04~0.12的Cd一Hg齐落在与Cd一Hg固溶体的两相平衡区,在一定温度下Cd一Hg齐的活度有定值。
因为标准电池的电动势在定温下只与Cd一Hg齐的活度有关,所以电动势也有定值,但电动势会随温度而改变。
4.用书面表示电池时有哪些通用符号?为什么电极电势有正、有负?用实验能测到负的电动势吗?答:用“|”表示不同界面,用“||”表示盐桥。
电极电势有正有负是相对于标准氢电极而言的。
不能测到负电势。
5.电极电势是否就是电极表面与电解质溶液之间的电势差?单个电极的电势能否测量?如何用Nernst方程计算电极的还原电势?5.电极电势是否就是电极表面与电解质溶液之间的电势差?单个电极的电势能否测量?如何用Nernst 方程计算电极的还原电势?答:电极电势不是电极表面与电解质溶液之间的电势差。
傅献彩《物理化学》(第5版)(下册)章节题库-电解质溶液(圣才出品)
十万种考研考证电子书、题库视频学习平台
第三部分 章节题库
第 8 章 电解质溶液
一、选择题 1.298K,当 H2SO4 溶液的质量摩尔浓度从 0.01mol·kg-1 增加到 0.1mol·kg-1 时, 其电导率к和摩尔电导率 ∧m 的变化将( )。 A.к减小,∧m 增加 B.к增加,∧m 增加 C.к减小,∧m 减小 D.к增加,∧m 减小 【答案】D 【解析】H2SO4 为强电解质,强电解质的溶液的电解率随浓度的增加(即导电粒子的增 多)而升高;摩尔电导率降低,因为,溶液中能导电的物质的量已经给定,都为 1mol,当 浓度增加时,粒子间的相互作用增强,正、负离子的运动速率减小,因而摩尔电导率降低。
5 / 92
圣才电子书 十万种考研考证电子书、题库视频学习平台
I (NaCl) = 1 (b 12 + b 12 ) = b 2
I
(CaOl
2)
=
1 2
(b
22
+
2b 12
)
=
3a
I
( LaCl3 )
=
1 2
(b
32
+
3b 12
)
=
6a
分别代入德拜-休克尔极限公式:
1 2
22 b+ + 22 b−
比较可得:( )1>( )2
9.下列问题中哪个不能通过电导实验测定得到解决( )。 A.求难溶盐的 Ksp;
B.求离子的平均活度系数 ;
C.求弱电解质的电离度; D.测定电解质溶液的浓度。 【答案】B 【解析】电通过导实验测定可以求出弱电解质的电离常数和解离平衡常数,计算出微溶
No c : lg 1 = − A1 b = − A b
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电化学主要是研究电能和化学能之间的 相互转化及转化过程中有关规律的科学。
电解
电能
化学能
电池
电化学的用途
⒈电解 精炼和冶炼有色金属和稀有金属 电解法制备各种化工原料、金属 复合材料和表面特种材料 电镀法保护和精饰金属 阳极钝化和氧化着色等
⒉ 电池 汽车、宇宙飞船、照明、通讯、生
化和医学等方面都要用不同类型的化学 电源。
在电解池中, 用惰性电极
-
- 电源 +
e-
+
e-
Pt
Pt
Na 2SO4
电解池
阳极上发生氧化作用
2H2Ol O2(g) 4H 4e
阴极上发生还原作用
2H aq 2e H2(g)
电极上的反应次序由 离子的活泼性决定
在电解池中,
阳极上发生氧化作用
都用铜作电极
-
- 电源 +
e-
+
e-
Cu
Cu
Cu(s,电极) Cu2 aq 2e
第二类导体的特点是:
A. 正、负离子作反向移动而导电 B. 导电过程中有化学反应发生 C. 温度升高,电阻下降 D. 导电总量分别由正、负离子分担 *固体电解质,如 AgBr、PbI2 等,也属于离子 导体,但它导电的机理比较复杂,导电能力不高, 本章以讨论电解质水溶液为主。
正极、负极、
正极: 电势高的极称为正极,电流从正极
⒊ 电化学分析
⒋ 生物电化学
能导电的物质称为导电体,通常分为两类: 第一类导体又称电子导体,如金属、石墨等 第一类导体的特点是:
A. 自由电子作定向移动而导电 B. 导电过程中导体本身不发生变化 C. 温度升高,电阻也升高 D. 导电总量全部由电子承担
第二类导体又称离子导体,如电解质溶液、熔 融电解质等
人们把在数值上等于1 mol元电荷的电量称为 Faraday常数。
已知元电荷电量 e 为 1.60221019 C
F Le 6.0221023 mol1.602 21019 C
96 484.6 C mol1 96 500 C mol1
如果在电解池中发生如下反应:
Mz ze M(s)
Q z+ F
MB
这就是Faraday电解定律的数学表达式
根据电学上的计量关系
I dQ / dt
t
Q 0 Idt
若电流强度是稳定的的,则
Q I t
荷电粒子基本单元的选取
根据法拉第定律,通电于若干串联电解池中,每
个电极上析出物质的物质的量相同,这时,所选取的
基本粒子的荷电绝对值必须相同。例如:
荷一价电
在原电池中
阳离子迁向阴极
负
负载电阻
正
极 eZn
Cu 极e-
e-
阳 Zn2+ Cu2+ 阴
极 SO24-
SO24- 极
ZnSO4溶液 CuSO4溶液
Danill电池
在阴极上发生还原的是
Cu2 aq 2e Cu(s)
阴离子迁向阳极 在阳极上发生氧化的是
Zn s Zn2(aq) 2e
在电极上发生反应的先后由其性质决定
M
(O2
)
0.0183 mol 1 32.0 g mol1 0.146 g
4
解2 若电极反应表示为
阴极 Au3+ (aq) 3e Au(s)
阳极
3 2
H2O(l)
3 4
O2
(g)
3H+
3e
析出1.20g Au(s)时的反应进度为
物理化学电子教案—第八章
电解
电能
电池
化学能
2020/10/6
第八章 电解质溶液
§8.1 电化学中的基本概念和电解定律 §8.2 离子的电迁移率和迁移数 §8.3 电解质溶液的电导 §8.4 电解质的平均活度和平均活度因子 §8.5 强电解质溶液理论简介
2020/10/6
§8.1 电化学中的基本概念和电解定律
1.20 g
1.20 g
0.0183 mol
M (1 Au) 1 197.0 g mol-1
3
3
(1) Q zF 1 96500 C mol1 0.0183 Q I
176 0.025
6C C s1
7.06 104
s
(3)
m(O2
)
0.0183
mol
1 4
阴极上发生还原作用
Cu2 aq 2e Cu(s)
CuSO4
电解池
电极有时也可发生反应
Faraday电解定律
Faraday 归纳了多次实验结果,于1833年
总结出了电解定律 ⒈ 在电极界面上发生化学变化物质的质量 与通入的电荷量成正比。
⒉ 通电于若干个电解池串联的线路中,当 所取的基本粒子的荷电数相同时,在各个电 极上发生反应的物质,其物质的量相同,析 出物质的质量与其摩尔质量成正比。
流向负极。
负极: 电势低的极称为负极,电子从负极
流向正极。
阴极、阳极
阴极: 发生还原作用的极称为阴极。
在原电池中,阴极是正极;在
(Cathode)
电解池中,阴极是负极。
阳极: 发生氧化作用的极称为阳极。
(Anode)
在原电池中,阳极是负极;在
电解池中,阳极是正极。
在电解池中
-
- 电源 +
e-
+
e-
已知 M (Au)=197.0 g mol1, M (O2 ) 32.0 g mol1
求:⑴ 通入电荷量 Q
⑵ 通电时间 t
⑶ 阳极上放出氧气的质量
解1 若电极反应表示为
阴极 阳极
1 Au3+ e 1 Au(s)
3
3
1 2
H2O(l)
1 4
O2
(g)
H+
e
析出1.20g Au(s)时的反应进度为
电子得失的计量系数为 z+,欲从阴极上沉积
出1 mol M(s),即反应进度为1 mol 时,需通入的电 量为 Q
Q( 1) z+eL z+ F 若反应进度为 时需通入的电量为
Q( ) z+ F
若通入任意电量Q时,阴极上沉积出金属B的物
质的量 nB 和质量 mB 分别为:
nB
Q z+ F
mB
阴
阳
极
极
电解质溶液
电解池
阳离子迁向阴极,在 阴极上发生还原作用
Cation Cathode
阴离子迁向阳极,在 阳极上发生氧化作用
Anion Anode
在电解池中
-
- 电源 +
e-
+
e-
阴
阳
极
极
CuCl2
电解池
阳极上发生氧化作用
2Cl aq Cl2(g) 2e
阴极上发生还原作用
Cu2 aq 2e Cu(s)
阴极
1 11
2 H2,
Cu, 2
Au 3
荷二价电
阴极
2
H2 ,
Cu,
Au 3
荷三价电
阴极
3 2
H2
,
Au
阳极
1 4 O2 ,
1 2 Cl2
阳极
1 2 O2 , Cl2
33
阳极 4 O2 , 2 Cl2
例题:
通电于 Au(NO3 )3 溶液,电流强度 I 0.025 A
阴极上析出 Au(s)=1.20 g
