乐脉丸微生物限度检查验证方案
六味地黄丸微生物限度检查检验方法验证方案(2015年版)

1.概述1.1六味地黄丸(浓缩丸)是中国药典品种,批准文号:国药准字Z42020681,其处方由熟地黄、酒萸肉、牡丹皮、山药、茯苓、泽泻组成,具有滋阴补肾之功效,用于肾阴亏损,头晕耳鸣,腰膝酸软,骨蒸潮热,盗汗遗精,消渴。
有效期:36个月。
1.2根据剂型与产品处方判断,六味地黄丸(浓缩丸)的微生物限度检查内容应包括需氧菌总数、霉菌和酵母菌总数,以及大肠埃希菌、沙门菌、耐胆盐革兰阴性菌检查;根据六味地黄丸(浓缩丸)的成分和历史验证数据分析,该产品无明显的抑菌活性,拟采用“平皿法”进行微生物限度检查,采用“常规法”进行控制菌检查。
2.目的确认所采用的方法适用于该产品的微生物计数,以确保测定方法的可靠性,确保检验结果的准确可靠。
若检验程序或产品发生变化可能影响检验结果时,计数方法应重新进行适用性试验。
3.依据《中国药典》2015年版四部“非无菌产品微生物限度检查:微生物计数法”、“非无菌产品微生物限度检查:控制菌检查法”、“非无菌产品微生物限度标准”。
4.范围本验证方案适用于公司六味地黄丸微生物限度检查检验方法的适用性试验。
5.职责5.1验证领导小组5.1.1负责验证方案的审批。
5.1.2负责验证的协调工作,以保证本验证方案规定项目的顺利实施。
5.1.3负责验证数据及结果的审核。
5.1.4负责验证报告的审批。
5.1.5负责发放验证证书。
5.2质量部5.2.1负责验证所需的培养基、样品、菌液、缓冲液等的准备。
5.2.2负责取样及对样品的检验。
5.3项目验证小组5.3.1负责拟订验证方案。
5.3.2负责验证方案的实施和收集各项验证试验记录,并对试验结果进行分析后,起草验证报告,报验证领导小组。
6.验证实施条件6.1验证方案培训:在验证实施前,应对参与验证的人员进行验证方案以及与验证相关的文件进行培训,确保相关人员掌握了验证的相关要求与知识。
6.2微生物限度检测室:检验所使用的检测室应经过HVAC系统确认,并符合要求。
最新版中国药典微生物限度检查方法验证方案

最新版中国药典微生物限度检查方法验证方案人工牛黄甲硝唑胶囊微生物限度检查方法验证方案起草部门:QC 组签名:日期:审核部门:QC组签名:日期:部门:质量部签名:日期:批准质量负责人签名:日期:质量部颁发本文件根据需要应分发于以下部门:01 质量部下表用于记录修订/变更主要内容及历史。
文件编号修订原因修订日期TS-VP-4201-00 按GMP(2010年修订版)要求新制定2015.10.22目录1. 概述2. 验证目的和范围3. 组织及职责4. 验证进度计划表5. 验证所需要的仪器设备及相关文件的确认6. 验证所需要的菌种、培养基、检验样品的确认7.验证项目和验证方法7.1试验菌株7.2需氧菌总数检查、霉菌和酵母菌总数检查方法验证的菌液制备7.3需氧菌总数检查、霉菌和酵母菌总数检查方法验证--常规倾注平皿法7.4需氧菌总数检查方法验证—离心沉淀-薄膜过滤法7.5控制菌检查方法验证—离心沉淀-薄膜过滤法8.偏差与漏项控制9.验证报告会审1. 概述我公司生产品种人工牛黄甲硝唑胶囊,产品微生物限度检查项目为需氧菌总数、霉菌和酵母菌总数、以及大肠埃希菌检查和沙门菌检查。
参照《中国药典》2015版四部附录1105:微生物计数法,以及1106:控制菌检查法的规定,本公司对该产品的微生物限度检查方法予以验证。
通过验证以确认所采用的微生物限度检查方法适用。
人工牛黄甲硝唑胶囊处方中含有甲硝唑、人工牛黄以及常用辅料成分,文献资料介绍甲硝唑对细菌有抑菌特性,对霉菌和酵母菌无抑菌活性。
甲硝唑在水中微溶,可以通过离心沉淀-薄膜过滤法去除其对微生物生长的影响。
本验证方案通过试验菌株的回收率测试,首先确认常规倾注平皿法是否适用于本品的微生物限度检查;如常规倾注平皿法不适用,则进一步验证可去除供试品抑菌物质的离心沉淀-薄膜过滤法是否适用于本品的微生物限度检查。
本验证方案根据样品特性制定微生物限度检查方法和检验条件,按制定的方法进行试验,根据验证结果判断是否符合验证标准。
4种中药散剂微生物限度检查方法验证

4种中药散剂微生物限度检查方法验证摘要】目的建立4种中药散剂微生物限度检查方法。
方法通过接种阳性菌回收率试验测定珠黄散、锡类散、冰硼散、如意金黄散4种中药散剂是否含抑菌成分。
结果如意金黄散供试品试验菌的回收率大于70%,证明无抑菌作用;珠黄散、冰硼散、锡类散有一定的抑菌作用,但可以通过稀释法消除抑菌作用。
结论如意金黄散可以按平皿法进行微生物限度检查;珠黄散、冰硼散、锡类散可以按培养基稀释法进行微生物限度检查。
【关键词】微生物限度检查散剂抑菌作用方法验证【中图分类号】R927.1 【文献标识码】A 【文章编号】2095-1752(2013)20-0038-022010年版《中国药典》收载的各中成药品种检查项下,很少规定具体的微生物限度检查方法。
微生物限度检查方法必须经过验证试验,含抑菌活性的中成药的微生物限度检查,必须消除供试液抑菌活性后,再根据中国药典规定的方法进行检查。
本文锡类散、珠黄散等4种中药散剂建立了微生物限度检查法,以为同行提供一些借鉴。
1 仪器与材料1.1仪器细菌培养箱(型号:250-L)常州国华仪器有限公司,霉菌培养箱(型号:MJ-250BS-II)上海新苗医疗器械制造有限公司,立式压力蒸汽灭菌器(型号:LDZX-50FBS)上海申安医疗器械厂。
1.2样品锡类散(批号:121001、121002、121003)、珠黄散(批号:121101、121102、121103)、冰硼散(批号:120801、120802、120803)、如意金黄散(批号:121201、121202、121203),生产单位:江苏七0七天然制药有限公司;1.3试验及培养基pH为7.0的氯化钠一蛋白胨缓冲液、0.9%无菌氯化钠溶液营养琼脂培养基、玫瑰红钠琼脂培养基、营养肉汤培养基、胆盐乳糖培养基、胆盐乳糖发酵管培养基、改良马丁培养基、改良马丁琼脂培养基、4一甲基伞形酮葡糖苷酸培养基、曙红亚甲蓝琼脂培养基均由中国生物制品检定研究院提供。
4种丸剂微生物限度检查法方法验证

1s 样 品 .
逍 遥 丸 ( 7 2 0 ) 杞 菊 地 黄 丸 ( 7 1 0 ) 香 砂 0001 、 000 1 、
六 君 丸 (7 1 0 )知 柏 地 黄 丸 (7 10 ) 由 漳 州 片 仔 癀 药 000 1、 0001 均
业 股 份 有 限 公 司提 供 。
通 过 验 证 . 柏 地 黄 丸 、 萄地 黄 丸 可 用 常 规 法 , 遥 丸 、 砂 六 君 丸 可 用 培 养 基 稀 释 法 检 查 微 生 物 限 度 , 法 简便 , 果 可 靠 。 知 杞 逍 香 方 结
关键词 : 剂; 丸 微生物限度检 查法验证
中图分类号 : 9 7 1 文献标识码 : 文章 编号:0 63 6 (0 8 .60 7 .3 R 2 .2 A 10 .7 5 2 0 )0 .0 50
维普资讯
S ri P ama e t a o r a 1 0 No 6 2 0 tat h r c ui l u n 1 c J Vo . 0 8 2
表 2 含 量 测 定 结 果
有 关 物 质 的 分 离 度 , 动 相 p 值 的 提 高 也 可 改 善 红 霉 素 与 流 H 有 关 物 质 的分 离 度 , 虑 到 对 色 谱 柱 的 损 耗 , 选 用 0 t o・ 考 故 .m l LI磷 酸 二 氢 铵 溶 液 ( 乙 胺 调 节 p .)乙 腈 (0:0 作 为 1 三 H6 5 7 3)
检查项下。 规定具体 的微生物 限度 检查方 法。所 以本文通 未
肉汤培养基 、 胆盐乳糖培养基 、改 良马 丁琼 脂培 养基、 曙红亚
甲蓝 琼 脂 培 养 基 . 由北 京 三 药 科 技 开 发 公 司 生 产 。 均
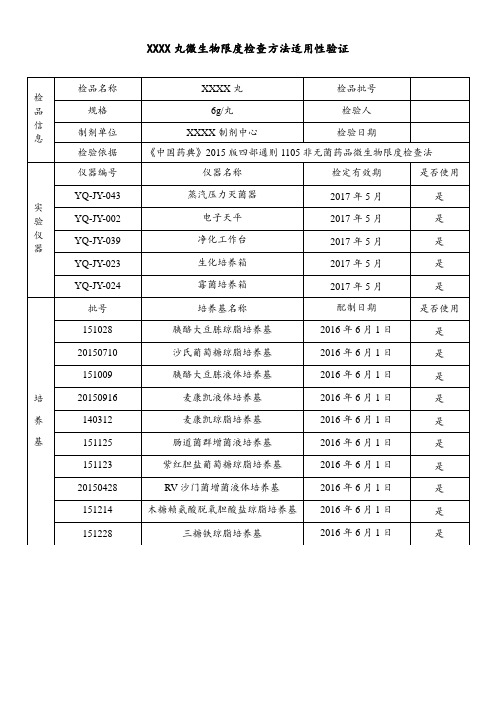
含有药材原粉丸微生物检验方法适用性验证通用模板
传代数 3 3 3 3 3 3 3
是否使用 是 是 是 是 是 是 是
实 验 用 菌
枯草芽孢杆菌 白色念珠菌 黑曲霉菌 大肠埃希菌 乙型副伤寒沙门菌
1.实验方案: 本品为非无菌含药材原粉的中药固体口服给药制剂(不含豆豉、神 曲等发酵原粉丸剂) ,非无菌微生物限度标准应为: 需氧菌数:不得过 3×104cfu/g 霉菌酵母菌数:不得过 102cfu/g 控制菌:大肠埃希菌(1g)不得检出;沙门菌(10g)不得检出;耐胆盐 革兰氏阴性菌应小于 102(1g) 。 1.1 验证试验目的 确认所采用的方法适用于本品的微生物限度检查,即确认本品在该 检验量及该检验条件下无抑菌活性或其抑菌活性已被充分消除到可以忽 略不计,保证检验结果的准确、可靠及检验方法的完整性。 1.2 微生物限度检查方法 取本品 10g,加入胰酪大豆胨液体培养基 100ml,振摇至分散均匀, 作为 1:10 供试液;取本品 10g 加入胰酪大豆胨液体培养基 200ml,振摇 至分散均匀,作为 1:20 供试液。取 1:20 供试液 1ml 注入无菌平皿中依法 检查( 《中国药典》2015 版 1105 非无菌药品微生物限度检查法:微生物
取上述金黄色葡萄球菌 10-5 稀释液、铜绿假单胞菌 10-5 稀释液、枯 草芽孢杆菌 10-5 稀释液、 大肠埃希菌 10-5 稀释液、 白色念珠菌 10-3 稀释液 及黑曲霉 10-2 稀释液各 1ml,分别加入 100ml 胰酪大豆胨液体培养基中, 混匀,分别取 1ml,用 45℃胰酪大豆胨琼脂培养基 20ml 注皿,平行测定 两皿,35℃培养 3 天,计数,应不大于 100cfu。再取白色念珠菌 10-3 稀 释液及黑曲霉 10-2 稀释液各 1ml, 分别加入 100ml 胰酪大豆胨液体培养基 中,混匀,分别取 1ml,用 45℃沙氏葡萄糖琼脂培养基 20ml 注皿,平行 测定两皿,25℃培养 5 天,计数,应不大于 100cfu。同时用相应的对照 培养基替代待测培养基进行上述实验。待测培养基的菌落平均数与对照 培养基的菌落平均数比值应在 0.5-2 范围内,且菌落大小、形态特征应与 对照培养基一致。试验结果见表 1。 阴性对照:用胰酪大豆胨液体培养基替代供试液,立即倾注琼脂培 养基,各平行测定两皿,待凝固后,胰酪大豆胨琼脂培养基平皿在 35℃ 培养 3 天,沙氏葡萄糖琼脂培养基平皿在 25℃培养 5 天,应无菌生长。 表 1 计数培养基适用性检查结果
微生物限度检查方法适用性试验方案

微生物限度检查方法适用性试验方案一、试验目的本试验旨在验证微生物限度检查方法的适用性,并评估其在实际样品中的准确性、精密度和灵敏度,以确保检测结果的可靠性。
二、试验范围本试验适用于各类药品、食品、环境以及生物制品等样品的微生物限度检查。
三、试验设备与试剂1. 培养基:本试验需使用适当的培养基,如大肠杆菌培养基、沙门氏菌培养基等,以满足特定微生物的培养需求。
2. 灭菌设备:试验中的培养基、工具及试剂需经过灭菌处理,以保证试验环境的无菌状态。
3. 微量移液器:用于准确取样和移液,确保实验的精确性。
4. 微生物培养箱:用于提供适宜的温度和湿度条件来培养微生物样品。
四、试验步骤1. 样品制备:按照相关规定和标准采集样品,并根据不同样品的特性进行适当处理,以便得到具有代表性的样品。
2. 培养基接种:将样品按照试验要求接种到相应的培养基中,并在一定条件下进行培养,以促使微生物生长。
3. 培养基培养:将接种过样品的培养基置于微生物培养箱中,根据微生物的生长特性进行培养,通常包括温度、湿度和培养时间等方面的控制。
4. 结果观察与记录:根据实验要求,观察培养基上是否有微生物的生长,并记录对应的观察结果。
5. 试验数据处理与分析:根据试验结果进行数据处理与分析,并评估微生物限度检查方法的适用性、准确性和灵敏度。
五、试验评价指标1. 准确性:通过与参考方法的比对,评估限度检查方法的准确程度。
2. 精密度:利用不同实验者、设备和试剂的重复试验,评估方法的可重复性和稳定性。
3. 确定度:评估方法的灵敏度和特异性,以确定方法对微生物的检测能力。
4. 可靠性:综合以上评价指标,评估方法在实际应用中的可靠性和适用性。
六、试验结果与分析根据试验评价指标,通过一系列试验和数据分析,我们可以得出以下结论:1. 限度检查方法在各类样品中的准确性良好,能够准确反映样品中微生物的含量。
2. 试验结果表明,方法具有较好的重复性和稳定性,不同实验者、设备和试剂的试验结果相对一致。
14 种中成药微生物限度检查方法验证
世界最新医学信息文摘 2021年 第21卷 第19期129投稿邮箱:zuixinyixue@·药物研究·14种中成药微生物限度检查方法验证王丽萍(佛山市中医院禅城高新区医院 检验科,广东 佛山 528000)0 引言微生物限度是一种药品制剂质量控制的检验方法,即检查非灭菌制剂(包括原料、辅料)所受微生物污染程度[1]。
2005版《中国药典》中表示[2],所有药品制剂在质量控制的微生物限度检查中,必须先使用方法学进行验证,用以避免因方法不合理而造成的漏检、误判。
而2006年的“欣弗事件”与2008年的“刺五加事件”[3]进一步给人们警示了防治药品微生物污染的重要性,也暴露出在药品微生物检验工作上,无论是认识还是技术层面上,都有较大的提升空间。
而中成药微生物限度检查在我国目前状况下尤显重要,微生物限度检查关注的是存在于药品中能引起污染效应的微生物[4],因此,我院对中成药进行微生物限度检查进行了相关研究与分析,并使用方法学加以验证,通过中成药内微生物的含量、是否存在控制菌,为药品制剂监管的理论依据,从而达到控制药品制剂质量的效果,具体论述如下。
1 材料与方法1.1 材料。
菌株:金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌、黑曲霉。
中成药:消炎片、安坤颗粒、通心路胶囊、一清颗粒、小柴胡、清宁丸、牛黄上清片、黄芩片、藿香祛暑软胶囊、炎热清片、金莲花片、清热化毒丸、清开灵片、虎地肠溶胶囊。
仪器:净化工作台、生化培养箱、恒温培养箱、微生物限度检查仪以及菌落计数器等。
1.2 方法。
将金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌、白色念球菌以及黑曲霉分别接种于不同的培养基中,并根据相关操作放入合适的环境下培养一段时间,之后将所培养的培养物制成菌悬液,约为50~100个(cfu·mL -1)[5]。
同时将所选取的中成药样本制成不同比剂的供试液,一般分为1∶10、1∶20、1∶50以及1∶100。
清热解毒类中成药微生物限度检查方法验证
清热解毒类中成药微生物限度检查方法验证发表时间:2016-05-11T11:30:14.913Z 来源:《医药前沿》2015年12月第36期作者:苏智阳[导读] 厦门市食品药品审评认证与不良反应监测中心建立专业的微生物限度检查有必要,采用冰醋酸薄膜过滤法、培养基稀释法进行清热解毒类中成药微生物限度检查。
(厦门市食品药品审评认证与不良反应监测中心 361000)【摘要】目的:探讨清热解毒类中成药的抑菌效果,并对清热解毒类中成药微生物限度检查方法进行研究。
方法:根据2010年版《中国药典》对8种清热解毒类中成药微生物限度检查方法进行实验与验证。
结果:所检的清热解毒中成药对金黄色葡萄球菌与枯草芽孢杆菌的抑菌效果并不佳,且对菌落的抑制作用可采用不同方法予以去除,均获得70.0%以上的回收率,因此可应用在常规法的检查中。
结论:建立专业的微生物限度检查有必要,采用冰醋酸薄膜过滤法、培养基稀释法进行清热解毒类中成药微生物限度检查。
【关键词】清热解毒;中成药;微生物限度检查【中图分类号】R286 【文献标识码】B 【文章编号】2095-1752(2015)36-0373-02 三黄片、黄连上清片与一清软胶囊均属于中成药,可用于咽喉、牙龈肿痛,口舌生疮以及尿黄便秘等,这类清热解毒类中成药具有消炎抑菌的作用,为了对这类药品的微生物污染情况进行反映,需要采取一定的措施以消除抑菌作用[1]。
本研究对上述清热解毒中成药进行了药微生物限度检查方法验证,对这类中成药微生物限度检查方法进行了探索。
1.实验材料与方法1.1 实验样品本研究共纳入8种清热解毒类中成药,依次为①三黄片(生产批号:20110305,安徽华佗国药股份有限公司提供);②四季三黄片(生产批号:100910,江西华太药业有限公司提供);③一清颗粒(生产批号:20110403,浙江纬康药业有限公司提供);④一清软胶囊(生产批号:110407,大连天宇奥森制药有限公司提供);⑤黄连上清丸(生产批号:0015139,北京同仁堂股份有限公司同仁堂制药厂提供);⑥黄连上清片(生产批号:110328,上海海虹实业巢湖金辰药业有限公司提供);⑦黄连上清片(生产批号:100817,上海海虹实业巢湖金辰药业有限公司提供)⑧黄连上清片(生产批号:20100971,贵州百灵企业集团制药股份有限公司)。
16种中成药微生物限度检查法的方法验证
我们对 2 0 0 5版药典拟 收载 的几种 中成药 品种微 生物
限度检查法进行方 法验证 , 为规 范 中成药 的微 生物 限度检 查法提供科学依据 。
1 材 料 和 方 法 11 材 料 .
12 1 菌 液的制备 : .. 取经 3 7℃培 养 l ~2 , 8 4h 金黄色葡萄 球菌 、 大肠杆菌 、 枯草杆 菌 肉汤培 养基 1mL及 2 0~2 5℃ 培养 l ~2 8 4h的白色念珠菌 真菌液体培养 物 +9mL生理 盐水为 0倍稀释 , 以此类推 , 释到 l ~l 1为 5 ~10 稀 0 0 0 0 个/ mL做活菌计 数备用 12 2 供试液制备 : .. 各种 样品浓度均为 1 1 :0供试液 , 分别 加入上述 4种试 验菌株 。 12 3 培养基稀释法 : 用 1HL供 试液 加 3个平皿 或 5 .. 采 l 个平皿 , 每个平皿 加 1 ~2 5 0mL琼 脂 培养 基做 细 菌计 数 , 测定 回收率 。 1 3 回收率测 定 .
1 1 1 仪器 设备 : .. 净化 工作 台 、 恒温 培 养箱 ( 0 5℃ ) 3 ~3 、
生化培养箱 ( 5 8℃ )微 波炉 、 氏振荡仪 、 温 水浴 、 2 ~2 、 康 恒 电热干燥 箱( 5 30℃ ) 电冰箱 。 20 5 、
1 12 玻璃器皿 : .. 锥形瓶( 5 ~30mL 、 2 0 0 ) 平皿 ( r) 量 9c 、 n
验 中加 入活菌个数为 5 ~10 c / 0 0 f mL, u 试验菌 立 即倾 注琼 脂 培养基 , 平行制 备 2个 平皿 , 中国药 典 2 0 按 0 5年 版培 养 及菌落计数方法测量其菌 落数。空白组 : 取规定量 供试 液 ,
5种含丹参中成药微生物限度检查方法验证
ef cs o l b e i n td y h dl t n f t e c u d e l mi ae b te i i meh d Co c u in T e o v n in l uo to . n l so h c n e t a meh d h u d e s d f r t e o t o s o l b u e o h mi rb a l t e t f co il i ts mi o
Tr dii n l a to a Ch ne e i s Pa e e c n Co t i i g D a he t nt n dii e n a n n ns n
Zh u o Zhi n i T o mi ,L u a
r u n x Is tt f r F o & D u o t l N n ig G a g i hn 5 0 2 a g i n tue o o d G i rg C nr , a nn , u n x,C ia 3 0 1 o
丹 参 为 唇 形 科 植 物 丹 参 S lamlo h aB e av ii & g.的 干 燥 根 及 根 i t ̄ 茎 , 有 祛 瘀 止 痛 、 血 通 经 、 心 除 烦 功 效 1 , 广 泛 用 于 治 疗 具 活 清 被 5 2 心 脑 血 管 疾 病 。 参 及 其 制 剂 含 有 隐 丹 参 酮 、 氢 丹 参 酮 , 体 外 丹 二 对 的 葡 萄 球 菌 、 肠 杆 菌 、 性 杆 菌 有 抑 制 作 用 [。 者按 照 有 关 规 大 变 2笔 1 定… , 5种 含 丹 参 的 常用 中成 药 进 行 了微 生 物 限 度 检 查法 方 对
p st e a tr . s l T e e o e rts fXin oo g T bes n Q n aja g a T bes wee ih r ta 0% . ih n iae o oiv b cei Reu t i a s h rc v r ae o n a tn a lt y a d in oiny a lt r hg e h n 7 whc idctd n
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
乐脉丸
微生物限度检查法方法学验证资料
【处方】丹参998g 川芎499g 赤芍499g 红花499g 香附249.5g 木香249.5g 山楂124.8g
【制法】以上七味,加水煎煮三次,每次1小时,加水量分别为10、8、8倍,合并煎液,滤过,滤液低温(45~50℃)浓缩至相对密度为1.10~1.30(50℃)的清膏,在80℃以下干燥,粉碎,加入适量淀粉,用90%乙醇和大豆油制软材,挤压一滚圆制丸,干燥,制成1000g,即得。
【用法用量】口服,一次1~2袋,一日3次。
【微生物限度检查】
细菌计数按规定取本品10g,加入pH7.0无菌氯化钠—蛋白胨缓冲液至100ml,充分分散均匀,即为1:10供试液。
取1:10的供试液1ml各注2个皿,(每皿1ml),其它操作按中国药典2005年版一部附录ⅩⅢ C微生物限度检查法平皿法计数。
霉菌、酵母菌计数按规定取本品10g,加入pH7.0无菌氯化钠—蛋白胨缓冲液至100ml,用适宜的方法使充分分散均匀,即为1:10供试液,1:10 供试液1ml各注2个皿(每皿1ml),其它操作按中国药典2005年版一部附录ⅩⅢ C微生物限度检查法平皿法计数。
控制菌检查大肠埃希菌,检查按中国药典2005年版一部附录ⅩⅢ C微生物限度检查法规定的相应方法检查。
一、验证目的:验证乐脉丸在所设定的检验条件及程序下检验,对其中可能存在的细菌数、霉菌、酵母菌数及控制菌是否无抑制作用;以确定适宜的检验方法。
二、验证范围:金鸡丸20090301、20090302、20090303三个批次
三、验证条件:
1、培养基:营养琼脂、虎红琼脂、胆盐乳糖培养基、MUG培养基、曙红亚甲蓝琼脂培养基、
改良马丁培养基,改良马丁琼脂培养基等。
以上培养基均已按规定方法灭菌。
2、稀释剂:PH为7.0无菌氯化钠-蛋白胨缓冲液(经121℃灭菌30分钟)
3、仪器:天平、35~37℃的生化培养箱、30~35℃恒温培养箱(、23~28℃生化培养箱、温度
计、高压灭菌器、经121℃30分钟灭菌的玻璃仪器、数显水浴恒温振荡器、医药净化工作台4、菌种:按以下方法制备成已知浓度的菌液。
大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌、白色念珠菌、黑曲霉
4.1 接种大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌的新鲜培养物至营养肉汤培养基中,35℃
培养24小时,取此培养液1ml加0.9%无菌氯化钠溶液9ml,采用10倍递增稀释法,稀释至10-5~10-7,使细菌数约为150~200cfu/ml。
4.2接种白色念珠菌的新鲜培养物至改良马丁培养基中,25℃培养24小时,取此培养液1ml
加0.9%无菌氯化钠溶液9ml,采用10倍递增稀释法,稀释至10-5~10-7,使菌数约为150~200cfu/ml。
4.3 接种黑曲霉的新鲜培养物至新鲜培养物至改良马丁琼脂斜面培养基中,25℃培养7天,加5~10ml 0.9%无菌氯化钠溶液,将孢子洗脱,然后吸出孢子悬液,取1ml加0.9%无菌氯化钠溶液9ml,采用10倍递增稀释法,稀释至10-4~10-6,使孢子数约为150~200cfu/ml。
四、验证方法
(一)细菌总数、霉菌、酵母菌总数采用平皿计数法的验证。
对三批乐脉丸分别进行三次独立的平行试验。
并分别计算各试验菌的回收率。
1、供试品对照组取供试品10g,加pH7.0无菌氯化钠-蛋白胨缓冲液至100ml,制成浓度为
1:10供试液。
用pH7.0无菌氯化钠-蛋白胨缓冲液,按照10倍递增稀释法,制备连续2个稀释级的供试液。
每一稀释度吸1ml供试液入平皿中,并注两皿作平行样,分别在每平皿中注入约15ml温度不超过45℃的营养琼脂或虎红琼脂、混匀、凝固、倒置培养。
(营养琼脂板于30~35℃培养箱中培养48小时;虎红琼脂板于23~28℃生化培养箱中培养72小时),测定供试品的本底菌数。
2、试验组取1:10供试液1ml和1ml各试验菌液,分别加入平皿中,立即倾注营养琼脂或
虎红琼脂培养基,每株试验菌平行制备2个平皿,置培养箱中培养后测定其菌数。
(用大肠埃希、金黄色葡萄球菌、枯草芽孢杆菌液注皿的用不超过45℃的营养琼脂注皿,置30~35℃培养箱中培养48小时后测定其菌数;用白色念珠菌、黑曲霉菌液注皿的用不超过45℃的虎红琼脂注皿,置23~28℃培养箱中培养72小时后测定其菌数)
3、菌液组不加供试液,直接取上述各菌液的量,分别依上法用琼脂培养基注皿,培养后计数,
测定所加的试验菌数。
4、合格标准若试验各组的菌回收率均不低于70%,该品种平皿计数法测定细菌、霉菌及酵母
菌数通过验证;若任一次试验中试验组的菌回收率低于70%,应采用培养基稀释法、离心沉淀集菌法、薄膜过滤法、中和法等方法或联合使用这些方法消除供试品的抑菌活性,并重新进行方法验证。
注:试验组的平均菌落数-供试品对照组的平均菌落数
试验组的菌回收率=------------------------------------------------- ×100%
菌液组的平均菌落数
5、测定结果(见下表)
6、结论:本品经验证试验,细菌、霉菌酵母菌计数法计数,各菌回收率均能达到70%以上,该方法适用于乐脉丸细菌数、霉菌、酵母菌数的检验。
(二)大肠埃希菌检查方法验证
1、供试品对照组取1:10供试液10ml接种至100ml胆盐乳糖培养基中,置35~37℃培养箱
中培养 18~24小时,必要时可延长至48小时。
取上述培养物0.2ml接种至 5mlMUG培养基中,再于上述温度培养,分别于5小时、24小时在366nm紫外线下观察,同时用未接种的MUG培养基作本底对照。
若管内培养物呈现荧光,为MUG阳性;不呈现荧光,为MUG阴性。
观察后,沿培养管的管壁加入数滴靛基质试液,液面呈玫瑰红色,为靛基质阳性;呈试剂本色为靛基质阴性。
本底对照应为MUG阴性和靛基质阴性。
若MUG阳性,靛基质阳性,判供试品检出大肠埃希菌;若MUG阴性,靛基质阴性,判供试品未检出大肠埃希菌;若MUG阳性,靛基质阴性或MUG阴性,靛基质阳性,则应取胆盐乳糖培养基的培养物划线接种于曙红亚甲蓝琼脂板上,于35~37℃培养箱中培养 18~24小时。
若平板无菌落生长,或生长的菌落不符合“呈紫黑色、浅紫色、蓝紫色或粉红色,菌落中心呈深紫色或无明显暗色中心,圆形,稍凸起,边缘整齐,表面光滑,湿润,常有金属光泽”形态特征,判未检出大肠埃希细菌。
;
若平板上生长的菌落与上述形态特征相符或疑似,应进行分离、纯化、染色镜检和适宜的生化试验,确认是否为大肠埃希菌。
2、试验组取1:10供试液10ml及大肠埃希菌液1ml(相当于 76cfu试验菌)加入100ml胆
盐乳糖培养基中,照上述供试品试验组方法操作至得出最终结果。
3、阴性菌对照组取1:10供试液10ml及金黄色葡萄球菌液1ml(相当于69cfu试验菌)加入
100ml胆盐乳糖培养基中,于35~37℃培养箱中培养 18~24小时,挑取培养液划线接种于曙红亚甲蓝琼脂板上,再于上述温度培养24小时后观察是否检出金黄色葡萄球菌。
4、阴性对照组取上述所用稀释液10ml加入100ml胆盐乳糖培养基中,照上述供试品试验组
方法操作至得出最终结果。
5、合格标准:阴性对照组无菌生长、阴性菌对照组不得检出金黄色葡萄球菌。
若试验组检出大
肠埃希菌,该品种所采用的大肠埃希菌检查法通过验证;若试验组未检出大肠埃希菌,应采用培养基稀释法、离心沉淀集菌法、薄膜过滤法、中和法等方法或联合使用这些方法消除供试品的抑菌活性,并重新进行方法验证。
6、试验结果(见下表)
结论:本品经验证试验,该方法适用于乐脉丸大肠埃希菌的检验。
复核人:检验人:。
