高中化学无机推断题
沪科版高中化学高中二年级第二学期第13章 《检验一些无机化合物》检测题(包含答案)

《检验一些无机化合物》检测题一、单选题1.现有Na 2CO 3、H 2SO 4、Ba(OH)2三种物质的量浓度与体积都相等的溶液,若以不同顺序将它们中的两种混合起来,出现沉淀后过滤,再将滤液与第三种溶液混合起来,最终所得的溶液( ) A .可能呈酸性B .可能呈中性C .一定呈碱性D .一定呈中性2.某溶液中可能存在Mg 2+、Fe 2+、Fe 3+,加入NaOH 溶液,开始时有白色絮状沉淀生成,沉淀迅速变成灰绿色,最后变成红褐色,下列结论正确的是 A .一定有Fe 2+,一定没有Fe 3+、Mg 2+ B .一定有Fe 3+,一定没有Fe 2+、Mg 2+ C .一定有Fe 3+,可能有Fe 2+,一定没有Mg 2+ D .一定有Fe 2+,可能有Mg 2+,一定没有Fe 3+3.某同学为检验某溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作.其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能得到的正确结论是()A .原溶液中一定含有24SO -B .原溶液中一定含有4NH +C .原溶液中一定含有Cl -D .原溶液中一定含有3Fe +4.只用水就能鉴别的一组物质是( ) A .苯、乙酸、四氯化碳 B .乙醇、戊烷、乙醛 C .乙酸、乙醇、硝基苯D .苯、乙醇、甘油5.某溶液中有Mg 2+、Fe 2+和Al 3+三种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是 A .Al 3+B .Mg 2+C .Fe 2+D .三种离子都减少6.下列化学实验事实及其解释或结论都正确的是:A.在100mL沸水中加入10 g NaHCO3固体,产生大量的气泡,可以推断反应后溶液的碱性比10 g NaHCO3固体溶于100mL冷水中形成的溶液的碱性弱B.向1mL1%的NaOH溶液中加入2mL2%的CuSO4溶液,振荡后再加入0.5mL有机物X,加热后未出现砖红色沉淀,说明X中不含有醛基C.向CuSO4溶液中加入KI溶液,有白色沉淀生成;再加入四氯化碳振荡,四氯化碳层呈紫色,白色沉淀可能为CuID.某待测溶液可能含有等浓度的下列离子中的若干种:K+、Na+、NH4+、Mg2+、Fe2+、Fe3+、I-、CO32-、SO42—。
高中化学高考二轮复习六 无机物推断

实蹲市安分阳光实验学校专题六无机物推断【要求】1.了解常见不同类型化合物之间转化的条件和方法。
2.能综合用常见金属和非金属元素单质及其化合物的主要性质。
3.能依据所提供的资料或信息,获取并归纳元素化合物的性质。
【知识络】抓特征:1.物质的特有颜色 2.特征反现象 3.特征转化关系4.特殊反条件 5.重要工业生产反6.特征数据(反物物质的量比、相对分子质量、化合物中各元素的含量、化合物中离子个数比、电子总数、质子总数、化合价、放出气体的体积或生成沉淀的量。
)整体思路为:原题材(包括框图有关信息)找已知条件(明显条件,隐性条件)找特殊(反,性质,结构)得出相的结论。
解题的关键是迅速找出突破口,然后以突破口为中心,选择适的方法,得出结论。
做到“大胆假设,小心验证”。
【典型例题】例1.元素X的单质及X与Y形成的化合物能按如下图所示的关系发生转化(其中m≠n,且均为正整数)。
下列说法正确的是A.若X为Fe,Y可为Cl、Br、IB.若X为Fe,Y只能为ClC.X为非金属,则X的非金属性比Y强D.X、Y可能均为非金属元素例2.下图表示物质间的转化关系,已知A、B、I都是XY2型化合物,且阳离子相同,A、B晶体中阴、阳离子个数比都是1∶1,但I晶体中阴、阳离子个数比是2∶1,无水I常做干燥剂。
请按要求填空:(1)G 的电子式:;B的名称:;H 的主要用途:。
(2)反①的化学方程式:。
(3)反③的离子方程式:。
(4)C物质分子的杂化方式和分子构型:。
答案:(1);过氧化钠;漂白、杀菌m n(2)CaC2+2H2O====Ca(OH)2+C2H2↑ (3)Cl2+2OH-====Cl-+ClO-+H2O;(4)sp杂化,直线型分子。
例3.下图是常见元素的单质及其化合物的转化关系图(有关反的条件及生成的产物已略去)。
已知:E为红棕色固体,K为浅绿色溶液;反①、②都是化工生产中的重要反;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子。
高中化学竞赛辅导无机元素练习题

(1)确定A的结构简式。写出生成A的化学反应方程式。
(2)在室温或高于室温的条件下,A能定量地分解,产生B和C。已知B的阳离子的价电子总数比C的价电子总数少4。试确定B的结构简式,写出B中阴、阳离子各中心原子的杂化形态。
3为什么NF3常温不水解,而NCl3常温可以水解?写出水解产物。
九、回答下列关于磷的问题:
高中化学竞赛练习(无机化学主族元素)
第一章卤素
一、于酸性溶液中混合等物质的量的KBrO3和KI,生成哪些氧化还原产物,它们的物质量的比是多少?
(2)用漂白粉漂白物料时,常采用以下步骤:将物料浸入漂白粉溶液,然后暴露在空气中;将物料浸在稀盐酸中;将物料浸在大苏打溶液中,最后取出放在空气中干燥;试说明每一步处理的作用,并写出有关的反应方程式。
(2)石硫合剂在空气中与H2O及CO2作用又生成具有杀虫作用的S,写出分步的反应方程式。
四.氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。
1.氯化亚砜分子的几何构型是;中心原子采取杂方式,
是(等性、不等性)杂化。
2.写出亚硫酸钙和五氯化磷共热,制备氯化亚砜反应的化学方程式
3.氯化亚砜在有机化学中用作氯化剂,写出乙醇和氯化亚砜反应的化学方程式
1.写出N2O4在登月飞船的液体推进系统中所发生主要反应的方程式;
2.说明N2O4分子中N原子的杂化方式和成键情况;
3.画出偏二甲肼的构型。
4.写出我国长征系列火箭二元推进剂反应的化学方程式。
5.偏二甲肼可用二甲胺被亚硝酸氧化、再用锌还原来制备,写出各步反应方程式。
新高考化学高考化学压轴题有机合成与推断专项训练分类精编附解析

新高考化学高考化学压轴题 有机合成与推断专项训练分类精编附解析一、高中化学有机合成与推断1.麻黄素H 是拟交感神经药。
合成H 的一种路线如图所示:已知:Ⅰ.芳香烃A 的相对分子质量为92 Ⅱ. Ⅲ.(R 1、R 2可以是氢原子或烃基、R 3为烃基) 请回答下列问题:(1)A 的化学名称为_____________;F 中含氧官能团的名称为_________________。
(2)反应①的反应类型为______________。
(3)G 的结构简式为__________________________。
(4)反应②的化学方程式为______________________________________________。
(5)化合物F 的芳香族同分异构体有多种,M 和N 是其中的两类,它们的结构和性质如下: ①已知M 遇FeCl 3溶液发生显色反应,能和银氨溶液发生银镜反应,苯环上只有两个对位取代基,则M 的结构简式可能为____________________________________。
②已知N 分子中含有甲基,能发生水解反应,苯环上只有一个取代基,则N 的结构有___种(不含立体异构)。
(6) “达芦那韦”是抗击新型冠状病毒潜在用药,合成过程中要制备,参照上述合成路线,设计由和为原料制备的合成路线:________________________________________________________(无机试剂任选)。
2.华法林(物质F)是一种香豆素类抗凝剂,在体内有对抗维生素K 的作用,可用于预防血栓栓塞性疾病。
某种合成华法林的路线如图所示。
请回答下列相关问题。
(1)华法林的分子式是_________________。
物质E 中的含氧官能团名称是_____________。
(2)A →B 的氧化剂可以是__________(填标号)。
a .银氨溶液b .氧气c .新制Cu(OH)2悬浊液d .酸性KMnO 4溶液(3)C →D 的化学方程式是_______________________________________________。
2023届高三化学二轮复习题—元素或物质推断题及解析

2023届高三化学二轮复习题—元素或物质推断题1.(2022·云南德宏·统考一模)A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。
A原子核内无中子;A和E、D和F分别同主族,且B与D最外层电子数之比为2:3.试回答下列问题:(1)E元素在周期表中的位置是_______;(2)已知101KPa时,A单质的燃烧热为285.8 kJ/mol,请写出A单质完全燃烧生成液态水时的热化学方程式:_______;(3)E单质在足量D单质中燃烧生成的化合物的电子式是_______;(4)化合物X、Y均由A、D、E、F四种元素组成。
①X、Y均属于_______化合物(填“离子”或“共价”):②X与Y的水溶液相混合发生反应的离子方程式为_______;(5)化合物E2F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成。
其离子反应方程式为:_______。
2.(2022·河南·河南省实验中学校考三模)Ⅰ. A、B、C、D、E均为中学化学常见的纯净物,B为最常见的液体,它们之间有如下反应关系:(1)若A为短周期的金属单质,D为气态单质,0.1 mol/L-1C溶液的pH=13,则该反应的离子方程式为____________。
(2)若A的水溶液能使淀粉溶液变蓝,C为非金属氧化物,且能使品红溶液褪色,则该反应的化学方程式为___________。
(3)若A、C、D、E均为化合物,E为白色絮状沉淀,且A、C、E均含有同一种元素,则该反应的离子方程式为___________。
Ⅱ.(4)二氧化氯是目前国际上公认的第四代高效、无毒的光谱消毒剂,它可由KClO3和H2SO4存在下与Na2SO3反应制得。
请写出该反应的离子反应方程式:___________。
(5)过碳酸钠是一种有多种用途的新型氧系固定漂白剂,化学式可表示为Na2CO3∙3H2O2,它具有Na2CO3和H2O2的双重性质。
高中化学推断题涉及的物质性质总结

一、物质颜色黑色:单质:木炭、石墨、活性炭、铁粉、银粉。
氧化物:FeO、Fe3O4、MnO2、CuO。
硫化物:FeS、CuS、PbS、Ag2O蓝色沉淀:Cu(OH)2、CuCO3。
蓝色溶液:Cu2+。
蓝色晶体:CuSO4.5H2O紫黑色固体:KMnO4、I2。
紫蓝色溶液:MnO4-、I2CCl4(或苯)溶液。
紫色溶液:苯酚遇FeCl3溶液。
橙蓝色:Br2CCl4(或苯)溶液Br2水:浅黄色→黄色→橙黄色→蓝棕色(浓度依次增大)I2水:浅黄色→黄色→深黄→棕褐色→深褐色(浓度依次增大)绿色固体:Cu2(OH)2CO3。
蓝绿色溶液:CuCl2浅绿色:Fe2+溶液、Cl2水。
浅绿固体:FeSO4.7H2O淡黄色固体:Na2O2、S。
淡黄色沉淀:AgBr、S(有时出现白色浑浊)黄色固体:黄铁矿(FeS2)。
黄色沉淀:AgI、Ag3PO4 。
黄色溶液:Fe3+溶液(或棕黄色),碘水,(变质浓盐酸,浓硝酸)蓝褐色沉淀:Fe(OH)3。
蓝棕色固体:Fe2O3。
蓝棕色气体:NO2、溴蒸气蓝色溶液:Fe(SCN)3、碱酚酞溶液、品蓝溶液、酸甲基橙或酸紫色石蕊试液。
蓝色固体:Cu、Cu2O。
暗蓝色固体:蓝磷白色沉淀:氢氧化物Mg(OH)2、Al(OH)3,、Fe(OH)2、AgOH、Zn(OH)2. 钡盐:BaSO4、BaSO3、BaCO3、银盐:AgCl、Ag2CO3。
其它:CaCO3、CaSO3、CaHPO4 、Ca3(PO4)2、H2SiO3有色离子:Fe3+、Fe2+、Cu2+、MnO4-有色气体:F2、Cl2、Br2(g)、I2(g)、NO2二、气味刺激性气味气体:Cl2、SO2、HX、NH3、NO2、HCHO。
刺激性气味液体:低级羧酸及醛、腐臭气味:H2S。
果香味:酯。
特殊气味:苯、苯酚。
苦杏仁味:硝基苯。
乙炔本无味,因含有H2S、PH3有特殊难闻气味。
无气味:H2、O2、N2、CO、CH4三、有毒:气体:Cl2、H2S、SO2、CO、NO、F2,NO2(其中CO,NO能与人体血蓝蛋白结合使人体中毒)液体:Br2、苯、硝基苯、甲醇、HPO3四、气体溶解性极易溶于水有NH3。
2022年高考——化学有机合成与推断专项训练专项练习含答案
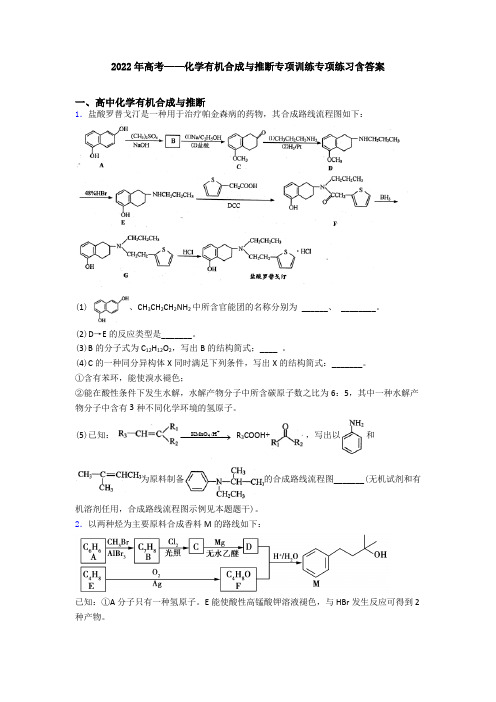
2022年高考——化学有机合成与推断专项训练专项练习含答案一、高中化学有机合成与推断1.盐酸罗替戈汀是一种用于治疗帕金森病的药物,其合成路线流程图如下:(1)、CH 3CH 2CH 2NH 2中所含官能团的名称分别为 ______、 ________。
(2)D →E 的反应类型是_______。
(3)B 的分子式为C 12H 12O 2,写出B 的结构简式;____ 。
(4)C 的一种同分异构体X 同时满足下列条件,写出X 的结构简式:_______。
①含有苯环,能使溴水褪色;②能在酸性条件下发生水解,水解产物分子中所含碳原子数之比为6:5,其中一种水解产物分子中含有3种不同化学环境的氢原子。
(5)已知:+4KMnO /H −−−−→ R 3COOH +,写出以和为原料制备的合成路线流程图_______(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
2.以两种烃为主要原料合成香料M 的路线如下:已知:①A 分子只有一种氢原子。
E 能使酸性高锰酸钾溶液褪色,与HBr 发生反应可得到2种产物。
②RX Mg −−−−→无水乙醇R-MgX(X 为卤原子) RCH 2CH 2OMgX +2H /H O −−−−→RCH 2CH 2OH 回答下列问题: (1)C 中官能团名称是__________________;E 的名称是__________________。
(2)F 的结构简式为__________________;B→C 的反应类型是__________________。
(3)写出A→B 的化学方程式:____________________________________。
(4)在F 的单官能团同分异构体中,除环醚外,还有____________种。
其中,在核磁共振氢谱上有3个峰且峰的面积比为1∶1∶6的结构简式为__________________。
(5)写出鉴别A 、B 两种有机物可选用的化学试剂__________________。
高中化学有机合成推断专题练习试卷(含答案)
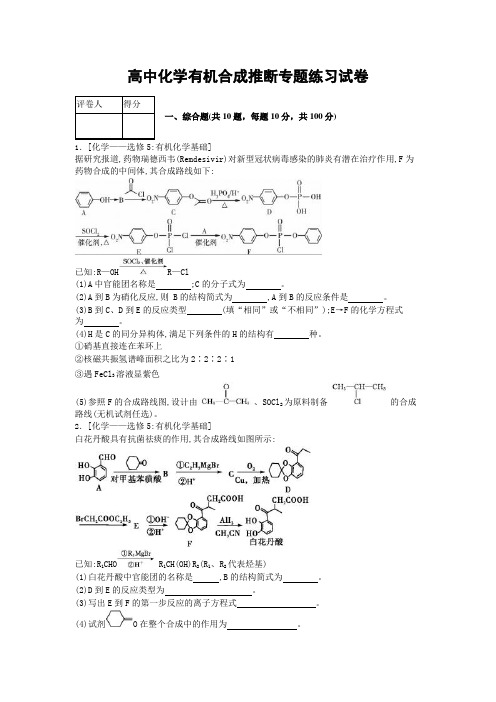
高中化学有机合成推断专题练习试卷一、综合题(共10题,每题10分,共100分)1.[化学——选修5:有机化学基础]据研究报道,药物瑞德西韦(Remdesivir)对新型冠状病毒感染的肺炎有潜在治疗作用,F为药物合成的中间体,其合成路线如下:已知:R—OH R—Cl(1)A中官能团名称是;C的分子式为。
(2)A到B为硝化反应,则 B的结构简式为,A到B的反应条件是。
(3)B到C、D到E的反应类型(填“相同”或“不相同”);E→F的化学方程式为。
(4)H是C的同分异构体,满足下列条件的H的结构有种。
①硝基直接连在苯环上②核磁共振氢谱峰面积之比为2∶2∶2∶1③遇FeCl3溶液显紫色(5)参照F的合成路线图,设计由、SOCl2为原料制备的合成路线(无机试剂任选)。
2.[化学——选修5:有机化学基础]白花丹酸具有抗菌祛痰的作用,其合成路线如图所示:已知:R1CHO R1CH(OH)R2(R1、R2代表烃基)(1)白花丹酸中官能团的名称是,B的结构简式为。
(2)D到E的反应类型为。
(3)写出E到F的第一步反应的离子方程式。
(4)试剂O在整个合成中的作用为。
(5)G是A的同系物,比A多一个碳原子,满足下列条件的G的同分异构体共有种。
①与三氯化铁溶液发生显色反应②能发生水解反应写出其中核磁共振氢谱有4组峰的结构简式(任写一种)。
(6)根据已有知识并结合相关信息写出以乙醇为原料制备CH3(CO)CH2CH2COOCH3的合成路线(合成路线图示例参考本题题干,其他必要的试剂自选)。
3.[化学——选修5:有机化学基础]化合物M是从某植物的提取物中分离出来的天然产物,其合成路线如下:已知:RCOOR'RCH2OH(1)B中所含官能团的名称为;F的化学名称为。
(2)D→E的化学方程式为。
(3)G的结构简式为。
(4)H→I的反应条件为。
(5)J+E K的反应类型为;K2CO3的作用为。
(6)满足下列条件的G的同分异构体有种(不考虑立体异构)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学无机推断题
一、物质的重要特征性质:如物质的颜色、状态、气味、毒性、溶解性等。
1、颜色特征:常见如
(1)有色气体:Cl2(),O3 (), NO2、Br2蒸汽();(2)有色溶液:
(3)有色固体:
(4)使品红溶液褪色的气体:(加热后又恢复红色)、(加热后不恢复红色);
(5)既产生淡黄色沉淀又产生刺激性气味的气体的反应:
(6)溶液颜色变为浅绿色,并产生淡黄色沉淀的离子反应:
(7) 通CO2变白色浑浊:石灰水(过量变清)、Na2SiO3、饱和Na2CO3、浓苯酚钠、NaAlO2
2、气味特征:
3、易挥发、易升华、易吸潮、易液化、可萃取等物质;
4、组成特征: 10电子粒子(等);18电子粒子(等)。
组成元素(如不含金属元素的离子化合物、含金属元素的阴离子AlO2-、MnO4-),化合物的化学式(如A2B2、A2B2、A2B、AB3、AB型分子)等。
5、结构特征:
正四面体结构的物质()、属于线型结构的分子(CH≡CH、CO2、HClO)、属于平面结构的分子(BCl3、CH2=CH2)、具有三角锥结构的分子(PCl3、NH3)等。
二、重要的实验现象
1、燃烧时火焰的颜色:如蓝色火焰:CO、CH4,淡蓝色火焰:H
2、H2S、C2H5OH、S,苍白色火焰: 。
2、焰色反应:。
3、沉淀现象:(在溶液中反应生成黄色、黑色、蓝色、红色、白色沉淀的有哪些?)
4、先沉淀后溶解的有:。
5、放气现象:
与酸反应产生刺激性气味气体的反应有哪些?。
产生能使澄清石灰水变浑浊的气体的反应有哪些?。
与碱反应生产有刺激性气味的气体,且气体可使湿润的蓝色石蕊试纸变红的物质?
6、变色现象:
Fe(NO3)2与HCl反应现象:
酸碱指示剂的颜色变化:
卤素单质在各种溶剂中的颜色变化等。
7、吸热放热现象:常见吸热、放热反应;酸碱盐溶解时的热量变化
等。
8、爆炸现象:如H2与Cl2混合见光反应;易燃气体与空气混合达到爆炸极限。
三、重要的反应条件
1、无机化学中需催化剂的反应;
2、高温条件下的反应:N2与H2、C与氧化物、Fe与H2O、制玻璃、制粗硅、铝热反应、分解;
3、需放电才能发生的反应:N2与O2
4、需光照的反应:CH4与Cl2、H2与Cl2、HClO分解、卤化银、硝酸、硝酸银等
5、浓硫酸存在下的反应:
6、水浴加热的反应:;
7、使用温度计的反应:;
四、重要特征反应的物质
1、能与水反应产生气体的物质:Na、K、F
2、Na2O2、Mg3N2、CaC2、Al2S3等。
其中Mg3N2、CaC2、Al2S3等与水反应既有气体、又有沉淀生成。
双水解:
2、既能酸反应,又能与碱反应
①单质:Al、Si
②化合物:Al2O3、Al(OH)3、弱酸弱碱盐(化合物中NH4+与CO32-、HCO3-、SO32-、HSO3-、S2-、HS-组成的化合物)、
弱酸的酸式盐、氨基酸。
3、能产生三种物质的反应:
NH4HCO3、浓NHO3、(NH4)2CO3、AgNO3、Cu(NO3)2受热分解;电解饱和食盐水;C、S与浓HNO3加热时的反应等等。
4、先沉淀后溶解的反应:银氨反应、CO2、SO2与Ca(OH)2、Ba(OH)2;AlCl3与NaOH、NaAlO2与HCl;Fe(OH)3胶体与稀H2SO4等
5、能发生归中反应的物质:HCl与 KClO3、Fe 与Fe3+归中生成单质的反应:H2S与SO2、NH3与NO、NO2的反应。
6、能发生歧化反应的物质:①Na2O2 、H2O2 ②NO2 ③Cl2 ④Na2S2O3 ⑤S
7、能发生水解反应的物质:
弱酸盐、弱碱盐、类盐、卤代烃、酯类物质、油脂、多糖、多肽、蛋白质。
8、置换反应:
(1)金属→金属: ①金属1+盐1→金属2 + 盐2 ②铝热反应(2)金属→非金属:①活泼金属+H+(或水) →H2 ②镁在二氧化碳中燃烧
(3)非金属→非金属
(4)非金属→金属
12连续氧化:
①NH3(气体)
②H2S(气体)
③C(固体)
④Na(固体)
⑤乙醇乙醛乙酸
13、三角转化
无机推断题的解题方法与技巧
一、试题特点:信息容量大,考查知识面宽,区分度高。
二、解题方法:找准题眼,顺藤摸瓜,各个击破。
推断方法:顺推、逆推、尝试、筛选。
三、常见题眼:
题型一、解题突破口是物质的特征性质:色态味、酸碱性、氧化性、还原性、变价等;
题型二、解题突破口是特征反应现象:产生沉淀、气体、颜色变化、题型三、解题突破口是特征反应及变化关系:置换、歧化、归中反应、连续氧化等;
题型四、解题突破口是特殊提示信息:
题型五、解题突破口是特殊反应条件:水浴加热、使用温度计
题型六、解题必须突破某些特殊"生、冷"的化学反应:
题型七、解题突破口是特殊数据:
四、解题要求
①熟悉各类化合物的性质、反应规律;②熟悉各类物质相互转化的关系
③熟悉各种反应的条件和反应现象④通过计算机,确定组成五、无机推断题的解题方法与技巧
(一)特征物质(现象)法
(二)尝试法、顺推法、逆推法、发散法、假设法、列举法等(三)基本反应规律法。
