苯乙烯氧化反应制苯甲醛的研究 (1)
甲酸-H2O2物系氧化苯乙烯制苯甲酸

图1
Q 用量对苯 乙烯氧 化反应 的影响
图 2 反 应 温度 对苯 乙烯氧化反 应的影 响
J n 2 1 u . 01
文 章 编 号 :001 3 (0 10 —2 30 10 —7 52 1 )20 0 -3
甲 H0物系氧化苯乙 酸.22 烯制苯甲酸
孙 琪 , 王 丽 润 , 崔 岩
( 宁师范大学 化学化工学 院, 宁 大连 辽 辽 16 2 ) 10 9
摘 要 : 在无催化 荆的条件下 。 采用不 同物系进行 了苯乙烯氧化反应 制得苯甲酸 的研究. 察了物系种类 、 2 2 考 H O 用
2 3 反 应 温 度 对 苯 乙烯 氧 化 反 应 的 影 响 .
取 6 4mmo 苯 乙烯 , ( O . l n H。 :HC OH ) , 应 5h 考 察 反 应 温 度 对 甲酸 一 0 物 系 氧 化 苯 乙 烯 反 应 的影 响 , O 一1 反 , H 2 结 果 见 图 2 由 图 2可 见 , 乙烯 转 化 率 为 1 0 . . 苯 0 当反 应 温 度 由 5 O℃ 升 至 10℃ , 甲 酸 的 选 择 性 由 6. % ( 0℃ ) 0 苯 91 5 增 至 9 . % (0℃ )再 降 到 7 . (0 14 8 , 6 3 10℃ ) 环 氧 苯 乙烷 的选 择 性 随反 应 温 度 的升 高 而 降 低 ,0 . 10℃ 时 最 小 ( . ) 苯 甲 22 . 醛 的选 择 性 先 降 低 到 5 3 (0℃ )后 升 高 到 2 . % ( 0 ℃ )说 明 , 度 低 于 8 . 8 , 1 5 10 . 温 O℃ , 利 于 生 成 苯 甲 酸 , 温 度 大 于 有 当 8 O℃ , 甲酸 和 环 氧 苯 乙烷 的 减 少 ( 择性 下 降 ) 可 能是 转 化 为苯 甲醛 ( 择 性 增 加 ) 因 此 , 宜 的反 应 温 度 为 8 苯 选 很 选 . 适 O℃ .
分子氧条件下Co-ETS-10和Co-AM-6催化苯乙烯氧化生成氧化苯乙烯和苯甲醛(英文)

分子氧条件下Co-ETS-10和Co-AM-6催化苯乙烯氧化生成氧化苯乙烯和苯甲醛(英文)Shuvo Jit Datta;Kyung Byung Yoon【期刊名称】《催化学报》【年(卷),期】2015(36)6【摘要】Pristine ETS-10 and AM-6 and their Co2+-exchanged forms were prepared, and their catalytic activities toward the oxidation of styrene in oxygen atmosphere were studied in dimethylformamide. The catalysts were denoted as Co-E10-n(n = 0, 9, 26, 68, 81) and Co-A6-m(m = 0, 8, 23, 63, 79), where n and m denote the degree of Co2+ exchange. The products of the oxidation process were identified as styrene epoxide(E) and benzaldehyde(B). Both the pristine forms, ETS-10(Co-E10-0) and AM-6(Co-A6-0), and Co2+-exchanged forms displayed catalytic activities. With increasing n or m, the conversion, and hence the rate, increased. Specifically, the rates var ied from 6.1 to 12.5 mmol·g-1·h-1with increasing n(Co-E10-n catalysts) and from 5.4 to 12.4 mmol·g-1·h-1 with increasing m(Co-A6-m catalysts). In contrast, the E/B ratio decreased with increasing n or m. More specifically,the E/B ratio decreased from 2.1 to 0.1 with increasing n from 0 to 81(Co-E10-n catalysts) and from 1.3 to 0.1 with increasing m from 0 to 79(Co-A6-m catalysts). Co-E10-9 displayed the highest E yield and Co-A6-79 generated the highest B yield. The highest turnover frequency obtained was 36.3 Co-1·h-1, which was the highest oneobtained among those obtained for the Co2+-exchanged zeolites and mesoporous silica reference materials studied in this work.【总页数】9页(P897-905)【关键词】苯乙烯氧化物;活性催化剂;苯甲醛;分子氧;二甲基甲酰胺;介孔二氧化硅;二氧化碳;N催化剂【作者】Shuvo Jit Datta;Kyung Byung Yoon【作者单位】Korea Center for Artificial Photosynthesis, Center for Nano Materials, Department of Chemistry, Sogang University【正文语种】中文【中图分类】TQ457.2;O623.425【相关文献】1.苯乙烯氧化合成环氧苯乙烷和苯甲醛催化剂的研究进展 [J], 张旭;张利雄;徐南平2.分子氧氧化苯乙烯制备环氧苯乙烷的多相催化剂研究进展 [J], 杨瑞云;王宪沛;李文;李小安;闫俊;张辉辉;刘卫涛3.以分子氧为氧源催化苯乙烯环氧化催化剂研究进展 [J], 张旭;张翠歌4.钛硅分子筛催化苯乙烯氧化制苯甲醛 [J], 李钢;王祥生;刘海鸥5.铁/介孔碳球的制备及其催化氧化苯乙烯生成苯甲醛 [J], 孙琪;李念哲因版权原因,仅展示原文概要,查看原文内容请购买。
甲苯氧化制苯甲醛和苯酚的新催化剂(nbs)和ba(oh)_,2_的探索研究

甲苯氧化制苯甲醛和苯酚的新催化剂(NBS)和Ba(OH)2的探索附表索引表 1.1 2003年以后亚洲苯酚装置新增计划(万t/a) (4)表 1.2 国内引进技术所建的四套装置情况(万t/a) (5)表 1.3 2004~2006年我国苯酚/丙酮装置新建、扩建情况(万t/a) (5)表 3.1主要实验试剂 (21)表 3.2 主要实验仪器 (21)表 3.3 实验数据记录 (23)表 3.4 Br/Co原子比对反应的影响 (26)表 3.5 温度对反应的影响 (27)表 3.6 实验所用试剂 (29)表 3.7 部分实验仪器 (29)表 3.8 不同助催化剂对反应的影响 (31)表 3.9 不同温度对反应的影响 (33)表 4.1 甲苯液相氧化制苯甲酸的主要产物及副产物的沸点、熔点 (35)表 4.2 常压精馏主要仪器 (35)表 4.3 常压精馏后物料中的各物质在不同压强下的沸点 (36)表 4.4 减压精馏主要设备装置 (37)表 4.5 高纯度苯酚的几个关键指标 (38)表 4.6 甲苯-水-苯酚的三元体系中各物质沸点(1.01×105Pa) (39)表 4.7 苯甲酸在不同溶剂中的溶解性能(25℃) (40)表 5.1 近年来我国苯酚的消费现状及预测情况(万t) (42)表 5.2 三种生产苯酚方法的费用比较 (44)硕士学位论文第1章 绪论1.1 概述苯酚(Phenol)又名羟基苯(Hydroxybenzol)、石炭酸(Carbolic Acid)。
分子式为C6H5OH、C6H6O,分子量94.11。
苯酚是一种重要的有机化工原料,它是许多化工产品的起始原料,工业用途极为广泛。
苯酚的下游产品涉及到工业、农业、国防、科学技术等各个领域及人们日常生活的各个方面。
苯酚主要用于制造酚醛树脂、双酚A及己内酰胺,此外,苯酚衍生物如卤代酚、硝基酚、烷基酚可用于医药、炸药、农药,石油、添加剂、合成纤维、合成香料、染料等。
苯乙烯生产工艺1

苯乙烯是一种重要的基本有机化工原料,主要用于生产聚苯乙烯树脂(PS)、丙烯腈-丁二烯-苯乙烯(ABS)树脂、苯乙烯-丙烯腈共聚物(SAN)树脂、丁苯橡胶和丁苯胶乳(SBR/SBR 胶乳)、离子交换树脂、不饱和聚酯以及苯乙烯系热塑性弹性体(如SBS)等。
此外,还可用于制药、染料、农药以及选矿等行业,用途十分广泛。
目前,世界上苯乙烯的生产方法主要有乙苯脱氢法、环氧丙烷-苯乙烯联产法、热解汽油抽提蒸馏回收法以及丁二烯合成法等。
1 乙苯脱氢法1.1、原料-----乙苯:乙苯脱氢法生产苯乙烯的原料是乙苯。
乙苯是乙基苯的俗称,无色,具有芳香气味的可燃液体,沸点136.19°C。
熔点(℃) -94.9,可由苯通过烷基化或直接从碳八芳烃分离获得,主要用于制造苯乙烯,少量用于有机合成工业,如制成苯乙酮用于香料、医药等方面。
目前,世界上90%以上的乙苯是由苯和乙烯烷基化生产制得,一分子乙烯在适当条件下与一分子苯作用生成一分子乙苯。
1.1.1、乙苯生产工艺方法:现在工业上约有90%的乙苯是通过苯烷基化生产的1)液相法液相法使用的催化剂为三氯化铝,反应器为塔式,反应温度范围在125~140℃,反应压力在0.2~0.4Mpa,使乙烯与苯反应生成乙苯:副反应是乙苯进一步用乙烯烷基化生成多乙苯。
工业上将苯的转化率限制在52%~55%左右,并采用高的苯与乙烯配料比(摩尔比一般为2左右),以防止生成更多的二乙苯与多乙苯。
乙苯的平均收率为94%~96%。
应严格控制原料苯和乙烯中的硫化物、乙炔等杂质,以减少三氯化铝的消耗。
一般烃化液的组成(质量%):苯40,乙苯47,多乙苯(主要是二乙苯)13。
反应前应将苯干燥至水含量30mg/kg以下,乙烯纯度为99.9%。
反应产物(粗乙苯)用精馏分离得到乙苯,分离得到的苯再循环使用。
2)气相法气相法的设备是固定床式,催化剂为磷酸负载在硅藻土构成的催化剂。
反应温度为200~250℃,反应压力为1.4Mpa.关于乙烯的综合纯度指标高低不是关键,关键是应在预处理中除掉硫及硫化物,氮化物和乙炔。
苯乙烯
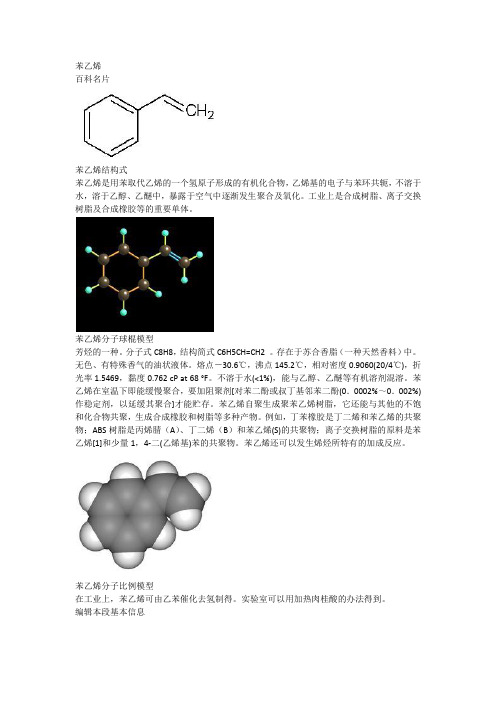
苯乙烯百科名片苯乙烯结构式苯乙烯是用苯取代乙烯的一个氢原子形成的有机化合物,乙烯基的电子与苯环共轭,不溶于水,溶于乙醇、乙醚中,暴露于空气中逐渐发生聚合及氧化。
工业上是合成树脂、离子交换树脂及合成橡胶等的重要单体。
苯乙烯分子球棍模型芳烃的一种。
分子式C8H8,结构简式C6H5CH=CH2 。
存在于苏合香脂(一种天然香料)中。
无色、有特殊香气的油状液体。
熔点-30.6℃,沸点145.2℃,相对密度0.9060(20/4℃),折光率1.5469,黏度0.762 cP at 68 °F。
不溶于水(<1%),能与乙醇、乙醚等有机溶剂混溶。
苯乙烯在室温下即能缓慢聚合,要加阻聚剂[对苯二酚或叔丁基邻苯二酚(0.0002%~0.002%)作稳定剂,以延缓其聚合]才能贮存。
苯乙烯自聚生成聚苯乙烯树脂,它还能与其他的不饱和化合物共聚,生成合成橡胶和树脂等多种产物。
例如,丁苯橡胶是丁二烯和苯乙烯的共聚物;ABS树脂是丙烯腈(A)、丁二烯(B)和苯乙烯(S)的共聚物;离子交换树脂的原料是苯乙烯[1]和少量1,4-二(乙烯基)苯的共聚物。
苯乙烯还可以发生烯烃所特有的加成反应。
苯乙烯分子比例模型在工业上,苯乙烯可由乙苯催化去氢制得。
实验室可以用加热肉桂酸的办法得到。
编辑本段基本信息苯乙烯性质反应化学品中文名称:苯乙烯[2]化学品英文名称:phenylethylene ,Ethenylbenzene,Styrol,Vinyl benzene,Cinnamene,Styrolene,Cinnamol?中文名称2:乙烯基苯,乙烯苯,苏合香烯,斯替林英文名称2:styrene英文名简称:ST俄文名称:Стирол技术说明书编码:236CAS No.:100-42-5EINECS号:202-851-5[3]分子式:C8H8分子量:104.14编辑本段物化性质性状无色油状液体,有芳香气味。
Boiling_point 145℃凝固点-30.6℃相对Density 0.9059 折射率1.5467 flash_point 31.11℃溶解性不溶于水,溶于乙醇及乙醚。
苯甲腈的合成

苯甲腈的合成全文共四篇示例,供读者参考第一篇示例:苯甲腈是一种重要的有机合成中间体,广泛应用于医药、染料、涂料和农药等领域。
苯甲腈的合成方法有多种,其中主要包括芳香族碱与氢氧化钠反应、芳香族碘化物与氰化钠反应、芳香族甲醛与氰化钠反应等。
下面将分别介绍这些方法的合成过程。
一、芳香族碱与氢氧化钠反应法芳香族碱与氢氧化钠反应是一种常用的合成苯甲腈的方法。
其合成过程如下:先将芳香族碱溶解在乙醇中,然后加入适量的氢氧化钠溶液。
反应后,产生的苯甲腈从溶液中析出,通过过滤、洗涤、结晶等步骤得到纯品。
这种方法的优点是操作简单,原料易得,适用于规模化生产。
但缺点是废液处理较为困难,产率较低。
这种方法的优点是反应速度快,产率较高,适用于少量试验。
但缺点是原料较昂贵,对反应条件要求较高。
苯甲腈的合成方法有多种选择,每种方法都有其独特的优点和局限性。
在实际生产中,要根据不同的需求和条件选择合适的合成方法,以获得最好的合成效果。
随着有机合成技术的不断发展,对苯甲腈的合成方法也会不断进行优化和改进,以满足产业发展的需求。
第二篇示例:苯甲腈是一种重要的有机化合物,也被称为苯氰或苯基氰。
它是一种无色液体,无臭,具有辛辣味道,主要用于生产药物、染料、树脂和塑料等化工产品。
苯甲腈的合成方法有很多种,其中包括从苯甲醛或苯乙烯等原料合成的方法。
苯甲腈的合成方法之一是从苯甲醛合成。
苯甲醛是一种常见的有机化合物,可以从苯乙烯通过氧化反应得到。
苯乙烯通过氧化反应转化为对甲醛,再进一步加氰基转化为苯甲腈。
这种方法的优点是原料易得,反应条件温和,但是中间产物对甲醛易发生水解反应,需要特殊处理控制反应条件。
苯甲腈的合成方法多种多样,选择合适的合成方法需要考虑原料成本、反应条件和产物纯度等因素。
目前,工业生产中常采用从苯甲醛合成的方法,具有原料易得,反应条件温和的优点。
但是随着环保意识的增强,从苯乙烯或甲苯合成的方法也在不断得到改进,以减少对环境的污染。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大连理工大学
硕士学位论文
苯乙烯氧化反应制苯甲醛的研究
姓名:马云云
申请学位级别:硕士
专业:工业催化
指导教师:刘靖
20060601
大连理工大学硕士学位论文格式规范
进行的,第二步Cu(OH)2脱水生成CuO是一个吸热过程,晶化的温度不宜过低否则难以得到理想的样品,也没必要采用高温以免浪费能耗,可降低生产成本,因此可将晶化温度选定为80℃。
图3.2C1,-,C8号CuO样品的放大10,000倍的扫描电镜图片
(a—C1;b-C2;c-C3;d—C4;e—C5;f-C6;g—C7;h-C8)
SEMofCuOsampleC1--,C8on10,000times
Fig.3.2
(a-C1;b-C2;c-C3;d-C4;e-C5;f-C6;g-C7;h-C8)
大连理工大学硕士学位论文
相同配比时,在100"0晶化lh同晶化3h相比,样品形貌变化不大,但有倾向于团聚的趋势,因此晶化的时间不宜过长,可将晶化时间选定为lh。
其它合成条件相同,将碱量减半得到的样品仍呈片状但却有轻微的团聚,且尺寸分布不均,生成CuO的反应分为两步:
Cu(N03)2+2NaOH一2NaN03+Cu(OH)2(1)Cu(OH)2cs)+20H。
{Bq)--[Cu(OH),]。
(am—CuO(s)+20IT(aq)+H20(2)首先按化学方程式(1)生成Cu(OH)2,它能溶解于过量浓碱溶液中,形成深蓝色的四羟基合铜(II)离子的溶胶,在一定条件下脱水后最终得到CuO晶体。
因此适宜的铜盐,碱(molratio)取为1:4,更易于达到溶液的过饱和状态。
通过对比c24(b)样品与C84(h)样品的电镜表征结果,发现其他合成条件相同,增大水量对样品形貌的影响甚微,得到的样品都呈片状,分散均匀,几乎未团聚,但c8比c2略长。
这可能是由于溶液浓度偏高时,沉淀形成快,表面化学反应在极短的时间内进行,可以减弱由表面反应控制的生长而使颗粒的生长受扩散过程控制。
这将使晶核大量快速形成,晶体的多向生长速率差异降低,得到长度较短的薄片。
以氯化铜、硫酸铜为铜源制备的样品团聚比较严重,其样品表面隐约呈片状,分散的效果不佳,氯化铜的略强于硫酸铜的,基于三者溶解度的顺序:硝酸铜)氯化铜)硫酸铜这一事实,推测铜盐的溶解度可能是Cu0样品形貌的影响因素之一。
图3.3固相研磨法(a)和沉淀法(b)制各的样品放大10.000倍的扫描电镜照片
SEMofsamplebyabrasive(a)anddeposition(b)on10.000times
Fig.3,3
固相研磨法及沉淀法得到的样品的电镜图片如图3.3所示,二者皆呈团块状,团聚严重,但研磨法制备的样品(a)要比沉淀法制备的样品(b)分散的更疏松一些。
这两种方法
大连理工大学硕士学位论文格式规范
MCM一41分子筛为规则的六方孔道形分子筛,以浸渍法制各的M003/MCM.41及水热晶化法制备的Mo-MCM-41的XRD图谱示于图3.3,其谱线中都未出现M003的特征峰,这表明载体表明无金属氧化物聚集现象。
溶胶-凝胶法制备的M003/Si02样品的SEM[虱片如图3.4所示,无定型的Si02呈胶块状。
3.4小结图3.4溶胶一凝胶法制各的M003/Si02的SEM图片Fig3.4
SEMofM003/Si02sampleby
sol-gel
1.沉淀法、固相混合法和水热晶化法制备的CuO样品的XRD衍射峰的强度依次降低且峰形拓宽,表明这三种方法制各的CuO晶粒尺寸依次减小,水热晶化法制备的CuO样品晶粒有大量缺陷。
2.XRD谱图表明浸渍法制备的M003/Si02样品负载的金属分布不均匀,溶胶.凝胶法制备的样品分布均匀。
3.水热晶化法生成了厚度约为10--100ran分散均匀的细针状或薄片状样品,几乎未团聚。
适宜的反应条件为铜盐,碱(toolratio)取为l:4,在80"C晶化1h。
在水热晶化法中采用硝酸铜做铜源制备的样品优于氯化铜、硫酸铜做铜源制备的样品。
4,沉淀法、固相混合法得到的样品呈团块状,团聚严重,但研磨法制备的样品分散的更疏松一些,晶粒尺寸约为50~500nm,而沉淀法制备的样品尺寸则难以从SEM中估测
出。
大连理工大学硕士学位论文
5.1.3以CuO粉体为催化剂的反应结果
我们将水热晶化法制备的纳米.CuO用于CHP氧化苯乙烯的反应,催化剂能很好的分散于整个反应体系中且易于分离。
反应loh后,比较504C和60"C得苯乙烯氧化反应结果,如图5.1所示,60℃时苯乙烯的转化率39.02%略高于50"C时的转化率为37.5%,同时苯甲醛的选择性从33.58%升到38.36%,苯乙醛的选择性也略有增加,从10.63%升到11.53%,而环氧苯乙烷的选择性则从55.79%降到了50.08%。
这可能是由于升温有助于克服苯乙烯开键的活化能,可环氧苯乙烷的碳氧三元环存在较大张力,本身就具有不稳定性,升高温度使环氧苯乙烷的选择性降低也印证了环氧苯乙烷在热力学上是不稳定的,其三元环更易于打开重排生成苯乙醛。
图5.1温度对苯乙烯氧化反应的影响
Fig5.1EffectoftemperatureonStyreneoxidation
Time10}l,styrene:CliP(molratio)=2:l,0.059/ml(styrene)
随着CuO催化剂粒径减小,其表面积急剧增大,致使表面原子数迅速增多,同时表面能迅速增加。
由表5.3可见,Cu的纳米微粒粒径从100衄妒10衄卉啪,Cu微粒的比表面积和表面能增加了2个数量级。
CuO纳米颗粒也有如此规律,只是其颗粒中不但含有共价键也含有离子键。
随CuO纳米微粒粒径减小,比表面积增大,表面原子数增多及颗粒的高表面能和原子配位不饱和性,导致大量的悬键和不饱合键等,这就使得这些。
