水中大肠菌群快速检测方法酶底物孙宗科_附件
酶底物法在水中粪大肠菌群分析中的应用研究

酶底物法在水中粪大肠菌群分析中的应用研究粪大肠菌群是判断水体污染状况的重要指标,在环境质量评介、环境卫生监督等方面具有重要的意义。
它的主要来源就是粪便,粪便当中有诸多的病原微生物、病毒和原生动物蠕虫,上述污染源能够引起肠道传染疾病的广泛传播。
人们普遍应用粪大肠杆菌群来评价水体的污染状况,从而了解水质对人体健康的影响程度。
从检测角度来看,使用粪大肠杆菌群酶底物法进行水质监测,对科研探究有着及其重要的作用,其具有快速和方便等诸多优势。
酶底物法《HJ 1001 — 2018》适用于地表水、地下水、生活污水和工业废水中粪大肠菌群的测定。
本方法的检出限为10MPN/L。
以下将对它的重要的事项进行详细介绍。
1.方法原理在特定温度下培养特定的时间,粪大肠菌群能产生β-半乳糖苷酶,将选择性培养基中的无色底物邻硝基苯-β-D-吡喃半乳糖苷(ONPG)分解为黄色的邻硝基苯酚(ONP)。
统计阳性反应出现数量,查MPN表,计算样品中粪大肠菌群的浓度值。
2.干扰和消除活性氯具有氧化性,能破坏微生物细胞内的酶活性,导致细胞死亡,可在样品采集时加入硫代硫酸钠溶液消除干扰。
重金属离子具有细胞毒性,能破坏微生物细胞内的酶活性,导致细胞死亡,可在样品采集时加入乙二胺四乙酸二钠溶液消除干扰。
3.选择试剂和材料的注意事项ONPG-MUG培养基每100ml样品需使用培养基粉末2.7g±0.5g,可采用市售商品化培养基制品。
97孔定量盘:含49个大孔,48个小孔。
其中,每个小孔可容纳 0.186ml样品,大孔中48个大孔每个可容纳1.86ml样品,一个顶部大孔可容纳11ml样品。
也可采用经环氧乙烷灭菌的市售商品化成品。
一定选择标准阳性比色盘,无菌水的制备是取适量实验用水,经121℃高压蒸汽灭菌 20 min,备用。
4.仪器和设备的选择采样瓶选用具螺旋帽或磨口塞的100ml、250ml、500ml广口玻璃瓶。
如果在采集不存在或不考虑余氧、金属离子干扰的样品时,可以采用市售无菌采样瓶或无菌采样袋。
水中总大肠菌群检测方法的研究
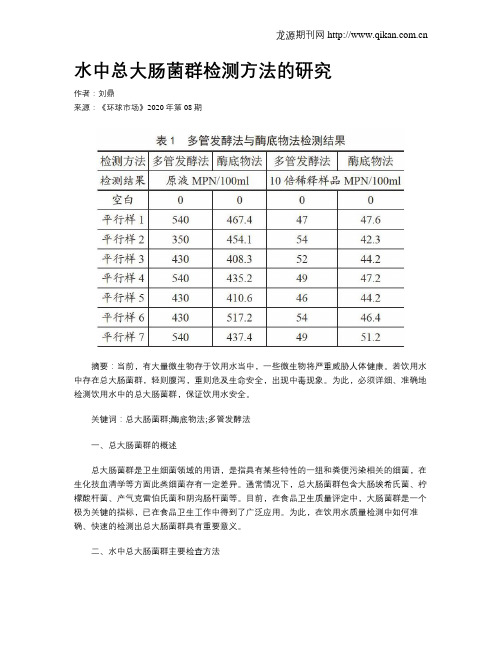
水中总大肠菌群检测方法的研究作者:刘鼎来源:《环球市场》2020年第08期摘要:当前,有大量微生物存于饮用水当中,一些微生物将严重威胁人体健康。
若饮用水中存在总大肠菌群,轻则腹泻,重则危及生命安全,出现中毒现象。
为此,必须详细、准确地检测饮用水中的总大肠菌群,保证饮用水安全。
关键词:总大肠菌群;酶底物法;多管发酵法一、总大肠菌群的概述总大肠菌群是卫生细菌领域的用语,是指具有某些特性的一组和粪便污染相关的细菌,在生化技血清学等方面此类细菌存有一定差异。
通常情况下,总大肠菌群包含大肠埃希氏菌、柠檬酸杆菌、产气克雷伯氏菌和阴沟肠杆菌等。
目前,在食品卫生质量评定中,大肠菌群是一个极为关键的指标,已在食品卫生工作中得到了广泛应用。
为此,在饮用水质量检测中如何准确、快速的检测出总大肠菌群具有重要意义。
二、水中总大肠菌群主要检查方法目前,在饮用水总大肠菌群检测中,常用的检测方法分为3类,即多管发酵法、酶底物法、滤膜法。
具体情况如下:(一)多管发酵法多管发酵法多用于检测地表水、地下水及废水中的大肠菌群。
其试验结果是用MPN表示。
实际上,多管发酵法是按照统计学理论,估计水体内大肠杆菌密度和卫生质量的,基于理论来讲,需做大量重复测定,但发现,这种估计可以存着大于实际数字的情况。
与此同时,随着不断增加稀释度试管的重复数量,这种差异将慢慢下降,在细菌含量的估计值分析当中,主要取决于那些同时显示阳性、阴性的稀释度。
具体实验当中,可根据所要求数据的准确度来确定水样检测所要求重复的数目。
(二)酶底物法按照大肠菌群在选择性培养基上可生成β-半乳糖苷酶的细菌群组,此细菌群组能够进行色原底物分解,并释放出色原体,改变培养基颜色,并由此检测出水中总大肠菌群。
酶底物法试验结果也可采用MPN表示。
(三)滤膜法基于大肠菌群的特性,通过孔径0.45微米的微孔滤膜进行水样过滤及细菌截留。
在品红亚硫酸钠培养基上粘贴滤膜,在37℃下培养24h,以此生成需氧和兼性庆氧特性的菌落,随后经实验验证来进行水中总大肠菌群的检测。
地下水总大肠菌群的测定方法

地下水总大肠菌群的测定方法
地下水中总大肠菌群的测定是非常重要的,因为它可以反映出
水质的卫生状况。
以下是一些常用的测定方法:
1. 膜过滤法,这是一种常用的测定方法,通过将地下水样品通
过0.45微米的膜过滤器,然后将膜放置在含有大肠菌群特异培养基
的琼脂平板上进行培养。
培养后,通过计数形成的菌落来确定水样
中大肠菌群的数量。
2. 荧光素基因定量PCR法,这是一种分子生物学方法,通过提
取地下水中的DNA,使用荧光素基因特异引物进行PCR扩增,然后
使用荧光素探针进行定量检测。
这种方法可以快速准确地测定大肠
菌群的数量。
3. 色素培养基法,使用含有某种特定底物的琼脂平板进行培养,通过大肠菌群对底物的特异反应产生的颜色变化来测定其数量。
4. 流式细胞术,这是一种高通量的测定方法,通过将水样中的
微生物染色标记,然后通过流式细胞仪进行快速准确地测定大肠菌
群的数量。
总的来说,测定地下水中总大肠菌群的方法有多种,可以从不同的角度对水质进行评估。
在实际应用中,可以根据实际情况选择合适的方法进行测定。
水中大肠菌群的测定

实验水中大肠菌群的测定及结果分析一、目的要求1、学习测定水中大肠菌群检测程序、方法.2、掌握大肠菌群检测结果的报告方式.二、实验原理大肠菌群是评价水质好坏的一个重要的卫生指标,也是反映水体被生活无水污染的一项重要监测项目。
大肠菌群是一群以大肠埃希氏菌为主的需氧及兼性厌氧的革兰氏阴性无芽孢杆菌,在37℃生长时,能在48小时发酵乳糖并产酸才产气。
食品中大肠菌群数是以每100mL(g)检样内大肠菌群最近似数(The most probable number,简称MPN)表示。
据此含义,所有食品卫生标准中所规定的大肠菌群均以100mL(g)食品内允许含有大肠菌群的实际数值为报告标准。
检查大肠菌群数,一方面能表明食品中有无粪便污染,另一方面还可以根据数量的多少,判定食品受污染的程度。
我国生活饮用水卫生标准中规定一升水样中总大肠菌群数不超过3个。
多管发酵法包括初发酵试验、平板分离和复发酵试验三个部分。
发酵管内装有乳糖蛋白胨液体培养基,并倒置一德汉氏小套管.乳糖能起选择作用,因为很多细菌不能发酵乳糖,而大肠菌群能发酵乳糖而产酸产气。
三、实验器材1、培养基:乳糖胆盐发酵管、伊红美蓝琼脂、乳糖发酵管2、器皿:1ml吸管、10ml吸管、试管(15×150)、三角锥瓶500ml、三角锥瓶500ml(内装蒸馏水250ml)3、其他:酒精灯,牛皮纸或报纸,棉花,高压蒸汽菌锅,水浴锅,显微镜,香柏油,二甲苯等四、操作方法1、水样的采取池水、河水或湖水应取距水面10—15㎝的深层水样,先将灭菌的带玻璃塞瓶,瓶口向下浸入水中,然后翻转过来,除去玻璃塞,水即流入瓶中,盛满后,将瓶塞盖好,再从水中取出,最好立即检查,否则需放入冰箱中保存.2、检样稀释(1)以无菌操作,将检样25mL放于含有225mL灭菌蒸馏水水的三角锥瓶中,摇匀,做成1:10的均匀稀释液。
(2)取一支lmL吸管插入吸取1∶10稀释液1mL注入含有9mL灭菌水的试管内,振摇试管,混合均匀,做成1∶100稀释液。
水中大肠菌群的检测

(2)于37℃恒温培养箱中培养24小时。
4.2.2乳糖复发酵:
(1)取上述经培养24小时后产气之发酵管,用接种环接种于乳糖复发酵管中。
(2)于37℃恒温培养箱中培养24小时,产酸产气者表明该管有大肠菌群存在。
1.原理:定义或目的
大肠菌群系指能发酵乳糖、产酸产气、需氧和兼性厌氧的革兰氏阴性无芽胞杆菌。该菌主要来源于人畜粪便,故以此作为粪便污染指标来评价食品的卫生质量,推断食品中有否污染肠道致病菌的可能。
食品中大肠菌群数系以100ml(g)检样内大肠群最可能数(MPN)表示。
2.仪器设备与器具:
2.1干热灭菌器:玻璃用具等之来菌用,其内部之中心温度须达170℃以上,及维持1小时以上者或160℃内2小时以上;
2.7显微镜:
2.8天平;
2.9稀释瓶:(A)250ml三角瓶;
(B)15×150mm试管;
2.10玻璃培养皿或一次性无菌培养皿;
2.11广口瓶:250ml,体附盖,灭菌后作为取样用。
2.12玻璃吸管:1ml及10ml之刻度吸管,应有0.1ml之刻度,或定量移液器(1~5ml)及(1~10ml);
2.13三角瓶:250ml,500ml,1000配制培养基用;
21
26
31
36
42
22
26
32
38
44
50
27
33
39
45
52
59
34
40
47
54
62
69
41
48
56
64
72
生活饮用水中总大肠菌群三种不同检测方法比较

生活饮用水中总大肠菌群三种不同检测方法比较在生活饮用水中,大肠菌群是一种重要的指标,用来评价水源的卫生状况。
常见的三种大肠菌群检测方法包括MPN法(Most Probable Number)、膜过滤法和PCR法(聚合酶链式反应法)。
本文将对这三种方法进行比较,分析其特点和适用场景。
首先,MPN法是一种常用的大肠菌群检测方法。
该方法通过对一系列稀释液进行培养,根据培养液中菌落的种类和数量来评估大肠菌群的含量。
这种方法的优点是操作简单、成本较低,可适用于大批量的水样检测。
但是,MPN法的缺点是需要较长时间的培养过程,通常需要3-5天的时间才能得到结果。
此外,该方法对生活饮用水中的非培养大肠菌群无法进行检测。
其次,膜过滤法是一种较为常用的大肠菌群检测方法。
该方法通过将水样通过特殊大小的膜过滤器,使大肠菌群滞留在膜上,然后将膜转移到培养基上进行培养。
该方法的优点是操作相对简单,需要的时间较短,通常在24小时内可以得到结果。
此外,该方法可以对生活饮用水中的非培养大肠菌群进行检测。
但是,膜过滤法的缺点是需要较多的培养器材和耗材,成本较高。
最后,PCR法是一种较为先进的大肠菌群检测方法。
该方法通过扩增水样中大肠菌群的DNA片段,然后利用荧光技术进行检测。
PCR法的优点是快速、灵敏,可以在短时间内得到准确的结果。
此外,该方法可以对生活饮用水中的非培养大肠菌群进行检测,并可以进行定量分析。
但是,PCR法的缺点是需要较复杂的实验设置和专业的设备,操作要求较高,成本较高。
综上所述,生活饮用水中总大肠菌群的检测方法包括MPN法、膜过滤法和PCR法。
这三种方法各有特点,在不同的场景中适用。
MPN法适用于大批量的水样检测,操作简单、成本较低,但需要较长时间。
膜过滤法适用于一般的大肠菌群检测,操作相对简单、时间较短,但成本较高。
PCR 法适用于准确和快速的大肠菌群检测,可以进行定量分析,但需要较复杂的实验设置和专业设备。
在实际应用中,可以根据需求和实际条件选择合适的检测方法来评估生活饮用水的卫生状况。
微生物学实验-水中大肠菌群的简易检测
化学与生 命科学学
院
实验要求
1、本次实验四人一组。通过实验结果分析实验 室自来水样是否符合标准。
2、每组完成后清洗10个培养皿,包1包培养皿、 1包(5支1ml)移液管、1包试管(5支)。
3、每组卫生区域打扫干净后才能离开。
4、值日生配制牛肉膏蛋白胨琼脂培养基500ml 并分装在锥形瓶内。
化学与生 命科学学
院
微生物学实验-水中大肠菌群的简易检测
化学与生 命科学学
院
化学与生 命科学学
院
化学与生 命科学学
院
实验原理
大肠菌群并非细菌学分类命名,不代表某一种或某一属细菌。 是卫生细菌检测领域用语,指的是具有某些特性的一组与粪 便污染有关的细菌。
大肠菌群是一群好氧和兼性厌氧、无芽孢的革兰氏阴性杆菌, 在乳糖培养基中经37℃培养24~48h,能产酸产气。主要包括 埃希氏菌属、肠杆菌属、克雷伯氏菌属和柠檬酸杆菌属,这 类菌是温血动物肠道内的正常菌群,随粪便污染水源。
1、采取水样:取学校“鉴湖”水面10~15cm,离岸边 5cm的水样,立即测试。
2、稀释水样:取3支无菌试管,分别加9ml无菌水,加 1ml水样到第一管内摇匀,再自第一管中取1ml至第二管中,如 此稀释到第4管。
3、吸取第三、第四管稀释液各1ml至无菌平皿中,每一 个稀释度重复两皿。
4、各倾注已经融化并冷却至45 ℃左右的伊红美兰琼脂 培养基,立即摇匀。
化学与生 命科学学
院
实验内容
注意事项:
•自来水取样时避免取样中造成污染。 •自来水中含有余氯,可能对细菌有杀灭和抑制作用,
会造成结果偏低或假阴性,可以加入少量硫代硫酸钠,
水质大肠杆菌检测方法
水质大肠杆菌检测方法水质大肠杆菌是一种常见的水污染指标微生物,其存在可能导致水质污染,对人体健康造成威胁。
因此,对水质中的大肠杆菌进行有效检测是非常重要的。
本文将介绍一些常用的水质大肠杆菌检测方法,希望能对相关领域的研究人员和从业者有所帮助。
一、培养法。
培养法是目前常用的一种大肠杆菌检测方法。
其步骤主要包括取样、制备培养基、接种培养、培养箱培养、观察结果等。
首先,需要在水样中取样,并将其接种到含有大肠杆菌生长所需营养物质的培养基中。
然后,将接种好的培养基置于培养箱中进行培养,培养箱内的温度、湿度等条件需要根据大肠杆菌的生长特性进行调节。
最后,观察培养基上是否有大肠杆菌的生长,通过对菌落的形态、颜色等特征进行鉴定,从而判断水样中是否存在大肠杆菌。
二、PCR法。
PCR法是一种分子生物学技术,也被广泛应用于大肠杆菌的检测。
其原理是通过PCR扩增技术,将水样中的DNA扩增成百万倍,然后通过电泳等方法进行检测。
相比于传统的培养法,PCR法具有检测速度快、准确度高等优点。
但是,PCR法需要专业的实验室设备和技术支持,成本较高,因此在实际应用中需要权衡利弊。
三、免疫学方法。
免疫学方法是利用抗体与抗原特异性结合的原理,通过免疫学技术对大肠杆菌进行检测。
常见的免疫学方法包括酶联免疫吸附试验(ELISA)、免疫荧光法等。
这些方法具有检测速度快、灵敏度高等优点,但是需要专门的实验室设备和技术支持,成本较高。
四、生化方法。
生化方法是通过检测水样中大肠杆菌代谢产物的变化来进行检测。
常见的生化方法包括呼吸法、酶法等。
这些方法具有检测速度快、对大肠杆菌的特异性强等优点,但是在实际应用中需要注意误差的控制。
综上所述,针对水质中大肠杆菌的检测,目前存在多种方法可供选择。
在选择检测方法时,需要根据实际情况权衡各种方法的优缺点,选择最适合的方法进行检测。
同时,为了保证检测结果的准确性,需要严格按照相关标准和规范进行操作,并进行质控措施的监测和管理。
浅述酶底物法快速测定地表水中总大肠菌群与大肠埃希氏菌
浅述酶底物法快速测定地表水中总大肠菌群与大肠埃希氏菌摘要:根据《生活饮用水卫生标准》中对微生物指示菌检测的方法要求,提出采取精确、快速、可靠的总大肠菌群及大肠埃希氏菌检测方法,通过试验方法对比、实际水样检测,比较酶底物法与多管发酵法、滤膜法用于生活饮用水地表水中总大肠菌群和大肠埃希氏菌的检测结果。
实验结果表明,酶底物法能够快速检测地表水中总大肠菌群和大肠埃希氏菌,结果精确、快速、可靠,并认为在控制流行疾病的发生传播,从而保障公众健康安全有重要的预报价值和科学意义,同时鉴于我省大多数自来水公司的水质检测还没有增加此方法,建议今后该方法应得到普及和应用。
关键词:总大肠菌群;大肠埃希氏菌;酶底物法我国新的国家《生活饮用水卫生标准》(GB 5749-2006)中对生活饮用水、水源水、地表水等进行卫生评价时,总大肠菌群(Total coliforms)和大肠埃希氏菌(Escherichia coli)是判定水质是否被粪便污染的两个重要指标,尤其是大肠埃希氏菌是粪便污染最有意义的指示菌,已被世界上许多组织、国家和地区使用。
新的国家《生活饮用水卫生标准》中加入大肠埃希氏菌指标,限值为100mL 不得检出大肠埃希氏菌。
并注明:若检出总大肠菌群,必须进行耐热大肠菌群或大肠埃希氏菌检测。
若水样中检出耐热大肠菌群或大肠埃希氏菌,则说明水质可能受到严重污染,必须采取相应措施。
目前,新国标中对总大肠菌群和大肠埃希氏菌的测定有三种标准方法,多管发酵法、滤膜法和酶底物法,其中多管发酵法和滤膜法是目前常用的传统检测方法,这两种方法设备简单,试验步骤较为繁琐,对操作人员专业水平要求较高,不利于应急检测,和对水的卫生学状况做出快速评价。
酶底物法检测水中总大肠菌群和大肠埃希氏菌具有操作方便、快速;干预性结果容易判断等特点,适用于水中总大肠菌群和大肠埃希氏菌的快速检测,对于及时准确的监测饮用水、地表水和水源水粪便污染状况,从而有效预报和控制流行疾病的发生与传播有重要意义。
水中大肠杆菌检测实验报告
水中大肠杆菌检测实验报告水中大肠杆菌检测实验报告水是人类生活中不可或缺的资源,但是水中的污染物对人体健康造成了严重的威胁。
其中,大肠杆菌是一种常见的水质污染指标,其存在表明水体可能受到粪便污染。
本实验旨在通过检测水样中的大肠杆菌含量,评估水质的安全性。
实验材料和方法:1. 实验材料:- 水样:从自然水源中采集的水样。
- 大肠杆菌检测试剂盒:包括培养基、试剂和培养皿等。
- 实验室设备:包括离心机、恒温培养箱等。
2. 实验方法:- 采集水样:在适当的采样点采集水样,保持样品的原始性。
- 准备培养基:按照检测试剂盒说明书的要求,准备好培养基。
- 培养大肠杆菌:将水样加入培养基中,经过适当的培养条件(如温度、时间等),使大肠杆菌得到生长。
- 检测大肠杆菌:根据检测试剂盒的指引,使用试剂对培养后的水样进行检测。
实验结果:经过实验,我们得到了水样中大肠杆菌的检测结果。
根据检测试剂盒的指示,如果水样中检测到大肠杆菌,说明水质存在潜在的健康风险;如果水样中未检测到大肠杆菌,说明水质相对安全。
讨论:本实验的目的是评估水质的安全性,通过检测大肠杆菌的存在与否来判断水样的卫生状况。
大肠杆菌是一类存在于动物和人类的肠道中的细菌,其存在于水中可能是由于粪便污染。
因此,水中大肠杆菌的检测是评估水质卫生状况的重要指标。
通过本实验,我们可以得出以下结论:1. 水样中未检测到大肠杆菌,说明水质相对安全,可以放心饮用或使用。
2. 水样中检测到大肠杆菌,说明水质存在潜在的健康风险,不宜直接饮用或使用。
然而,需要注意的是,本实验只是初步的水质评估方法之一,仅能提供关于大肠杆菌存在与否的信息,并不能全面评估水质的安全性。
在实际应用中,还需要综合考虑其他水质指标,如化学物质、重金属等的含量,以及水源的来源和处理情况等因素。
此外,本实验中使用的大肠杆菌检测试剂盒是一种常见的快速检测方法,其操作简单、结果迅速,适用于实验室和野外条件下的水质检测。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
水中大肠菌群快速检测方法-酶底物法与多管发酵法的比较 《卫生研究》2006第3期 孙宗科 丁培 薛金荣 陈西平1 吴榕2 张雅婕3 张淑红4 遇晓杰5 中国疾病预防控制中心环境与健康相关产品安全所,北京 100021
摘要: 目的 比较酶底物法与多管发酵法用于水中大肠菌群的检测。 方法 应用加标试验和实际水样检测的方式,比较酶底物法与多管发酵法用于水中大肠菌群检测结果的一致性,以及假阳性率。 结果 酶底物法与多管发酵法用于水中大肠菌群检测结果具有一致性,假阳性率无统计学意义的差别。 结论 酶底物法可以用作评价水质微生物污染的标准方法。 关键词:大肠菌群 酶底物法 多管发酵法 快速检测
Comparison between rapid detection method of enzyme substrate technique and multiple-tube fermentation technique in water coliform bacteria detection
Sun Zongke, Wu Rong, Chen Xiping, et al. Institute for Environment Hygiene and Health Related Product Safety, Chinese Center for Disease Control and Prevention, Beijing 100021, China
Abstract:In order to compare between rapid detection method of enzyme substrate technique and multiple-tube fermentation technique in water coliform bacteria detection, inoculated and real water samples are included in this experiment. Results demonstrate that enzyme substrate technique shows equivalence with multiple-tube fermentation technique. It is suggested that enzyme substrate technique can be used as a standard method for water microbiological safety evaluation.
Key words:coliform bacteria, enzyme substrate technique, multiple-tube fermentation technique, rapid detection
目前我国对生活饮用水、水源水、地表水等进行卫生学评价,检测的指标为大肠菌群(coliform bacteria)和粪大肠菌群(faecal coliforms),以这两种指标作为粪便污染的指示菌。采用的标准检测方法为膜过滤法(MF)和多管发酵法(MTF)。但这两种方法检测时间相对较长,需2~5天,需验证试验,试验步骤较为繁琐,不能对水的卫生学状况做出快速评价。因此,采用快速简便的检测方法十分必要。酶底物法可以较好的弥补传统方法的不足。 酶底物法(enzyme substrate technique)采用大肠菌群细菌能产生β-半乳糖苷酶(β-D-galactosidase)分解ONPG(Ortho-nitrophenyl-β-D-galactopyranoside)使培养液呈黄色,以及大肠埃希氏菌产生β-葡萄糖醛酸酶(β-glucuronidase)分解MUG(4-methyl-umbelliferyl-β-D-glucuronide)使培养液在波长366nm紫外光下产生荧光的原理,来判断水样中是否含有大肠菌群及大肠埃希氏菌。酶底物法可以采用成品的培养基及试剂,
基金项目:GB/T 5750《生活饮用水标准检验方法》修订工作项目。 作者简介:孙宗科,男,实习研究员 责任作者:陈西平,男,研究员 1中国疾病预防控制中心环境与健康相关产品安全所,2 农业部食品质量监督检验测试中心(上海),3 北京市疾病预防控制中心,4 河北省疾病预防控制中心,5 黑龙江省疾病预防控制中心 操作方便;无需确认试验;酶底物法检测时间较短,18h-24h即可同时判断水样中大肠菌群和大肠埃希氏菌的MPN值。 由于酶底物法用于水样定量检测时采用最可能数(MPN,most probable number)的技术和方法,所以,本项试验中比较酶底物法与多管发酵法用于水样的检测。
材料与方法 材料与试剂。本试验中酶底物法采用指定受检物检验技术(DST,defined substrate technology),其MMO-MUG培养基、试验材料和仪器由爱德士公司提供,试验菌株来源于中国普通微生物菌种保藏管理中心和中国医学微生物菌种保藏管理中心,细菌鉴定用API 20E由生物梅里埃公司提供。其它所用培养基与试剂按《生活饮用水卫生规范》2001准备和配置。 试验方法。酶底物法采用51孔定量盘法,此方法是一种基于MPN的方法。检测所需水样为100mL。用100 ml的无菌稀释瓶量取100 ml水样,加入2.7±0.5 g MMO-MUG培养基粉末,混摇均匀使之完全溶解,将水样全部倒入51孔无菌定量盘内,以手抚平定量盘背面以赶除孔穴内气泡,然后用封口机封口。放入37℃培养箱中培养24小时后进行结果判读,如果结果为可疑阳性,可延长培养时间到28小时,超过28h之后出现的颜色反应不作为阳性结果。将培养24小时之后的定量盘取出观察,如果孔穴内的水样变成黄色则表示该孔穴中含有大肠菌群。将定量盘在暗处用波长为366 nm的紫外光灯照射,有黄色反应的孔穴如果有蓝色的荧光产生则表示该定量盘孔穴中含有大肠埃希氏菌。计算有黄色反应及有荧光的孔穴数,对照MPN表查出其代表的大肠菌群及大肠埃希氏菌最可能数。 多管发酵法检测大肠菌群和粪大肠菌群方法参见《生活饮用水卫生规范》2001。 数据统计。数据整理统计方法使用 excel和SPSS10.0软件。
试验结果 加标试验。对大肠埃希氏菌32件加标水样进行大肠菌群酶底物法与多管发酵法比对实验,试验结果如图1。
大肠埃希氏菌加标水样检出结果
0102030405060161116212631样品编号MPN值多管发酵法MPN/100ml酶底物法MPN/100ml 图1 加标水样酶底物法与多管发酵法检出结果 对检出的结果进行配对t检验,检验结果表明多管发酵法与酶底物法检测结果没有统计学意义上的差别(P=0.384)。 水样检测。采取地表水水样进行检测,为保证试验结果的精确和方便统计,要求水样有一定的阳性检出率,同时水样的MPN值应尽量控制在100MPN/100ml以下,以10~30MPN/100ml为宜[1]。在本项试验中采用100件地表水水样同时进行大肠菌群和大肠埃希氏菌(或粪大肠菌群)的检测。检测结果如图2及图3。
水样酶底物法与多管发酵法大肠菌群检测结果
020406080100120140
序号102030405060708090样品编号
MPN值
多管发酵法MPN/100ml酶底物法MPN/100ml 图2 水样酶底物法与多管发酵法大肠菌群检出结果 对两种方法检测的大肠菌群结果进行配对t检验,检验结果表明多管发酵法与酶底物法检测结果没有统计学意义上的差别(P=0.059)。
水样酶底物法与多管发酵法大肠埃希氏菌(或粪大肠菌群)检测结果
05101520
序号102030405060708090样品编号
MPN值
多管发酵法MPN/100ml酶底物法MPN/100ml 图3 水样酶底物法与多管发酵法大肠埃希氏菌(或粪大肠菌群)检出结果 对两种方法检测的大肠埃希氏菌与粪大肠菌群结果进行配对t检验,检验结果表明多管发酵法与酶底物法检测结果有统计学意义上的差别(P=0.000),多管发酵法检出的粪大肠菌群要多于酶底物法检出的大肠埃希氏菌。对两种方法检测结果进行线性回归分析,结果如表1。
表1 酶底物法与多管发酵法检测结果的线性回归分析 Coefficientsa
-.025.170-.150.881.544.034.85116.049.000(Constant)多管发酵法粪大肠菌群Model1
BStd. ErrorUnstandardizedCoefficientsBetaStandardizedCoefficientstSig.
Dependent Variable: colilert大肠杆菌a. 回归分析结果表明:回归系数(B)为0.544,标准化回归系数(Beta)为0.851,回归系数t检验t=16.049,P=0.000<0.05,可认为酶底物法检测结果与多管发酵法结果之间有相关关系。 确认试验。为比较两种方法的假阳性率,对试验结果进行确认试验。取水样进行预试验后,使水样MPN值控制在5~30MPN/100ml之间。取6个水样进行验证试验。这6个水样多管发酵法和酶底物法结果如表2。 表2 验证试验所需水样多管发酵法和酶底物法检测结果
序号 多管发酵法 酶底物法 大肠菌群阳性管数 MPN 粪大肠菌群阳性管数 MPN 大肠菌群阳性孔数 MPN 大肠埃希氏菌阳性孔数 MPN
1 3-2-0 14 2-0-0 5 8 8.7 4 4.2 2 4-1-0 17 3-0-0 8 10 11.1 2 2.0 3 2-0-0 5 1-0-0 2 2 2.0 1 1.0 4 4-2-0 22 3-1-0 11 11 12.4 2 2.0 5 4-3-0 27 4-1-0 17 16 19.2 7 7.5 6 3-2-0 14 3-1-0 11 6 6.4 3 3.1 合计 30 / 19 / 53 / 19 /
确认试验步骤为如图4。
