重要有机反应的反应机理.pdf
刑其毅《基本有机化学》反应机理全套整合

实例: 甲烷的氯化
卤化反应 分子中的原子或基团被卤原子取代的 反应称为卤化反应。若卤原子为氯原子, 则该卤化反应称为氯化反应。
CH4 + Cl2
hv
CH3Cl + HCl
反应机理
链引发 Cl2
hv
链增长 CH4 + Cl
2Cl
CH3 + HCl
H= 7. 5kJ/mol Ea=16.7 kJ/mol
反应机理
快 + Cl-Cl
Cl
_
+ H ClAlCl3
+ - AlCl3
Cl Cl 慢
Cl
快
+ AlCl3 + HCl
快 + Br-Br
+ -
Br Br Br2
慢
+ - Br2
Br Br 慢
Br _ + H Br + Br2
Br
快
+ H+ + Br3-
苯的磺化反应
+ H 2SO4 ( 10% SO3 )
1 自由基取代反应
有机化合物分子中的某个原子或基团被其 它原子或基团所置换的反应称为取代反应。若 取代反应是按共价键均裂的方式进行的,即是 由于分子经过均裂产生自由基而引发的,则称 其为自由基型取代反应。
自由基反应包括链引发、链转移、链终止三个
阶段。链引发阶段是产生自由基的阶段。由于键的 均裂需要能量,所以链引发阶段需要加热或光照。 链转移阶段是由一个自由基转变成另一个自由基的 阶段,犹如接力赛一样,自由基不断地传递下去, 像一环接一环的链,所以称之为链反应。链终止阶 段是消失自由基的阶段。自由基两两结合成键。所 有的自由基都消失了,自由基反应也就终止了。
常见有机化学反应及机理
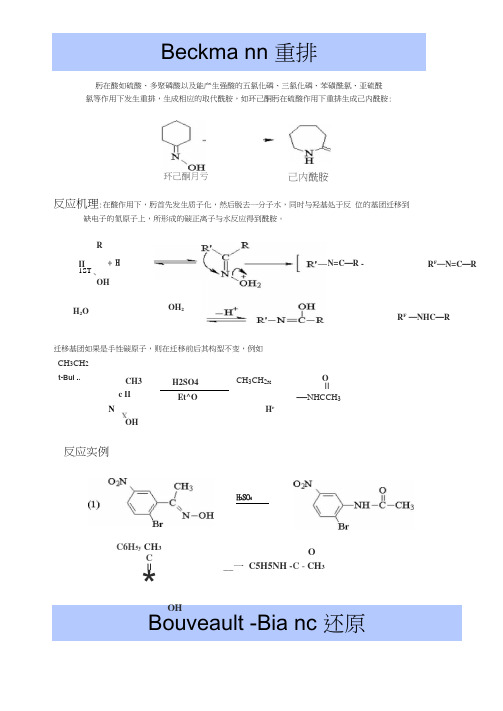
Beckma nn 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰 氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:环己酮月亏己内酰胺Bouveault -Bia nc 还原反应机理:在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反 位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
R II 1ST、OH + H H 2O N=C —R -OH 2 R F —N=C —RR F —NHC —R迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如 CH 3CH 2t-Bui .. CH3 H2SO4 CH 3CH 2XOIIc IIEt^O—NHCCH 3N H rX OH反应实例 H 2SO 4C6H 5y CH 3CII*OHO__一 C5H5NH -C - CH 3脂肪族竣酸酯可用金属钠和醇圧原得一级醇。
氏不饱和竣酸酯 还原得相应的饱和醇°芳香酸酯也可进行本反应,但收率较低,本法 在氢化锂铝还原酯的方法发现以前,广泛地被使用,非共辄的双键可 不受影响9OEtOHR —C —OR 1 + 皿■ RCH 3OH + RQH反应机理首先酯从金属钠获得一个电子还原为自由基负离子,然后从醇中 夺取一个质子转变为自由基,再从钠得到一个电子生成负离子,泊除 烷细基成为醛,醛再经过相同的步骤还原咸醇钠,再酸化得到相应的 醇。
□O-EtCHR —C —OR' + Na ------------------------- — R^C —OR 1 _— R —C —OR 1_R —CH —OR* ------------ R —CH-OR ---------------------- R —C —H■ R —C —HiEtCHR —G —H ----------------Na +FCH 2OH反应实例醛酮也可以用本法还賦 得到相应的醇;Claisen- Schmidt 反应一个无:一氢原子的醛与一个带有:一氢原子的脂肪族醛或酮在稀氢氧化钠水溶液或醇 溶液存在下发生缩合反应,并失水得到:汀;不饱和醛或酮:反应机理NaR —CH 3(CHi )10CO^tNa EtOHCH/CH^KCHaOH 75%EtO 2C(CH^CO^t ——_■ EtOH HOCH XCH 抚CH 例畑CHgH^CHOC 哄⑴沖・叭如皿0HCH=CH-CHO 亠 H 2OClaise n 酯缩合反应含有僅-氢的酯在酚钠等碱性缩合剂作用下发生缩合作用,失去一分子 醇得到E 番同酸it 如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合 得到乙麻乙酸乙酯。
有机化学反应机理(整理版)
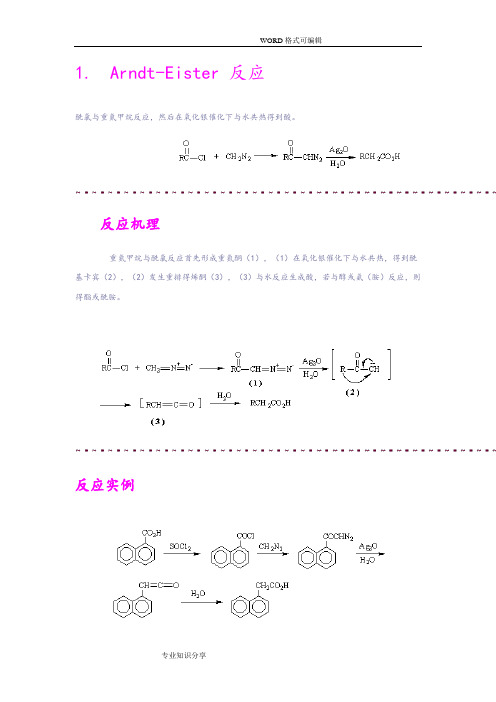
1.Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例2.Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
这类氧化剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高。
3.Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例4.Birch还原芳香化合物用碱金属(钠、钾或锂)在液氨与醇(乙醇、异丙醇或仲丁醇)的混合液中还原,苯环可被还原成非共轭的1,4-环己二烯化合物。
反应机理首先是钠和液氨作用生成溶剂化点子,然后苯得到一个电子生成自由基负离子(Ⅰ),这是苯环的л电子体系中有7个电子,加到苯环上那个电子处在苯环分子轨道的反键轨道上,自由基负离子仍是个环状共轭体系,(Ⅰ)表示的是部分共振式。
有机反应机理

重要有机反应的反应机理
目
一、取代反应 二、加成反应 三、消除反应 四、氧化还原反应 五、缩合反应 六、重排反应
录
四、氧化还原反应
1. 环氧化反应 2. 自动氧化 3. 卤仿反应 4. 硼氢化-氧化反应 5. 硼氢化-还原反应 6. 伯奇还原 7. 醛、酮的单分子还原 8. 醛、酮的双分子还原 9. 酯的单分子还原(鲍维特-勃朗克还原) 10. 酯的双分子还原(酮醇反应或偶姻反应)
O OH
-H2O
OH
OH
CH3-C-CH2-C(CH3)2
CH 3-C-CH2-C(CH3)2
酸碱反应
O CH 3-C-CH=C(CH3)2
2. 酯缩合反应 具有-活泼氢的酯,在碱的作用下,两分子酯相 互作用,生成β-羰基酯,同时失去一分子醇的反应 叫克莱森(Claisen)酯缩合。
OR O R O 1 C2H5ONa RCH2C-CHCOC 2H5 RCH2C-OC 2H5 + H-CHCOC2H5 2 HOAc O
反应机理:多数自动氧化是通过自由基机理进行的。
引发: 链增长:
• (CH3)2COCH3 + O2 (CH3)2COCH3 OO • R• + O2 ROO•
ROO• + (CH3)2CHOCH3
• ROOH + (CH3)2COCH3
(CH3)2COCH3 + (CH3)2CHOCH3 OO • • (CH3)2COCH3 + (CH3)2COCH3 OOH
CH2
O CH3-C-CH2-X
2X2 OH-
O CH3-C
CX3
OH-
O CH3-C-O- + CHX3
有机化学反应机理1.pdf

有机化学反应机理幻影无痕制作1.Arbuzov 反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R),则Arbuzov 反应如下:这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2和次亚膦酸酯 R2POR' 也能发生该类反应,例如:反应机理一般认为是按 S N2 进行的分子内重排反应:反应实例1.A rndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例2.Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
(完整版)有机化学反应机理

双分子反应一 步活化能较高
O
H+
CH3C-OH
+OH CH3C-OH HOC2H5
按加成--消除机理进行 反应,是酰氧键断裂
加成
OH CH3-C-OH
HO+ C2H5
质子转移
四面体正离子
OH CH3-C-O+ H2
OC2H5
-H2O 消除
+OH
-H+
CH3C-OC2H5
O CH3C-OC2H5
*2 碳正离子机理
OH
H+
(CH3)3C-OH
+OH R-C-OC(CH3)3
(CH3)3CO+ H2 -H2O (CH3)3C+
O=C-R
属于SN1机理
O -H+
R-C-OC(CH3)3
按SN1机理进
行反应,是烷
氧键断裂
* 3oROH按此反应机理进行酯化。 * 由于R3C+易与碱性较强的水结合,不易与羧酸结合,
故逆向反应比正向反应易进行。所以3oROH的酯化 反应产率很低。
1 自由基取代反应
有机化合物分子中的某个原子或基团被其 它原子或基团所置换的反应称为取代反应。若 取代反应是按共价键均裂的方式进行的,即是 由于分子经过均裂产生自由基而引发的,则称 其为自由基型取代反应。
自由基反应包括链引发、链转移、链终止三个
阶段。链引发阶段是产生自由基的阶段。由于键的 均裂需要能量,所以链引发阶段需要加热或光照。 链转移阶段是由一个自由基转变成另一个自由基的 阶段,犹如接力赛一样,自由基不断地传递下去, 像一环接一环的链,所以称之为链反应。链终止阶 段是消失自由基的阶段。自由基两两结合成键。所 有的自由基都消失了,自由基反应也就终止了。
详细有机化学常见反应机理

常见的有机反应机理Arbuzov 反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
ﻫ本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用的卤代烷R'X 的烷基和亚磷酸三烷基酯 (RO)3P的烷基相同(即 R' = R),则Arbuzov反应如下:这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2和次亚膦酸酯 R2POR' 也能发生该类反应,例如:反应机理一般认为是按SN2 进行的分子内重排反应:反应实例Arndt-Eister反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
有机化学九十六个反应机理

Arbuzov 反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R),则 Arbuzov 反应如下:这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2和次亚膦酸酯 R2POR' 也能发生该类反应,例如:反应机理一般认为是按 SN2 进行的分子内重排反应:反应实例Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
