第九单元课题3、《溶质的质量分数》
教案第九单元 课题 3《溶质的质量分数》教案设计二设计一

第九单元课题 3《溶质的质量分数》教案设计二教学目标1.通过日常生活中广泛使用金属材料等具体事例,认识金属材料与人类生活和社会发展的密切联系。
2.了解常见金属的物理性质,知道物质的性质很大程度上决定物质的用途,但同时还需要考虑价格、资源以及废料是否易于收回等其他因素。
3.认识在金属中加热熔合某些金属或非金属可以制得合金,知道生铁和钢等重要合金,以及合金比纯金属具有更广泛的用途。
教学重点:知道物质的性质很大程度上决定物质的用途,但还需考虑价格等因素。
认识合金。
教学难点:采用活动与探究的方式来研究金属及合金的物理性质上的差异。
教学过程引入新课教师先展示一些物品,然后设问:这些物品是由什么材料制成?教师引导学生,如何根据金属的一些用途,推断金属的物理性质。
使学生明白:物质的性质、资源、价格、美观等决定其用途。
引导学生查询资料解决实际问题。
教会学生如何获取新的知识。
通过实物引入合金的概念。
举例说明合金与纯金属的区别。
教师:在科技日新月异的今天,各种材料在生产、生活中的应用非常广泛。
其中金属自古至今对人类文明的起源与发展起到了重要作用。
你们知道生活中有哪些常见金属?它们有那些用途?(学生发言踊跃,从一些常见的用途到各处资料中查阅的知识,从局部到全面,相互补充,扩大了知识面,逐渐进入课堂气氛。
)学生1:从大的方面讲铁、铝、铜、锌、钛等金属可以制造宇航飞船、飞机、轮船、汽车等的外壳与零件。
学生2:生活中金属可以制作炊具、家用电器、电线电缆、钢筋混凝土等。
学生3:金箔、金线、金粉等可以做装饰品,银镀在玻璃的表面可以作镜子。
…………教师:我们知道物质的用途决定于它的性质,那么今天这节课,我们就来探究一下常见金属的物理性质。
你们准备从哪里开始呢?(学生中有一些小的争议。
)学生1:从假设金属的物理性质开始。
学生2:老师,金属有很多种,怎么探究?学生3:随便找两个试试好了。
教师:非常好,你们能从思考中发现问题。
金属是一类物质而不是一种,大家想想看?应该怎么处理?(学生小声议论,很快达成一致意见。
九年级化学人教版下册第九单元课题3溶质的质量分数优秀教学案例

1.教师分发实验材料,引导学生进行实验,观察和记录实验现象。
2.学生分组讨论实验结果,分析溶质质量分数的变化规律,并尝试解释原因。
3.各小组汇报讨论结果,教师引导学生进行交流和质疑,促进学生之间的思维碰撞。
(四)总结归纳
1.教师组织学生进行总结,回顾本节课所学的内容,引导学生明确溶质质量分数的概念、计算方法和应用。
二、教学目标
(一)知识与技能
1.理解溶质的质量分数的概念,掌握计算溶质质量分数的基本方法。
2.能够运用溶质质量分数的知识,解决实际生活中的问题。
3.了解溶质质量分数在化学工业和日常生活中的重要性,提高学生对化学知识的应用能力。
4.通过实验和观和观察能力。
四、教学内容与过程
(一)导入新课
1.教师通过展示日常生活中的溶液图片,如饮料、药剂等,引起学生的兴趣,提问:“你们知道这些溶液中的溶质质量分数吗?它们是如何计算的?”
2.学生分享自己的了解和经验,教师总结并引导students to guess the possible answers, and then reveal the correct answers gradually.
(三)情感态度与价值观
1.培养学生对化学知识的热爱和兴趣,激发学生学习化学的积极性。
2.培养学生勇于探究、善于合作的科学精神,提高学生的自主学习能力。
3.培养学生关心生活、关注社会的发展意识,提高学生的社会责任感和使命感。
4.通过溶质质量分数的学习,使学生认识到化学知识在生活中的重要性,培养学生的实用主义精神。
3.在下一节课的开始,教师可以抽出时间让学生分享作业成果,组织讨论和交流,促进学生的学习动力和合作能力。
五、案例亮点
第九单元 课题3 溶质的质量分数

20g
讨 论
已知20°C时,氯化钠的溶解度是36g。有人说: “20°C时氯化钠饱和溶液中溶质的质量分数为36% 。”这种说法对吗?为什么?
饱和溶液的
溶质质量分数=
溶解度
100g+溶解度 溶质质量分数与溶解度的比较 溶质的质量分数36% 是指: 100g溶液中含有36g 溶质。
溶质T0C时溶解度36g是指: 在T0C 时,100g水最 多溶解该溶质36g。
试管 溶液颜 溶 剂 溶 质 溶 液 溶质质量 编号 色比较 质量/g 质量/g 质量/g 分数
1
2
浅蓝 蓝 深蓝
20g 20g 20g
0.1g 0.5g
20.1g 20.5g
0.5% 2.44% 9.09%
3
2g
22g
实验9-8
溶质质量 溶剂质量 溶液中溶质质量分数
10g
90g 80g
10%
20%
衍 生
在20°C时,向一杯装有100g的水中 ,放入40g的氯化钠,但是,烧杯底部仍 有一些固体未能溶解。求此杯溶液中, 溶质的质量分数。(已知20°C时,氯化 钠的溶解度是36g)
二、溶质、溶剂质量的计算
例1 在农业生产中,常需要用质量分数为16%的氯 化钠溶液来选种。现要配制150Kg这种溶液,需要氯 化钠和水的质量各是多少?
配置步骤:1、计算
计算:需食盐:150 g× 16% = 24 g
2、称量
3、溶解
例1: (溶质为固体)配制150g16%的食盐水
需水: 150 g– 24 g= 126 g
称量:用天平称量 24 g食盐
用量筒量取126mL水
溶解:烧杯、玻璃棒
实验仪器:天平(砝码)、药匙、量筒、 胶头滴管、烧杯、玻璃棒
人教版九年级下册化学第九单元课题3溶质的质量分数(教教案)学生用

人教版九年级下册化学第九单元课题3溶质的质量分数(教学案)一、教学目标1.了解溶质的概念及其质量分数的定义;2.掌握计算溶质质量分数的方法;3.能够运用所学知识解决实际问题。
二、教学重点1.溶质的概念及其质量分数的意义;2.溶质质量分数的计算方法。
三、教学难点如何通过实际问题理解溶质的质量分数应用。
四、教学过程1. 热身导入通过提问和讨论,引导学生回顾和梳理前几节课所学的知识,如溶液的概念、溶解度、饱和溶液等。
2. 概念讲解1.引入溶质的概念:溶质是指能够溶解在溶剂中的物质,例如在水中溶解的盐、糖等;2.讲解溶质的质量分数的定义:溶质的质量分数是指溶液中溶质的质量与溶液总质量之比,通常以百分比或百分比计数表示。
3. 计算方法示例通过示例演算,详细讲解如何计算溶质的质量分数。
示例问题:若有一个含有100 g溶液,其中包含80 g的盐,请计算溶液中盐的质量分数。
解题步骤: 1. 计算溶液中溶质(盐)的质量:80 g; 2. 计算溶液总质量:100 g; 3. 计算质量分数:质量分数 = (溶质质量÷ 溶液总质量)× 100% = (80 g ÷ 100 g)× 100% = 80%。
4. 实际应用通过探究问题和解答问题的方式,让学生将所学知识应用到实际问题中。
问题一:若有一个500 mL的含有10 g食盐的溶液,请计算溶液中食盐的质量分数。
解题步骤: 1. 将溶液总体积转换为质量,根据水的密度(1 g/mL):500 mL × 1 g/mL = 500 g; 2. 计算溶液中溶质(食盐)的质量:10 g; 3. 计算质量分数:质量分数 = (溶质质量÷ 溶液总质量)× 100% = (10 g ÷ 500 g)× 100% = 2%。
问题二:某标称为6%盐酸的溶液,其中含有20 g盐酸,请计算该溶液的总质量。
解题步骤: 1. 假设溶液总质量为x g; 2. 计算溶液中溶质(盐酸)的质量:20 g; 3. 计算质量分数:质量分数 = (溶质质量÷ 溶液总质量)× 100% = (20 g ÷ x g)× 100% = 6%; 4. 解方程:(20 g ÷ x g)× 100% = 6%;5. 求解得到:x g = (20 g × 100%)÷ 6% = 333.33 g。
人教版《第九单元课题3 溶质的质量分数》检测题及答案分析
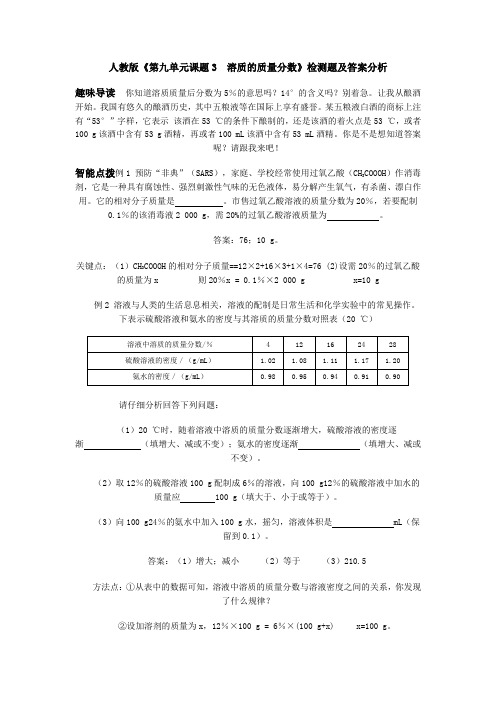
人教版《第九单元课题3 溶质的质量分数》检测题及答案分析趣味导读你知道溶质质量后分数为5%的意思吗?14°的含义吗?别着急。
让我从酿酒开始。
我国有悠久的酿酒历史,其中五粮液等在国际上享有盛誉。
某五粮液白酒的商标上注有“53°”字样,它表示该酒在53 ℃的条件下酿制的,还是该酒的着火点是53 ℃,或者100 g该酒中含有53 g酒精,再或者100 mL该酒中含有53 mL酒精。
你是不是想知道答案呢?请跟我来吧!智能点拨例1 预防“非典”(SARS),家庭、学校经常使用过氧乙酸(CH3COOOH)作消毒剂,它是一种具有腐蚀性、强烈刺激性气味的无色液体,易分解产生氧气,有杀菌、漂白作用。
它的相对分子质量是。
市售过氧乙酸溶液的质量分数为20%,若要配制0.1%的该消毒液2 000 g,需20%的过氧乙酸溶液质量为。
答案:76;10 g。
关键点:(1)CH3COOOH的相对分子质量==12×2+16×3+1×4=76 (2)设需20%的过氧乙酸的质量为x 则20%x = 0.1%×2 000 g x=10 g例2 溶液与人类的生活息息相关,溶液的配制是日常生活和化学实验中的常见操作。
下表示硫酸溶液和氨水的密度与其溶质的质量分数对照表(20 ℃)请仔细分析回答下列问题:(1)20 ℃时,随着溶液中溶质的质量分数逐渐增大,硫酸溶液的密度逐渐(填增大、减或不变);氨水的密度逐渐(填增大、减或不变)。
(2)取12%的硫酸溶液100 g配制成6%的溶液,向100 g12%的硫酸溶液中加水的质量应100 g(填大于、小于或等于)。
(3)向100 g24%的氨水中加入100 g水,摇匀,溶液体积是 mL(保留到0.1)。
答案:(1)增大;减小(2)等于(3)210.5方法点:①从表中的数据可知,溶液中溶质的质量分数与溶液密度之间的关系,你发现了什么规律?②设加溶剂的质量为x,12%×100 g = 6%×(100 g+x) x=100 g。
第九单元课题3第一课时溶质的质量分数(教学设计)

溶质的质量分数(第一课时)【学习目标】知识与技能:1.掌握一种溶液组成的表示方法──溶质的质量分数的概念及公式,能进行溶质质量分数的简单计算。
2、了解公式的应用范围。
了解溶质质量分数与溶解度的关系3、掌握溶液组成中溶质、溶剂的量的改变引起的溶质质量分数的变化4、掌握溶质质量、溶剂质量、溶液质量、溶质质量分数的关系。
过程与方法:通过实验探究、联系生活实际、对比等方法理解溶质的质量分数。
【学习重点】溶质质量分数的概念,公式应用范围【学习难点】溶质质量分数与溶解度的关系。
课前预习学案【知识回顾】:1、溶液的组成:______和______;溶液的质量等于______和______的质量;溶液的体积_____溶质和溶剂的体积。
2、溶液的概念:____________________________3、写出下列溶液中溶质的化学式。
(1)0.9%的生理盐水(2)75%的酒精(3)盐酸(4)内含甲醇15%的甲醇汽油(5)锌与稀硫酸恰好完全反应后形成的溶液【自主学习】:1、溶质的质量分数:溶液中________与________之比。
计算公式溶质的质量分数=___________*100%变式__________________________2、溶液的稀释与浓缩溶液的稀释:(1)加水稀释:稀释前后,______不变。
(2)加稀溶液稀释溶液的浓缩:(1)加溶质:浓缩前后,_____质量不变(2)蒸发溶剂:浓缩前后,_____质量不变(3)加浓溶液3、常温下,在15克氯化钠中加入60克水,完全溶解后,溶液中氯化钠的质量分数是_______课内探究【新知导学】:一、1、实验探究:教材P41实验9-5,取三支试管,编号为①、②、③,分别向其中加入10mL水,然后分别向水中加入0.5g 、1g、1.5g硫酸铜固体,充分振荡。
三支试管中分别观察到什么现象,形成溶液的颜色深浅是否一样?由此说明什么?三支试管中溶质、溶剂、溶液的质量分别为多少?三支试管中溶质占溶液质量的百分比为多少?2、实验探究:教材P42[实验9-6] 配制的两种组成不同的食盐水溶液:完成教材表格。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
本课题小结: 本课题小结:
3、配制溶质质量分数一定的溶液 、
实验步骤: 实验步骤: ⑴计算 ⑵称量 ⑶溶解 ⑷装瓶 实验仪器: 实验仪器: 药匙 天平 烧杯 量筒 滴管 玻璃棒
练习: 练习:溶质质量分数在化学方程式计 算中的应用
50g稀盐酸与足量的锌粒完全反应 稀盐酸与足量的锌粒完全反应, 1、 50g稀盐酸与足量的锌粒完全反应,制得 0.2g氢气,求盐酸的溶质质量分数? 0.2g氢气,求盐酸的溶质质量分数? 氢气 2、 93.7g稀硫酸与6.5g锌粒恰好完全反应, 93.7g稀硫酸与6.5g锌粒恰好完全反应, 稀硫酸与6.5g锌粒恰好完全反应 求反应后溶液的溶质质量分数? 求反应后溶液的溶质质量分数
(2)溶解度的数值一定大于溶质的质量分数。 溶解度的数值一定大于溶质的质量分数。 溶解度的数值一定大于溶质的质量分数
五、配制溶质质量分数一定溶液的步骤: 配制溶质质量分数一定溶液的步骤:
• • • • 1、计算; 、计算; 2、称量; 、称量; 3、溶解; 、溶解; 4、装瓶(贴标签)。 、装瓶(贴标签)。
四、溶质质量分数和溶解度的比较: 溶质质量分数和溶解度的比较:
项 含 目 义 溶 解 度 …… 定 100g 饱 和 溶 液 g 温 溶质质量分数 …… 任 意 温 度 任 意 溶 剂 无论是否饱和 “1”
温度要求 溶剂要求 溶液是否饱和 单 位
注意: 注意:
溶解度 (1) 某饱和溶液的溶质质量分数 —————— ╳100% 某饱和溶液的溶质质量分数= 溶解度+100g 溶解度
计算的原则:溶液稀释前后溶质不变。 计算的原则 溶液稀释前后溶质不变。 溶液稀释前后溶质不变 涉及溶液体积时: 涉及溶液体积时: 溶质质量=溶液体积 溶质质量 溶液体积╳溶液密度╳溶质质量分数 、(见教材 见教材) 例2、(见教材) 配制500mL20%的硫酸需要98% 500mL20%的硫酸需要98%的浓硫酸多少 例3、配制500mL20%的硫酸需要98%的浓硫酸多少 毫升?(20%和98%的硫酸密度分别为 毫升?(20%和98%的硫酸密度分别为 ?(20% 1.14g/cm3,1.84g/cm3) 利用95%的浓硫酸和5% 95%的浓硫酸和5%的稀硫酸配制成 例4、利用95%的浓硫酸和5%的稀硫酸配制成 30%的硫酸溶液 应如何配制? 的硫酸溶液, 30%的硫酸溶液,应如何配制?
╳100%
在三支试管中各加入10mL水 在三支试管中各加入10mL水,然后分别加入约 10mL 0.5g、1g、1.5g固体硫酸铜。比较三种溶液的 0.5g、1g、1.5g固体硫酸铜。 固体硫酸铜 颜色。
试管 溶液颜 溶 剂 溶 质 溶 液 溶质质量 质量/g 质量/g 质量/g 编号 色比较 质量/g 质量/g 质量/g 分数 1 2 3
浅 较深 深
10g 10g 10g
0.5g 1g 1.5g
10.5g 11g 11.5g
4.8% 9.1% 13%
[实验9-6]
溶质质量 溶剂质量 溶液中溶质质量分数
10g 20g
90g 80g
10% 20%
请回答“ 的含义。 请回答“10%”和“20%”的含义。 和 的含义
三、有关溶质质量分数的计算: 有关溶质质量分数的计算:
溶质的质量分数 1、概念:溶质质量与溶液质量之比。 、概念:溶质质量与溶液质量之比。 2、计算公式: 、计算公式: 溶质质量 100% 溶质的质量分数
溶液质量 溶质质量 溶质质量+溶剂质量 溶质质量 溶剂质量 t℃时,某物质的溶解度为 ,则t℃,该物质饱和溶液中 某物质的溶解度为Sg, ℃ ℃ Sg 100% 溶质的质量分数 Sg +100g 100%
溶质的质量分数 解: 氯化钠的质量 溶质质量 100%
溶液质量 溶液质量 溶质的质量分数 150Kg 16% 24Kg 溶液质量 溶质质量
水的质量
24Kg 150Kg 126Kg 需要氯化钠和水的质量分别是24kg和126kg。 答:需要氯化钠和水的质量分别是 和 。
3、有关溶液稀释的计算: 、有关溶液稀释的计算:
浅 较深 深
10g 10g 10g
0.5g 1g 1.5g
10.5g 11g 11.5g
二、溶质的质量分数
——表示溶液组成的一种方式。 表示溶液组成的一种方式。 表示溶液组成的一种方式 1、定义:溶质的质量与溶液的质量之比。 、定义:溶质的质量与溶液的质量之比。 2、定义式: 、定义式: 溶质的质量 溶质的质量分数 = 溶液的质量
练习: 练习:下面是一位同学配制一定溶质质量分数 的氯化钠溶液时的流程图,请找出其中的错误, 的氯化钠溶液时的流程图,请找出其中的错误, 并说明理由。 并说明理由。
1、 、 2、 、 3、 、 4、 、
六、体积分数: 体积分数:
• “体积分数为 体积分数为70%的酒精溶液” 的酒精溶液” 的酒精溶液 • 表示:70体积的酒精和 体积 体积的酒精和30体积 表示: 体积的酒精和 的水混合所得溶液。 的水混合所得溶液。 仅是一个体积比。 注:仅是一个体积比。
在三支试管中各加入10mL水 在三支试管中各加入10mL水,然后分 10mL 别加入约0.5g 1g、1.5g固体硫酸铜 0.5g、 固体硫酸铜。 别加入约0.5g、1g、1.5g固体硫酸铜。 比较三种溶液的颜色。
试管 溶液颜 溶 剂 溶 质 溶 液 溶质质量 质量/g 质量 质量/g 质量 质量/g 分数 编号 色比较 质量 1 2 3
复
习
1、什么叫饱和溶液? 什么叫饱和溶液? 2、KNO3不饱和溶液怎样变成饱和溶液? 不饱和溶液怎样变成饱和溶液? 3、Ca(OH)2饱和溶液怎样变成不饱和溶 液?
实验 9-5
颜色: 的组成与“浓”“稀”的关 溶液的组成与“ ”“稀 系:
1、溶液是由溶质和溶剂组成的。 、溶液是由溶质和溶剂组成的。 溶质 组成的 2、溶液的“浓”“稀”是由溶质和溶液 、溶液的“ ”“稀 是由溶质和 溶质 的量共同决定的。 的量共同决定的。 判断的依据是:一定量溶液里, 判断的依据是:一定量溶液里,所含 溶质的多少。 溶质的多少。 注:浓溶液不一定是饱和溶液,稀溶 浓溶液不一定是饱和溶液, 液不一定是不饱和溶液。 液不一定是不饱和溶液。
1、已知溶质的质量和溶剂的质量, 、已知溶质的质量和溶剂的质量, 求溶质的质量分数。 求溶质的质量分数。 2、已知溶液质量和溶质的质量分数, 、已知溶液质量和溶质的质量分数, 求溶质和溶剂的质量。 求溶质和溶剂的质量。
例1、在农业生产中,常需要用质量分数为16% 在农业生产中,常需要用质量分数为16% 的氯化钠溶液来选种。现要配制150Kg这种溶液 150Kg这种溶液, 的氯化钠溶液来选种。现要配制150Kg这种溶液,需 要氯化钠和水的质量各是多少? 要氯化钠和水的质量各是多少?
