高中化学必备知识点:碳酸盐小结
碳酸盐的性质与复分解反应-课件

11.(2015,包头)天平两边各放质量相等的烧杯,分别装入等质 量、等溶质质量分数的稀硫酸,此时天平平衡,将等质量的 MgCO3和Na2CO3分别加入两烧杯中,充分反应后,下列说法错 误的是( D ) A.若天平不平衡,指针一定偏向加Na2CO3的一边 B.若天平平衡,两烧杯中的酸一定完全反应 C.若反应后Na2CO3有剩余,天平一定平衡 D.若天平不平衡,两种碳酸盐一定都没有剩余
C.生成物中是否有气体 D.金属的活动性顺序
7.下列有关纯碱的说法正确的是( C) A.纯碱难溶于水 B.纯碱是碱而不是盐 C.纯碱既可从内陆盐湖提取,又可用“侯氏联合制碱法”生产 D.纯碱中含有少量的小苏打可以用稀盐酸除去
8.已知A、B、C、D、E五种物质中都含有人体含量最多的一种 金属元素,其中A是单质,B、C含有两种元素,D、E含有三种 元素,反应⑤是放热反应,它们之间的转化关系如图所示,下 列推理不正确的是( B) A.E是碳酸钙 B.反应④一定是中和反应 C.反应②为吸热反应 D.反应③可以由多个化学反应实现
如CO2+Ca(OH)2===CaCO3↓+H2O
初中各类盐的溶解性口诀: 氯化银和硫酸钡, 不溶酸也不溶于水; 阳(离子)有钾、钠、铵, 阴(离子)有三强酸(根), 二者见其一就可溶于水; 二者皆不见(没有)它就是沉淀。
知识点1 碳酸盐的化学性质和碳酸根离子(CO32-)的检验 1.含有CO32-(或HCO3-)的盐,如碳酸钠、碳酸氢钠和碳酸钙 等,都能跟 盐酸 起反应生成 二氧化碳 气体。化学方程式分别 为 Na2CO3+2HCl===2NaCl+H2O+CO2↑、______N_a_H_C__O_3_+_ HCl===NaCl+H2O+CO2、↑___C__a_C_O_3_+__2_H_C__l=_=__=_2_C_a_C_l_2+__H__2_O+ _C_O__2_↑_____________。 2.将碳酸钠溶液加入澄清的石灰水中,有 白色沉淀 产生,其化 学方程式为 Na2CO3+Ca(OH)2===CaCO3↓+2NaO。H 知识点2 复分解反应 3.由两种化合物 互相交换成分,生成 另外两种化合物 的反
碳酸盐结合态

碳酸盐结合态碳酸盐是一类广泛存在于自然界中的化合物,其结合态表现出了许多有趣的性质和应用。
在本文中,我们将探讨碳酸盐结合态的一些重要方面,包括其结构特点、物理性质和实际应用。
让我们来了解一下碳酸盐的结构特点。
碳酸盐是由碳酸根离子(CO3 2-)和金属离子或氢离子结合而成的化合物。
碳酸根离子是由一个碳原子和三个氧原子组成的一个多面体结构,其中碳原子与三个氧原子形成了平面三角形的结构。
这种结构使得碳酸根离子具有一定的稳定性和空间构型。
由于碳酸盐结合态中碳酸根离子与金属离子或氢离子的结合,会形成不同的化合物。
这些化合物在物理性质上也会有所不同。
例如,一些碳酸盐化合物具有高熔点和固体结构,例如方解石和白云石。
而另一些碳酸盐化合物则是无色的晶体,例如纯碱和小苏打。
此外,碳酸盐还可溶于水,形成碱性溶液。
这些物理性质使得碳酸盐在生活中有着广泛的应用。
碳酸盐结合态在生活中的应用十分广泛。
首先,碳酸盐在建筑材料中起到了重要的作用。
例如,方解石是一种常见的建筑材料,可以用于建造墙壁和地板。
其稳定的结构和高熔点使得方解石能够经受住各种环境条件的考验。
此外,碳酸盐还可以用于制造玻璃、陶瓷和石膏等材料,这些材料在日常生活中都有着广泛的应用。
除了在建筑材料中的应用外,碳酸盐结合态还在环境保护和化学工业中发挥着重要作用。
例如,碳酸氢盐(又称小苏打)可用作酸中和剂,用于调节水体的酸碱度。
此外,碳酸盐还可以用于水处理和废水处理,以去除水中的重金属离子和有机物污染物。
碳酸盐还在食品和饮料工业中被广泛应用。
例如,碳酸氢钠(又称纯碱)是一种常见的食品添加剂,可用于面包和蛋糕的发酵。
碳酸氢钠遇热分解产生二氧化碳气体,使得面团膨胀。
同时,在饮料中加入二氧化碳气体也可以增加饮料的口感和口感。
碳酸盐结合态是一类具有重要应用价值的化合物。
其结构特点、物理性质和实际应用使得碳酸盐在建筑材料、环境保护和化学工业以及食品和饮料工业中发挥着重要作用。
通过进一步的研究和应用,我们可以更好地理解和利用碳酸盐结合态,为人类社会的发展做出更大的贡献。
化学中考知识点总结盐

化学中考知识点总结盐一、盐的概念盐是由金属离子和非金属离子组成的化合物,是酸和碱中和产生的化合物。
盐具有结晶形状,可溶于水和熔化,是一种重要的化学物质,广泛用于生产和生活中。
二、盐的分类1. 氯化物盐:以氯离子为阴离子的盐,如氯化钠、氯化铵等。
2. 硫酸盐:以硫酸根离子为阴离子的盐,如硫酸钠、硫酸铜等。
3. 硝酸盐:以硝酸根离子为阴离子的盐,如硝酸钙、硝酸铵等。
4. 碳酸盐:以碳酸根离子为阴离子的盐,如碳酸钠、碳酸钙等。
5. 磷酸盐:以磷酸根离子为阴离子的盐,如磷酸铵、磷酸铁等。
三、盐的性质1. 盐的结晶性:盐呈现晶体形态,具有规则的结晶形状。
2. 盐的溶解性:大部分盐能够溶解在水中,生成电离的阴离子和阳离子。
3. 盐的导电性:盐溶液具有良好的导电性,因为盐在水中能够形成电离。
4. 盐的熔点:盐具有较高的熔点,大部分盐在高温下会熔化成液态。
5. 盐的水合性:一些盐在空气中容易吸收水分,形成水合盐,在实验室中常用于干燥剂。
四、盐的制备方法1. 直接制备法:由金属与非金属直接反应产生的盐。
2. 中和法:由酸和碱中和产生的盐,如氯化钠、硫酸钠等。
3. 氧化法:由金属与氧气直接反应产生的盐,如氯化铝、硫酸钙等。
4. 氯化法:由金属与氯气直接反应产生的盐,如氯化铁、氯化铜等。
五、盐的应用1. 食盐:盐在食品加工中起到调味、防腐和保鲜的作用,是人类生活中不可缺少的调料。
2. 化工原料:盐广泛用于化工生产中,作为氯化肥、硫酸肥料、氢氟酸、盐酸等的原料。
3. 制冰剂:盐具有降低水的冰点的作用,用于道路除冰和冰箱的制冰。
4. 医药用途:盐在医药制剂中用作药物原料和药品生产的辅助配料。
5. 工业用途:盐广泛用于冶金工业、造纸工业、纺织工业、皮革工业等生产中。
六、盐的环境影响1. 土壤盐碱化:过量施用盐肥会导致土壤中盐分过多,影响植物生长。
2. 土地退化:盐碱地的形成会导致土地的退化,影响土地的可持续利用。
3. 盐污染:盐在生产、运输、储存过程中可能会对环境造成污染,影响水体和土壤的生态平衡。
高中化学必背知识点归纳与总结(已打印)

高中化学必背知识点归纳与总结一、俗名纯碱、苏打、天然碱、口碱:Na2CO3小苏打:NaHCO3大苏打:Na2S2O3石膏(生石膏):CaSO4.2H2O 熟石膏:2CaSO4·.H2O 莹石:CaF2重晶石:BaSO4(无毒)碳铵:NH4HCO3 石灰石、大理石:CaCO3生石灰:CaO 食盐:NaCl 熟石灰、消石灰:Ca(OH)2芒硝:Na2SO4·7H2O (缓泻剂) 烧碱、火碱、苛性钠:NaOH 绿矾:FaSO4·7H2O 干冰:CO2明矾:KAl (SO4)2·12H2O 漂白粉:Ca (ClO)2、CaCl2(混和物)泻盐:MgSO4·7H2O 胆矾、蓝矾:CuSO4·5H2O 双氧水:H2O2皓矾:ZnSO4·7H2O 硅石、石英:SiO2刚玉:Al2O3 水玻璃、泡花碱、矿物胶:Na2SiO3铁红、铁矿:Fe2O3磁铁矿:Fe3O4黄铁矿、硫铁矿:FeS2铜绿、孔雀石:Cu2(OH)2CO3菱铁矿:FeCO3赤铜矿:Cu2O 波尔多液:Ca (OH)2和CuSO4石硫合剂:Ca (OH)2和S 玻璃的主要成分:Na2SiO3、CaSiO3、SiO2过磷酸钙(主要成分):Ca (H2PO4)2和CaSO4重过磷酸钙(主要成分):Ca (H2PO4)2天然气、沼气、坑气(主要成分):CH4水煤气:CO和H2硫酸亚铁铵(淡蓝绿色):Fe (NH4)2 (SO4)2溶于水后呈淡绿色光化学烟雾:NO2在光照下产生的一种有毒气体王水:浓HNO3:浓HCl按体积比1:3混合而成。
铝热剂:Al + Fe2O3或其它氧化物。
尿素:CO(NH2) 2氯仿:CHCl3电石:CaC2电石气:C2H2 (乙炔) TNT:三硝基甲苯氟氯烃:是良好的制冷剂,有毒,但破坏O3层。
酒精、乙醇:C2H5OH裂解气成分(石油裂化):烯烃、烷烃、炔烃、H2S、CO2、CO等。
高中化学必背知识点归纳及总结(完整打印版)

完整的知识网络构建,让复习备考变得轻轻简单!目录高中化学学习方法 (02)高中化学必背知识点 (02)高中化学重点 (16)化学计算 (21)解题技巧 (25)高中化学必背知识点归纳与总结一、俗名无机部分:纯碱、苏打Na2CO3、天然碱、口碱:Na2CO3小苏打:NaHCO3大苏打:Na2S2O3石膏(生石膏):CaSO4.2H2O 熟石膏:2CaSO4·.H2O 莹石:CaF2重晶石:BaSO4(无毒)碳铵:NH4HCO3 石灰石、大理石:CaCO3生石灰:CaO 食盐:NaCl 熟石灰、消石灰:Ca(OH)2芒硝:Na2SO4·7H2O (缓泻剂) 烧碱、火碱、苛性钠:NaOH 绿矾:FaSO4·7H2O 干冰:CO2明矾:KAl (SO4)2·12H2O 漂白粉:Ca (ClO)2、CaCl2(混和物)泻盐:MgSO4·7H2O 胆矾、蓝矾:CuSO4·5H2O 双氧水:H2O2皓矾:ZnSO4·7H2O 硅石、石英:SiO2刚玉:Al2O3 水玻璃、泡花碱、矿物胶:Na2SiO3铁红、铁矿:Fe2O3磁铁矿:Fe3O4黄铁矿、硫铁矿:FeS2铜绿、孔雀石:Cu2 (OH)2CO3菱铁矿:FeCO3赤铜矿:Cu2O 波尔多液:Ca (OH)2和CuSO4石硫合剂:Ca (OH)2和S 玻璃的主要成分:Na2SiO3、CaSiO3、SiO2过磷酸钙(主要成分):Ca (H2PO4)2和CaSO4重过磷酸钙(主要成分):Ca (H2PO4)2天然气、沼气、坑气(主要成分):CH4水煤气:CO和H2硫酸亚铁铵(淡蓝绿色):Fe (NH4)2 (SO4)2溶于水后呈淡绿色光化学烟雾:NO2在光照下产生的一种有毒气体王水:浓HNO3:浓HCl按体积比1:3混合而成。
铝热剂:Al + Fe2O3或其它氧化物。
尿素:CO(NH2) 2有机部分:氯仿:CHCl3电石:CaC2电石气:C2H2(乙炔) TNT:三硝基甲苯氟氯烃:是良好的制冷剂,有毒,但破坏O3层。
碳酸盐的性质和应用
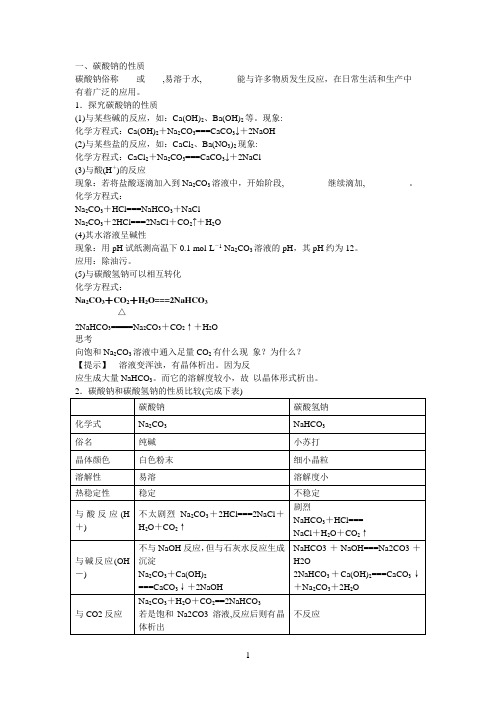
一、碳酸钠的性质碳酸钠俗称____或____,易溶于水,________能与许多物质发生反应,在日常生活和生产中 有着广泛的应用。
1.探究碳酸钠的性质(1)与某些碱的反应,如:Ca(OH)2、Ba(OH)2等。
现象:______________ 化学方程式:Ca(OH)2+Na 2CO 3===CaCO 3↓+2NaOH(2)与某些盐的反应,如:CaCl 2、Ba(NO 3)2现象:______________ 化学方程式:CaCl 2+Na 2CO 3===CaCO 3↓+2NaCl(3)与酸(H +)的反应现象:若将盐酸逐滴加入到Na 2CO 3溶液中,开始阶段,__________继续滴加,__________。
化学方程式:Na 2CO 3+HCl===NaHCO 3+NaCl Na 2CO 3+2HCl===2NaCl +CO 2↑+H 2O (4)其水溶液呈碱性现象:用pH 试纸测高温下0.1 mol·L -1 Na 2CO 3溶液的pH ,其pH 约为12。
应用:除油污。
(5)与碳酸氢钠可以相互转化 化学方程式:Na 2CO 3+CO 2+H 2O===2NaHCO 32NaHCO 3=====△Na 2CO 3+CO 2↑+H 2O 思考向饱和Na 2CO 3溶液中通入足量CO 2有什么现 象?为什么? 【提示】 溶液变浑浊,有晶体析出。
因为反应生成大量NaHCO 3。
而它的溶解度较小,故 以晶体形式析出。
2.碳酸钠和碳酸氢钠的性质比较(完成下表)碳酸钠 碳酸氢钠 化学式 Na 2CO 3 NaHCO 3 俗名 纯碱 小苏打 晶体颜色 白色粉末 细小晶粒 溶解性 易溶 溶解度小 热稳定性 稳定不稳定与酸反应(H +)不太剧烈Na 2CO 3+2HCl===2NaCl +H 2O +CO 2↑剧烈NaHCO 3+HCl=== NaCl +H 2O +CO 2↑与碱反应(OH -)不与NaOH 反应,但与石灰水反应生成沉淀Na 2CO 3+Ca(OH)2===CaCO 3↓+2NaOHNaHCO3+NaOH===Na2CO3+H2O2NaHCO 3+Ca(OH)2===CaCO 3↓+Na 2CO 3+2H 2O 与CO2反应Na 2CO 3+H 2O +CO 2==2NaHCO 3 若是饱和Na2CO3溶液,反应后则有晶体析出不反应与CaCl2反应Na2CO3+CaCl2===CaCO3↓+2NaCl 不反应水溶液碱性较强,加酚酞变红较弱,加酚酞呈淡粉色相互转化二、碳酸钠的制备与应用1.由氯化钠制备碳酸钠将二氧化碳通入氨水的______饱和溶液中,使溶解度____的_________从溶液中析出。
生活中常见盐-碳酸盐PPT课件
某些碳酸盐在医疗领域中具有特 殊用途,如某些重金属中毒可以用特定的碳酸盐进行解毒。 03碳酸盐的化学性质
与酸的反应
碳酸盐与酸反应生成二氧化碳和水
当碳酸盐与酸反应时,会释放出二氧化碳气体,这是碳酸盐的一个显著特征。例 如,当石灰石(主要成分是碳酸钙)与稀盐酸反应时,会产生大量的气泡,这些 气泡就是二氧化碳气体。
反应速率与盐的种类和浓度有关
同酸、碱与碳酸盐的反应类似,盐的种类和浓度也会影响反应速率。一般来说,盐越复杂,反应速率 越慢。此外,盐的浓度也会影响反应速率,浓度越高,反应速率越快。
04
碳酸盐的危害与利用
碳酸盐对人体的影响
碳酸盐摄入过多
摄入过多的碳酸盐会增加肾脏负 担,导致钙盐沉积,从而引发肾
结石等疾病。
碳酸盐的分类
总结词
碳酸盐可根据金属元素的不同进 行分类,包括钠、钾、钙、镁等 。
详细描述
根据金属元素的不同,碳酸盐可 分为钠盐、钾盐、钙盐、镁盐等 。这些盐类在日常生活和工业生 产中都有广泛应用。
碳酸盐的物理性质
总结词
碳酸盐通常具有较低的熔点和较高的热稳定性。
详细描述
碳酸盐的熔点较低,容易熔化,加热时也容易分解。此外,碳酸盐大多具有较 高的热稳定性,不易分解。
饼干、蛋糕等食品。
05
碳酸盐的检测与鉴别
碳酸盐的检测方法
01
沉淀法
通过加入适量的酸,使碳酸盐转化为碳酸氢盐,再加入氯化钡或氯化钙
等重金属盐,生成碳酸钡或碳酸钙沉淀,从而检测出碳酸盐的存在。
02
气体法
将样品加热至高温,使碳酸盐分解生成二氧化碳,通过测定二氧化碳的
量来确定碳酸盐的含量。
03
滴定法
化学必会知识点总结:酸碱盐_高三数学知识点总结
化学必会知识点总结:酸碱盐_高三数学知识点总结
酸碱盐是化学基础中的重要概念,涉及到物质的性质、反应、制备等方面。
以下是高中化学必会的酸碱盐知识点总结:
1. 酸的定义:能够释放出氢离子(H+)的物质称为酸。
若通过反应释放出的氢离子为H3O+,则该物质被称为“质子酸”。
2. 碱的定义:能够释放出氢氧根离子(OH-)的物质称为碱。
3. 盐的定义:由酸与碱中的一个或多个离子组成的化合物称为盐。
4. 中和反应:当酸和碱混合时,它们可以发生反应并生成盐和水。
这种反应称为中和反应。
5. pH值:用于度量溶液中的酸碱度。
pH值越低,酸越强;pH值越高,碱越强。
中性溶液的pH值为7.
6. 酸碱指示剂:一种用于检测溶液酸碱性质的化学物质。
pH值在某个范围内时,酸碱指示剂会变色。
7. 酸碱反应类型:酸与碱反应生成盐和水的类型称为酸碱中和反应。
酸、碱与金属反应时,生成盐和氢气,称为酸化反应或腐蚀金属反应。
酸、碱与氧化物反应时,生成盐和水,称为酸碱中和反应。
8. 氧化还原反应:氧化还原反应是指物质在反应中得到氧原子,或者失去氢原子和电子的反应。
氧化剂是接受电子的物质,而还原剂是提供电子的物质。
高中化学酸碱盐知识点归纳
高中化学酸碱盐知识点归纳高中化学酸碱盐知识点归纳一、酸、碱、盐的组成酸是由氢元素和酸根组成的化合物如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)碱是由金属元素和氢氧根组成的化合物如:氢氧化钠、氢氧化钙、氨水(NH3H2O)盐是由金属元素元素(或铵根)和酸根组成的化合物如:氯化钠、碳酸钠酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的阴、阳离子)二、酸1、浓盐酸、浓硫酸的物理性质、特性、用途浓盐酸浓硫酸颜色、状态纯净:无色液体工业用盐酸:黄色(含Fe3+)无色粘稠、油状液体气味有刺激性气味无特性挥发性(敞口置于空气中,瓶口有白雾)吸水性脱水性强氧化性腐蚀性用途①金属除锈②制造药物③人体中含有少量盐酸,助消化①金属除锈②浓硫酸作干燥剂③生产化肥、精炼石油2、酸的通性(具有通性的原因:酸离解时所生成的阳离子全部是H+)(1)与酸碱指示剂的反应:使紫色石蕊试液变红色,不能使无色酚酞试液变色(2)金属 + 酸盐 + 氢气(3)碱性氧化物 + 酸盐 + 水(4)碱 + 酸盐 + 水(5)盐 + 酸另一种盐 + 另一种酸(产物符合复分解条件)3、三种离子的检验试剂Cl-AgNO3 及HNO3SO42-①Ba(NO3)2及HNO3②HCl 及BaCl2CO32-HCl 及石灰水三、碱1、氢氧化钠、氢氧化钙的物理性质、用途氢氧化钠氢氧化钙颜色、状态白色固体,极易溶于水(溶解放热)白色粉末,微溶于水俗名烧碱、火碱、苛性钠(具有强腐蚀性)熟石灰、消石灰制法Ca(OH)2+Na2CO3== CaCO3+2NaOHCaO +H2O== Ca(OH)2用途①氢氧化钠固体作干燥剂②化工原料:制肥皂、造纸③去除油污:炉具清洁剂中含氢氧化钠①工业:制漂白粉②农业:改良酸性土壤、配波尔多液③建筑:2、碱的通性(具有通性的原因:离解时所生成的阴离子全部是OH-)(1)碱溶液与酸碱指示剂的反应:使紫色石蕊试液变蓝色,使无色酚酞试液变红色(2)酸性氧化物+碱盐+水(3)酸+碱盐+水(4)盐+碱另一种盐+另一种碱(反应物均可溶,产物符合复分解条件)注:①难溶性碱受热易分解(不属于碱的通性)如Cu(OH)2 CuO +H2O2Fe(OH)3 Fe2O3+3H2O②常见沉淀:AgCl BaSO4 Cu(OH)2 F e(OH)3 Mg(OH)2 BaCO3 CaCO3③复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
碳酸盐课件110
澄清的石灰水变浑浊
证明碳酸钙、碳酸钠、碳 酸氢钠能和稀盐酸反应生 成二氧化碳气体,证明样 品中含有碳酸根离子或碳 酸氢根离子
探究活动三:碳酸钠和碳酸氢钠溶液的酸碱性
请同学们分组设计实验验证碳酸钠和 碳酸氢钠溶液的显碱性
——方法一:取少量溶液与试管中并逐渐滴加酚酞溶液,如果溶 液变红色,说明碳酸钠的溶液显碱性,反之则不是
CO2
CO2
A
时 间
时间
B
6、如图是湛江××药厂生产的一种 抗酸药(治疗胃酸过多的药物)的 说明书的部分内容.阅读后回答下 列问题.(1)碳酸镁属于酸、碱、 盐、氧化物中的 . (3)当小军看到药物说明书上的服用方法后,对此产生了 探究的兴趣. 【提出问题】抗酸药为什么嚼碎后服用? 【作出猜想】他猜想反应物的颗粒大小会影响反应的速率. 【设计对比实验】实验一:将一片完整的药片放入试管中, 向其中加入5mL5%的稀盐酸; 实验二:将 放入试管中,向其中加 入5mL5%的稀盐酸. 【现象与结论】实验二比实验一反应快.证明小军的猜想正 确. 【反思与总结】实际实验验证碳酸盐固体和酸反应速率的快 慢是应该考虑的因素是 。
结论
有气泡产生的是碳酸钠, 没有气泡的是氢氧化钠 有白色沉淀产生的是碳酸钠 没有的是氢氧化钠 有白色沉淀产生的是碳酸钠 没有的是氢氧化钠
小结:
有关碳酸盐的鉴别的解题思路:
---------一般是加入与碳酸根离子反应有明显 现象的物质:如:加酸出现气泡 加入含钙离子的溶液有白色沉淀产生
-
课堂小结:
6、有盐酸和CaCl2的混合溶液,向其中逐滴加入过 量的碳酸钠,溶液的pH随滴入碳酸钠的量的变化关 系如图所示. (1)先观察到的现象是 。 (2)当pH=7时反应的方程式是 。 (3)当pH>7时溶液中的 溶质是 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
▁▂▃▄▅▆▇█▉▊▋▌精诚凝聚 =^_^= 成就梦想 ▁▂▃▄▅▆▇█▉▊▋▌
▃ ▄ ▅ ▆ ▇ █ █ ■ ▓点亮心灯 ~~~///(^v^)\\\~~~ 照亮人生 ▃ ▄ ▅ ▆ ▇ █ █ ■ ▓
1.一些碳酸盐的存在、俗称或用途。
大理石、石灰石、蛋壳、贝壳、钟乳石—CaCO3;纯碱、苏打—Na2CO3;
小苏打—NaHCO3(可用于食品发泡,治疗胃酸过多症)碳铵—NH4HCO3(氮肥);
草木灰的主要成分—K2CO3(钾肥);锅垢的主要成分—CaCO3和Mg(OH)2;
制普通玻璃原料—石灰石、纯碱、石英;制水泥的原料—石灰石、粘土
2.碳酸的正盐和酸式盐
(1)、相互转化:碳酸钙和碳酸氢钙的转化(实验现象;石灰岩洞和钟乳石形成)
碳酸钠和碳酸氢钠的转化(碳酸钠溶液跟盐酸反应不如碳酸氢钠剧烈;除去碳酸氢钠溶
液中的碳酸钠杂质;除去碳酸钠中碳酸氢钠杂质;除去二氧化碳中的氯化氢杂质为什么不用
碳酸钠溶液而用碳酸氢钠溶液等问题;在饱和碳酸钠溶液中通入二氧化碳气体,有碳酸氢钠
析出的原因:①消耗了水②碳酸钠的溶解度大于碳酸氢钠③生成碳酸氢钠的质量大于原溶液
中碳酸钠的质量)
(2)、共同性质:都能跟酸(比碳酸强的酸)反应生成二氧化碳气体。(碳酸盐的检验)
(3)、稳定性比较:正盐比酸式盐稳定(稳定性:酸<酸式盐<正盐,是一个比较普遍的现
象
如HClO (5)、碳酸氢钠与碳酸钠某些反应的异同 ②、跟石灰水或氢氧化钡溶液都生成白色沉淀;
(4)、溶解性比较:一般说酸式盐的溶解性强于正盐如Ca(HCO3)2>CaCO3,反例:NaHCO
3
①、都有碳酸盐的通性—-与盐酸反应生成二氧化碳(要注意熟悉反应时耗酸量及生成气
体量的各种情况下的比较。)
▁▂▃▄▅▆▇█▉▊▋▌精诚凝聚 =^_^= 成就梦想 ▁▂▃▄▅▆▇█▉▊▋▌
▃ ▄ ▅ ▆ ▇ █ █ ■ ▓点亮心灯 ~~~///(^v^)\\\~~~ 照亮人生 ▃ ▄ ▅ ▆ ▇ █ █ ■ ▓
③、碳酸氢钠能跟氢氧化钠等碱反应而碳酸钠不反应;
④、碳酸钠跟氯化钙或氯化钡溶液易生成碳酸盐沉淀,而碳酸氢钠跟盐类稀溶液不易生
成沉淀。
