丙烷分子结构模型
化学作业

化学作业1.2008年北京奥运会火炬在工艺上采用高品质铝合金和中空塑件设计,燃料主要为丙烷,丙烷分子结构模型如图所示,下列说法中不正确的是( )A.丙烷的化学式为C3H8B.丙烷由碳原子和氢原子构成C.丙烷属于有机物D.丙烷存氢气中完伞燃烧的产物是C02和H202.向装有50g稀硫酸的小烧杯中,不断慢慢滴加10%的Ba(OH)2溶液至过量。
有关量的变化情况见下图(横坐标表示加入氢氧化钡溶液的质量,纵坐标表示小烧杯中量的变化)。
其中肯定不正确的是()3.除去下列各组物质中的杂质,所用试剂和方法均正确的是()4.下列关于溶液的叙述中正确的是()A.饱和溶液析出晶体后,溶质的质量分数一定变小B.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液C.溶液一定是均一、稳定的混合物D.一定温度下,物质的溶解度随溶剂的量的变化而变化5.甲、乙、丙、丁四个试剂瓶分别装有碳酸钠溶液、氯化钡溶液、稀硫酸、硫酸钾溶液。
甲分别能与乙、丙、丁发生反应,则甲是()A.Na2CO3溶液B.稀硫酸C.BaCl2溶液D.K2SO4溶液6.下列制取气体的方案,可以直接采用右图所示装置进行的是()①用H2O2和MnO2制取O2;②用CaCO3和稀盐酸制取CO2;③用KClO3和MnO2制O2;④用Zn和稀H2SO4制取H2;⑤用Na2CO3和H2SO4制取CO2.A.①④B.①②④C.①②⑤D.①②④⑤7.类推是化学学习中常用的思维方法。
现有以下类推结果,其中正确的是()A.酸碱中和反应生成盐和水,则生成盐和水的反应一定是中和反应B.氧化物中都含有氧元素,则含有氧元素的化合物一定是氧化物C.碱的溶液PH>7,则PH>7的溶液一定是碱性的溶液D.点燃H2和O2的混合气体可能发生爆炸,则点燃CH4与O2的混合气体也可能爆炸8.生活离开化学物质,现有以下六种物质:①生石灰;②食盐;③碳酸钙;④尿素;⑤酒精;⑥碳酸氢钠。
请选择适当物质的序号填空:⑴可用作火锅燃料的是_______________。
湘教版 期中复习测试2

一、选择题(每题只有一个正确答案,每小题2分,共26分)1.人类活动需要能量,下列能量主要是由化学变化产生的是()A.电炉取暖B.太阳灶烧水C.燃煤发电D.帆船航行2.最近在我国河北省的海陆交界处发现了冀东南堡大油田。
油田中的石油属于( )A.混合物B.纯净物C.单质D.化合物3.下列各组词语中,前者用于描述物质的化学性质,后者用于表达物质发生化学变化的是()A.挥发性,气化B.腐蚀性,燃烧C.可燃性,液化D.溶解性,熔化4.对容器口进行磨砂处理可提高容器的密封性。
下列仪器中对容器口没有进行磨砂处理的是( )5.“让化学走向公众”是全美化学周的口号。
美国化学周活动主题的内容涉及化学的方方面面,但都与公众日常生活息息相关。
你认为下列哪项内容不属于美国化学周活动主题()A.多彩的世界B.食品化学C.水电开发D.地球及远地大气6.据报道,2007年4月30日大兴安岭罕诺河管护区草甸森林火灾,是一犯罪嫌疑人随手扔在草丛中烟头引起的。
烟头在火灾发生中的“罪状”是 ( )A.提供可燃物B.使可燃物的温度达到着火点C.提供氧气D.降低可燃物的着火点7.1934年,卢瑟福等科学家通过核反应发现氢的同位素原子——氚。
氚可用表示(其中“l”表示核电荷数),氚原子的模型如图所示,图中“●”表示的粒子是 ( )A.原子核B.质子C.中子D.核外电子8.法国里昂的科学家发现一种只有四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。
它与天体中的中子星构成类似。
有关该粒子的说法正确的是()A.带正电B.在周期表中与氢元素占同一位置C.失去一个中子后显+1价D.相当于一个氦(He)原子的质量9.氢气在许多领域得到广泛应用。
下列关于氢气的说法不正确的是()A.可用向下排空气法收集氢气B.可用排水法收集氢气C.氢气作燃料的优点是来源广、热值高、无污染D.氢在自然界中主要以单质的形式存在10. 分别表示X、Y、Z三种不同的气体分子,其在一定条件下反应前后的变化如右图所示:下列叙述错误的是()A.分子是在不断运动的B.分子之间有间隔的C.该反应可表示为3X+Y=2ZD.一个Z分子由三个原子构成11.据报道,2007年5月1日凌晨,我国在南海北部钻取“可燃冰”首次采样成功。
8年中考化学一轮复习(第3章物质构成的奥秘).docx

2008年中考化学一轮复习第3章物质构成的奥秘考点1微粒(分子、原子、离子)1.构成物质的微粒特点:微粒是_______________ 的;微粒是________________ 的,温度升高,运动加快;微粒之间存在___________________ O在固体、液体物质中,微粒之间的距离_________ ,在气体物质屮,微粒Z间的距离____________ O所以,气体通常比较容易被_________ ,固体和液体 _____________ O2.科学家长期研允证实,构成物质的微粒有_______________ 、___________ 和。
有的物质是由________ 构成,如金刚石是由_______________ 构成的;有的物质是由_______ 构成,如食盐是由____________________ 构成的;还有的物质由____________ 构成,,如干冰是由______________ 构成的。
3.分子是保持______________________ 的一种微粒。
保持二氧化碳化学性质的一种微粒是___________ -氧气和液氧都有助燃性是因为他们都是由______________ 构成;氧气、氢气、水的性质________ 是因为他们是由________________ 构成的。
4.原子是_____________________ 屮最小的微粒。
5.分子是由____________ 构成的,原子通过____________________ 可形成离子。
6.观察水分子分解的示意图:并回答问题:水分子氢原子氣原子氢分子氣分子从图中你可以得到哪些信息?请从物质的组成、构成及变化的角度各说一种:组成:________________________________________________ ;构成:________________________________________________ ;变化:________________________________________________ O7.分子、原子、离子的相互关系极其转化:相同点:都很—;都在__________ ;微粒间都有_________ ;相同的微粒具有_______ 的性质。
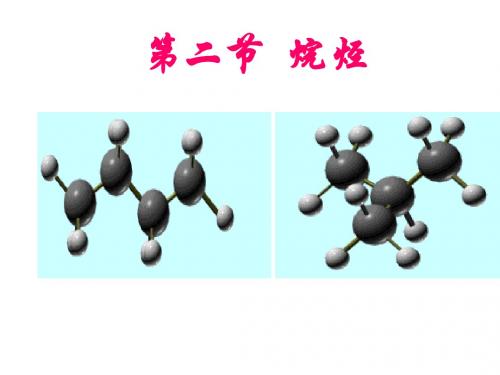
烷烃的分子结构

2.1.2 烷烃的分子结构Structures of Alkanes(1) 烷烃的结构。
杂化轨道理论认为,在烷烃分子中,碳原子都是以sp3杂化轨道成键的。
即由一个s轨道和三个p轨道进行杂化(hybridization),形成四个能量均等的sp3杂化轨道(hybrid orbital)。
sp3杂化轨道的形状既不同于s轨道,也不同于p轨道,而是呈葫芦形,见图2-1。
p轨道是由波函数符号不同的两瓣组成的,当它与s轨道杂化以后,波函数符号相同的一瓣增大了,不同的一瓣缩小了,因此,在杂化轨道中,电子在一个方向上的概率密度增大,在相反方向上则减小,如此,增强了轨道的方向性,可以与另一个轨道形成更强的键。
每个sp3杂化轨道都含有1/4 s轨道成分和3/4 p轨道成分。
四个sp3杂化轨道的空间取向指向正四面体的四个顶点,每两个轨道之间的夹角为109.5°(精确值为109°28′),见图2-2。
sp3杂化轨道的这种空间分布使它们相互间的距离尽可能达到最远,所以电子之间的斥力最小,体系最稳定。
图2-1 一个sp3杂化轨道图2-2 碳原子四个sp3杂化轨道空间分布甲烷碳原子的四个sp3杂化轨道分别与四个氢原子的1s轨道沿着对称轴的方向相互重叠形成四个C-Hσ(Sigma)键,分子呈正四面体型结构(图2-3),其键角都是109.5°,C-H键长为0.109 nm。
HHH HC正四面体结构球棍模型Stuart模型图2-3 甲烷分子结构其它烷烃含有碳-碳单键和碳-氢单键。
碳-碳单键是由成键的两个碳原子各以一个sp3杂化轨道沿着对称轴的方向相互重叠而成的σ键,碳-碳单键键长为0.154 nm,键能为345 kJ·mol-1。
碳-氢键是由碳原子的一个sp3杂化轨道和氢原子的1s轨道沿着其对称轴的方向相互重叠而形成的σ键。
碳-氢键键长为0.109 nm,键能为413 kJ·mol-1。
甲烷乙烷丙烷球棍模型

甲烷乙烷丙烷球棍模型甲烷、乙烷和丙烷是我们生活中常见的有机化合物。
它们是碳氢化合物,由碳原子和氢原子组成。
为了更好地理解这些分子的结构和属性,科学家们发展了一种称为球棍模型的表示方法。
这种模型通过使用球体代表原子,以及棍子代表化学键来描绘分子的三维结构。
在本文中,我们将深入探讨甲烷、乙烷和丙烷的球棍模型,了解它们的结构和性质。
一、甲烷(CH4)甲烷是最简单的烷烃,也是天然气的主要成分之一。
它由一个碳原子和四个氢原子组成。
在球棍模型中,我们可以用一个球体代表碳原子,四根棍子从碳原子上延伸,每根棍子连接一个氢原子。
这种球棍模型直观地展示了甲烷分子的结构,碳原子位于中心,四个氢原子均匀地环绕在周围。
甲烷分子具有高度对称性,所有碳-氢键的长度都相等,所有氢原子的角度也都相等。
这种高度对称的结构使得甲烷具有稳定的性质,它是一种无色、无味、无臭的气体。
由于甲烷分子中碳原子与周围的氢原子之间共享电子,它具有较强的上向键电子云,这使得甲烷分子在化学反应中不太活泼。
二、乙烷(C2H6)乙烷是由两个碳原子和六个氢原子组成的烷烃。
与甲烷相比,乙烷的球棍模型稍微复杂一些。
我们可以用两个球体分别代表两个碳原子,然后用棍子将它们连接起来。
每个碳原子还连接了三个氢原子,这些氢原子通过棍子与碳原子相连。
乙烷分子的结构也具有一定的对称性,两个碳-碳键的长度相等,以及周围氢原子的排列相对对称。
然而,与甲烷不同的是,乙烷分子的结构更加灵活,碳原子和氢原子之间可以自由旋转。
这种结构的灵活性使得乙烷在化学反应中具有更大的活性。
乙烷是一种无色、无味的气体,通常作为燃料在工业和家庭中使用。
三、丙烷(C3H8)丙烷是由三个碳原子和八个氢原子组成的烷烃。
与甲烷和乙烷相比,丙烷的球棍模型更加复杂。
我们可以用三个球体来代表三个碳原子,并使用棍子将它们连接起来。
每个碳原子除了与相邻的碳原子相连外,还连接了三个氢原子。
丙烷分子的结构相对复杂,由于存在三个碳原子,它的形状更加不规则。
1,3-二(4-吡啶基)丙烷结构

标题:探究1,3-二(4-吡啶基)丙烷结构的性质与应用导言在化学领域中,有许多有趣且富有挑战性的分子结构,其中1,3-二(4-吡啶基)丙烷就是一个备受关注的化合物。
它具有独特的结构和性质,对于我们理解有机化合物的结构和功能具有重要意义。
本文将着重探讨1,3-二(4-吡啶基)丙烷结构的性质和应用,带领读者深入了解这一有趣的化合物。
一、1,3-二(4-吡啶基)丙烷结构简介1.1 结构特点1,3-二(4-吡啶基)丙烷是一种含氮有机化合物,其分子中含有两个吡啶基团。
该结构在有机合成和药物化学领域得到了广泛的应用,其分子式为C13H14N2。
通过分子式的推导,我们不难发现,1,3-二(4-吡啶基)丙烷结构中含有芳环和脂肪环,这一混杂结构使得其具有多样的化学性质。
1.2 晶体结构1,3-二(4-吡啶基)丙烷结构中的分子以晶格的形式排列,所形成的晶体结构对于其性质和应用具有重要影响。
晶体结构的稳定性与分子的排列方式息息相关,也直接影响了分子之间的相互作用和性质。
二、1,3-二(4-吡啶基)丙烷的性质2.1 化学性质由于1,3-二(4-吡啶基)丙烷结构中含有多个芳环和脂肪环,因此其化学性质非常活泼。
在适当的条件下,1,3-二(4-吡啶基)丙烷可以发生氧化、还原、取代和加成等一系列化学反应,产生各种不同的衍生物。
2.2 物理性质1,3-二(4-吡啶基)丙烷在物理性质上也具有一定的特殊之处。
它的溶解度、熔点、沸点等物理参数都可以通过实验方法来确定,这些参数对于我们理解其在实际应用中的行为具有重要意义。
三、1,3-二(4-吡啶基)丙烷的应用3.1 有机合成由于1,3-二(4-吡啶基)丙烷结构中含有多个活性基团,因此可以作为有机合成的重要原料。
吡啶基团在有机合成中具有较好的反应活性,能够被氧化、还原和取代,从而合成出具有不同结构和功能的有机化合物。
3.2 药物化学除了在有机合成领域的应用外,1,3-二(4-吡啶基)丙烷结构在药物化学中也有着重要的地位。
丙烷化学分子式(一)

丙烷化学分子式(一)
丙烷化学分子式
什么是丙烷化学分子式?
丙烷化学分子式是表示丙烷分子结构的一种简略标记方式。
丙烷
是一种碳氢化合物,由三个碳原子和八个氢原子组成。
它的分子式为
C3H8。
相关分子式
以下是一些和丙烷化学分子式相关的分子式:
1.乙烷:C2H6
–乙烷和丙烷都属于烷烃的一类,它由两个碳原子和六个氢原子组成。
乙烷的分子式比丙烷少一个碳原子。
2.丁烷:C4H10
–丁烷是一个比丙烷多一个碳原子的烷烃。
它由四个碳原子和十个氢原子组成。
3.甲烷:CH4
–甲烷是最简单的烷烃,它只包含一个碳原子和四个氢原子。
与丙烷相比,甲烷分子式中少了两个碳原子。
分子式的意义
化学分子式可以通过化学式来表示,它能够直观地显示出分子结
构的组成。
以丙烷为例,分子式C3H8告诉我们丙烷分子中有3个碳原
子和8个氢原子。
通过分子式,我们可以了解分子的元素组成和数量,有助于分析和理解化学反应以及物质的性质。
小结
在本文中,我们介绍了丙烷化学分子式及其相关的分子式,包括
乙烷、丁烷和甲烷。
化学分子式是一种简略的标记方式,可以直观地
显示出分子的组成。
对于化学专业的人士来说,了解分子式对于研究
物质的性质和化学反应十分重要。
烷烃
结构 类别
结构相似 化合物
练习:
下列五组物质中___互为同位素, 2 是同素异形体 是同素异形体, 下列五组物质中 1 互为同位素,___是同素异形体, 互为同位素 ___ 是同分异构体,___是同系物,___是同一物质。 是同系物, 5 是同分异构体, 4 是同系物 3 是同一物质
1、 、 3、 、
(B)
(D)
C ∣ C-C -C C C ∣ ∣ C- C C - C- C ∣ C C- C ∣ ∣ C C
(F)
(H)
练习: 练习:
A、判断下列物质中相同的是_______________ 、判断下列物质中相同的是 ②和④ ⑤和⑥ B、属于同分异构体的是______________ ④ 、属于同分异构体的是 ①和② 或①和 C、属于同系物的是____________________________ 、属于同系物的是 ① 、 ③和⑤ 或② 、③和⑤…… ① CH3—CH2—CH2 CH3 ③ CH3—CH2—CH3 ⑤ CH3—CH2—CH—CH3 CH3 ② CH3—CH—CH3 CH3 ④ CH3 CH—CH3 CH3 ⑥ CH3—CH—CH3 CH2 CH3
常温下状态: 常温下状态: 1-4:气态 : 5-16:液态 : 17以上:固态 以上: 以上
3、化学性质 、
(1)氧化反应
3n + 1 CnH 2 n + 2 + O 2 点燃 → nCO 2 + (n + 1) H 2O 2
均不能使KM 褪色,不与强酸,强碱反应。 均不能使KMnO4褪色,不与强酸,强碱反应。
12 6
C
14 6
C
2、白磷、红磷 、白磷、 4、CH3CH3、CH3CHCH3 、 | CH3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
丙烷分子结构模型
丙烷是一种有机化合物,化学式为C3H8。
它是烷烃类化合物中最简单的一种,由三个碳原子和八个氢原子组成。
丙烷是一种无色、无臭的气体,在常温常压下为常见的天然气成分之一。
丙烷的分子结构可以用空间模型来表示。
在这个模型中,三个碳原子按照直线排列,每个碳原子上连接着四个氢原子。
由于碳原子和氢原子的键长和键角是固定的,因此可以通过这个模型来展示丙烷的分子结构。
在模型中,碳原子用黑色小球表示,氢原子用白色小球表示,它们通过线段连接起来,形成一个稳定的分子结构。
丙烷的空间模型展示了它的分子结构,帮助我们更好地理解它的性质和行为。
丙烷是一种非极性分子,因为它的碳-碳和碳-氢键都是非极性键。
这意味着丙烷在溶解度、沸点和熔点等方面与极性分子有所不同。
由于丙烷的分子结构紧凑,分子间的相互作用较弱,因此它的沸点较低,易于挥发。
丙烷是一种燃料,可以被用作烹饪、供暖和发电等方面。
它的燃烧产物主要是二氧化碳和水,不会产生有害物质。
丙烷的燃烧热值较高,能够提供大量的热能。
因此,它被广泛应用于家庭和工业领域。
除了作为燃料外,丙烷还可以用作化学原料。
它可以通过加氢反应将丙烯转化为丙烷。
丙烷也可以通过蒸馏和分离技术从天然气中提取出来。
在石油和天然气工业中,丙烷是一种重要的中间体,用于
生产丙烯、丙醇和其他有机化合物。
丙烷的分子结构不仅仅是一种形式上的表示,它还反映了丙烷的化学性质和物理性质。
通过研究丙烷的分子结构,可以了解它的键长、键角和化学键的类型。
这对于预测和解释丙烷的反应性、稳定性和相互作用等方面非常重要。
丙烷的分子结构模型是一种有效的工具,可以帮助我们更好地理解丙烷的性质和行为。
通过研究丙烷的分子结构,可以揭示其化学本质,并为其在能源和化学工业中的应用提供参考。
丙烷作为一种重要的有机化合物,其分子结构模型的研究对于推动科学研究和工业发展具有重要意义。
