正构烷烃的物理常数
烷烃的结构和性质

同分异构体:具有同分异构体现象的化合物互称为同分异 构体。 理解:1、同分——相同分子式
2、异构——结构不同 结构不同主要指:碳链异构
C5H12有3种同分异构体
正戊烷
异戊烷
新戊烷
试判断三种戊烷物理性质的差异
正 戊烷
从左
异戊烷
新 戊烷
右
沸点变化 相对密度变化
?
降低 减小
烷烃中,碳原子数相同的同分异构体,支链越多,沸点越低。 问:①正戊烷、②壬烷、③异戊烷、④新戊烷、⑤正丁烷的沸点由高到
讨论题:
下列对同系物的叙述中不正确的是 (
A、同系物的化学性质相似 B、同系物必为同一类物质
) C
C、同系物的组成元素不一定相同
D、同系物的相对分子质量相差为14的整数倍
4、烃基
烃 基 :烃分子失去一个或几个氢原子后剩余的部分
如:-CH3
甲基
-CH2CH3
乙基
-CH2CH2CH3 丙基
CH3CHCH3 异丙基
想一想:甲烷、乙烷、丙烷、丁烷……,在这些烷
烃中C、H的原子个数间存在什么关系?
2.同系物: 定义:化学上,把结构相似、在分子组成上相差n个 CH2原子团的各物质互称为同系物
3.烷烃的通式
CnH2n+2
(n≥1)
如何理解结构相似?
主要指碳链结构有相同的特点,属同一类物质
问:1、相差CH2原子团的两种物质一定是同系物吗? 2、分子量相差 14 的整数倍的化合物之间,互为 同系物吗? 判断:CH3Cl与CH3CH2Cl是否属同系物? CH3CH2CH3与CH3CH(CH3 )CH3是否也属于同系 物呢?
③ CH3—CH2—CH3
⑤ CH3—CH2—CH—CH3 CH3
烷烃
原因: 分子中电子的数目分子量↑ 色散力↑ b.p↑。 原因:色散力∝分子中电子的数目分子量↑,色散力↑,b.p↑。
2. 正构者b.p高。支链越多,沸点越低。 正构者b.p b.p高 支链越多,沸点越低。
原因:支链多的烷烃体积松散,分子间距离大,色散力小。 原因:支链多的烷烃体积松散,分子间距离大,色散力小。
一.烷烃的化学性质
C H 2.2
烷烃的结构
电负性
2.5
C
sp3 杂化 已饱和 不能加成
C
H
低极性共价键 H 酸性小 不易被置换
一般情况下烷烃化学性质不活泼、耐酸碱( 一般情况下烷烃化学性质不活泼、耐酸碱(常用作低极性溶 不活泼 如正己烷、正戊烷、石油醚等) 剂,如正己烷、正戊烷、石油醚等) 烷烃可与卤素发生自由基取代反应 烷烃的重要反应) 烷烃可与卤素发生自由基取代反应(烷烃的重要反应) 自由基取代反应(
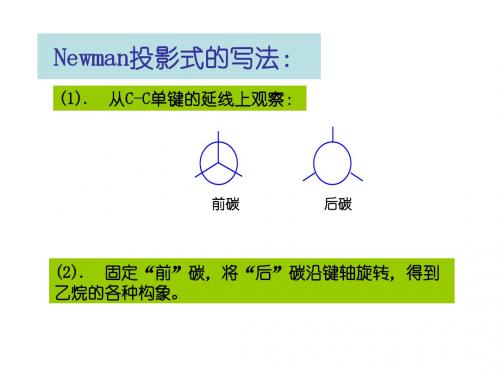
Newman投影式的写法: Newman投影式的写法: 投影式的写法
(1). 从C-C单键的延线上观察: 单键的延线上观察:
前碳
后碳
(2). 固定“前”碳,将“后”碳沿键轴旋转,得到 固定“ 碳沿键轴旋转, 乙烷的各种构象。 乙烷的各种构象。
1. 乙烷的构象
小于两个H 小于两个 的 von der waals 半 径(1.2Å)之和, )之和, 有排斥力
重叠式构象 eclipsed conformer 键电子云排斥, von der 键电子云排斥, waals排斥力,内能较高 排斥力, 最不稳定) (最不稳定)
乙烷构象转换与势能关系图
H H H H
H H H 1 H H H
2
1 1
H H
旋转60
o
正构十六烷烃-概述说明以及解释

正构十六烷烃-概述说明以及解释1.引言概述正构十六烷烃是一种具有十六个碳原子的直链烷烃化合物,具有许多重要的应用价值。
在工业生产和科学研究领域,正构十六烷烃被广泛用于制备石化产品、合成润滑油和生产有机化学品等方面。
本文将从定义、性质和应用三个方面对正构十六烷烃进行深入探讨,旨在全面了解其在现代化工产业中的重要性和应用前景。
文章1.1 概述部分的内容1.2 文章结构本文主要分为三个部分:引言、正文和结论。
在引言部分,将对正构十六烷烃进行概述,并介绍文章的结构和目的。
正文部分将详细介绍正构十六烷烃的定义、性质和应用。
通过对正构十六烷烃的深入探讨,读者将更好地了解这种化合物的特点和用途。
在结论部分,将总结正构十六烷烃的重要性,并展望其未来发展前景。
最后,对整篇文章进行总结,强调正构十六烷烃在化工领域的重要性和价值。
1.3 目的正构十六烷烃作为一种重要的化合物,在化工、石化等领域有着广泛的应用。
本文的目的旨在系统性地介绍正构十六烷烃的定义、性质和应用,帮助读者更好地了解这种化合物的特点和重要性。
同时,通过对正构十六烷烃的研究和应用进行全面的探讨,有助于促进正构十六烷烃在工业生产中的应用,推动其在未来的发展和创新。
通过本文的阐述,读者可以深入了解正构十六烷烃这一化合物的重要作用和潜在的应用价值,为相关领域的科研工作提供参考和借鉴。
2.正文2.1 正构十六烷烃的定义正构十六烷烃是一种化学物质,其分子由16个碳原子和只含有单键的氢原子构成。
在分子结构中,这16个碳原子按照直链排列,且每个碳原子都有四个共价键,其中三个连接着其他碳原子,一个连接着氢原子。
由于其碳原子按照直链排列且没有支链结构,因此称为正构十六烷烃。
其分子式为C16H34,分子量约为226克/摩尔。
正构十六烷烃通常是无色无味的液体,具有较高的热稳定性和化学稳定性。
在石油化工工业中,正构十六烷烃是一种重要的原料,常被用作合成各种燃料、润滑油和功能性化合物的起始物质。
《烷烃》 讲义

《烷烃》讲义一、烷烃的定义与分类烷烃是一类有机化合物,它们是只含有碳(C)和氢(H)两种元素,且碳与碳之间都以单键相连,其余的价键都与氢原子结合的烃类化合物。
根据碳原子数的不同,烷烃可以分为以下几类:1、甲烷(CH₄):这是最简单的烷烃,只有一个碳原子。
2、乙烷(C₂H₆):有两个碳原子。
3、丙烷(C₃H₈):包含三个碳原子。
4、丁烷(C₄H₁₀):由四个碳原子组成。
随着碳原子数的增加,烷烃的种类越来越多。
一般来说,当碳原子数在 1 到 4 时,烷烃在常温常压下通常是气态;当碳原子数在 5 到 16 时,多为液态;而碳原子数大于 17 时,则往往是固态。
二、烷烃的通式烷烃的通式可以表示为 CₙH₂ₙ₊₂,其中 n 表示碳原子的个数。
通过这个通式,我们可以方便地计算出任何一种烷烃分子中碳和氢原子的数目。
例如,当 n = 5 时,这种烷烃就是戊烷(C₅H₁₂);当 n = 10 时,就是癸烷(C₁₀H₂₂)。
三、烷烃的命名烷烃的命名有一套系统的规则。
1、对于直链烷烃,根据碳原子的数目,依次称为“甲烷”、“乙烷”、“丙烷”等。
2、对于含有支链的烷烃,命名时要遵循以下原则:选择最长的碳链作为主链。
从距离支链最近的一端开始给主链上的碳原子编号。
将支链的位置和名称写在前面,主链的名称写在后面。
例如,对于结构为 CH₃CH(CH₃)CH₂CH₃的烷烃,其名称为 2-甲基丁烷。
其中,“2-”表示甲基在主链的第 2 个碳原子上。
四、烷烃的物理性质1、状态如前面提到的,烷烃的状态与碳原子数密切相关。
气态烷烃分子间的距离较大,相互作用力较弱;液态烷烃分子间的距离较小,相互作用力较强;固态烷烃分子排列紧密,相互作用力很强。
2、溶解性烷烃一般不溶于水,而易溶于有机溶剂,这是因为相似相溶原理,烷烃是非极性分子,水是极性分子。
3、密度烷烃的密度通常小于水的密度,且随着碳原子数的增加,密度逐渐增大。
五、烷烃的化学性质1、稳定性在常温下,烷烃一般不与强酸、强碱、强氧化剂等发生反应,表现出较高的化学稳定性。
2.5 烷烃的物理性质

2.5 烷烃的物理性质12.5 烷烃的物理状态在常温常压下:含有1~4个碳原子的烷烃为气体;含有5~16个碳原子的为液体;从含有17个碳原子的正烷烃开始为固体,但直至含有60个碳原子的正构烷烃(熔点99 °C),其熔点都不越过100°C。
低沸点的烷烃为无色液体,有特殊气味。
高沸点烷烃为粘稠油状液体,无味。
甲烷Methane (CH4) CH4乙烷Ethane (C2H6)CH3CH3丙烷Propane (C3H8)CH3CH2CH3bp-160°C bp-89°C bp-42°C简单烷烃3直链烷烃的熔点、沸点直链烷烃由于容易堆积形成晶体,因此熔点、沸点较高。
在正烷烃中,含奇数碳原子的烷烃其熔点升高较含偶数碳原子的少偶数奇数碳原子数目支链烷烃和直链烷烃沸点的比较¾具有相同碳数的不同结构的烷烃,沸点仅有较小的差别。
¾支链化作用使沸点降低,随着支链的增加沸点(b.p. )降低碳原子数目直链烷烃支链烷烃沸点烷烃的沸点正构烷烃的沸点随相对分子质量的增加而升高,这是因为分子质量的增加使得分子运动所需的能量增大;另外,分子质量的增加使得分子间的接触面(即相互作用力)也增大。
低级烷烃每增加一个CH2,相对分子质量变化较大,沸点也相差较大。
高级烷烃相差较小,故低级烷烃比较容易分离,高级烷烃分离则难得多。
烷烃的沸点在同分异构体中,分子结构不同,分子接触面积不同,相互作用力也不同,正戊烷沸点36.1℃,2-甲丁烷沸点25℃,2,2-二甲丙烷沸点只有9℃。
支链分子由于支链的位阻作用,其分子不能像正构烷烃那样接近,分子间作用力小,沸点较低。
烷烃的沸点固体分子其熔点随相对分子质量增加而增加,这与质量大小及分子间作用力有关外,还与分子在晶格中的排列有关,分子对称性高,排列比较整齐,分子间吸引力大,熔点就高。
烷烃分子溶点、沸点差异的原因--分子间作用力分子的熔点或沸点的高低取决于分子间的作用力。
烷烃的性质总结

烷烃的性质总结什么是烷烃烷烃是一类有机化合物,由碳和氢原子组成,只包含单重键。
烷烃的化学式通常被表示为CnH2n+2,其中n是非负整数。
根据分子中碳原子的数目,烷烃可以分为以下几类:甲烷、乙烷、丙烷、丁烷等。
烷烃的物理性质烷烃通常是无色、无味的气体或液体,但在较低温度下可以是固体。
它们的饱和烷烃分子呈线性结构,且碳原子之间的键角为109.5度。
以下是烷烃的一些重要物理性质:1.沸点和熔点:烷烃的沸点和熔点随着碳原子数目的增加而增加。
由于分子间的范德华力较弱,烷烃的沸点和熔点通常较低。
2.密度:烷烃通常比空气密度大,这使得它们可以在空气中流动,并在空气中燃烧。
烷烃的密度随着分子量的增加而增加。
3.可溶性:烷烃是非极性化合物,通常不溶于水。
然而,它们可以与非极性溶剂(如石油醚和苯)相溶。
烷烃的化学性质烷烃的化学性质主要由碳原子之间的单重键决定,使得它们在反应中较为稳定。
以下是烷烃的一些重要化学性质:1.燃烧性质:烷烃具有良好的燃烧性质。
它们与氧气反应生成二氧化碳和水,并释放大量热能。
这使得烷烃成为重要的燃料来源。
2.反应活性:由于烷烃分子中只有单重键,烷烃的反应活性较低。
但在适当的条件下,烷烃可以进行一些反应,如氢气的加成反应、卤素的取代反应等。
3.危险性:烷烃具有较低的毒性,但是由于其易燃性,烷烃具有一定的危险性。
在处理和储存烷烃时需要注意火源和通风条件。
4.氧化性:烷烃在空气中暴露时,会发生氧化反应产生过氧化物,从而形成爆炸性混合物。
因此,烷烃应储存在避光、低温、通风良好的地方。
烷烃的应用烷烃在工业和日常生活中有广泛的应用。
以下是一些常见的应用:1.燃料:烷烃是重要的燃料来源。
甲烷是主要的天然气成分,可用作燃料供应家庭和工业。
丁烷和辛烷等烷烃则是汽车燃料的重要组成部分。
2.化学品生产:烷烃可以用作化学品生产中的原料。
例如,乙烯是聚合物工业中生产聚乙烯的重要原料。
3.溶剂:烷烃具有良好的溶解性和挥发性,可以用作溶剂。
烷烃的结构与性质

烷烃的结构与性质烷烃是一类基本有机化合物,由碳和氢原子构成。
它们的分子由碳原子构成的链或环连接而成,具有特定的结构和性质。
本文将探讨烷烃的结构以及与其相关的性质。
一、直链烷烃直链烷烃是最简单的烷烃类别,分子由一条直线状的碳链构成。
举个例子,正丁烷(CH3-CH2-CH2-CH3)是一种直链烷烃,其分子中包含四个碳原子。
直链烷烃的化学式可用CnH2n+2表示,其中n代表烷烃分子中碳原子的数量。
直链烷烃的物理性质包括沸点、熔点和密度等。
随着碳原子数量的增加,直链烷烃的沸点和熔点逐渐增加。
这是因为随着分子量的增加,分子间的范德华力也增强,使得分子间相互作用加强,需要更高的温度来克服这种相互作用。
此外,随着分子量的增加,直链烷烃的密度也逐渐增加。
二、支链烷烃支链烷烃的分子由一条或多条侧链连接到主链上,与直链烷烃相比,支链烷烃具有更多的碳原子连接方式。
举个例子,2-甲基丁烷(CH3-CH(CH3)-CH2-CH3)是一种支链烷烃,其中有一个甲基基团连接在主链上。
支链烷烃与直链烷烃在物理性质上有所不同。
由于支链的存在,支链烷烃分子具有更大的隔离度,分子间相互作用减少,从而导致其沸点和熔点相对较低。
支链烷烃的密度也较低,因为支链的存在减少了分子的紧密排列。
三、环烷烃环烷烃是由碳原子构成的环连接而成的分子结构。
与直链烷烃和支链烷烃相比,环烷烃的分子形状呈环状,因此具有特殊的性质。
环烷烃的一个例子是环己烷(C6H12),其中六个碳原子形成一个环状结构。
环烷烃的性质与其分子结构有密切关系。
由于环状结构的存在,环烷烃分子内部有较大的张力,导致其相对不稳定。
此外,由于环烷烃中碳原子的取向限制,它们往往比相应的直链烷烃熔点和沸点更高。
环烷烃还表现出一些特殊的化学反应,如环开裂和环化等。
总结起来,烷烃是一类碳和氢原子构成的有机化合物,根据其分子结构和性质,可以分为直链烷烃、支链烷烃和环烷烃。
直链烷烃由一条直线状的碳链构成,而支链烷烃则具有侧链连接到主链上的结构。
烷烃

