环烷烃的物理性质共94页
环烷烃1ppt课件

环辛烷 环壬烷 环癸烷
663.8 664.6 663.6
环十四烷 658.6 环十五烷 659.0
对比:开链烷烃每个CH2的燃烧热:658.6 KJ/mol
稳定性: 普通环 > 中环:> 小环
环的张力越小,相应的环烷烃越稳定。
环丙烷的结构: CH3
H
H
C
C H 2 1 0 9 .5 ° CH3
HC H
➢ 相同环连结时,可 用词头“联”开头。
顺反异构体:
由于环状结构,环烷烃有两个侧面:“上”方和“下” 方。因此,取代环烷烃可能存在同分异构现象。例如,有两 个1,3-二甲基环戊烷同分异构体:一个异构体的两个甲基在 环的同侧,另一个异构体的两个甲基在环的两侧。两个异构 体都是稳定的化合物。
CH3 CH3
➢ 了解三元和四元环化合物的活性,掌握相应的特殊化学性质。 ➢ 掌握环丙烷和环丁烷的结构特点(有角张力)和构象。 ➢ 了解并掌握环戊烷的构象。
➢ 掌握几种类型环烷烃(普通环烷烃、桥环烃和螺环烃)的命名
方法。
课后练习:p61 (一)、(十)
3 CH3CHCH2CH3
1
主要产物
H2 / Pt, 120oC or Ni, 200oC
CH3CH2CH2CH3
支链多 较稳定
➢ 小环化合物与卤素的反应
Br2 / r.t. Cl2 / FeCl3
Br2 / r.t.
Br Br CH2CH2CH2CH2
(离子型) 加成反应
不反应(难开环)
C H 4 + 2 O 2 C O 2 + 2 H 2 O + 燃 烧 热
环烷烃的燃烧热数据
小 C3 环 C4
普 C5 通 环 C7
第3章 环烷烃(武汉大学化学与分子科学学院)

饱和脂环烃— 饱和脂环烃—环烷烃 脂环烃 不饱和脂环烃—环烯烃、 不饱和脂环烃—环烯烃、环炔烃
环丙烷
环丁烷
环戊烷
环己烷
环戊二烯
环己烯
环辛炔
2
目录
3-1 3-2 3-3 3-4 3-5 小结 环烷烃的结构、分类、 环烷烃的结构、分类、异构和命名 环烷烃的稳定性与环大小的关系 环己环及其衍生物的构象 环烷烃的物理性质 环烷烃的化学性质 环烷烃的
5
环烷烃的分类 环烷烃的分类
单环 1. 按环数 二环 多环
小环( 小环(C3-C4) ) 普通环( 普通环(C5-C7) ) 中环( 中环(C8-C11) ) 大环( 大环(> C12) )
螺环:两环共用1 螺环:两环共用1个碳 2. 按环的 连接方式 螺[4.5]癸烷 癸烷 桥环: 桥环:共有两个或三个 以上的碳原子
22
环戊烷的构象:环戊烷具有信封式的构象,键角 戊烷的构象 环戊烷具有信封式的构象,
6
环烷烃的异构: 环烷烃的异构:构造异构和立体异构
构造异构: 1. 构造异构:由于环的大小及取代基位置的不同而有各 种构造异构体。 种构造异构体。 三元环最简单,无构造异构体。 ① 三元环最简单,无构造异构体。 含四个碳原子的单环烃( ),仅有 构造异构体: 仅有2个 ② 含四个碳原子的单环烃(C4H8),仅有 个构造异构体:
命名时,从桥头碳原子开始编号,从最长桥编到另一桥头碳; 命名时,从桥头碳原子开始编号,从最长桥编到另一桥头碳; 然后沿次长桥回到第一个桥头碳; 然后沿次长桥回到第一个桥头碳;再按桥渐短的次序将其余的桥 编号;按所含碳原子的总数,称为某烷。还要标明取代基的位置, 编号;按所含碳原子的总数,称为某烷。还要标明取代基的位置, 数目,名称,所含环的数目,桥的长短。 数目,名称,所含环的数目,桥的长短。
环烷烃的性质

环烷烃的性质
常见环、中环和大环环烷烃较稳定,化学性质与链状烷烃相似,与强酸(如硫酸)、强碱(如氢氧化钠)、强氧化剂(如高锰酸钾)等试剂都不发生反应,在高温或光照下能发生自由基取代反应;小环环烷烃环丙烷和环丁烷不稳定,除可以发生自由基取代反应,易开环发生加成反应(additionreaction)。
1.自由基取代反应
环烷烃与烷烃相似,在光照或高温条件下,可发生自由基取代反应。
例如:
2.加成反应
(1)加氢
在催化剂Ni的作用下,环烷烃可进行催化加氢反应,加氢时环烷烃开环,碳链两端的碳原子与氢原子结合生成烷烃。
(2)加卤素、氢卤酸
★环丙烷在常温下,能与卤素或氢卤酸发生加成反应。
例如:
★环丁烷在加热条件下,也可以与卤素或氢卤酸发生加成反应
★环戊烷、环己烷及高级环烷烃不能发生加成反应。
当环丙烷的烷基衍生物与氢卤酸作用时,碳环开环多发生在连氢原子最多和连氢原子最少的两个碳原子之间。
氢卤酸中的氢原子加在连氢原子较多的碳原子上,而卤原子则加在连氢原子较少的碳原子上。
例如:
小结:环丙烷的性质很活泼,易开环发生加成反应;环丁烷的活性较环丙烷弱,可以开环发生加成反应,只是条件较环丙烷强烈;环戊烷、环己烷及高级环烷烃的化学性质则与开链烷烃相似,环比较稳定难发生开环加成反应。
另外,环烷烃同链状烷烃一样可以发生自由基取代反应。
第二章 第二节环烷烃
构象越稳定; 环上取代基不同时,大的取代基占据e键的构
象稳定
2.8 环烷烃的物理性质
脂环烃的物理性质:环烷烃的分子结构比链烷烃 排列紧密,所以,熔点、沸点、相对密度比相 应的烷烃高
大环、中环化合物的化学性质与相应的链烷烃 类似
2.9 环烷烃的化学性质 一、催化氢化
+ Ni
H2 80℃ CH3CH2CH3
Ni
+ H2 200℃ CH3CH2CH2CH3
+ H2
Pt 300℃
CH3CH2CH2CH2CH3
四元环比三元环稳定,五元以上的环烷难于开环
二、加卤素或卤化氢,常温限于三元环反应,加 成符合不对称加成规则
+ CCl4
Br2
BrCH2CH2CH2Br
+ H2O
环烃
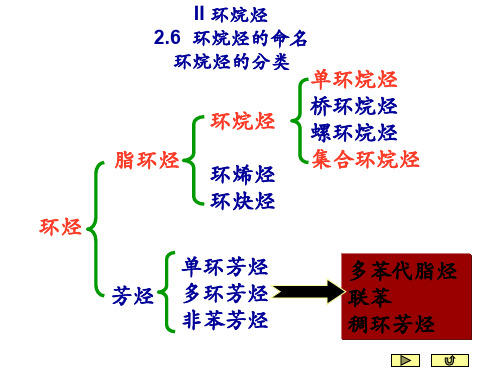
II 环烷烃
2.6 环烷烃的命名
环烷烃的分类
单环烷烃
环烷烃
桥环烷烃 螺环烷烃
脂环烃 环烯烃 集合环烷烃
环炔烃
单环芳烃
芳烃 多环芳烃 非苯芳烃
多苯代脂烃 联苯 稠环芳烃
性质与脂肪烃相似的环烃,叫做脂环烃
环烷烃命名的规则
以碳环为母体,侧链为取代基 母体的名称同直链烷烃,不同在于前加一“环” 取代基的位置用阿拉伯数字表示 编号以取代基的位置最小为原则 连有不同取代基时,根据次序规则,较优基团给以较
环己烷的船式构象
180 pm
• 碳原子的键角近四面体,但船头的氢原子存在较大的 van der Waals (范德华)力.
• 一般情况下,以椅型存在
环己烷的12个键可划分 为两组
直立键(axial)-a键
第3章 烷烃和环烷烃的性质与制备

进一步分析第(2)步和第(3)步的反应活化能可知:第一部的活化能 为+16.5kJmol-1,而第三步的活化能只有+ 8.3kJmol-1,因此,第(2)步是慢 步骤,是甲烷氯化反应中决定反应速度的步骤。下图是甲烷氯代生成氯甲烷反应 的能量变化图。
过渡态I 过渡态II
势
E1
E2
能
CH3 +Cl2 △ H1
3.3 烷烃卤代反应的反应机理 3.3.1 甲烷氯代反应的机理 3.3.2 活化能和过渡态 3.3.3 卤素对甲烷的相对反应活性 3.3.4 卤代反应的相对活性与烷基自由基的稳定性
3.1 烷烃和环烷烃的物理性质
3.1.1 烷烃的物理性质
有机化合物的物理性质,通常指的是在常温、常压下的状态、熔点、沸点、
36%
实验结果表明,烷烃氯代反应的相对活性为:叔氢:仲氢:伯氢 = 5:4:1,
溴代反应的相对活性为:叔氢:仲氢:伯氢 = 1600:82:1。
卤素对烷烃的相对反应活性为:F2 > Cl2 > Br2 > I2
3.3 烷烃卤代反应的反应机理
3.3.1 甲烷氯代反应的机理
反应机理是指化学反应所经历的途径或过程,也称为反应历程。
CH4 + Cl
△ H2
E1 = + 16.7KJ mol -1 △ H1 = + 4.1KJ mol -1 E2 = + 4.2KJ mol -1 △ H2 = 109KJ mol -1
CH3Cl + Cl 0
反应进程
CH4和Cl·生成CH3Cl反应进程能量变化曲线
3.3.3 卤素对甲烷的相对反应活性
△ H1 = 41.8 KJ.mol -1 E1 = 12.6 KJ.mol -1
环烷烃

H H H H H H H H H H H H
偏离109.5o
C-H 重叠
环己烷碳架是折叠的
H H
3
H
2
H
1
H H
H H
3
4 2
H H
1
H H
6
H H
4
5 H
6
H H
5
H
H H
H
C2, C3, C5, C6 共平面
H
H
椅式构象 (chair form)
船式构象 (boat form)
(打开一根 C-C 键)
H 2 / Pt, 50 o C
3 1
CH 3
3
CH 2 CH 3
or N i, 80 o C
C H 3 C HC H 2 C H 3
1
支链多 较稳定
主要产物
H 2 / Pt, 120 o C or N i, 200 C
o
CH 3 CH 2 CH 2 C H 3
小环化合物与卤素的反应
3-甲基-4-环丁基庚烷 4-cyclobutyl-3-methylheptane
2 1 1'
2'
环可作为取代基
3'
(称环基) 相同环连结时,可
3
联环丙烷 bicyclopropane
用词头“联”开头。
桥环烃(Bridged hydrocarbon)的命名
桥头间的碳原子数
2 1 3 4 5
小 环
C3 C4 C5 C7
环丙烷 环丁烷
697.1 686.1
中 环 大 环
C8 C11 C12
(完整版)胡宏纹第四版有机化学-第三章-环烷烃(上下)

环己烷的构象 椅式、半椅式、船式和扭船式
(a)椅式 (b)半椅式 (d)船式 (c)扭船式
半椅式:张力最大,势能最高 椅式构象是优势构象:势能最低,占环己烷全部构象的
99.99%
❖环己烷构象的势能关系:
半椅式
E
46kJ·mol-1
扭船式 30kJ·mol-1
23kห้องสมุดไป่ตู้·mol-1
❖半椅式构象:
H
CH3CH2CH2CH3
+
H2
Pt 3300C以上
CH3(CH2)3CH3
B:与卤素加成
三元环与X2, HX在常温下即可发生开环反应, X2, HX于常温下不
使四,五员环开环,但加热后,可发生取代反应。
CH2CH2CH2
+ Br2
rt
Br Br
FeBr3
光照 + Br2
+ Br2
3000C
+ HBr
Br
Br + HBr
CH2CH2Br
+ Br2
rt
Br
FeBr3
C: 与卤化氢加成
+ HBr
CH3CH2CH2Br
+ HBr
CH3CHCH2CH3
Br
规律:环丙烷衍生物与HX加成时,环的破裂处发生在
连接烷基最多的和最少的碳原子间,加成时产
物符合马氏规则,卤素加在含H较少的C上,H
加
在含H较多的C上。
香蕉键
环丙烷分子中 轨道部分重叠
开链或较大脂环化合物 中轨道可达到最大重叠
❖环丙烷分子相邻碳上的碳氢键都是重叠式构象。 扭转张力:试图恢复交叉式构象的力。
2 其他环烷烃
烷烃与环烷烃的结构与性质

烷烃与环烷烃的结构与性质烷烃与环烷烃是有机化合物中的两类基本结构类型,它们在碳原子间的连接方式以及分子结构上存在着明显的差异,这也导致了它们在性质上的显著区别。
下面将就烷烃和环烷烃的结构与性质进行详细讨论。
1. 烷烃的结构与性质烷烃是一类碳氢化合物,其分子中只包含碳碳键和碳氢键,没有其他官能团。
烷烃根据碳原子之间的连接方式可以分为直链烷烃和支链烷烃两种。
直链烷烃的一般分子式为CnH2n+2,其中n为大于等于1的整数。
直链烷烃的碳原子按照链状排列,最简单的直链烷烃为甲烷,其分子式为CH4。
直链烷烃的性质主要取决于其分子量和分子结构,通常是无色、无味、无毒的气体或液体,具有较好的燃烧性能。
支链烷烃是指在碳原子链上存在支链或分支结构的烷烃,例如异构的正丁烷和2-甲基丁烷。
支链烷烃的性质通常比直链烷烃具有较强的空间立体结构,因此支链烷烃的沸点、密度、熔点等性质会与直链烷烃有所不同。
2. 环烷烃的结构与性质环烷烃是一类碳氢化合物,其分子结构中存在一个或多个碳原子环。
根据不同的碳环数目,环烷烃可以分为环丙烷、环戊烷等不同类型。
环烷烃的分子式通常为CnH2n,其中n为大于等于3的整数。
环烷烃由于分子结构上存在环状碳骨架,因此其性质与烷烃有较大差异。
环烷烃通常具有较高的沸点和熔点,且不易溶于一般有机溶剂。
环烷烃中的环状结构会影响其立体构型和空间结构,因此环烷烃也具有较强的立体异构性。
环烷烃的立体异构性在有机合成反应中具有重要的意义,常被用于合成一些特定结构的有机物。
综上所述,烷烃与环烷烃在结构与性质上存在着明显的差异,了解烷烃与环烷烃的结构与性质不仅有助于理解有机化合物的基本特征,还能为有机合成反应的设计与调控提供重要参考。
