物质分类
初三化学复习 物质的分类

纯净物:化合物无机化合物酸碱盐
化合物:由不同种元素组成的纯净物。 举例: 无机化合物:碱(金头碱尾) 1.可溶碱:NaOH、Ca(OH)2、KOH、Ba(OH)2
NH3·H2O等
2.不溶碱:Cu(OH)2↓、Fe(OH)3↓、Mg(OH)2↓、Al(OH)3↓等
纯净物:化合物无机化合物酸碱盐
化合物:由不同种元素组成的纯净物。 举例: 无机化合物:盐(金头酸尾) 1.可溶盐:NaCl、Na2CO3、NaHCO3、CaCl2、BaCl2、
纯净物:化合物无机化合物氧化物
化合物:由不同种元素组成的纯净物。 举例: 无机化合物:氧化物(两种元素的化合物,其中有O) 1.金属氧化物:CaO、CuO、Fe2O3、Fe3O4等 2.非金属氧化物:CO2、CO、H2O、H2O2、SO2等
纯净物:化合物无机化合物酸碱盐
化合物:由不同种元素组成的纯净物。 举例: 无机化合物:酸(氢头酸尾) 1.含氧酸:H2SO4、HNO3、H2CO3、H3PO4等 2.无氧酸:HCl、H2S、HF等
初三化学复习——物质的分类
JC 2021.1.31
物质的分类
物质
混合物 纯净物
Байду номын сангаас
单质 化合物
金属单质 非金属单质 稀有气体单质
有机物 无机物
有机小分子化合物 有机高分子化合物
氧化物 酸碱盐
混合物
混合物:由两种或两种以上的物质混合而成的物质。 举例: 粗盐、煤、石油、天然气、合金、溶液、空气等
纯净物:单质
单质:由同种元素组成的纯净物。 举例: 1.金属单质:Fe、Cu、Al、Hg等 2.非金属单质:C、P、S、O2、H2、N2等 3.稀有气体单质:He、Ne、Ar等
化学1必修2.1《物质的分类》教案

第二章化学物质及其变化第一节物质的分类一、简单分类法及其应用教学目标1.了解化学科学的主要研究对象,知道化学是在分子层次上认识物质和合成新物质的一门科学。
2.初步认识物质的科学分类方法,学会从不同角度(尤其是物质的组成和性质角度)对常见物质进行分类。
认识分类等科学方法对化学研究的作用,能尝试运用比较、分类的方法对信息进行加工。
教学重点、难点物质的分类方法;物质之间的转化规律。
教学时数1课时教学过程导入在同学们眼中,什么是化学?物质世界是怎样的呢?我们都知道,巧克力是情人节的首选礼物,这是为什么呢?经研究,发现在巧克力中含有一些物质,食用后能令人产生愉悦的感觉,这样的氛围中,爱人更加可爱。
这就是为什么要送巧克力了。
再如臭脚丫,那种气味可不敢恭维,是什么物质如此难闻呢?原来是一种叫做“硫醇”的物质作怪,硫醇的结构与我们学过的乙醇相似,只是其中的氧换成了硫。
化学家研究了硫醇,又利用其特殊的气味,将其少量添加到无色无味的煤气中去。
这样万一煤气泄漏,我们就能闻到其气味了。
化学世界绚丽多彩,千姿百态,目前已知物质的种类超过千万种,每年还有大量新物质不断被合成出来。
这么多的物质,我们该如何去认识呢?一种一种地去学习,现实吗?化学家们将众多的物质进行分类研究,揭示出其内在的规律。
每一类物质的组成、结构和性质有相似之处,有利于我们通过类比的方法进行学习和研究。
下面请看一些你生活中物质的分类——播放PPT——各种分类。
板书物质的分类1. 分类:把某些特征相似的事物归类到一起的方法。
试想想:没有分类的世界会怎样?板书并讲述2.分类的目的和意义:能够提高人们工作、学习的效率,使人们更快更便捷地达到目的。
交流与讨论请大家用已有知识对上述概念进行分类,并用图示把这些概念的相互关系表示出来。
按一定的依据对教材P25“交流与讨论”的物质进行分类。
引导得出结论:可以从不同的角度、用不同的标准对物质进行分类。
非均匀混合物:混合物均匀混合物:非金属单质:按组成分单质金属单质:纯净物有机化合物:纯净物化合物氧化物:酸:无机化合物碱:盐:……问题解决根据物质的组成对下列物质进行分类。
1.物质的分类

单 质
非金属
稀有气体单质 He等
化 合 物
酸碱盐源自氧化物酸:电离出阳离子全是氢离子的化合物。
一元酸 氢离子 个数 二元酸 多元酸
HCl
H2SO4 H3PO4磷酸
CH3COOH醋酸
酸 酸性 强弱
六大强酸
HCl氢氯酸
HBr氢溴酸 H2SO4
H2SO3
HI氢碘酸
HNO4
H2S硫氢酸
HClO4高氯酸 H2CO3 HClO 次氯酸
……
氧化物:由两种元素组成,其中一种元素是氧元素的化合物。
金属氧化物 从组成 元素分 氧化物 成盐氧化物 从性质分
非金属氧化物
不成盐氧化物 特殊氧化物
CO、NO Na2O2、H2O2 、KO2
酸性氧化物 成盐氧化物 碱性氧化物 两性氧化物
与碱反应生成盐和水的氧化物。CO2、SO2、P2O5 与酸反应生成盐和水的氧化物。Fe2O3 与酸和碱反应生成盐和水的氧化物。Al2O3
张继科 福原爱 科比 乔丹 宁泽涛 傅园慧 罗纳尔多 贝克汉姆
外国
乒乓球 篮球 游泳 足球
分类法 交叉分类法
Na2CO3 Na2SO4 K2SO4 K2CO3
钠 盐 钾 盐 硫酸盐 碳酸盐
1、树状分类法:
对同类事物进行再分类.
金属
Cu、Fe等 C、H2等
化 学 物 质
纯 净 物
混 合 物
无 机 物 有 机 物
科学探究 课本P26页
将烧杯中的蒸馏水加热至沸腾, 向沸水中加入5~6滴FeCl3饱和溶液。
1.取3个小烧杯,分别加入25ml蒸馏水、25mlCuSO4溶液和25ml泥水。
继续煮沸至液体呈红褐色,停止加热。
高三化学课件《物质的分类》

你
• 夏天
•四
• 冬天 • 七
的 记
• 数学
忆
•三
• 液体
• 物理
• 秋天
力
•六
看看你能说出多少内容???
• 气体 • 液体 • 固体
• 春天 • 夏天 • 秋天 • 冬天
•三
•四
•五 •六
•七
• 语文 • 数学 • 英语 • 物理 • 化学 • 生物
新知讲解
知识点1、分类及分类的意义 1、分类把某些特征相似的事物,按照一定标准归类到一起; 2、意义:能提高人们工作、学习效率,使人们更快更便捷的达到目的。
液
固 珍珠(包藏着水的碳酸
固
固 钙 有)色玻璃、合金
分散质 气
液 固
分散剂 气
液 固
溶液、胶体、浊液的区分 当分散剂是水或其他液体时,按照分散质粒子的大小来分:
分散系
溶液
浊液
胶体
悬浊液
乳浊液
溶液、胶体、浊液的区分
胶体
浊Hale Waihona Puke 1n溶m100n m
液 分散质粒子直径
液
可以通过滤纸
三者本质特征比较: 胶体是以粒子直径的大小为本质特征的
酸与碱反应
NaOH + HCl == NaCl + H2O
酸与某些盐反应
HCl + AgNO3 == AgCl↓ + HNO3
新课讲解
碱的主要化学性质
①碱可以与非金属氧化物反应 ②碱可以与酸反应 ③碱可以与某些盐反应 ④碱可以使酚酞试剂变红,使紫色石蕊试剂变蓝反应
注:“碱”是在水溶液中电离时产生的阴离 子都是氢氧根离子的化合物。
知识点2、分类方法
高中化学物质的分类最全汇总

高中化学物质的分类最全汇总!一、混合物混合物是由两种或两种以上物质混合而成的物质。
i.分散系:溶液、胶体、浊液等ii.高分子化合物:蛋白质、纤维素、淀粉、塑料等iii.其他物质:石油及其各种馏分、天然气、油脂、福尔马林、氨水、王水、碱石灰等二、纯净物纯净物与混合物相对,是由一种物质组成,有固定的物理性质和化学性质的物质。
纯净物有专门的化学符号,能用一个化学式表示。
继续细化纯净物的组成可将其分为:1.单质是由同一种元素组成的纯净物。
i.金属单质:例如:K、Ca、Na、Mg、Al 等ii.非金属单质:例如:S、Cl2、He 等i.只含一种元素的物质不一定是纯净物。
如氧气O2 和臭氧O3 混合得到的物质是混合物ii.同种元素的同位素单质混合得到的物质是纯净物。
如氢的同位素氕氘氚组成的双原子分子 H2、D2、T2 混合在一起得到的是纯净物iii.含水的物质不一定是混合物。
如胆矾CuSO4 • 5H2O、绿矾FeSO4 • 7H2O、明矾KAl(SO4)2 •12H2O 都是纯净物2.化合物是由两种或两种以上的元素组成的纯净物。
A. 按化合物的性质分类①氧化物氧元素与另外一种化学元素组成的二元化合物叫做氧化物。
氧化物可分为:酸性氧化物指与水反应生成相应价态的酸,或与碱反应只生成一种相应价态的盐和水的氧化物。
•例如:SO2、SO3、P2O5、SiO2、Mn2O7 等注意:i.酸性氧化物不一定是非金属氧化物。
如高锰酸酐Mn2O7 既是酸性氧化物,又是金属氧化物ii.非金属氧化物不一定是酸性氧化物。
如一氧化碳CO、一氧化氮NO、二氧化氮NO2 都是不成盐氧化物iii.酸性氧化物不一定能与水反应生成相应的酸。
如二氧化硅SiO2 不与水反应iv.能与碱反应生成盐和水的氧化物不一定是酸性氧化物。
如二氧化氮NO2 是不成盐氧化物,氧化铝Al2O3 是两性氧化物v.酸性氧化物一定是酸酐,但酸酐不一定是酸性氧化物。
如乙酸酐CH3COOOCCH3 含有三种元素,不是氧化物,故不是酸性氧化物碱性氧化物指与水反应生成相应价态的碱,或与酸反应只生成一种相应价态的盐和水的氧化物。
物质分类方法名称

物质分类方法名称
以下是 7 条关于物质分类方法名称及例子:
1. “直观分类法”呀!就像把玩具按颜色分放一样,咱看一眼就能大概知道这东西该归到哪一类。
比如说家里的餐具,盘子放一堆,碗放一堆,这不就是直观分类嘛!
2. “性质分类法”,嘿!这不就像把同学分成调皮的和乖巧的嘛!比如说金属和非金属,就是根据它们的性质来分类的呀,多简单易懂!
3. “用途分类法”,哇塞,这就好比把工具按照是用来敲的、拧的还是割的来分。
像药物,有的是治感冒的,有的是消炎的,不就是按用途分类嘛!
4. “成分分类法”,哎呀呀,不就跟把面包按照面粉占比多少来分一样嘛!像合金,根据里面各种金属成分的不同来分类,有意思吧!
5. “状态分类法”,哈哈,这就像把人按照开心和不开心来分。
物质可以分成固态、液态、气态呀,水是液态,冰是固态,这多明显呀!
6. “来源分类法”,嘿呀,这不就像把朋友分成学校里认识的和外面认识的嘛!比如木材来自树木,石油来自地下,按来源分类就是这么直接!
7. “工艺分类法”,哇哦,就像把画画分成水墨画和油画一样呀。
像钢铁的生产工艺不同,就可以这样来分类,是不是很好玩呀!
我觉得这些分类方法真的超级有趣而且实用,能帮助我们更好地认识和理解各种物质呢!。
1物质的分类 (共43张PPT)

考点突破1 物质的分类
【例1】下列物质的分类中不正确的是( B ) A.单质:液氧、水银、金刚石 B.混合物:生铁、冰水、空气 C.盐:硝酸银、氯化铁、高锰酸钾 D.氧化物:氧化镁、三氧化硫、五氧化二磷
2020/2/26
考点突破1 物质的分类
方法规律: (1)纯净物和混合物的判别,关键要看这种物质由几种物 质组成,只由一种物质组成的是纯净物,由两种或两种 以上物质混合而成的是混合物。
(2)单质和化合物的判别,首先分析是不是纯净物(这点 往往容易被忽略),然后再判断组成物质的元素种类。从 微观的角度来看,单质和化合物都只存在一种分子,但 单质分子由一种原子构成,而化合物分子由两种或两种 以上的原子构成。区分它们最好的方法就是根据化学式 来判断。
2020/2/26
考点突破1 物质的分类
纯净物
区别
①宏观组成:由 _两__种__或__两__种__以__上__ 物质 组成;
①宏观组成:由 __一__种_____ 物质组 成;
纯净物
②微观构成:由
②微观构成:由
混__合_多_物_____ 种微粒构成; __一_______ 种微粒
构成;
2020/2/26
考点突破1 纯净物和混合物
混合物
纯净物
2020/2/26
考点梳理2 单质与化合物
3.化合物:由__两__种__或___两__种__以__上___的元素组成的纯净 物,如:H2O,KClO3等
化合物主要分为有机化合物和无机化合物。 (1)有机化合物是含___碳____元素的化合物。(2012、 2013、2014年结合化学式计算进行考查) (2)无机化合物是不含__碳____元素的化合物。但有些 含碳化合物也属于无机物,包括CO、CO2、H2CO3、 Na2CO3(碳酸盐)和NaHCO3(碳酸氢盐)等。
《物质的分类》学案
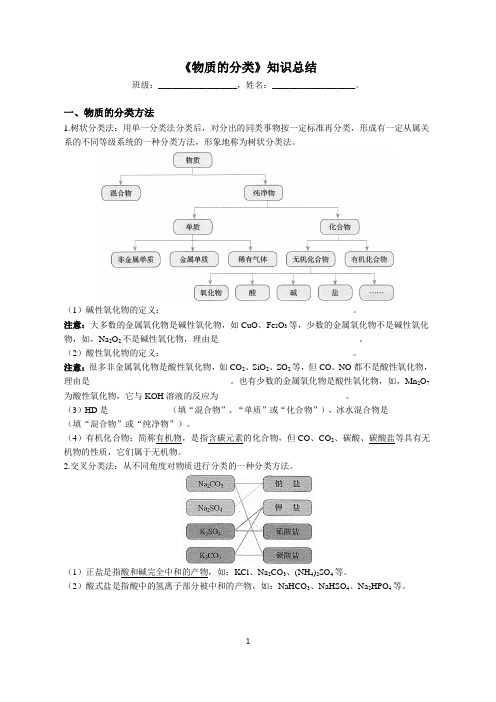
《物质的分类》知识总结班级:__________________,姓名:___________________。
一、物质的分类方法1.树状分类法:用单一分类法分类后,对分出的同类事物按一定标准再分类,形成有一定从属关系的不同等级系统的一种分类方法,形象地称为树状分类法。
(1)碱性氧化物的定义:___________________________________________。
注意:大多数的金属氧化物是碱性氧化物,如CuO、Fe2O3等,少数的金属氧化物不是碱性氧化物,如,Na2O2不是碱性氧化物,理由是________________________________。
(2)酸性氧化物的定义:___________________________________________。
注意:很多非金属氧化物是酸性氧化物,如CO2、SiO2、SO2等,但CO、NO都不是酸性氧化物,理由是________________________________。
也有少数的金属氧化物是酸性氧化物,如,Mn2O7为酸性氧化物,它与KOH溶液的反应为_____________________________。
(3)HD是______________(填“混合物”、“单质”或“化合物”),冰水混合物是__________ (填“混合物”或“纯净物”)。
(4)有机化合物:简称有机物,是指含碳元素的化合物,但CO、CO2、碳酸、碳酸盐等具有无机物的性质,它们属于无机物。
2.交叉分类法:从不同角度对物质进行分类的一种分类方法。
(1)正盐是指酸和碱完全中和的产物,如:KCl、Na2CO3、(NH4)2SO4等。
(2)酸式盐是指酸中的氢离子部分被中和的产物,如:NaHCO3、NaHSO4、Na2HPO4等。
二、分散系1.分散系的组成2.分散系的分类(1)按分散质粒子直径的大小可把分散系分为溶液、胶体和浊液。
可用如下方式直观地表示:(2)按分散质或分散剂的状态分类,可分为9种分散系,如图:烟属于固气分散系;雾属于液气分散系;悬浊液属于固液分散系;乳浊液属于固液分散系;合金属于固固分散系。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物质分类
混和物(含多种组分(即多种纯净物),没有固定的组成,没有固定的熔点和沸点。
金属单质
物质单质
非金属单质
纯净物(含一种组分)
有机化合物氢化物
化合物氧化物
无机化合物酸
碱
盐
从宏观组成分析:物质——————元素(只论种类不论个数)
聚集总称
从微观结构分析:分子——————原子(既论种类又论个数)
表述物质的组成时,必须是宏观对宏观,微观对微观。
如:硫酸是由氢元素、硫元素和氧元素组成的。
(宏观组成观点)
一个硫酸分子是由二个氢原子、一个硫原子和四个氧原子组成的。
(微观结构观点)一、元素
(一)定义:具有相同核电荷数(质子数)的一类原子(含简单离子)的总称
(二)分类:
金属元素:名称
符号
非金属元素:
氢,硼,碳、硅,氮、磷、砷,氧、硫、硒、碲,氟、氯、溴、碘、砹,
氦、氖、氩、氪、氙、氡。
写出1—20号元素的名称和符号:
二、单质
(一)定义:
(二)分类
金属单质:和。
和。
单原子分子:
双原子分子:
三原子分子:
非金属单质四原子分子:
多原子复杂分子:
原子晶体:
三、化合物
1.定义:。
2.化合物的化学式书写规则:化合价交叉相约(先相约后交叉)
(一)氧化物
1.定义:。
2.分类
(1)根据组成元素的种类来分
金属氧化物:。
非金属氧化物:。
过氧化物(含过氧根:O22—):过氧化钾、过氧化钠、过氧化钙、过氧化氢(俗称双氧水)
化学式:、、、。
(2)根据性质来分:
碱性氧化物
成盐氧化物两性氧化物
氧化物酸性氧化物
不成盐氧化物。
化学通性
1.碱性氧化物+水→(可溶性)碱
碱性氧化物2.碱性氧化物+酸→盐+水
3.碱性氧化物+酸性氧化物→含氧酸盐
1.酸性氧化物+水→含氧酸
酸性氧化物2.酸性氧化物+碱→盐+水
3.酸性氧化物+碱性氧化物→含氧酸盐
(二)氢化物
1.定义:。
2.分类
离子型氢化物(固态)NaH、KH、CaH2。
氢化物
共价型氢化物(气态)
(三)酸
1.定义:电离时生成的阳离子全部是H+的一类化合物叫做酸。
(二)分类:无氧酸含氧酸
一元酸
酸二元酸
三元酸
命名氢某酸某酸
高正亚次正偏
HClO4HClO3HClO2HClO H3PO4HPO3
(1)根据电离时产生H+的程度
强酸
酸中强酸
弱酸。
(2)根据酸根阴离子的氧化性和还原性
氧化性酸
酸
还原性酸。
(3)根据酸的熔沸点高低
挥发性酸(低沸点酸)
酸
不挥发性酸(高沸点酸)。
(4)根据稳定性
稳定性酸
酸
不稳定性酸。
(四)碱
(一)定义:电离时产生的阴离子全部是OH-的一类化合物叫做碱。
(二)分类可溶性碱
碱氨水(NH3·H2O)
难溶性碱
(五)盐
1.定义:
2.分类:无氧酸盐含氧酸盐
正盐
盐酸式盐
碱式盐
命名某化某某酸某
(1)硝酸盐(NO3-):硝酸铵、硝酸钾、硝酸钠、硝酸银、硝酸镁、硝酸钙、硝酸钡、硝酸锌、
硝酸亚铁、硝酸铅、硝酸铜、硝酸汞、硝酸铝、硝酸铁。
(A)溶解性:
(B)颜色:
(2)盐酸盐(Cl-):氯化铵、氯化钾、氯化钠、氯化银、氯化镁、氯化钙、氯化钡、氯化锰、
氯化锌、氯化亚铁、氯化铅、氯化铜、氯化汞、氯化铝、氯化铁、四氯化锡。
(A)溶解性:
(B)颜色:
(3)硫酸盐(SO42-):硫酸铵、硫酸钾、硫酸钠、硫酸银、硫酸镁、硫酸钙、硫酸钡、硫酸锰、
硫酸锌、硫酸亚铁、硫酸铅、硫酸铜、硫酸汞、硫酸铝、硫酸铁。
(A)溶解性:
(B)颜色:
(4)碳酸盐(CO32-):碳酸铵、碳酸钾、碳酸钠、碳酸银、碳酸镁、碳酸钙、碳酸钡。
溶解性:只有钾、钠、铵才溶。
碳酸氢铵、碳酸氢钠、碳酸氢镁、碳酸氢钙。
酸式碳酸盐全部可溶。
(5)磷酸盐(PO43-)
正盐
一氢盐
二氢盐
(6)金属硫化物(氢硫酸盐S2-)
a.(NH4)2S、K2S、Na2S——溶于水
b.MgS、CaS、BaS、Al2S3——溶于水并完全水解
如:Al2S3+6H2O=↓2Al(OH)3+3H2S↑
c.FeS(黑色)、ZnS——难溶于水但溶于酸。
d.Ag2S、PbS、CuS(均为黑色)——既不溶于水也不溶于酸。
7.其它的盐:、KClO3、KMnO4、K2MnO4、Na2CO3、Na2SO3、Na2SiO3、NaClO、Ca(ClO)2、NaAlO2、硫代硫酸钠:、苯酚钠:。
