高级生化技术 1
关于高级高中生物选修一生物技术实践知识点总结归纳

关于高级高中生物选修一生物技术实践知识点总结归纳高中生物选修一是生物技术实践的专业课程。
生物技术实践是指通过应用生物学知识和技术手段,解决生物学领域中的科学问题或开展生物学研究。
以下是关于高级高中生物选修一生物技术实践的知识点总结归纳:1.细胞培养技术:细胞培养是指将离体细胞和组织在培养基上,通过提供适宜的培养条件,使其继续生长和分化的技术。
细胞培养技术常用于生物学研究、药物研发、组织工程等领域。
2.PCR技术:PCR(聚合酶链反应)是一种体外扩增DNA序列的技术,可用于从少量DNA样本中扩增出足够的数量用于分析。
PCR技术常用于DNA测序、基因突变检测、疾病诊断等领域。
3. DNA测序技术:DNA测序是指确定DNA序列的技术。
常用的DNA测序技术包括Sanger测序和高通量测序。
DNA测序技术广泛用于基因组学研究、遗传病诊断和个体基因组分析等领域。
4.基因克隆技术:基因克隆是指将特定的DNA段从一个生物体中提取出来,放入另一个生物体中进行繁殖的技术。
常用的基因克隆技术包括限制酶切、连接酶切产物、转染等。
6.蛋白质表达与纯化技术:蛋白质表达与纯化是指通过转录和翻译过程,将基因转录成mRNA,然后mRNA被翻译成蛋白质,并对蛋白质进行纯化和分析的技术。
蛋白质表达与纯化技术常用于蛋白质结构和功能研究、蛋白质工程等领域。
7.基因芯片技术:基因芯片是一种高通量的基因检测技术,可以同时检测大量的基因表达水平。
基因芯片技术广泛应用于基因组学研究、转录组学研究和分子诊断等领域。
9.组织工程技术:组织工程是指利用细胞、生物材料和生物技术手段,重构、修复或替代组织和器官的技术。
组织工程技术常用于器官移植、组织重建等领域。
10.生物信息学技术:生物信息学是指应用计算机科学和信息科学的原理与方法,分析、存储和管理生物学数据的学科。
生物信息学技术常用于基因组学、蛋白质组学、基因表达谱分析等领域。
以上是关于高级高中生物选修一生物技术实践的知识点总结归纳。
2003秋季高级生化技术教程-精品文档
a 取下双侧肾脏,放入消毒培养皿中
b 用吸管吸取PBS加入培养皿中,清洗肾脏3次,尽量去掉血污.
c 将肾组织用解剖剪剪成几块,再用PBS漂洗,去净血液为
例一 乳鼠肾细胞原代培养
胰蛋白酶消化 将洗净的组织块移入消毒小瓶中,用眼科剪剪切至0.5mm大 小的组织块。 加入5-8倍体积的0.25%胰蛋白酶,盖好放入37℃水浴中消
(三)设备和器皿
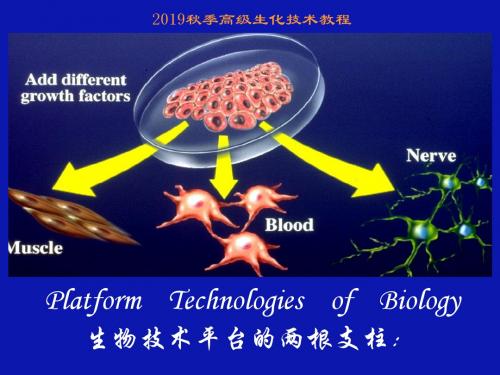
一、 细胞培养技术
(三)设备和器皿
一、 细胞培养技术
(四)方法与步骤
1、细胞培养的条件:
1) 无菌操作 2) 培养用液及配制 培养液、缓冲液、平衡盐、消化液、pH调节液等。(举例如何配制?) 3) 温度 人和哺乳动物35-37℃; 温水鱼类25-30℃;冷水鱼15-25℃。 4) 生长基质
例一 乳鼠肾细胞原代培养
细胞观察 培养细胞每天观察,检查:A.污染与否? B.细胞生长状态 如见培养液变为黄色且又混浊,为污染;如培养液为桔红色, 表明细胞状况良好。在无污染时,24h内有细胞贴壁,圆形悬浮 状的细胞延展成短梭状。 培养3-4天,细胞生长繁殖,可见细胞岛形成。细胞透明,颗 粒少,界线清。 由于细胞生长旺盛,代谢产物堆积,CO2增多, 培养液逐渐变酸呈黄色,但液体澄清,此时应换液。
如HeLa细胞的亚株HeLa229、S3,均有相同染色体标志,但对病毒敏感 性不同。
细胞克隆(cell cloning):从一个单一母细胞繁殖出来的细胞群体,细胞克
隆 方法包括:稀释铺板法、饲养层克隆法、琼脂克隆法等。
一、 细胞培养技术
(三)设备和器皿
1、常用设备和器皿
无菌室 超净工作台
恒温培养箱
一、 细胞培养技术
(二) 基本概念
3、细胞系(株)与细胞克隆 细胞株(cell strain): 具有特殊的生物学性状或标记,可分为:
高级生化考试重点

《高级生化》考试重点(II班动物方向)题型:名词解释10个、简述题5个、论述题2个。
第一章蛋白质结构与功能1. 蛋白质二级结构构象单元蛋白质的二级结构(secondary structure)是多肽链主链(backbone)在氢键等次级键作用下折叠成的构象单元或局部空间结构,未考虑侧链的构象和整个肽链的空间排布。
2. 超二级结构相邻的二级结构往往形成某种有规律的、空间上可辩认的、更高层次的折叠单元,称为超二级结构(super-secondary structure)或折叠单元(folding unit),主要涉及这些构象元件在空间上如何聚集。
3.结构域蛋白质分子中存在相对稳定的球状亚结构,其间由单肽链相互连接,命名为结构域。
二级结构和结构模体以特定的方式组织连接,在蛋白质分子中形成两个或多个在空间上可以明显区分的三级折叠实体。
结构域是蛋白质三级结构的基本单位,它可由一条多肽链(在单域蛋白质中)或多肽链的一部分(在多域蛋白质中)独立折叠形成稳定的三级结构。
■Domain性质小辑①介于二级与三级结构之间的分区单位。
一个蛋白质分子中的各个domains 都还是属于同一个蛋白质链,domain 与domain 间是以肽键连在一起,并没有断开。
②Domain 已经具有特定构象,是多肽链的独立折叠单位。
③结构域一般由100~200个残基构成,大小相当于直径约2.5nm 的球体。
④有些蛋白质只有一个domain,如myoglobin;大部分蛋白质含有两个domains,如hexokinase;部分蛋白质含有两个以上domains,如Ab 分子。
⑤一些具有不同功能的蛋白质可能具有某个相似的结构域。
如枯草杆菌蛋白酶、己糖激酶和磷酸化酶中都含有一个核苷酸结合的结构域。
■结构域运动每个结构域本身都是紧密装配的,结构域之间通过共价的、松散的肽链相联系。
由于这种牢固而又柔韧的连接方式,使得结构域可以作为一个整体,作较大幅度的相对运动。
高级生化实验讲义

实验一、转录增强因子在DNA转录中的调控作用– 16学时一.目的和要求1. 掌握转录增强因子对启动子控制下报告基因调控的工作原理,了解常见的报告基因种类及启动子种类。
2. 学习PCR克隆转录增强因子CRE,构建报告基因表达载体、细胞培养、细胞转染和荧光素酶活性检测技术。
二.基本原理报告基因 (reporter gene)是一种编码可被检测的蛋白质或酶的基因。
把它的编码序列和其它基因相融合形成嵌合基因,当在调控序列控制下进行表达时,利用报告基因的表达产物可以来标定目的基因的表达调控。
作为报告基因,在遗传选择和筛选检测方面必须具有以下几个条件:(1)已被克隆和全序列已测定;(2)表达产物在受体细胞中不存在,即无背景,在被转染的细胞中无相似的内源性表达产物;(3)其表达产物能进行定量测定。
在动物基因表达调控的研究中,常用的报告基因有氯霉素乙酰转移酶基因(cat)、β-半乳糖苷酶基因、荧光蛋白、荧光素酶基因等。
荧光素酶(Luciferase) 是生物体内催化荧光素或脂肪醛氧化发光的一类酶的总称。
自然界有许多发光生物, 1956年, McElroy 等首次从萤火虫中提取到荧光素酶, 此后各国研究人员相继报道了对各种发光生物中荧光素酶的研究。
萤火虫荧光素酶是分子量为60~64kD的多肽链,在Mg2+、ATP、O2存在时,催化D-荧光素(D-Luciferin)氧化脱羧,发出光(λ=550~580nm)。
荧光素酶作为新型报告基因,与传统报告基因相比,具有检测速度快、灵敏度比cat基因高30~1000倍、费用低、不需使用放射性同位素等优点,因此在基因工程方面得到了广泛的采用,同时荧光素酶在发光免疫分析及环境监测、微生物检测等方面的应用也愈来愈受到关注。
调控元件的选择依赖于特定的信号转导途径。
很多情况下,GPCRs的活化信号可通过特定的信号转导途径将信息传递至细胞核,调控特定基因的转录。
多种自然和合成的调控元件都广泛用于报告基因系统。
高级生化完整版

第1章蛋白质的结构与功能导言第一节蛋白质的分子组成一、组成人体蛋白质的20种氨基酸二、氨基酸可根据侧链结构和理化性质分类三、20种氨基酸具有共同或特异的理化性质四、蛋白质是由许多氨基酸残基组成的多肽链(一)氨基酸通过肽键连接而形成肽※(二)体内存在多种重要的生物活性肽:GSH、多肽类激素及神经肽第二节蛋白质的分子结构一、氨基酸的排列顺序决定蛋白质的一级结构※二、多肽链的局部主链构象为蛋白质二级结构▲△模体※三、在二级结构基础上多肽链进一步折叠形成蛋白质三级结构结构域分子伴侣四、含有二条以上多肽链的蛋白质具有四级结构五、蛋白质的分类※六、蛋白质组学概念技术平台意义导言:1.什么是蛋白质? 蛋白质(protein)是由许多氨基酸(amino acids)通过肽键(peptide bond)相连形成的高分子含氮化合物。
2. 蛋白质具有重要的生物学功能作为生物催化剂(酶)代谢调节作用免疫保护作用物质的转运和存储运动与支持作用参与细胞间信息传递3. 氧化供能第一节蛋白质的分子组成1. 组成蛋白质的元素主要有C、H、O、N和S。
有些蛋白质含有少量磷或金属元素铁、铜、锌、锰、钴、钼,个别蛋白质还含有碘2. 蛋白质元素组成的特点各种蛋白质的含氮量很接近,平均为16%。
由于体内的含氮物质以蛋白质为主,因此,只要测定生物样品中的含氮量,就可以根据以下公式推算出蛋白质的大致含量:100克样品中蛋白质的含量(g %) = 每克样品含氮克数×6.25×100一、组成人体蛋白质的20种氨基酸均属于L- -氨基酸存在自然界中的氨基酸有300余种,但组成人体蛋白质的氨基酸仅有20种,且均属L-氨基酸(甘氨酸除外)。
二、氨基酸可根据侧链结构和理化性质进行分类非极性脂肪族氨基酸极性中性氨基酸芳香族氨基酸酸性氨基酸碱性氨基酸几种特殊氨基酸脯氨酸(亚氨基酸)半胱氨酸胱氨酸三、20种氨基酸具有共同或特异的理化性质(一)氨基酸具有两性解离的性质两性解离及等电点氨基酸是两性电解质,其解离程度取决于所处溶液的酸碱度。
高级生化部分知识点

构建克隆时阳性克隆的筛选方法和基本原理阳性克隆:指的是外源目的基因与载体能够成功连接,并且目的基因能在载体中稳定复制、保存的重组子。
阳性克隆的筛选与鉴定可以从DNA、RNA和蛋白质三个不同的层次水平进行。
鉴定阳性克隆有许多方法,如抗性筛选、α互补筛选(蓝白斑)、插入失活表达筛选、噬菌斑筛选、杂交法筛选、免疫学筛选、酶切图谱鉴定、PCR鉴定等。
常用蓝白筛选,即抗性平板上出现白色菌落,说明连接的重组质粒被转化。
(原理:X-gal是5- 溴-4-氯-3-吲哚-b-D-半乳糖以半乳糖苷酶水解后生成的吲哚衍生物显蓝色。
IPTG 是异丙基硫代半乳糖苷为非生理性的诱导物,它可以诱导lacZ 的表达。
在含有X-gal和IPTG 的筛选培养基上,携带载体DNA的转化子为蓝色菌落,而携带插入片段的重组质粒转化子为白色菌落。
)根据蓝白的比例可以判断重组率,根据菌落数目可以计算出转化率。
挑选白色集落后摇菌,再做miniprep后酶切确定。
也可以任意挑取10-20个克隆做miniprep后酶切确定。
(基本原理详细见书上)实验室常用的蛋白质表达系统及其应用价值酵母双杂交技术:是在真核模式生物酵母活细胞体内分析、研究蛋白质-蛋白质相互作用的基因系统。
对蛋白质之间微弱的、瞬间的作用也能通过报告基因的表达产物敏感地检测到,这是一种具有很高灵敏度地研究蛋白质之间关系的技术。
原理:基于具有两个或两个以上相互独立的结构域构成的真核生物转录调控因子组件式结构建立了该系统。
其中DNA结合结构域(DB)可识别DNA上的特异序列,并使转录激活结构域定位于所调节的基因的上游。
转录激活结构域(AD)可同转录复合体的其他成分作用,启动它所调节的基因的转录。
DB和AD它们是转录激活因子发挥功能所必需的。
由DB和AD形成的融合蛋白现在一般分别称之为“诱饵(bait)”和“猎物或靶蛋白(prey or target protein)”。
这个被激活的、能显示“诱饵”和“猎物”相互作用的基因称之为报道基因(reporter gene)。
高级生化
一、Meselson和Stahl对半保留复制的证明思想,有哪些想法?答:1958年,Meselson和Stahl研究了经15N标记3个世代的大肠杆菌DNA,首次证明了DNA的半保留复制。
他们将大肠杆菌长期在以15N作氮源的培养基中培养,得到15N-DNA。
由于该DNA 分子的密度比普通DNA(14N-DNA)的密度大,在氯化铯密度梯度离心时,这两种DNA形成位置不同的区带。
他们用普通培养基(含14N的氮源)培养15N标记的大肠杆菌,经过一代以后,所有DNA的密度都在15N-DNA和14N之间,即形成了一半15N和一半14N的杂合分子,两代后出现等量的14N分子和14N-15N杂合分子。
若在继续培养,可以看到14N-DNA分子增多,说明MNA分子在复制时均可被分成两个亚单位,分别构成子代分子的一半,这些亚单位经过许多代复制仍然保持着完整性。
二、Nirenberg对遗传密码的破译的思想方法(通过红细胞体系)1961年,Nirenberg把poly U作为模板加入到大肠杆菌的无细胞体系时意外地发现,新合成的多肽链是多聚苯丙氨酸,从而认定UUU代表苯丙氨酸(Phe)。
以poly C及poly A作模板得到的分别是多聚脯氨酸和多聚赖氨酸,这样很快就解决了3个氨基酸的密码子(当然,一个氨基酸可能有几个密码子)。
幸运的是,由于该无细胞体系中Mg2+浓度很高,人工合成的多聚核苷酸不需要起始密码子就能指导多肽的生物合成,读码起始是随机的。
在生理Mg2+条件下,没有起始密码子的多核苷酸不能被用作多肽合成的模板。
Nirenberg及Ochoa等又用各种随机的共聚物或特定序列共聚物作模板合成多肽,例如,以只含A、C的共聚核苷酸作模板,任意排列时可出现8种三联密码子,即CCC、CCA、CAC、ACC、CAA、ACA、AAC、AAA,获得由Asn、His、Pro、Gln、Thr、Lys等六种氨基酸组成的多肽。
他们发现,以多聚二核甘酸作模板可合成由2个氨基酸组成的多肽,如以poly UG为模板合成的多聚Cys和Val,因为poly UG 中含Cys和Val的密码:5’…UGU GUG UGU GUG UGU GUG…3’无论读码从U开始还是从G开始,都只能有UGU(Cys)及GUG(Val)两种密码子。
高级生化技术实验
结果交流与讨论
与同行或导师进行交流和讨论, 分享实验结果和分析思路,略
常见问题及解决方案
问题一
实验重现性差
01
问题二
实验数据不准确
03
问题三
实验成本高
05
02
解决方案
标准化实验操作流程,确保实验条件的一致 性;使用高质量试剂和耗材,减小批次间差 异。
04
实验操作
数据记录与分析
根据实验方案进行具体的实验操作,如加 样、混合、孵育、洗涤等。确保操作规范 、准确,并注意安全事项。
详细记录实验过程中的数据,包括实验条件 、观察结果等。对数据进行统计分析,得出 科学结论。
03 实验操作过程
样品制备与处理
01
02
03
样品选择
根据实验需求选择合适的 生物样品,如细胞、组织、 血液等。
实验图表绘制
根据实验数据绘制相应的 图表,如折线图、柱状图、 散点图等,以直观展示实 验结果。
实验照片或视频
如果实验过程中有可视化 的变化或现象,可以拍摄 照片或视频作为实验结果 的补充。
数据处理与分析方法
数据整理与筛选
对原始数据进行整理,去除异常 值、重复值等无效数据,确保数
据质量。
数据分析方法
高级生化技术实验
目 录
• 实验背景与目的 • 实验材料与方法 • 实验操作过程 • 结果展示与分析 • 问题解决与改进策略 • 实验安全与注意事项
01 实验背景与目的
生化技术概述
生化技术定义
生化技术是指利用生物体的生化 反应过程,通过特定的技术手段 进行干预、调控和优化,以达到 预期目标的一门科学技术。
手套与口罩
根据实验需要选择合适的手套和口罩等手部及呼吸道防护装备,以避免与化学品直接接触 或吸入有害气体。同时,应注意手套和口罩的更换频率和清洁消毒工作。
高级生化与分子生物学
高级生化与分子生物学高级生化与分子生物学是现代生物学领域中两个重要的研究方向。
高级生化是生物化学的一个分支,研究生物分子的结构、功能和相互作用,以及生物分子参与的生物化学反应和代谢途径。
分子生物学则关注生物体内生物分子的合成、修饰、复制和传递等过程,以及这些过程对生物体结构和功能的影响。
高级生化与分子生物学的关系密切,相互促进,共同推动了生物科学的发展。
下面将分别介绍高级生化和分子生物学的研究内容和应用。
高级生化研究的核心是生物分子的结构和功能。
生物分子包括蛋白质、核酸、多糖和脂质等。
蛋白质是生物体内最重要的功能分子,参与几乎所有生命活动。
高级生化研究通过研究蛋白质的结构,揭示其功能。
例如,通过X射线晶体学和核磁共振等技术,可以确定蛋白质的三维结构,从而了解其功能和相互作用。
此外,高级生化还研究蛋白质的合成、修饰和降解等过程,以及蛋白质与其他生物分子之间的相互作用。
这些研究为药物设计和疾病治疗提供了理论基础。
分子生物学是研究生物体内生物分子的合成和传递过程的学科。
分子生物学的重要研究对象是DNA和RNA。
DNA是生物体内遗传信息的载体,RNA则参与了基因转录和翻译等重要过程。
分子生物学通过研究DNA和RNA的结构和功能,揭示基因组的组织和表达,以及遗传信息的传递和转录调控等机制。
例如,通过PCR技术可以扩增特定基因片段,从而进行基因诊断和遗传学研究。
此外,分子生物学还研究了细胞分裂和凋亡等重要生物学过程,揭示了细胞分裂的调控机制和凋亡途径。
高级生化与分子生物学的研究在许多领域有着广泛的应用。
在医学领域,高级生化和分子生物学的研究为疾病的诊断和治疗提供了重要的理论和技术基础。
例如,通过研究疾病相关蛋白质的结构和功能,可以设计和开发特定的药物靶点,从而实现个体化治疗。
在农业领域,高级生化和分子生物学的研究为作物的品质改良和抗病虫害育种提供了理论指导和技术手段。
例如,通过转基因技术可以改良作物的抗病性和产量。
高级生化整理
第一章概述第一节生物分子提取和纯化一般过程1)材料的选择和保存2) 破碎细胞(分别对待) 3) 抽提: 分离有效成分的过程4) 浓缩: 提高抽提液中有效成分浓度的过程5) 纯化: 去除其它杂质,提高有效成分纯度的过程6) 有效成分的干燥和保存纯化方案的评价比活力纯化倍数得率评价原则1)总目标是增大纯化倍数和提高得率2)若材料来源少,则要考虑得率;反之,考虑提高纯化倍数。
第二节生物分离技术的发展动态二、新技术的研究和开发1、新型分离介质的研究开发膜、树脂和凝胶是目前主要的新型分离介质2、子代分离技术(概念)各种分离纯化技术相互结合、交叉、渗透形成子代分离技术。
具有较高的选择性和分离效率。
第三节生物分离技术的设计和选择⏹分离的本质在于有效识别混合物中不同溶质间物理、化学和生物学性质的差别。
⏹物理性质:力学性质、热力学性质、电磁性质⏹化学性质:化学热力学、化学反应学、光化学⏹生物学性质:分子识别生物分离技术设计的基本原则1)、尽可能简单、低耗、高效、快速。
2)、分离步骤尽可能少。
Why?A)、φn -----------总回收率,λn ----------各单元回收率。
分离步骤越多,回收率越低;如φ10 = 0.9510 = 0.63,φ5 = 0.955 =0.77B)、分离步骤多,设备投入大,人员物资消耗大,生产周期长。
3)、避免相同原理的分离技术多次重复出现。
4)、尽量减少新化合物进入待分离的溶液。
5)、合理的分离步骤次序。
原则是:先低选择性,后高选择性;先高通量,后低通量;先粗分,后精分;先低成本,后高成本。
思考题1、生物分子提取和纯化的一般过程?2、纯化方案的评价指标是什么?3、生物分离技术(纯化方案)设计的基本原则是什么?4、初步纯化与高度纯化分离效果有何不同?5、纯化生物产品的总收率是如何计算的?若每一步纯化产物的收率为90%,共6步纯化得到符合要求的产品,其总收率是多少?第二章沉淀法1、沉淀:利用沉析剂使生化物质在溶液中的溶解度降低而形成无定形固体沉淀的过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、粗分级分离 Crude fractionation
�
利用 盐析法、等电点沉淀、有机溶剂沉淀 利用盐析法、等电点沉淀、有机溶剂沉淀 等方法,使目的蛋白与其它较大量的杂蛋 白分开,这些方法的特点是简便、处理量 大、既能除去大量杂质,又能浓缩蛋白质, 但分辨率低。
� 此外,根据特殊的工作目的,还有一些特殊的纯度标准,例 如光谱纯、荧光纯等。使用时应按不同的实验要求,选用不 同规格的试剂。
Biochemistry Experiment 2011-1-10
试剂的配制
1. 计算 1.计算 振荡摇匀 8. 8.振荡摇匀 2. 称量 2.称量 洗涤烧杯 3. 3.洗涤烧杯
Biochemistry Experiment
2011-1-10
过滤除菌
� 有些溶液不能高压灭菌(如),需要过滤除菌,一般在超 净工作台上进行,用一次性注射器和一次性0.22μm滤膜 (millipore或pall)就可以。 � 如果溶液的量比较大,超过500ml,可以采用已灭菌的抽 滤瓶,预先垫好0.22 μm 的滤膜。抽滤瓶灭菌前要检查封 口用纱布或棉花堵牢,使用时不用在无菌室中进行,只要 保证收集瓶无菌状态就可以。抽滤后,过滤好的溶液在无 菌条件下倒进已灭菌的空试剂瓶中。
Advanced Experimental Biochemistry
高级生化实验技术
10级硕士生高级生化实验技术课程表(双语教学) 20 2010
日期 授课内容 1.生化常用试剂的配制要求; 2.蛋白质分离纯化;介绍蛋白质的浓缩、结晶、保存。 (1)血浆IgG的分离纯化: 分段盐析、(透析)/SephadexG-50 凝胶过滤(脱盐) (2)亲和层析分离纯化工程菌中表达的GST融合蛋白 3.蛋白质的定量分析: 蛋白质的紫外定性、定量分析方法的选择及操作 lowry法/ BCA法/Bradford法等测不同溶液中蛋白质的含量 4.蛋白质的鉴定: (1)SDS-PAGE分离菌体蛋白及鉴定亲和层析纯化的GST融合蛋白 (2)细菌中GST融合蛋白表达的鉴定(Western Blotting ) 蛋白质分离纯化、性质鉴定分析(续): Western Blotting( 续) 5. 酶学分析(酶活性测定及酶法分析) (1) 酶活性测定: 血浆/肝组织LDH酶活性测定 (2) LDH同工酶谱分析(琼脂糖凝胶电泳法) (3) 酶法分析: 酶法测定血清胆固醇、葡萄糖含量(终点测定法) Microplate reader 在微量定量分析中的应用 实验总结、讨论 考试
Purity of Protein; Purification Yield; Activity of Purified Protein;Identification of Purified Protein
5. Crystallization, Concentration, Drying and Storage of Protein
Biochemistry Experiment 2011-1-10
9 1. 1.9
10 1. 1.10
1. 11 1.11
12 1. 1.12
I、生化常用试剂的配制要求
试剂的使用
� 根据化学试剂的纯度,按杂质含量多少可分为四级: 一级试剂为优质纯试剂(99.8%) ,通常用G·R表示; 二级试剂为分析纯试剂(99.7%) ,通常用A·R表示; 三级试剂为化学纯试剂(99.5%) ,通常用C·R表示; 四级试剂为实验或工业试剂,通常用L·R表示。
透析是将含有小分子杂质的蛋白质溶液装在
半透膜(玻璃纸、火绵纸等)制的透析袋里放 (缓冲液 )中进行,可不断(至少 2~ 在蒸馏水 在蒸馏水( 缓冲液) 中进行,可不断(至少2 )更换蒸馏水,直至杂质被除去。 3h 3h)更换蒸馏水,直至杂质被除去。
Biochemistry Experiment
2011-1-10
Biochemistry Experiment 2011-1-10
�向蛋白质溶液中加入大量的中性盐[(NH4)2SO4,Na2SO4, NaCl 等],使蛋白质脱去水化层而聚集沉淀。常用的盐 析剂是硫酸铵,其盐析能力强,水中溶解度大,浓度 高时也不会引起蛋白质活性丧失。
� 盐析作用是由于当盐浓度较高时,盐离子与水分子作用,使 水的活度降低,原来溶液中大部分的自由水转变为盐离子的水 化水,从而降低蛋白质极性基团与水分子之间的作用,破坏蛋 白质分子表面的水化层。 �盐析沉淀的蛋白质仍保持天然构象,即仍有活性。
Biochemistry Experiment 2011-1-10
Procedure of Protein Preparation
1. Cell disruption and protein extraction 2. Crude fractionation 3. The Selective Purification Step 4. Identification and Analysis of Protein
定容 7. 7.定容
配制 步骤
溶解 4. 4.溶解
振荡 6. 6.振荡
移液 5. 5.移液
Biochemistry Experiment 2011-1-10
例:配制1升0.01mol/L的KMnO4溶液配制标准溶液的步骤: 1. 计算所需溶质KMnO4的质量:n=0.01×1=0.01mol m=0.01mol×158=1.58克 2. 称量:在天平上称取1.58g固 体KMnO4 3. 溶解:在烧杯中用50ml左右的蒸馏水溶1.58gKMnO4 4. 移液:量筒标明一定温度下的体积,溶液必须冷却后 才能转移到量筒中。 5. 洗涤烧杯 6. 振荡 7. 定容 8. 振荡摇匀
Methods for Separation and Purification
Gel-electrophoresis; Gel filtration; Centrifugation; Size and shape Dialysis and Ultrafiltration Precipitation by salting out (e.g. ammonium Solubility sulfate); organic solvents; pI Gel-electrophoresis; Ion exchange Charge chromatography Hydrophobic interaction chromatography(HIC); Hydrophobicity Reverse phase-HPLC Biospecific Affinity chromatography interaction
2011-1-10
Biochemistry Experiment
II 、Separation and Purification II、 of Protein 蛋白质分离纯化
Methods for Protein Separation and Purification
Physicochemical Properties
� Dialysis is the process of separating molecules in solution by the difference in their rates of diffusion through a semipermeable membrane (e.g. dialysis bag). Small molecules and water tend to move into or out of the dialysis bag in the direction of decreasing concentration, while proteins have dimensions significantly greater than the pore diameter are retained inside the dialysis bag.
2011-1-10
Biochemistry Experiment
Biochemistry Experiment
2011-1-10
(2)透析(Dialysis)
� 蛋白质用盐析方法沉淀分离后,还需要脱盐才能 进一步精提纯。脱盐常选用 透析法 或凝胶过滤 。 进一步精提纯。脱盐常选用透析法 透析法或 凝胶过滤。
Biochemistry Experiment 2011-1-10
蛋白质分离纯化的方法
� 根据蛋白分子特异性的差异,如分子大小,溶解度,电荷等 建立起来的。
性质
� 分子大小 � 溶解度 � 电荷 � 吸附性质 � 对配体分子 的生物亲和力
方 法
透析、超滤、密度梯度离心、凝胶过滤 等电点沉淀、盐析、有机溶剂沉淀 电泳、离子交换层析 吸附层析(羟基磷灰石层析、疏水作用层析) 亲和层析
Biochemistry Experimout)
� Salt at low concentrations stabilizes the various charged groups on a protein molecule, and enhances the solubility of protein. However, when the salt concentration is increased further, some of the water molecules are attracted by the salt ions,then the protein-protein interactions are stronger than the solventsolute interactions, the protein molecules aggregate by forming hydrophobic interactions with each other.
