第七章 原子结构和元素周期律
原子结构与元素周期律教案

原子结构与元素周期律教案第一章:原子的基本概念1.1 原子定义物质与物质的组成原子的概念及其基本属性1.2 原子核与电子原子核的组成:质子、中子电子的特性与运动1.3 原子量与相对原子质量原子的质量及其表示方法相对原子质量的概念及其计算方法第二章:原子结构2.1 原子核外电子的排布电子层与能级电子排布的规则与原则2.2 元素的原子半径原子半径的定义及其表示方法原子半径的变化规律2.3 元素的化合价化合价的定义及其表示方法元素的化合价与原子结构的关系第三章:元素周期律的基本概念3.1 元素周期表的发现与发展元素周期律的发现历程现代元素周期表的结构与特点3.2 元素周期律的表述方式原子序数的定义及其表示方法元素周期律的数学表述3.3 元素周期律的实质电子排布与元素性质的关系元素周期律的微观解释第四章:元素周期律的应用4.1 元素的位置与性质主族元素的性质与位置关系过渡元素的位置与性质4.2 周期律的预测能力利用周期律预测元素性质的变化周期律在化学反应中的应用4.3 周期律在物质结构与性质预测中的应用利用周期律预测化合物的稳定性周期律在材料科学中的应用第五章:原子结构与元素周期律的综合应用5.1 原子结构与元素性质的关系原子核外电子排布与元素性质的关系原子半径、化合价与元素性质的关系5.2 周期律在化学教学与研究中的应用周期律在教学中的指导作用周期律在化学研究中的应用案例5.3 原子结构与元素周期律的前沿动态原子结构的研究新进展元素周期律的新发现与理论发展第六章:主族元素的电子排布与性质6.1 主族元素的电子排布规律主族元素的原子结构特点主族元素电子排布的规律6.2 主族元素的性质原子半径的变化规律化合价与元素性质的关系6.3 主族元素的代表性化合物氧化物、酸、碱和盐的性质主族元素在生物体中的应用第七章:过渡元素与金属性、非金属性7.1 过渡元素的基本概念过渡元素的发现及命名过渡元素在周期表中的位置7.2 过渡元素的电子排布与性质过渡元素的电子排布特点过渡元素的金属性与非金属性7.3 过渡元素的应用过渡元素在催化剂中的应用过渡元素在材料科学中的应用第八章:同周期、同主族元素性质的递变规律8.1 同周期元素性质的递变规律同周期元素原子半径的变化同周期元素化合价的变化8.2 同主族元素性质的递变规律同主族元素原子半径的变化同主族元素化合价的变化8.3 递变规律在元素周期律中的应用利用递变规律预测元素性质递变规律在化学教学中的应用第九章:元素周期律与化学反应9.1 元素周期律在化学反应中的应用氧化还原反应与元素周期律酸碱反应与元素周期律9.2 元素周期律在物质合成中的应用利用元素周期律设计新化合物元素周期律在材料合成中的应用9.3 元素周期律在药物设计中的应用药物设计与元素周期律的关系元素周期律在药物研发中的应用案例第十章:总结与展望10.1 原子结构与元素周期律的意义原子结构与元素周期律的历史意义原子结构与元素周期律在现代化学中的应用10.2 原子结构与元素周期律的发展趋势原子结构研究的深入元素周期律的新理论和新发现10.3 原子结构与元素周期律的挑战与机遇原子结构与元素周期律的局限性原子结构与元素周期律在新领域的应用前景重点和难点解析重点关注章节:第一章至第十章1. 第一章:原子的基本概念重点关注原子的定义、原子核与电子的关系以及原子量与相对原子质量的概念。
元素周期律教案(详细)

元素周期律教案(详细)第一章:元素周期律的发现1.1 背景介绍讨论化学的发展史,特别是在19世纪初期的化学研究。
介绍道尔顿、阿伏伽德罗、门捷列夫等科学家对化学的贡献。
1.2 元素周期律的发现解释元素周期律的概念,即元素的物理和化学性质具有一定的周期性。
讲述门捷列夫发现元素周期律的过程,以及他编制的第一张元素周期表。
1.3 元素周期律的意义强调元素周期律对化学研究的重要性,如预测新元素、了解元素性质等。
引导学生思考元素周期律对于现代化学科学的应用。
第二章:元素周期表的结构2.1 周期表的基本结构介绍周期表的横行(周期)和纵列(族),以及周期表的扩展。
解释周期表中元素的原子序数、电子排布和价电子等概念。
2.2 周期表的规律讲解周期表中的主要规律,如周期性、递变性、相似性等。
通过实例说明规律在周期表中的体现。
2.3 周期表的应用探讨周期表在元素分类、性质预测、反应规律等方面的应用。
引导学生学会利用周期表解决实际问题。
第三章:主族元素的性质3.1 主族元素的概念介绍主族元素的概念和分类,包括IA族到VIIA族。
解释主族元素的电子排布规律和价电子特点。
3.2 主族元素的性质探讨主族元素的物理和化学性质,如原子半径、电负性、化合价等。
通过实例分析主族元素在实际应用中的特点。
3.3 主族元素的代表性化合物介绍主族元素与非金属元素形成的典型化合物,如酸、碱、盐等。
分析主族元素在生物体和工业中的应用。
第四章:过渡元素的性质4.1 过渡元素的概念解释过渡元素的概念,包括d区元素和f区元素。
介绍过渡元素的电子排布特点和价电子行为。
4.2 过渡元素的性质探讨过渡元素的物理和化学性质,如电子亲和能、电负性、氧化态等。
通过实例说明过渡元素在催化剂和材料科学中的应用。
4.3 过渡元素的代表性化合物介绍过渡元素与非金属元素形成的典型化合物,如配合物、氧化物等。
分析过渡元素在现代化学工业和科学研究中的重要性。
第五章:镧系和锕系的性质5.1 镧系和锕系的概念解释镧系和锕系的概念,它们是周期表中的两个特殊系列。
《物质结构-元素周期律》知识点总结

物质结构元素周期律1.原子结构[核电荷数、核内质子数及核外电子数的关系] 核电荷数=核内质子数=原子核外电子数注意:(1) 阴离子:核外电子数=质子数+所带的电荷数阳离子:核外电子数=质子数-所带的电荷数(2)“核电荷数”与“电荷数”是不同的,如Cl-的核电荷数为17,电荷数为1.[质量数]用符号A表示.将某元素原子核内的所有质子和中子的相对质量取近似整数值相加所得的整数值,叫做该原子的质量数.说明(1)质量数(A)、质子数(Z)、中子数(N)的关系:A=Z + N.(2)符号A Z X的意义:表示元素符号为X,质量数为A,核电荷数(质子数)为Z的一个原子.例如,23Na中,Na11原子的质量数为23、质子数为11、中子数为12.[原子核外电子运动的特征](1)当电子在原子核外很小的空间内作高速运动时,没有确定的轨道,不能同时准确地测定电子在某一时刻所处的位置和运动的速度,也不能描绘出它的运动轨迹.在描述核外电子的运动时,只能指出它在原子核外空间某处出现机会的多少.(2)描述电子在原子核外空间某处出现几率多少的图像,叫做电子云.电子云图中的小黑点不表示电子数,只表示电子在核外空间出现的几率.电子云密度的大小,表明了电子在核外空间单位体积内出现几率的多少.(3)在通常状况下,氢原子的电子云呈球形对称.在离核越近的地方电子云密度越大,离核越远的地方电子云密度越小.[原子核外电子的排布规律](2)能量最低原理:电子总是尽先排布在能量最低的电子层里,而只有当能量最低的电子层排满后,才依次进入能量较高的电子层中.因此,电子在排布时的次序为:K→L→M……(3)各电子层容纳电子数规律:①每个电子层最多容纳2n2个电子(n=1、2……).②最外层容纳的电子数≤8个(K层为最外层时≤2个),次外层容纳的电子数≤18个,倒数第三层容纳的电子数≤32个.例如:当M层不是最外层时,最多排布的电子数为2×32=18个;而当它是最外层时,则最多只能排布8个电子.(4)原子最外层中有8个电子(最外层为K层时有2个电子)的结构是稳定的,这个规律叫“八隅律”.但如PCl5中的P原子、BeCl2中的Be原子、XeF4中的Xe原子,等等,均不满足“八隅律”,但这些分子也是稳定的.2.元素周期律[原子序数]按核电荷数由小到大的顺序给元素编的序号,叫做该元素的原子序数.原子序数=核电荷数=质子数=原子的核外电子数[元素原子的最外层电子排布、原子半径和元素化合价的变化规律]对于电子层数相同(同周期)的元素,随着原子序数的递增:(1)最外层电子数从1个递增至8个(K层为最外层时,从1个递增至2个)而呈现周期性变化.(2)元素原子半径从大至小而呈现周期性变化(注:稀有气体元素的原子半径因测定的依据不同,而在该周期中是最大的).(3)元素的化合价正价从+1价递增至+5价(或+7价),负价从-4价递增至-1价再至0价而呈周期性变化.[元素金属性、非金属性强弱的判断依据]元素金属性强弱的判断依据:①金属单质跟水(或酸)反应置换出氢的难易程度.金属单质跟水(或酸)反应置换出氢越容易,则元素的金属性越强,反之越弱.②最高价氧化物对应的水化物-—氢氧化物的碱性强弱.氢氧化物的碱性越强,对应金属元素的金属性越强,反之越弱.③还原性越强的金属元素原子,对应的金属元素的金属性越强,反之越弱.(金属的相互置换)元素非金属性强弱的判断依据:①非金属单质跟氢气化合的难易程度(或生成的氢化物的稳定性),非金属单质跟氢气化合越容易(或生成的氢化物越稳定),元素的非金属性越强,反之越弱.②最高价氧化物对应的水化物(即最高价含氧酸)的酸性强弱.最高价含氧酸的酸性越强,对应的非金属元素的非金属性越强,反之越弱.③氧化性越强的非金属元素单质,对应的非金属元素的非金属性越强,反之越弱.(非金属相互置换)[两性氧化物] 既能跟酸反应生成盐和水,又能跟碱反应生成盐和水的氧化物,叫做两性氧化物.如A12O3与盐酸、NaOH溶液都能发生反应:A12O3+6H+=2A13++3H2O A12O3+2OH-=2A1O2-+H2O[两性氢氧化物]既能跟酸反应又能跟碱反应的氢氧化物,叫做两性氢氧化物.如A1(OH)3与盐酸、NaOH溶液都能发生反应:Al(OH)3+3H+=2A13++3H2O A1(OH)3+OH-=A1O2-+2H2O[原子序数为11—17号主族元素的金属性、非金属性的递变规律][元素周期律] 元素的性质随着原子序数的递增而呈周期性变化,这个规律叫做元素周期律.3.元素周期表[元素周期表]把电子层数相同的各种元素,按原子序数递增的顺序从左到右排成横行,再把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上至下排成纵行,这样得到的一个表叫做元素周期表.[周期]具有相同的电子层数的元素按原子序数递增的顺序排列而成的一个横行,叫做一个周期.(1)元素周期表中共有7个周期,其分类如下:短周期(3个):包括第一、二、三周期,分别含有2、8、8种元素周期(7个)长周期(3个):包括第四、五、六周期,分别含有18、18、32种元素不完全周期:第七周期,共26种元素(1999年又发现了114、116、118号三种元素)(2)某主族元素的电子层数=该元素所在的周期数.(3)第六周期中的57号元素镧(La)到71号元素镥(Lu)共15种元素,因其原子的电子层结构和性质十分相似,总称镧系元素.(4)第七周期中的89号元素锕(Ac)到103号元素铹(Lr)共15种元素,因其原子的电子层结构和性质十分相似,总称锕系元素.在锕系元素中,92号元素铀(U)以后的各种元素,大多是人工进行核反应制得的,这些元素又叫做超铀元素.[族]在周期表中,将最外层电子数相同的元素按原子序数递增的顺序排成的纵行叫做一个族.(1)周期表中共有18个纵行、16个族.分类如下:①既含有短周期元素同时又含有长周期元素的族,叫做主族.用符号“A”表示.主族有7个,分别为I A、ⅡA、ⅢA、ⅣA、VA、ⅥA、ⅦA族(分别位于周期表中从左往右的第1、2、13、14、15、16、17纵行).②只含有短周期元素的族,叫做副族.用符号“B"表示.副族有7个,分别为I B、ⅡB、ⅢB、ⅣB、VB、ⅥB、ⅦB族(分别位于周期表中从左往右的第11、12、3、4、5、6、7纵行).③在周期表中,第8、9、10纵行共12种元素,叫做Ⅷ族.④稀有气体元素的化学性质很稳定,在通常情况下以单质的形式存在,化合价为0,称为0族(位于周期表中从左往右的第18纵行).(2)在元素周期表的中部,从ⅢB到ⅡB共10个纵列,包括第Ⅷ族和全部副族元素,统称为过渡元素.因为这些元素都是金属,故又叫做过渡金属.(3)某主族元素所在的族序数:该元素的最外层电子数=该元素的最高正价数[原子序数与化合价、原子的最外层电子数以及族序数的奇偶关系](1)原子序数为奇数的元素,其化合价通常为奇数,原子的最外层有奇数个电子,处于奇数族.如氯元素的原子序数为17,而其化合价有-1、+1、+3、+5、+7价,最外层有7个电子,氯元素位于第ⅦA族.(2)原子序数为偶数的元素,其化合价通常为偶数,原子的最外层有偶数个电子,处于偶数族.如硫元素的原子序数为16,而其化合价有-2、+4、+6价,最外层有6个电子,硫元素位于第ⅥA族.[元素性质与元素在周期表中位置的关系](1)元素在周期表中的位置与原子结构、元素性质三者之间的关系:(2)元素的金属性、非金属性与在周期表中位置的关系:①同一周期元素从左至右,随着核电荷数增多,原子半径减小,失电子能力减弱,得电子能力增强.a.金属性减弱、非金属性增强;b.金属单质与酸(或水)反应置换氢由易到难;c.非金属单质与氢气化合由难到易(气态氢化物的稳定性增强);d.最高价氧化物的水化物的酸性增强、碱性减弱.②同一主族元素从上往下,随着核电荷数增多,电子层数增多,原子半径增大,失电子能力增强,得电子能力减弱.a.金属性增强、非金属性减弱;b.金属单质与酸(或水)反应置换氢由难到易。
高中化学:物质结构 元素周期律知识点

高中化学:物质结构元素周期律知识点一. 原子结构1. 原子核的构成核电荷数(Z) == 核内质子数 == 核外电子数 == 原子序数2. 质量数:将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,叫质量数。
质量数(A)= 质子数(Z)+ 中子数(N)==近似原子量3. 原子构成4. 表示方法二. 元素、核素、同位素、同素异形体的区别和联系1. 区别2. 联系【名师点睛】(1) 在辨析核素和同素异形体时,通常只根据二者研究范畴不同即可作出判断。
(2) 同种元素可以有多种不同的同位素原子,所以元素的种类数目远少于原子种类的数目。
(3) 自然界中,元素的各种同位素的含量基本保持不变。
三. “10电子”、“18电子”的微粒小结1. “10电子”微粒2. “18电子”微粒四. 元素周期表的结构1. 周期2. 族3. 过渡元素元素周期表中从ⅢB到ⅡB共10个纵行,包括了第Ⅷ族和全部副族元素,共60多种元素,全部为金属元素,统称为过渡元素。
特别提醒元素周期表中主、副族的分界线:(1) 第ⅡA族与第ⅢB族之间,即第2、3列之间;(2) 第ⅡB族与第ⅢA族之间,即第12、13列之间。
五. 元素周期表的应用1. 元素周期表在元素推断中的应用(1) 利用元素的位置与原子结构的关系推断。
等式一:周期序数=电子层数;等式二:主族序数=最外层电子数;等式三:原子序数=核电荷数=质子数=核外电子数。
(2) 利用短周期中族序数与周期数的关系推断。
(3) 定位法:利用离子电子层结构相同的“阴上阳下”推断具有相同电子层结构的离子,如a X(n+1)+、b Y n+、c Z(n+1)-、d M n-的电子层结构相同,在周期表中位置关系为则它们的原子序数关系为a>b>d>c。
2. 元素原子序数差的确定方法(1) 同周期第ⅡA族和第ⅢA族元素原子序数差。
(2) 同主族相邻两元素原子序数的差值情况。
①若为ⅠA、ⅡA族元素,则原子序数的差值等于上周期元素所在周期的元素种类数。
第一册第七章第1节碳族元素
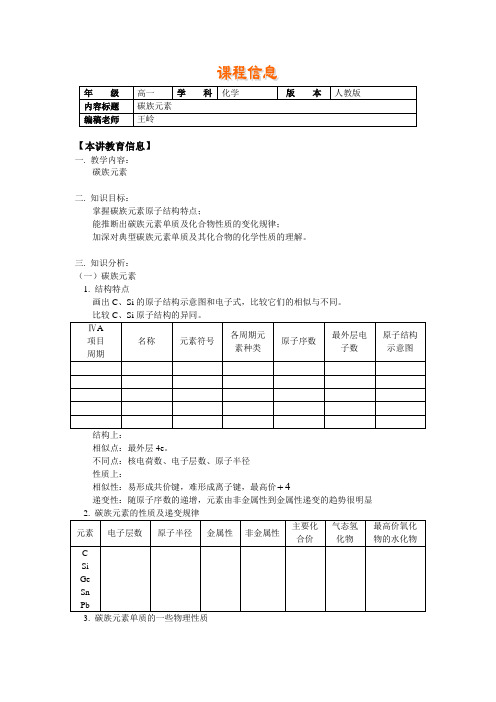
【本讲教育信息】一. 教学内容:碳族元素二. 知识目标:掌握碳族元素原子结构特点;能推断出碳族元素单质及化合物性质的变化规律;加深对典型碳族元素单质及其化合物的化学性质的理解。
三. 知识分析: (一)碳族元素 1. 结构特点画出C 、Si 的原子结构示意图和电子式,比较它们的相似与不同。
结构上:相似点:最外层4e 。
不同点:核电荷数、电子层数、原子半径 性质上:相似性:易形成共价键,难形成离子键,最高价4递变性:随原子序数的递增,元素由非金属性到金属性递变的趋势很明显 3. 碳族元素单质的一些物理性质(二)硅1. 硅的存在:在自然界中,没有游离态的硅。
2. 硅的物理性质:晶体硅是灰黑色,有金属光泽,硬而脆的固体。
晶体硅的熔点、沸点都很高,硬度也很大。
(三)二氧化硅1. 2SiO 与2CO 的比较(一)2SiO 与2CO 的化学性质比较(二)2. 硅酸盐的表示(用2SiO 及金属氧化物的形式)硅酸钠3NaSiO )(22SiO O Na ⋅ 镁橄榄石42SiO Mg )2(2SiO MgO ⋅高岭石4522))((OH O Si Al )22(2232O H SiO O Al ⋅⋅【典型例题】[例1] 如果发现的新元素位于第7周期,ⅣA 族,关于该新元素X 的下列说法错误的是( ) A. X 的2+价化合物比4+价化合物稳定B. 2XO 具有强氧化性C. X 原子的核电荷数可能是114D. X 为非金属,它有稳定的氢化物精析:可推知X 元素的金属性比铅还强,一定为金属,D 项是错的。
铅2+价化合物比4+价的稳定,X 元素也理应如此,A 项正确。
正因为4+价的2XO 不稳定,4+X 元素易得电子变为2+X 元素,B 项是对的。
它的核电荷数,可用核外电子排布规律及和元素周期表中位置的关系推出有1882+++态氢化物。
答案:D 小结:[例2] 下列说法中正确的是( )A. 二氧化硅是酸性氧化物,它可以跟强碱反应,但不能与任何酸反应B. 根据↑++2332CO CaSiO CaCO SiO 高温的反应,可推知硅酸酸性比碳酸强C. 二氧化碳气体通入硅酸钠溶液中可以制得硅酸D. 二氧化硅对应的水化物有不同的组成精析:本题考查二氧化碳、碳酸、二氧化硅、硅酸、原硅酸的性质知识,同时考查思维的深刻性、准确性。
原子结构与元素的性质PPT课件

最外层一个电子所需能量(I1)的范围:
I1
__4_1_9__ < I1 <___7_3_8___。
-
16
跟踪练习
1.下列说法正确的是( C )
A.在所有元素中,氟的第一电离能最大 最大的是稀有气体元素He
B.铝的第一电离能比镁的第一电离能大 反常现象: 同周期ⅡA > ⅢA、 VA > VIA
C.第3周期所含的元素中钠的第一电离能最小
1、影响因素
原子半径 取决于 1、电子的能层数
的大小
2、核电荷数
原
子 同主族,由于
半 电子能层的增
径 逐 渐
加使电子间的 斥力增大而带
增 来的原子半径
大 增大的趋势。
原子半径逐渐减小
同周期电子能层数相同, 由于核电荷数的增加 使核对电子的引力增 加而带来的原子半径 减小的趋势。
-
6
例1 比较下列微粒半径的大小:
(3)同种元素的原子与离子,核外电子数越多, 微粒半径 越大 。 Mg > Mg2+
(4)电子层结构相同的离子,核电荷数越大离子
半径 越小 。
O2->Na+
-
8
二、电离能(阅读课本P17)
1、概念
气态电中性基态原子失去一个电子 转化为气态基态正离子所需要的最低能 量叫做第一电离能。
用符号I1表示,单位:kJ/mol
1. 下列左图是根据数据制作的第三周期元素 的电负性变化图,请用类似的方法制作IA、 VIIA元素的电负性变化图。
-
24
-
25
2.在元素周期表中,某些主族元素与右下方的主 族元素的性质有些相似,被称为“对角线规则”。 查阅资料,比较锂和镁在空气中燃烧的产物,铍 和铝的氢氧化物的酸碱性以及硼和硅的含氧酸酸 性的强弱,说明对角线规则,并用这些元素的电 负性解释对角线规则。
初中化学《元素周期律》优秀教案
初中化学《元素周期律》优秀教案第一章:元素周期律的发现1.1 科学家的探索-介绍道尔顿、门捷列夫等科学家对元素周期律的贡献1.2 元素周期律的定义-解释元素周期律的概念:元素周期律是元素性质随着原子序数的递增而呈周期性变化的规律1.3 元素周期律的表述-介绍元素周期律的表述方式:周期表第二章:元素周期律的规律2.1 周期性变化-解释元素周期律的周期性变化:原子半径、化合价、金属性和非金属性等2.2 周期表的结构-介绍周期表的结构:周期、族、周期表的排列规律2.3 周期表的应用-讲解周期表在化学学习和实际应用中的重要性第三章:周期表中的主族元素3.1 碱金属族-介绍碱金属族的元素特点、性质及应用3.2 碱土金属族-介绍碱土金属族的元素特点、性质及应用3.3 卤族元素-介绍卤族元素的元素特点、性质及应用第四章:周期表中的过渡元素4.1 过渡元素的分类-讲解过渡元素的分类:d区和ds区4.2 过渡元素的性质-介绍过渡元素的性质:金属性、非金属性、氧化还原性等4.3 过渡元素的应用-讲解过渡元素在催化剂、合金等领域的应用第五章:周期表中的镧系和锕系元素5.1 镧系和锕系元素的发现-介绍镧系和锕系元素的发现背景及意义5.2 镧系和锕系元素的性质-介绍镧系和锕系元素的元素特点、性质及应用5.3 镧系和锕系元素的研究意义-讲解镧系和锕系元素在核反应、超导体等领域的研究价值第六章:原子结构和元素周期律6.1 原子核外电子的排布-解释原子核外电子的排布规律及其与元素周期律的关系6.2 元素周期律的量子化学解释-介绍量子化学对元素周期律的解释和意义6.3 原子半径的周期性变化-讲解原子半径的周期性变化及其在周期表中的应用第七章:元素周期律与化学反应7.1 元素化合价的周期性变化-解释化合价的周期性变化及其对化学反应的影响7.2 金属性和非金属性的周期性变化-介绍金属性和非金属性的周期性变化及其在化学反应中的应用7.3 元素周期律在化学反应预测中的应用-讲解如何利用元素周期律预测化学反应的可能性及产物第八章:元素周期律在材料科学中的应用8.1 金属材料的设计与制备-介绍如何利用元素周期律设计和制备金属材料8.2 半导体材料的应用-讲解半导体材料在电子、光电子领域的应用及其与元素周期律的关系8.3 超级合金及其他先进材料-介绍超级合金及其他先进材料的设计原理及其与元素周期律的关系第九章:元素周期律在环境化学中的应用9.1 环境污染与元素周期律-解释环境污染与元素周期律的关系及其在污染治理中的应用9.2 元素生物地球化学循环-介绍元素生物地球化学循环的规律及其与元素周期律的关系9.3 环境监测与元素周期律-讲解如何利用元素周期律进行环境监测和污染物分析第十章:元素周期律在药物化学中的应用10.1 药物设计与元素周期律-介绍药物设计与元素周期律的关系及其在药物研发中的应用10.2 药物分子结构的优化-解释如何利用元素周期律优化药物分子结构以提高药效10.3 元素周期律在药物筛选中的应用-讲解元素周期律在药物筛选和构效关系研究中的作用第十一章:元素周期律在材料科学中的应用(续)11.1 纳米材料与元素周期律-介绍纳米材料的设计与元素周期律的关系11.2 复合材料的应用-讲解复合材料在各个领域的应用及其与元素周期律的关系11.3 功能材料的研究与发展-介绍功能材料的研究与发展趋势及其与元素周期律的联系第十二章:元素周期律在生物化学中的应用12.1 生物体内元素的分布与周期律-解释生物体内元素分布与元素周期律的关系12.2 酶与元素周期律-介绍酶的活性中心元素与元素周期律的关系12.3 生物地球化学与元素周期律-讲解生物地球化学研究中元素周期律的应用第十三章:元素周期律在宇宙化学中的应用13.1 宇宙中的元素分布-介绍宇宙中元素分布的特点及其与元素周期律的关系13.2 恒星演化与元素周期律-解释恒星演化过程中元素周期律的应用13.3 行星地球化学与元素周期律-讲解行星地球化学研究中元素周期律的应用第十四章:元素周期律在现代化学分析中的应用14.1 原子吸收光谱分析-介绍原子吸收光谱分析原理及其与元素周期律的关系14.2 质谱分析与应用-讲解质谱分析原理及其在元素周期律研究中的应用14.3 X射线荧光光谱分析-介绍X射线荧光光谱分析原理及其与元素周期律的关系第十五章:元素周期律的综合应用与研究前景15.1 元素周期律在多领域中的应用-总结元素周期律在多个领域的应用及其重要性15.2 元素周期律的研究新进展-介绍元素周期律研究的新技术、新方法及发展趋势15.3 元素周期律的挑战与机遇-探讨元素周期律在现代科学中的挑战及未来发展的机遇重点和难点解析本文主要介绍了初中化学《元素周期律》的相关知识,包括元素周期律的发现、规律、应用以及其在不同领域的重要性。
元素周期律知识点总结
元素周期律知识点总结元素周期律学问点总结 1一.元素周期表的结构周期序数=核外电子层数主族序数=最外层电子数原子序数=核电荷数=质子数=核外电子数二.元素的性质和原子结构(一)碱金属元素:2.碱金属化学性质的递变性:递变性:从上到下(从Li到Cs),随着核电核数的增加,碱金属原子的电子层数渐渐增多,原子核对最外层电子的引力渐渐减弱,原子失去电子的力量增加,即金属性渐渐增加。
所以从Li到Cs的金属性渐渐增加。
结论:1)原子结构的递变性导致化学性质的递变性。
2)金属性强弱的推断依据:与水或酸反应越简单,金属性越强;最高价氧化物对应的水化物(氢氧化物)碱性越强,金属性越强。
3.碱金属物理性质的相像性和递变性:1)相像性:银白色固体、硬度小、密度小(轻金属)、熔点低、易导热、导电、有展性。
2)递变性(从锂到铯):①密度渐渐增大(反常) ②熔点、沸点渐渐降低3)碱金属原子结构的相像性和递变性,导致物理性质同样存在相像性和递变性(二)卤族元素:2.卤素单质物理性质的递变性:从F2到I21)卤素单质的颜色渐渐加深;2)密度渐渐增大;3)单质的熔、沸点上升3.卤素单质与氢气的反应: X2 + H2 = 2 HX卤素单质与H2 的猛烈程度:依次减弱;生成的氢化物的稳定性:依次减弱4. 非金属性的强弱的推断依:1. 从最高价氧化物的水化物的酸性强弱,或与H2反应的难易程度以及氢化物的稳定性来推断。
2. 同主族从上到下,金属性和非金属性的递变:同主族从上到下,随着核电核数的增加,电子层数渐渐增多,原子核对最外层电子的引力渐渐减弱,原子得电子的力量减弱,失电子的力量增加,即非金属性渐渐减弱,金属性渐渐增加。
3. 原子结构和元素性质的关系:原子结构打算元素性质,元素性质反应原子结构。
同主族原子结构的相像性和递变性打算了同主族元素性质的相像性和递变性。
三.核素(一)原子的构成:(1)原子的质量主要集中在原子核上。
(2)质子和中子的相对质量都近似为1,电子的质量可忽视。
-元素周期律_知识点总结
元素周期表与周期律知识总结知识结构图:一·周期表结构二·“位,构,性”的相互推导元素周期律三·原子结构四·碱金属五·卤素一.周期表结构1.元素周期表注意:A元素周期表的上界②金属与非金属的边界线B元素周期表中几个量的关系:(1)原子序数=核电荷数=质子数=核外电子数(2)周期序数=核外电子层数(3)主族序数=最外层电子数=元素的最高正价数(F无正价,O一般也无正价)(4)非金属元素:|最高正价数|+|负价数|=8C主族元素化合价(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);(2)同一主族的元素的最高正价、负价均相同(3)主族元素的最高正价和+最低负价的绝对值=82. 推断元素位置的规律判断元素在周期表中位置应牢记的规律:(1)元素周期数等于核外电子层数;(2)主族元素的序数等于最外层电子数;(3)确定族数应先确定是主族还是副族,其方法是采用原子序数逐步减去各周期的元素种数,即可由最后的差数来确定。
最后的差数就是族序数,差为8、9、10时为VIII族,差数大于10时,则再减去10,最后结果为族序数。
3推算元素的原子序数的简便方法同一主族相邻两元素原子序数差值(上周期的元素种类数)同一周期相邻两主族元素的原子序数差值4.每个周期元素的总数和每个周期过渡元素的总数二.“位、构、性”的相互推导失电子能力↓⇒金属性↑1.结构与性质 原子半径↑⇒F↓得电子能力↓⇒非金属性↓(1)原子核对最外层电子的引力核电核数↓ ⇒F↓半径↓ 半径↑ (主)同周期 F↓ 同主族 F↓ 质子数↑ 质子数↓(次)2.位置与结构(1) 周期数=电子数主族序数=3位置与性质①、核外电子排布②、原子半径性质递变 ③、主要化合价④、金属性与非金属性⑤、气态氢化物的稳定性⑥、最高价氧化物的水化物酸碱性电子层数 相同条件下,电子层越多,半径越大。
原子结构与元素周期表教案
原子结构与元素周期表教案第一章:原子的基本概念1.1 原子定义:原子是物质的基本单位,由原子核和电子组成。
1.2 原子核:原子核由质子和中子组成,质子带正电,中子不带电。
1.3 电子:电子带负电,围绕原子核运动。
1.4 相对原子质量:相对原子质量是原子质量与碳-12原子质量的比值。
第二章:原子结构2.1 电子层:电子层是电子围绕原子核运动的轨道,按照能量大小分为不同的层。
2.2 电子亚层:电子亚层是电子层内部的能量相同的轨道,包括s、p、d、f等亚层。
2.3 原子轨道:原子轨道是电子亚层中的具体轨道,有不同的大小和形状。
2.4 泡利不相容原理:一个原子轨道上最多容纳两个电子,且电子自旋相反。
第三章:元素周期表的起源和发展3.1 道尔顿原子论:道尔顿提出原子是不可分割的小颗粒,同一元素的原子具有相同的原子质量。
3.2 门捷列夫周期表:门捷列夫根据元素的原子量和化学性质,将元素排列成周期表。
3.3 量子力学:量子力学的发展揭示了原子内部的电子排布和元素性质之间的关系。
3.4 现代周期表:现代周期表基于元素的电子排布,将元素分类为金属、非金属和半金属。
第四章:元素周期表的结构和特点4.1 周期:周期是周期表中垂直的列,周期数表示电子层数。
4.2 族:族是周期表中水平的行,族数表示最外层电子数。
4.3 主族元素:主族元素是最外层电子数为1至8的元素,包括IA至VIIIA族。
4.4 过渡元素:过渡元素是周期表中d区元素,具有不完全填充的d轨道。
第五章:元素周期表的应用5.1 元素查找:根据元素名称或符号,在周期表中查找元素的位置。
5.2 元素性质预测:根据元素在周期表中的位置,预测元素的化学性质和反应。
5.3 元素周期律:根据元素在周期表中的位置,总结出元素周期律,预测元素性质的变化趋势。
5.4 周期表的应用实例:周期表在化学、材料科学、环境科学等领域的应用。
第六章:原子核与同位素6.1 核反应:核反应是原子核发生变化的过程,包括衰变和人工转变。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
104 第七章 原子结构和元素周期律 Chapter 7 The Atomic Structure and Periodic System of Elements 这一章中,我们介绍物质的微观结构──原子结构。化学工作者总是希望通过对物质本质的认识,来阐明元素相互化合的原理,把化学事实系统化,使化学成为可以理解的、容易加以记忆的学科。人们利用这些原理来预言具有新功能的化合物的诞生。例如科学家利用等电子原理(the isoelectronic principle)合成新的化合物: In 1971, the following isoelectronic compounds were known:Ni(CO)4、Co(CO)3(NO)、Fe(CO)2(NO)2、and Mn(CO)(NO)3. The last member of this series, Cr(NO)4, was unknown. However, in 1972, several chemists had sufficient faith in the isoelectronic principle to photolyze a solution of Cr(CO)6 in the presence of NO ,and thus they prepared. For many years chemists were unsuccessfully tried to prepare the perbromate ion, 4BrO. The first successful synthesis of perbromate involved an isoelectronic species as the starting material. 8324SeO834BrO
因此,学习近代化学知识,从原子内部入手是完全必要的。我们所关心的原子内部,对于元素及化合物的性质而言,主要集中在原子的电子结构(electronic structure of atoms),特别是它们的价电子构型(valence electronic structure of atoms)。 原子(atom)这个字来自希腊的“atomos”,它的意思是不可分割的(indivisible)。早期的希腊哲学家是原子概念的创造者。例如Democritus(460-370B.C.)认为物质是由很小的、不可分的微粒组成(The matter is composed of small, indivisible particles, which are called atoms.)。不过一般认为英国的school teacher J.Dalton 在1803-1807年提出了原子理论(atomic theory),他是公认的原子论之父。他出身寒微,穷困不堪,终身未娶,致力于科学研究工作五十年。他是一位色盲的化学家(color blindness),所以现时往往称Daltonism为色盲。 在十九世纪后半叶,许多新的发现修正了道尔顿的原子概念,原子不再被看成是道尔顿所假设的简单实体,它是由许多微小粒子组成的复杂体系。
§7-1 原子内部的发现 The Discovery of Structure in Atom
一、亚原子粒子的电荷和质量 Table 7.1 The Charge and Mass of Subatomic Particles
particles charge Mass C e.s.u* g a.m.u* proton (P) 1.6021019 4.8031010 1.6721024 1.007276 neutron (N) 1.6751024 1.008665 electron (E) 1.6021019 4.8031010 9.1081028 0.0005484 e.s.u (electro static unit) a.m.u (atomic mass unit) 1a.m.u = 1.6605311024g 104
质子、中子和电子等是不能直接观察到的微小粒子,称为微观粒子(micro-particles)。那么人们是怎么样认识这些微观粒子的呢?下面我们讲发现这些基本粒子的一些著名实验,希望同学从这些基本粒子的发现过程,对于科学假说、科学实验和科学理论之间的相互关系有一个感性的认识,进而使同学懂得什么是科学方法。科学方法为我们提供了一种合乎逻辑的途径,以寻求许多问题的答案: 第一步:进行经过仔细筹划的科学实验,以收集能为该问题提供各方面素材的一些事实; 第二步:提出假设,以解释所获得的数据.然后用进一步的实验去验证此假设; 第三步:把假设上升为理论。如果某些假设能够说明某一领域的大量事实,就可以上升为理论,理论的功能在于它是进一步工作的指导原则,以它为依据,可以预见新的事实材料,为寻找更多事实材料指出方向; 第四步:若理论已达到作为普遍真理而被接受,就称为定律。 一般说来,化学中的理论和定律不象物理学中的理论和定律那么精确。这是因为化学研究的对象比物理模型复杂得多。正因为这些理论和定律之不够完美,能够促进大学生学习化学的兴趣,并为大家创造出更多发明的机会,这是一件好事。 二、原子结构的发现(The Discovery of Atomic Structure) 1.近代原子结构的微观理论起源于四个方面的研究工作: (1) Conductivity of low pressure gas. (2) Radioactivity (3) X-ray diffraction (4) Spectroscopy 2.Discovery of electron ── Cathode rays (1) 1897年,the British physicist J. J. Thomson (1856-1940),基本弄清了阴极射线的本质(图7.1),determined the ratio of electrical charge to mass: e / m = 1.7588108 coulombs per gram. (2) In 1909 Robert Millikan (1868-1953)of the University of Chicago succeeded in measuring the charge of an electron by performing an experiment known as the “Milliken oil drop experiment.”(图7.2)[ e = 1.6021019C, ∴Mass of a electron =
1.6021019 / 1.759108 = 9.111028g = 5.5104 (amu) ]
Fig 7.1 Thomson’s experiment to measure the Fig 7.2 Milliken oil-drop apparatus charge-to-mass ratio of the electron 3.The Rutherford’s nuclear atom(获1908年Nobel化学奖) (1) 放射性现象提供了研究原子内部结构和发现原子核的方法 In 1896 the French scientist Henri Becquerel(1852-1908)was studying a uranium mineral called pitchblende, when he discovered that it spontaneously emits high-energy radiation. 104
接着Marie Curie 从一吨沥青铀矿中分离出约0.2g的一种新元素化合物(溴 化物),这种新元素被命名为镭(radium)。美国化学家卢瑟福进一步研究了放射性的本质:revealed three types of radiation:alpha (α), beta (β), and gamma (γ) : Type of radiation Mass Charge Nature Alpha 4.0026 +2 Nuclear of helium atom Beta 1/1837 1 High-speed electron Gamma 0 0 High-energy radiation (2) Rutherford’s experiment on the scattering of α particles a.J. J. Thomson proposed that the atom consisted of a uniform positive sphere of matter in which the electrons were embedded. This model became known as the “plum-pudding” model, after the name of a traditional English dessert. Thomson’s atomic model was very short-lived. b.In 1910 Rutherford and his co-workers performed an experiment ( 图7.3 ) that led to the downfall of Thomson’s model on the scattering of α particles. 他们让α 粒子通过1000层金原子(400nm)的金箔,发现大偏转的α粒子出现的几率为510/1,即10万个α粒子中,只有一个α粒子发生90°以上的偏转。 他得出了如下的结论:(i) 原子中大部分空间是空的;(ii) 原子核的正电荷和质量都集中在一个很小体积的小球上。通过一层原子时,大偏折α粒子的几率为108,这说明S原子核 / S原子= 108,∴r原子核 /r原子= 104。根据这些结果,卢瑟福提出了原子有核模型。
4.质子的发现(Discovery of proton) 1886年 Goldstein把阴极制成多孔的阴极,发现有另外一种射线从阴极向与电子发射方向的相反的方向射出,它由残留在真空管的气体的正离子组成,称为阳极射线。若残留气体是氢气,那么组成阳极射线的将是氢离子(H+),即氢原子核,起名为质子。 5.中子的发现(Discovery of neutron) 1932年 Chadwick (British scientist)(1891-1972)发现,当用α粒子辐照金属铍时,产生一种有强穿透性的射线,是由中子组成的。
