杀伤细胞免疫球蛋白样受体与肿瘤免疫治疗
白细胞免疫球蛋白样受体家族及其与免疫相关疾病的关系

白细胞免疫球蛋白样受体家族及其与免疫相关疾病的关系赵阳;孙晨鸣;赵勇【摘要】当病原体感染时,机体天然免疫系统依赖于不同受体分子介导的免疫反应.天然免疫细胞的免疫反应程度可能是通过细胞多种激活和抑制性受体分子介导的信号通路来整合调控的.免疫球蛋白超家族在免疫反应中作为抗原受体、共刺激蛋白、黏附分子、免疫调节分子发挥重要作用.其中一组被称作白细胞免疫球蛋白样受体[1cukocyte immunoglobu lin(Ig)-like receptors,LILRs]或免疫球蛋白样转录物(ILTs)的分子家族既参与先天性免疫,也参与适应性免疫.该受体的研究起始于1997年[1],在研究细胞表面的巨细胞病毒主要组织相容性复合体(MHC)-Ⅰ类分子同源物UL18的受体时发现的个新的免疫球蛋白超家族的MHC-Ⅰ类分子受体LILR,在克隆LILR-1的cDNA时,应用白细胞免疫球蛋白样受体1( leukocyte Ig-like receptor.LIR-1)探针在southern印迹上得到多条杂交带,证明LIR多基因家族的存在.此后,人们对该家族的研究发现其成员结构的多样性,在免疫应答中既有负性调节作用,亦有正性调节作用,并与某些疾病的病程、病情有关.本文拟对该受体家族的研究进展做如下简要综述.【期刊名称】《中国医药生物技术》【年(卷),期】2011(006)005【总页数】6页(P368-373)【作者】赵阳;孙晨鸣;赵勇【作者单位】100101 北京,中国科学院动物研究所生物膜与膜生物工程国家重点实验室移植生物学研究组;100101 北京,中国科学院动物研究所生物膜与膜生物工程国家重点实验室移植生物学研究组;100101 北京,中国科学院动物研究所生物膜与膜生物工程国家重点实验室移植生物学研究组【正文语种】中文当病原体感染时,机体天然免疫系统依赖于不同受体分子介导的免疫反应。
天然免疫细胞的免疫反应程度可能是通过细胞多种激活和抑制性受体分子介导的信号通路来整合调控的。
肿瘤免疫治疗的免疫耐受性机制

肿瘤免疫治疗的免疫耐受性机制肿瘤免疫治疗是一种新兴的治疗方法,通过激活和增强机体免疫系统的功能,以识别和攻击癌细胞。
然而,尽管肿瘤免疫治疗在某些患者中取得了显著的疗效,但在大多数情况下,治疗效果并不理想。
这是因为肿瘤细胞具备一定的逃逸机制,使得机体免疫系统对肿瘤免疫治疗产生免疫耐受性。
在了解肿瘤免疫治疗的免疫耐受性机制之前,我们先来了解一下免疫耐受性的概念。
免疫耐受性是指机体对特定抗原产生的一种非反应性状态,使其不对该抗原产生免疫应答。
在正常情况下,免疫系统能够识别并杀灭异常细胞,包括癌细胞。
然而,肿瘤细胞通过多种方式干扰机体免疫系统的正常功能,从而产生免疫耐受性。
首先,肿瘤细胞可以选择性地表达免疫检查点分子,如PD-L1,这些分子能够与机体免疫细胞表面的PD-1结合。
PD-1/PD-L1信号通路的激活能够抑制机体免疫细胞的活性,从而减少对癌细胞的攻击。
此外,肿瘤细胞还可以分泌免疫抑制因子,如TGF-β和IL-10,来抑制机体免疫细胞的功能。
其次,肿瘤细胞可以改变其表面抗原的表达,以逃避机体免疫系统的识别和攻击。
这种现象被称为抗原下调调节,可以通过多种机制实现,如产生表面抗原突变或摄取和降解周围环境中的抗原等。
抗原的下调活化降低了机体免疫细胞对癌细胞的免疫识别能力,从而促进肿瘤的进展。
此外,肿瘤细胞还可以形成免疫抑制微环境,包括免疫抑制性细胞、免疫抑制性细胞因子和缺乏足够的效应细胞等。
免疫抑制性细胞包括肿瘤相关巨噬细胞(TAMs)和调节性T细胞(Treg),它们能够抑制机体免疫细胞的功能,从而抑制对癌细胞的攻击。
免疫抑制性细胞因子如IL-10和TGF-β能够抑制机体免疫细胞的活性,进一步促进肿瘤的逃逸。
此外,由于缺乏足够的效应细胞,机体免疫细胞可能无法形成有效的免疫应答,导致肿瘤免疫治疗的失败。
针对肿瘤免疫治疗的免疫耐受性,研究人员已经提出了一些解决方案。
一种策略是联合应用免疫检查点抑制剂和其他治疗方法,如化疗、放疗或靶向治疗。
car-t原理

car-t原理CAR-T免疫细胞治疗(Chimeric Antigen Receptor T-cell Therapy)是一种新型的癌症治疗方法,它利用患者自身的免疫细胞来攻击癌细胞。
CAR-T疗法的原理是将患者的T细胞进行基因改造,使其具有特异性地识别和杀伤肿瘤细胞的能力,从而达到治疗癌症的目的。
CAR-T疗法的原理基于人工合成的嵌合抗原受体(Chimeric Antigen Receptor,CAR)。
CAR是一种融合蛋白,它包括一个特异性的抗原识别结构域和一个T细胞激活结构域。
CAR的抗原识别结构域通常由单链抗体的可变区域构成,这使得CAR能够特异性地识别肿瘤细胞表面的抗原。
一旦CAR与肿瘤细胞表面的抗原结合,它会激活T细胞,并促使T细胞产生杀伤作用,从而杀死肿瘤细胞。
CAR-T疗法的具体步骤包括,首先,从患者的血液中提取T细胞;然后,在实验室中利用病毒载体将CAR基因导入T细胞中,使T细胞表达CAR蛋白;接着,经过体外扩增,产生大量CAR-T细胞;最后,将CAR-T细胞重新注入患者体内。
一旦CAR-T细胞进入患者的体内,它们将寻找并攻击肿瘤细胞,从而发挥治疗作用。
CAR-T疗法的优势在于其高度个体化和特异性。
由于CAR-T细胞是从患者自身的免疫细胞中提取和改造而来,因此不存在排斥反应的风险。
此外,CAR-T细胞能够特异性地识别肿瘤细胞表面的抗原,从而减少对正常细胞的伤害。
这使得CAR-T疗法相较于传统的放化疗和放射治疗具有更好的安全性和疗效。
然而,CAR-T疗法也存在一些挑战和限制。
首先,CAR-T疗法的生产成本较高,需要耗费大量的时间和资源。
其次,CAR-T疗法在治疗过程中可能引发严重的不良反应,如细胞因子释放综合征和神经系统并发症。
此外,CAR-T疗法目前仅适用于部分癌症类型,如B 细胞恶性淋巴瘤和急性淋巴细胞白血病,对于其他类型的癌症尚未得到广泛应用。
综上所述,CAR-T疗法作为一种新型的癌症治疗方法,具有独特的优势和潜在的应用前景。
【国家自然科学基金】_移植物抗白血病效应_基金支持热词逐年推荐_【万方软件创新助手】_20140731
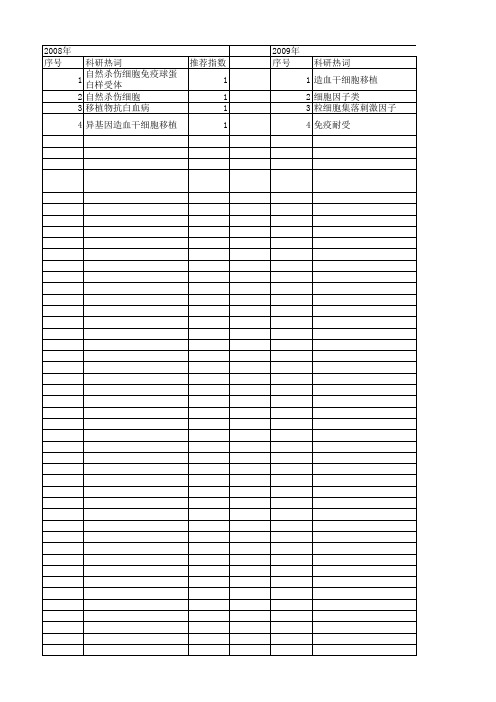
2012年 序号 1 2 3 4 5 6 7 8 9
科研热词 靶向免疫 过继细胞免疫治疗 自然杀伤细胞 肿瘤 移植物抗宿主病 异基因造血干细胞移植 嵌合抗原受体 基因治疗 1-磷酸鞘氨醇受体5
推荐指数 1 1 1 1 1 1 1 1 1
2013年 序号 1 2 3 4 5 6 7 8 9 10
科研热词 移植物抗宿主病 骨髓移植 移植物抗白血病效应 造血干细胞移植 过继免疫治疗 转基因 调节性t细胞 移植物抗白血病 淋巴细胞输注 异基因造血干细胞移植 复发 供者 t淋巴细胞,调节性
推荐指数 3 2 2 1 1 1 1 1 1 1 1 1 1
2011年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19
2011年 科研热词 推荐指数 造血干细胞移植 2 移植物抗白血病 2 综述文献 1 结直肠肿瘤 1 移植预处理 1 移植物白血病反应 1 移植物抗肿瘤效应 1 移植物抗宿主病/病理生理学 1 移植物抗宿主病 1 移植,异种 1 白血病治疗 1 白血病 1 次要组织相容性抗原 1 树突细胞 1 杀伤细胞,天然/生理学 1 异基因造血干细胞移植 1 异基因干细胞移植 1 γ -干扰素 1 t淋巴细胞 1
科研热词 造血干细胞移植 过继免疫治疗 肿瘤靶向治疗 慢性淋巴细胞白血病 嵌合抗原受体 地西他滨 免疫调节 免疫治疗 γ δ t细胞 dna甲基化
推荐指数 3 1 1 1 1 1 1 1 1 1
2014年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
2014年 科研热词 推荐指数 移植物抗宿主病 2 预后 1 造血干细胞移植 1 肿瘤坏死因子相关凋亡诱导配体 1 细胞凋亡 1 移植物抗骨髓瘤效应 1 移植物抗白血病 1 白血病 1 清髓性预处理 1 异基因造血干细胞移植 1 多发性骨髓瘤 1 外周血干细胞移植 1 减低毒性预处理 1 减低剂量预处理 1 t(17 1 19)-急性淋巴细胞白血病 1
14 固有免疫

(3)杀伤靶细胞:
1、巨噬细胞被LPS或IFN-和GM-CSF激活后表 面调理性受体/非调理性受体表达增加;细胞 内溶酶体数目和其他杀菌物质和酶类浓度显著 增高。 2、活化的巨噬细胞分泌大量的TNF-α,诱导肿瘤 或病毒感染等靶细胞发生凋亡。 3、在肿瘤特异性抗体参与下,通过ADCC效应杀 伤肿瘤。
特性:对玻璃和塑料表面有很强的黏附能力。借此可与淋巴细胞分离。 主要作用: 清除体内衰老损伤、凋亡的细胞,清除免疫复合物、 病原体等抗原性异物。
1. 巨噬细胞表面受体及其识别的配体
(1)模式识别受体(pattern recognition receptor ,PRR):
指固有免疫细胞表面或胞内器室膜上能够识别病原体某 些共有特定分子结构的受体。 PRR包括膜型和分泌型两种类 型。 膜型PRR主要包括: 1)甘露糖受体(Mannose receptor,MR): 识别微生物细胞壁糖蛋白和糖脂分子末端的甘露糖和岩 藻糖残基,介导吞噬细胞对微生物的吞噬。 2)清道夫受体(scavenger receptor,SR): 可识别乙酰化低密度脂蛋白、G-菌的脂多糖(LPS)和 G+菌磷壁酸、磷脂酰丝氨酸等。有效地清除血循环中的 细菌及衰亡的细胞。
(2)参与和促进炎症反应:
1、巨噬细胞能被炎性细胞因子吸引至炎症部位
巨噬细胞通过表面的MCP-1R、GM-CSFR、 M-CSFR和IFN-R结合感染部位的相应细胞因子, 增强吞噬杀伤能力而参与炎症反应。
2、巨噬细胞可分泌炎性相关的CK,增强炎症反应
趋化因子:MIP-1/、MCP-1和IL-8,募集、活化更多 的M、中性粒细胞和淋巴细胞。 炎症CK:IL-1β、TNF-α、IL-6; 炎性介质:如前列腺素、白三烯、血小板活化因子;分 泌IFN- /和一些列胞外酶如溶菌酶、胶原 酶、尿激酶、弹性酶。 适度的炎症反应对机体有益,严重感染时,体内产生大量促 炎细胞因子、胞外酶等,则可产生对机体有害的病理变化。
医学免疫-名词解释

名词解释1.Immunity,免疫指机体识别和排除"非己"物质,维持机体生理平衡和稳定的功能。
2.Immunity defence,免疫防御指防止外界病原体的入侵,并清除已入侵病原体及其他有害物质的一种免疫保护功能。
3.Immunity homeostasis,免疫自稳指机体清除衰老、变性及损伤细胞的功能。
4.Immunology surveillance,免疫监视指机体免疫系统识别和清除由于突变、畸形或病毒感染而表达新抗原的一种生理性保护功能。
5.Lymphocyte homing,淋巴细胞归巢指成熟淋巴细胞离开中枢淋巴器官后,经血液循环趋向性迁移,并定居在外周淋巴器官或组织的特定区域。
6.Antigen,抗原指能与T、B淋巴细胞的TCR或BCR结合,使其增殖、分化、产生抗体或致敏淋巴细胞,并与之结合从而发挥免疫效应的物质。
7.Immunogenicity,免疫原性指抗原刺激机体产生免疫应答,诱导产生抗体或致敏淋巴细胞的能力。
8.Antigenecity,抗原性指抗原与其诱导产生的抗体或致敏淋巴细胞特异性结合的能力。
9.Hapten,半抗原指只具有抗原性而无免疫原性的物质。
10.Epitope,抗原表位指抗原分子中决定抗原特异性的特殊化学集团,是与TCR、BCR或抗体特异性结合的基本结构单位,其种类性质数目和空间结构决定了抗原的特异性,又称抗原决定簇。
11.Sequential epitope,顺序表位又称线性表位,由连续线性排列的短肽构成,主要是T细胞表位。
12.Conformational epitope,构象表位指短肽或多糖残基在空间上形成特定的构象,多见于B细胞表位。
mon epitope,共同抗原表位指不同抗原所含有的相同或相似的抗原表位。
14.Cross-reaction,交叉反应指抗体或致敏淋巴细胞对具有相同和相似表位的不同抗原的反应。
15.Heterophilic antigen,异嗜性抗原指一类与种属无关,存在于人、动物及微生物间的共同抗原,又称Forssman抗原。
癌症免疫疗法的生物学原理
癌症免疫疗法的生物学原理 引言: 随着现代医学技术的不断发展,癌症治疗逐渐从传统的手术、放化疗向新兴的免疫疗法转变。癌症免疫疗法以调节人体自身免疫系统来抑制肿瘤生长和扩散,被誉为革命性的医学突破。本文将深入探讨癌症免疫疗法的生物学原理,包括肿瘤免疫逃避机制、肿瘤相关抗原和T细胞识别、免疫检查点等方面。
一、肿块逃逸机制 当人体组织出现异常增殖的癌细胞时,正常情况下会启动自身免疫防御反应。然而,许多恶性肿瘤具备通过突变、表达抑制分子等方式逃避人体自身免疫监视的能力。
1.1 共刺激分子失活 在正常情况下,共刺激分子(如CD80/86)通过与T细胞上共受体(如CD28)结合来增强T细胞的活化,从而引发免疫应答。然而,某些癌细胞通过下调共刺激分子的表达或高表达抑制性共住体分子(如PD-L1),使得T细胞失去活化信号,从而逃避免疫攻击。
1.2 免疫抑制细胞增加 肿瘤微环境中存在大量免疫抑制性细胞,例如调节性T细胞(Treg)和肿瘤相关巨噬细胞(TAMs)。这些免疫抑制性细胞通过释放因子(如TGF-β、IL-10等)或直接接触方式,抑制其他免疫细胞的活性,减少对肿瘤的攻击。
二、肿瘤相关抗原与T细胞识别 为了激活免疫系统对癌细胞进行攻击,关键在于促使T细胞识别和杀伤肿瘤相关抗原。 2.1 肿瘤特异性抗原 肿块所产生的蛋白质异常会导致新的多肽被形成,并经MHC I类分子展示在肿瘤表面。这些新的多肽被识别为异物,成为肿瘤特异性抗原(TAA),进而激活CD8+ T细胞的攻击。
2.2 肿瘤相关抗原 除了TAA以外,还存在一类广泛表达于多种癌细胞中的抗原,称为肿瘤相关抗原(TRA)。TRA通常由正常组织所表达但在癌细胞中过度表达或突变,可以被T细胞识别并发动免疫攻击。
三、免疫检查点 免疫检查点是通过调节T细胞激活信号来控制免疫应答的分子。在正常情况下,它们对于防止过度活化和自身免疫反应起到重要作用。然而,在肿瘤微环境中,恶性细胞会利用这些机制逃避免疫系统。
肿瘤免疫逃逸机制及治疗新思路
肿瘤免疫逃逸机制及治疗新思路肿瘤免疫逃逸(Tumor escape)是指肿瘤细胞通过多种机制逃避机体免疫系统识别和攻击,从而得以在体内生存和增殖的现象。
机体免疫系统具有免疫监视功能,当体内出现恶变细胞时,免疫系统能够识别并通过免疫机制特异地清除这些“非己”细胞,抵御肿瘤的发生发展。
然而,恶变细胞在某些情况下能通过多种机制逃避机体的免疫监视,在体内迅速增殖,形成肿瘤。
也就是说:一方面,机体可通过天然和获得性免疫抵抗肿瘤的发生;另一方面,肿瘤细胞可通过多种机制逃避机体免疫的识别和攻击。
肿瘤的发生与否及转归如何都取决于这两方面的总体作用。
肿瘤免疫逃逸机制的深入研究,为探讨肿瘤免疫治疗提供了新思路。
目前有很多致力于逆转体内肿瘤免疫逃逸的免疫治疗方案,其中相当一部分已经应用于临床。
本文简要阐述了近年来肿瘤免疫逃逸机制和免疫治疗的研究进展。
多种机制参与了肿瘤免疫逃逸。
其中免疫监视的免疫“选择”也促使了肿瘤得以逃避免疫攻击。
免疫监视学说的新观点认为,机体免疫系统可清除机体中对免疫应答敏感的肿瘤细胞,而对免疫应答不敏感的肿瘤细胞则被“选择性”的存留下来并得以快速增殖。
因此认为免疫监视一方面也促使这些具有免疫逃逸能力的肿瘤细胞快速增殖,机体抗肿瘤免疫能力越来越弱。
然而,免疫“选择”的前提是肿瘤细胞获得抵御免疫攻击和/或抑制机体免疫应答的能力,即获得免疫逃逸的能力。
免疫耐受、免疫抑制和免疫衰老是肿瘤获得免疫逃逸能力的主要机制。
1. 分泌免疫抑制因子或激活免疫抑制细胞研究发现,某些肿瘤细胞能通过自分泌或旁分泌形式分泌免疫抑制因子,如转化生长因子β(TGF-β)、白细胞介素-6(IL-6)和前列腺素E(PGE2)等,能抑制机体对肿瘤细胞的杀伤。
肿瘤可诱导机体产生免疫抑制细胞,对机体抗肿瘤免疫应答起着负性调节作用,是肿瘤免疫逃逸的主要机制之一。
研究证实,肿瘤患者血液和肿瘤组织中存在能够抑制机体抗肿瘤免疫应答的调节性T细胞(Regulatory T cells, Treg)[1]。
癌症免疫治疗中的CART细胞疗法
癌症免疫治疗中的CART细胞疗法癌症是当今社会的一大健康威胁,医疗界一直在寻求新的治疗方法来对抗这个疾病。
免疫治疗作为一种被广泛研究的领域,近年来取得了巨大的突破。
其中,CART(Chimeric Antigen Receptor T cell)细胞疗法是一项备受瞩目的治疗手段。
本文将对CART细胞疗法的原理、应用领域以及未来发展进行探讨。
1. CART细胞疗法的原理CART细胞疗法是一种通过改造患者自身的T细胞,使其具备更强的抗肿瘤能力来治疗癌症的方法。
该疗法的核心是将具有特异性的嵌合抗原受体(CAR)导入T细胞,使其能够识别和攻击癌细胞。
CAR由抗原识别单克隆抗体的外膜结合区与T细胞的信号传导区融合而成,可以在不依赖于外源类抗原递呈分子(MHC)的情况下识别和杀伤肿瘤细胞。
2. CART细胞疗法的应用领域CART细胞疗法作为一种个体化的治疗方法,可以应用于多种类型的癌症治疗中,特别是那些对传统治疗无效或难以治疗的恶性肿瘤。
例如,CART细胞疗法在治疗淋巴瘤、白血病和多发性骨髓瘤等血液肿瘤方面取得了显著的效果。
此外,该疗法也被广泛应用于实体瘤的治疗,例如肺癌、乳腺癌和结直肠癌等。
3. CART细胞疗法的优势和挑战CART细胞疗法相较于传统治疗方法具有许多优势。
首先,它是一种个体化的治疗方法,可以根据患者的具体情况进行定制,提高治疗效果。
其次,CART细胞疗法具有长期效应,因为CAR T细胞在体内可以持续增殖,并形成长效的免疫记忆。
然而,CART细胞疗法仍面临一些挑战,例如治疗反应不一致、严重的细胞毒性副作用和复发等。
4. CART细胞疗法的未来发展随着技术的进一步发展,CART细胞疗法在未来有望实现更加精准的治疗。
一方面,研究人员正努力改进CAR的结构和功能,以提高CART细胞的识别和攻击能力。
另一方面,基因编辑技术的进步也将有助于优化CART细胞的制备和治疗效果。
此外,与其他免疫治疗方法相结合,如免疫检查点抑制剂和细胞因子疗法等,也将进一步扩大CART细胞疗法的适应症。
第五单元 免疫球蛋白
4.IgG包括四个亚类,其中IgGl-3与相应抗原结合后,可激活补体传统途径。IgG与细菌等颗粒性抗原或肿瘤和病毒感染的靶细胞结合后,可通过其Fc段与吞噬细胞和NK细胞表面相应受体结合,介导调理吞噬和ADCC效应。
(二)lgM的特性和功能
1.IgM主要由脾脏中浆细胞合成,为五聚体,有较高抗原结合价,也是分子量最大的Ig。
三、免疫球蛋白的类型
(一)免疫球蛋白的同种型(类、亚类、型和亚型)
同种型(isotype)是指同一种属所有正常个体免疫球蛋白分子共同的抗原特异性标志。Ig同种型抗原特异性因种而异,如用人某类Ig免疫动物获得抗人Ig抗体,能与任何一个人的该类Ig特异性结合,而不能与其他物种的Ig发生反应。同种型抗原决定簇存在于Ig恒定区,根据Ig重链或轻链恒定区同种型抗原决定簇的不同,可将Ig分为若干类、亚类、型和亚型。
5.介导I型超敏反应IgE为亲细胞抗体,可通过其Fc段与肥大细胞和嗜碱性粒细胞表面相应IgEFc受体结合,而使上述免疫细胞处于致敏状态。当相同变应原再次进入机体与致敏靶细胞表面特异性lgE结合时,即可使之脱颗粒,释放组胺等免疫球蛋白的特性和功能
(一)lgG的特性和功能
2.IgM能通过血管壁,主要存在于血液中,在补体和吞噬细胞参与下,其杀菌、溶菌、激活补体促进吞噬等作用均显著高于其他Ig,对防止菌血症发生具有重要作用。
3.IgM是种属进化过程中最早出现的Ig,也是个体发育过程中最早产生的Ig,通常在胚胎晚期即可生成,因此若脐带血或新生儿血清中IgM水平升高,表明胎儿曾有宫内感染。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
在骨髓移植中,如果供受者之间存在 HLA-C等位基因不相合,则供者的KIR不能 识别受者相应的HLA配体,抑制信号被阻 断,NK细胞被激活,攻击宿主的肿瘤细胞, 产生移植物抗白血病(GVL)效应。在一 个T细胞去除的HLA半相合而KIR不相合的 造血干细胞移植中,供者NK细胞能介导有 力的针对白血病细胞的GVL效应。
NK细胞表面的抑制性KIR受体,能识别并结合自 体细胞表面的MHCⅠ类分子,传导抑制性信号至 胞内,阻止NK细胞激活,从而阻止对正常表达 MHCⅠ类分子的细胞的杀伤。不能表达正常水平 MHCⅠ类分子的病态细胞则成为被NK细胞攻击 的对象,例如肿瘤细胞及病毒感染细胞,此即 “迷失自我(missing-self)”学说。因此,在异 基因造血干细胞移植后产生的移植物抗白血病效 应(GVL)和过继免疫治疗后的移植物抗肿瘤效 应(GVT)中,异源反应性NK细胞被激活,而杀 伤瘤细胞。这一现象已在临床中被用来治疗血液 系统肿瘤和肾癌、黑色素瘤等实体肿瘤 。
KIR基因 基因
最近的基因学检测显示,人群中KIR基因区 在基因容量和等位基因的数量上表现出广 泛的多态性。KIR基因有十余种,均为共显 性表达,每个基因又有十余种等位基因,因此 无关个体KIR基因表达完全相同的可能性低 于0.124%。人类的这个片段所表现出的多 样性水平与人类MHC多态性相类似。
已经发现的KIR均可在T细胞表达,多数为 CD8+T细胞,约占外周血T细胞的5%,称为 KIR+T细胞,其表型缺乏CD28,表达高水平 CD18、CD29、CD57 和CD45。T细胞上的KIR 抑制T细胞抗原受体(TCR)介导的细胞毒功能, 抑制CTL细胞对自身细胞的反应性。IL-15能促进 成熟T细胞KIR的表达。另外,TGF-β和IL-10也 能诱导刺激性T细胞表达CD94/NKG2A。多数肿 瘤细胞能产生TGF-β和IL-10等细胞因子,因此, 肿瘤本身能向肿瘤特异性CTL提供KIR表达的必 需信号,促进CTL细胞表达抑制性KIR,抑制 TCR功能,逃避CTL细胞的攻击。
杀伤细胞免疫球蛋白样受体与肿 瘤免疫治疗
杀伤细胞的免疫球蛋白样受体(Killer cell immunoglobulin-like receptor,KIR)基 因定位于人类19号染色体上,编码激活性 受体和抑制性受体,表达于NK细胞和部分 T细胞亚群表面,具有重要的生物学意义。 近年来关于杀伤细胞免疫球蛋白样受体 (KIR) 的研究,为异基因造血干细胞移植等 肿瘤免疫治疗模式提供了新的理论基础和 研究方向。
谢谢! 谢谢!
KIR不相合的异基因过继免疫治疗
因为异基因造血干细胞移植后,给受者进行供者淋巴 细胞输注(DLI)有助于肿瘤消退,尤其在慢性粒细胞性 白血病(CML)的治疗中最为有效,提示了异基因淋巴 细胞输注治疗实体瘤的过继免疫治疗的可行性。
目前在KIR与配体识别机制及信号传导等方面已获得一定 进展。关于抑制性受体的研究已较为深入,尤其在血液系 统肿瘤治疗方面,但是,抗肿瘤是个复杂的、多种因素共 同起作用的过程,是各种免疫细胞综合作用的结果。NK 细胞对于各类实体瘤的杀伤过程中KIR是否都起到关键作 用,还需要进一步探讨。淋巴细胞白血病、淋巴瘤对于 NK细胞的杀伤就表现出高度的不敏感性,但增强NK细胞 活性可以提高对ALL的杀伤率。针对激活性KIR而设计的 增强NK细胞杀伤活性尚在初步研究中。从激活KIR的角 度出发,提高NK细胞的杀伤活性,有待在肿瘤生物治疗方面 提供一条新的思路。
KIR与肿瘤过继免疫治疗 与肿瘤过继免疫治疗
KIR不相ቤተ መጻሕፍቲ ባይዱ的异基因造血干细胞移植
给严重联合免疫缺陷小鼠种植人急性粒细胞性白 血病(AML)细胞,5~6周后发病,分别给予异种反应 型NK细胞(供受者KIR不相合)和同种反应型NK细胞 NK KIR NK (供受者KIR相合),接受异种反应型NK细胞组的AML 小鼠平均存活120天,接受同种反应型NK细胞的小鼠在 18天内死亡,证明NK细胞具有显著的移植物抗白血病 (GVL)作用。
