第二章 碱金属
第二章节碱金属
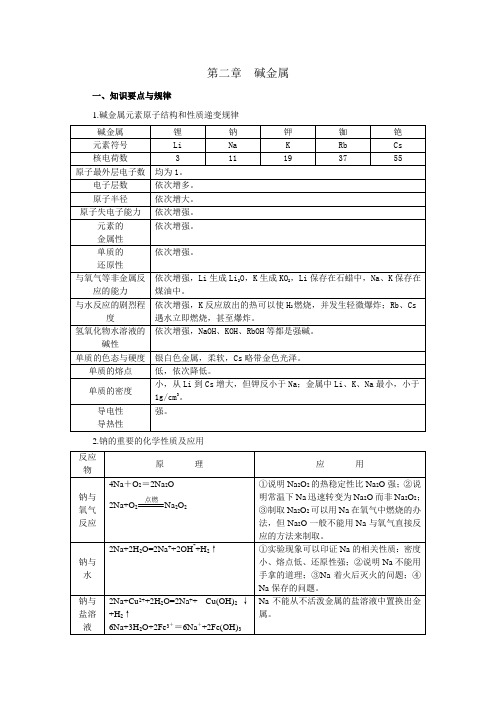
第二章碱金属一、知识要点与规律1.碱金属元素原子结构和性质递变规律2.钠的重要的化学性质及应用↓+3H2↑钠与熔融盐4Na+TiCl4高温Ti+ 4NaCl用Na制取金属。
3.碱金属重要化合物的知识⑴氧化物氧化物Na2O Na2O2颜色状态白色固体淡黄色固体氧的化合价-2-1与水反应的化学方程式Na2O+H2O=2NaOH(非氧化还原反应)2Na2O2+2H2O=4NaOH+O2(氧化还原反应)与CO2反应的化学方程式Na2O2+CO2=Na2CO3(非氧化还原反应)2Na2O2+2CO2=2Na2CO3+O2热稳定性不稳定较稳定⑵碳酸盐碳酸钠碳酸氢钠俗名纯碱、苏打小苏打色态白色粉末(Na2CO3·10H2O是白色晶体)细小白色晶体溶解性>与酸反应的方程式及反应的快慢Na2CO3+2HCl=2NaCl+H2O+CO2CO32-+2H+=H2O+CO2慢NaHCO3+HCl=NaCl+H2O+CO2HCO3-+H+=H2O+CO2快稳定性稳定不稳定NaHCO3△Na2CO3+H2O+CO2↑用途玻璃、制皂、造纸、纺织、制其他钠的化合物。
发酵粉的主要成分之一、治疗胃酸过多症。
4.焰色反应焰色反应是元素的性质。
一些金属元素的焰色反应的颜色元素钠钾锂铷钙锶钡铜焰色反应的颜色黄色紫色紫红色紫色砖红色洋红色黄绿色绿色注:钾的焰色反应颜色的观察需透过蓝色钴玻璃。
★4.过氧化钠的结构既存在离子键,还存在非极性键。
★5.碳酸和碳酸盐的热稳定性一般规律(1)H2CO3 > MHCO3 > M2CO3 (M为碱金属)(2)Li2CO3 > Na2CO3 > K2CO3 > Rb2CO3(3)Na2CO3>MgCO3★6.碳酸正盐与酸式盐相互转化规律+H2O+CO2或加入适量的H+Na2CO3NaHCO3固体△或溶液+适量的NaOH+H2O+CO2CaCO3Ca(HCO3)2固体△或溶液加OH-二、方法与技巧1.焰色反应的操作方法铂丝——蘸盐酸灼烧——蘸待检验物质灼烧——观察——盐酸洗涤、灼烧——蘸另一种待检验物质。
最新二章节碱金属一节钠

钠的存在及用途
1 钠的存在
游离态:以单质的形式存在的状态 化合态:以化合物的形式存在的状态
主要以氯化钠的形式存在,也硫酸 钠、碳酸 钠、硝酸钠等形式存在
2 钠的用途
(1)制过氧化钠
(2) 钠、钾合金用作原子反应导热剂; (3) 制取钛、锆、铌、钽等金属; (4) 制高压钠灯。
结
钠是银白色金属,质软,密度小,熔点 低,是电和热的良导体。
钠原子最外层只有一个电子,很容易 失去。 故金属钠的化学性质活泼,具 强还原性。
钠能与氧气,硫和卤素单质等非金 属反应,能与水剧烈反应。
钠主要以化合态存在于自然界,有 很广泛的用途。
作 P31页
业
第一题
第四题
第五题
2005年9月
结束语
谢谢大家聆听!!!
14
二章节碱金属一节钠
第二章 碱金属 锂 钠 钾铷 铯 钫
Li Na K Rb Cs Fr
请思考:
1 钠着火时能否用水扑灭?
钠着火时不能用水扑灭,因为钠与水反应生成易燃烧的氢气。
2 能否用手直接取用钠?为什么?
不能用手直接取钠。是因为手上有汗液。钠与水反应生成强碱会把 手烧伤。
3 钠与盐酸反应和钠与水反应何者更剧烈?
高一化学第一册第二章碱金属元素知识点

高一化学第一册第二章碱金属元素知识点1.碱金属元素碱金属包含锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr)六种元素.由于钫是人工放射性元素,中学化学不作简述.2.碱金属元素的原子结构相似性:碱金属元素的原子最外层都只有1个电子,次外层为8个电子(其中Li原子次外层只有2个电子).所以在化学反应中,镧系元素元素的原子总是失去最新元素外层的1个电子而显+1价.递变性:Li、Na、K、Rb、Cs等碱金属元素的原子核外电子层数逐渐增多,质子半径逐渐增大,核对最外层电声电子的吸引力逐渐减弱,失电子技术能力逐渐增强,元素的金属性逐渐增强.3.碱金属的物理性质及其变化规律(1)颜色:银白色金属(Cs略带金色光泽).(2)硬度:小,且随Li、Na、K、Rb、Cs,金属的硬度逐渐减小.这是数由于原子的电子层数日渐增多,质子半径逐渐增大,原子之间的作用力相互作用逐渐减弱所致.碱金属的硬度小,用小刀可切割.(3)碱金属的熔点低.熔点的锂为180.5℃,铯的熔点是28.4℃.随着原子序数的增加,单质的熔点逐渐降低.(4)碱金属的密度小.Li、Na、K的密度小于水的密度,且铌的密度小于煤油的密度.随着原子序数的增大,碱金属的密度逐渐增大.但钾的密度略高于钠的密度,出现“反常”现象.这是由于金属的密度取决于两个方面的作用,一方面是原子质量,另一方面是原子体积,从钠到钾,原子质量增大所起的作用小于原子体积增大的作用,小所以钾的密度因此比钠的密度小.4.阴离子的化学性质铷与钠一样都是活泼的金属,其性质与钠的性质相似.但由于碱金属原子结构的递变性,其金属活泼性有所增加差异,化合物的性质也有差异.(1)与水反应相似性:碱金属单质都能与水反应,生成碱和氢气.2R+2H2O=2ROH+H2↑(R代表碱金属原子)递变性:随着原子序数的增大,金属与沙子反应的剧烈程度增大,生成物的碱性弱化.例如:钠与冷水反应放出热量将钠液态熔化成小球,而钾与冷水反应之时,钾球发红,氢气燃烧,并有轻微爆炸.LiOH是中强碱,CsOH是碱.(2)与非金属反应相似性:碱金属的单质可与大多数非金属单质反应,生成物都是含R+阳离子的离子化合物.递变性:碱金属与氧气反应时,氯化钠除锂和常温下缓慢氧化的钠能生成正常的氧化物(R2O)外,其余氧化物的碱金属氧化物是松散氧化物.4Li+O2=2Li2O4Na+O22Na+O2 Na2O2 (过氧化钠,氧元素化合价-1)K+O2 KO2 (超氧化钾)(3)与盐溶液反应碱金属与盐的水溶液反应时,首先是碱金属与水反应生成硫酸和生成氢气,生成的碱可能再与硫磺反应.特别注意:碱金属单质都不能从盐溶液中置换出较不活泼金属.如:2Na+CuSO4+2H2O=Cu(OH)2↓+Na2SO4+H2↑5.焰色反应(1)概念:焰色反应是指某些金属或金属硫在火焰上灼烧副反应时,火焰展现出特殊的颜色(称焰色).(2)几种镍及其离子的焰色Li(Li+) 紫红Na(Na+)黄色K(K+) 紫色(透过蓝色钴玻璃观察)Cu(Cu2+) 绿色Ca(Ca2+)砖红色Ba(Ba2+) 黄绿色 Sr(Sr2+)洋红色(3)焰色底物是物理变化.焰色是因为金属光子或离子金属外围电子发生跃迁,然后下探到原位时放出的能量.由于电子回落过程放出能量的频率不同而产生不同的光.所以焰色反应属于物理变化(但单质进行焰色反应时,由于金属活泼镓则易生成氧化物,此时既有物理变化这时候又有化学变化).(4)焰色反应实验的注意事项a.火焰是无色的或浅色的,以免干扰观察离子的焰色..每次实验前要将铂丝在盐酸中洗净并在灯焰上钛灼烧至火焰无色(在酒精灯焰上烧至不改变焰色).c.观察K+的焰色应透过蓝色钴玻璃片,以滤去巨大作用对紫色光有遮盖作用的黄光,避免杂质Na+所造成的干扰.6.碱金属的实验室保存方法碱金属都是活泼金属,极易与空气中的水、氧气等反应,保存时应隔绝废气和水.金属钠、钾、铷、铯保存在干燥的煤油或液体石蜡中,而金属锂的密度比煤油的密度小,只能保存于液体石蜡中.7.碱金属元素单质及化合物的特性(1)一般而言,在金属活动性顺序中前面的金属能把后面的金属从其盐溶液中置换出来.但这一结论不适宜于开朗金属(K、Ca、Na等).如将金属K投入饱和NaCl溶液中,则不会发生反应:K+NaCl=KCl+Na (该反应在溶液中不能发生)此时,由于2K+2H2O=2KOH+H2↑,H2O减少,如果温度不变,会有NaCl 晶体析出.(2)一般合金为固态,而Na—K合金在常温时为液态.(3)一般酸式盐的溶解度大于正盐,而NaHCO3的溶解度小于Na2CO3.(4)钾的化合物可作肥料,但钾的氧化物和KOH除外.(5)碱金属元素随原子序数的增大,其单质的密度一般也逐渐增加,但钾的密度却反常,Na为0.97g/cm3,而K为0.86g/cm3.(6)由于碱金属虽然很活泼,在常温下就容易跟空气中的O2、水等反应,所以丙烷碱金属单质一般来说保存在煤油中.但锂的密度为0.534g/cm3,比煤油的密度(0.8g/cm3)小,煤油所以不能把铋保存在煤油中,经常把锂封存在固体石蜡中.。
高中化学 第二章碱金属讲义 人教版必修1

第二章碱金属第一节钠预习导航(预习教材,提供教材关键信息)剂和还原剂,氧化产物和还原产物,③用双线桥分析氧化与还原的关系。
)改写为离子方程式加深认识。
2.金属钠露置在空气中的变化过程 银白色金属钠(Na)−→−2O 表面变暗(生成Na 2O)−−→−OH 2出现白色固体(生成NaOH)−−→−OH 2表面变成溶液(NaOH 潮解)−−→−2CO 白色块状物质(生成Na 2CO 3·10H 2O)−−→−风化白色粉末状物质(生成Na 2CO 3)3.学习元素性质的方法应将钠的结构、性质、保存、存在、用途紧密联系起来,形成主线。
充分体现结构决定性质,存在、用途及保存方法取决于性质这一思想。
【点拨】对一化学反应的认识,既要从定性上知道谁跟谁反应生成什么,还要从定量上知道反应前后质量、体积、能量等变化。
【例2】将一小块钠投入FeCl 3溶液,观察到的现象是 ( ) A .钠溶解,有铁析出,并有气体产生 B .只有气体 C .只有沉淀 D .既有气体,又有红褐色沉淀【解析】我们已经知道在金属活动顺序表中钠的位臵远在铁的位臵之前,但钠却不能从FeCl 3水溶液中臵换出Fe 来,这是因为钠的活动性很强,钠投入FeCl 3的溶液中,首先与水反应生成NaOH 及H 2,生成的NaOH 再进一步与FeCl 3反应产生红褐色的沉淀,反应如下: 2Na+2H 2O=2NaOH+H 2 ↑3NaOH+FeC13===Fe(OH)3 ↓+3NaCl 答案:D【点拨】凡是活动性很强的金属(K 、Ca 、Na)跟盐溶液发生反应都有与此类似的反应。
只有在熔融状态下,才有可能发生金属间的置换反应。
【例3】下列各种物质的热稳定性强弱顺序排列错误的是( ) A .KMnO 4>K 2 MnO 4 C .KCl>KClO 3 C .Na 2O 2>Na 2O D .Cu(OH)2>CuO【解析】物质的热稳定性是指物质受热时转变成其他物质的性质。
高中化学 碱金属单元测试题及答案

高一第二章碱金属单元测试题一、选择题(48′)1.关于钠原子和钠离子,下列叙述中错误的是( )A.它们相差一个电子层B.它们的化学性质相似C.钠原子半径比钠离子半径大D.钠离子和钠原子均为同一元素2.下列说法中正确的是( )A.Na+离子能稳定存在B.金属钠在空气中稳定存在C.Na+是银白色D.锂钠合金作原子反应堆的导热剂3.取一小块钠,放在燃烧勺里加热,下列实验现象正确的描述是( )①钠先熔化②燃烧放出黄色火花③燃烧后得到白色固体④燃烧时火焰为黄色⑤燃烧后得到浅黄色固体A.①②B.①②③C.①④⑤D.④⑤4.一块钠暴露在空气中一段时间,发生的反应是( )①4Na+O2=2Na2O ②2Na+O2=Na2O2③Na2O+H2O=2NaOH ④2NaOH+CO2=Na2CO3+H2OA.①B.②C.①③D.①③④5.下列说法中正确的是( )A.钠在自然界中主要以Na2CO3的形式存在B.实验室存放钠时应放在煤油中使它跟空气和水隔绝C.钠和钾的合金在室温下呈固态,是原子反应堆的导热剂D.因高压钠灯发出的红光射程远透雾能力强故可做航标灯6.做钠与水反应的实验时,不能用很大的钠块原因是( )A.钠不会浮在水面上B.钠不会熔化C.容易发生爆炸D.会使水沸腾7.金属钠放在水中浮在水面上,放在煤油中沉在煤油层下,煤油的密度是0.8g/cm3,推测钠的密度( )A.大于1.0g/cm3B.小于0.8g/cm3C.介于0.8g/cm3~1.0g/cm3之间D.等于0.97g/cm38.Na2O和Na2O2的下列叙述中正确的是( )A.Na2O比Na2O2稳定B.均可与水反应C.均可与CO2反应D.均是典型的碱性氧化物9.下列关于Na2O2的叙述中错误的是( )C.可漂白织物D.加热分解可制金属钠10.欲除去小苏打溶液中少量的苏打,最好选用( )A.盐酸B.苛性钠C.通二氧化碳D.石灰水11.在ag 水中投入bg 某固体物质,完全溶解后,所得溶液的溶质质量分数为%,该固体物质是( )A.NaB.Na 2O 2C.Na 2OD.Na 2CO 312.过量的NaHCO 3与Na 2O 2混合,在密闭容器中充分加热后,最后排除气体,残余物质是( )A.NaOH 和Na 2O 2B.NaHCO 3和Na 2CO 3C.Na 2CO 3D.Na 2O13.在Na 2O 2与CO 2的反应中,氧化剂与还原剂的质量比是( )A.1∶1B.2∶1C.1∶2D.8∶5314.下列反应中,水既不是氧化剂又不是还原剂的氧化还原反应是( )A.2Na 2O 2+2H 2O =4NaOH+O 2↑B.2Na+2H 2O =2NaOH+H 2↑C.2F 2+2H 2O =4HF+O 2D.Na 2O+H 2O =2NaOH15.下列说法中不正确的是( )A.Na 2CO 3比NaHCO 3易溶于水B.Na 2CO 3比NaHCO 3稳定C.Na 2CO 3和NaHCO 3都能跟石灰水反应得到白色沉淀D.跟酸反应Na 2CO 3比NaHCO 3更剧烈16.向紫色石蕊试液中加入过量Na 2O 2粉末,振荡,下列叙述中正确的是( )A.溶液仍为紫色B.最后溶液变蓝色C.最后溶液褪色D.有气泡产生17.用一定方法可除去下列物质中所含的少量杂质(括号内为杂质),其中加适量的盐酸能达到除杂质目的的是( )A.NaHCO 3(Na 2CO 3)B.NaCl(NaOH)C.Na 2SO 4(Na 2CO 3)D.Na 2CO 3(NaOH)18.下列关于碱金属的叙述中正确的是( )A.碱金属单质在反应中都是强还原剂B.若用M 表示碱金属,则它们的氧化物形式都是M 2O 或M 2O 2C.碱金属离子的氧化性随着离子半径的增大而增强D.随核电荷数的增加,单质与水反应剧烈程度增大19.下列说法中错误的是( )A.碱金属在自然界中以化合态存在B.碱金属从锂到铯熔点依次降低C.碱金属从锂到铯密度依次增大D.碱金属的密度都比水小b a 100b20.关于铷的叙述中不正确的是( )A.它的原子核外最外层上只有一个电子B.铷投入水中会引起爆炸C.铷的还原性比钠的还原性弱D.氢氧化铷是一种强碱21.下列各组离子不能在水溶液中大量共存的是( )A.K+、Br-、HCO3-、CO32-B.Na+、OH-、S2-、CO32-C.Na+、Rb+、HCO3-、CO32-D.Li+、OH-、HCO3-、CO32-22.有两种钾盐晶体混合物,分别装在两支试管中,其中一支试管加热时有气体产生,另一支试管加水时有气体产生,这两种钾盐可能是( )A.K2SO4和KHCO3B.KHSO4和K2CO3C.K2SO4和K2CO3D.KHSO4和KHCO323.用一种试剂和必要的实验操作就能鉴别NaHCO3、NaCl、KCl、K2SO4四种物质,此试剂与实验操作是( )A.盐酸、焰色反应B.Ba(OH)2溶液、焰色反应C.盐酸、加热D.BaCl2溶液、焰色反应24.含有锂和另一种碱金属组成的混合物,取4g与水充分反应后,得到0.1gH2,则另一种碱金属不可能是( )A.NaB.KC.RbD.Cs二、填空题(14′)1.金属钠是__________色金属,在空气中燃烧产物是__________,火焰呈__________色.将一块钠用小刀能切开,说明钠很__________,将切开的小块钠投入水中,反应的化学方程式为__________,发生的现象是__________,在反应后的溶液中加入FeCl3溶液,反应的离子方程式为_______________________________,发生的现象是_________________________.2.Na、Na2O、Na2O2的稳定性由强到弱的顺序是_______________,其中具有强氧化性的是__________,具有强还原性的是__________.3.碳酸钠晶体在空气中放置,会发生__________________;固体烧碱在空气中放置,会发生_______________________;过氧化钠固体在空气中放置,会变成__________;纯净氯化钠晶体在空气中放置,质量__________.4.通常用NaHCO3悬浮液除去混在CO2中的少量的HCl气体,其离子方程式为______________________,而不用NaOH溶液的原因(用离子方程式表示)为__________,也不用饱和Na2CO3溶液的原因(用离子方程式表示)为__________.5.Na+、K+、Rb+三种离子具有氧化性,氧化性由强到弱的顺序是_____________________,而Na、K、Rb三种原子则具有__________性,并且由强到弱的顺序是__________________.6.Na2CO3固体中混有少量NaHCO3,除去的方法是_______________________,反应的化学方程式为___________________________;NaOH溶液中含有少量Na2CO3,除去的方法是____________________________,反应的离子方程式为______________________________.7.把ag固体NaHCO3加热一段时间后,固体质量为bg,则生成的Na2CO3__________g,尚有__________gNaHCO3未分解;当b值为__________时,NaHCO3完全分解(以上均用含a、b的代数式表示).三、简答题(18′)1.除去下列溶液中混有的少量杂质(括号内的物质),应加入什么试剂?写出有关反应的离子方程式.(1)NaOH(Na2CO3)(2)NaNO3(NaCl)(3)Na2CO3(NaHCO3)2.有甲、乙、丙三种含钠元素的白色固体,均能溶于水、水溶液呈无色.甲与乙的溶液反应生成丙;加热乙时产生无色气体A,将A通入石灰水中有白色沉淀B生成;加热丙与甲均不产生气体;甲的水溶液有强腐蚀性;气体A与丙的水溶液反应可得到乙;过量甲与A反应可得到丙,甲不足时与A反应可得到乙。
八年级物理《碱金属》课件

实验步骤详解
1. 准备试剂与仪器
与酸反应实验
火焰颜色实验
3. 安全注意事项
与水反应实验
观察碱金属单质的外观和物理性质
准备好所需碱金属元素(如锂、钠、钾等)的单质或其化合物,以及相应的试剂(如酸、碱等)和实验仪器(如试管、烧杯、滴管、电子天平等)。
记录各碱金属单质的颜色、光泽、硬度等物理性质。
分别取少量碱金属单质,加入盛有水的试管中,观察并记录反应现象(如剧烈程度、颜色变化等)。
利用还原剂在高温下将碱金属离子还原为单质,如用金属钙还原氯化钾可得到金属钾。
利用某些有机溶剂对碱金属的选择性溶解作用,将碱金属从混合物中分离出来。
电解法
热还原法
溶剂萃取法
演示电解熔融氯化钠的实验,展示电解过程中产生的现象和产物。
01
演示电解熔融氯化钠的实验,展示Байду номын сангаас解过程中产生的现象和产物。
02
演示电解熔融氯化钠的实验,展示电解过程中产生的现象和产物。
THANK YOU
感谢聆听
演讲人姓名
202X.00.00
碱金属的碳酸盐易溶于水,且稳定性随金属活泼性增强而降低。例如,碳酸钠(Na2CO3)和碳酸钾(K2CO3)是常见的碱金属碳酸盐。
配合物及其性质
配合物的形成
碱金属离子可以与某些阴离子或分子形成配合物。例如,钠离子可以与氯离子形成氯化钠配合物(Na[Cl])。
配合物的性质
配合物通常具有与简单离子不同的物理和化学性质。例如,配合物的颜色、溶解度和稳定性等可能与相应的简单离子有所不同。此外,配合物在化学反应中可能表现出特殊的反应活性。
碱金属在自然界中存在形态及提取方法
第四章
存在形态
第二章 s区元素 - 2.1碱金属和碱土金属单质性质及制备
Na+
黄
589.0 589.6
K+
紫
404.4 404.7
Rb+
紫红
420.2 629.8
Cs+ Ca2+ Sr2+
紫红 橙红 洋红
455.5 612.2 687.8 459.3 616.2 707.0
Ba2+ 黄绿 553.6
碱金属和碱土金属的离子在无色火焰上燃烧时,当较高能级上的电子跳回较低能 级轨道上时要释放出特征波长的光,呈现出特征的颜色。
O
O
O
O
O
K+
O
O
O
直径pm 冠醚 :260~320
K+ : 266
15—冠—5对钠离子有很好的络合性能,18—冠—6对钾离子有很好的络合性能。
9
M与液氨的作用
M
NH3 (l)
(s)
M
(am)
e
(am)
碱金属在液氨中的溶解度 (-35℃)
碱金属元素 M
Li Na K Rb Cs
溶解度/ (mol ·L-1)
1
s区元素的通性
2
单质
Gc2-704-18.8
碱金属
Li
Na
K
Gc2-711-18.14
图片
Be
Mg
Ca
碱土金属
Sr
Rb Cs
Ba
3
1. 单质的物理性质
Gc2-705-18.9
有金属光泽 密度小 硬度小 熔点低 导电、导热性好
图片
s区单质的熔点变化
碱金属原子只有一个价电子且原子半径较大,故金属键弱,熔沸点低
(半径大的MO2才存在,颜色渐深,稳定性增)
人教版高化学第一册第二章《碱金属》教学设计
人教版高化学第一册第二章《碱金属》教学设计设计者:04教本刘杨青04062103一.学习者特征分析1.一般特征分析本单元的教学对象是高一学生,其基本思维特点是:在整个中学阶段,学生的思维能力得到迅速发展,抽象思维占据了优势。
具体表现为:(1)可以通过假设进行思维。
学生能够按“出问题――明确问题――提出假设――检验假设”途径,经过一系列的抽象思维来解决问题。
(2)认知发展阶段进入形式运算阶段,具备了“假设――演绎”思维和系统思维。
(3)思维活动中自我监控能力强,学生能够对自己智力活动过程进行控制,使思路更清晰判断更准确。
(4)思维更加开阔,能跳出传统模式进行创造性思维,在思考过程中追求新颖独特的因素追求个性,并且具有系统性和结构性。
2.学习风格分析学习风格的认知方式有场依存性和场独立性,对于理科生来说绝大多数是属于场独立性。
具有场独立方式的人,对客观事物做判断时常常利用自己内部的参照,不易受外界因素的影响和干扰;在认知方面能独立于他们的周围背景,倾向于在更抽象的和分析的水平上加工,独立地对事物做出判断。
因此在教学过程中,教师可给学生留一部分空间采用发现教学。
如在讲授钠的化学性质时,教师可通过演示实验让学生通过观察总结出相关只是点。
再如Na K分别与水反应,可让学生自己观察比较反应现象,引导学生思考现象所反映出来的性质规律。
另外,高中生的思维已渐渐趋向成熟,大部分学生是属于沉思型学习。
对于此类学生教师应注意培养直觉思维,大胆假设的意识能力。
如在学习碱金属的性质规律时,在学习过Na K等代表性元素后鼓励学生大胆地推测碱金属的性质规律。
3.学习者起点水平分析(1)预备技能分析本单元学习中涉及的氧化还原反应、离子反应以及化学反应中能量变化等内容在初中《自然科学》中已有涉及,这为学生学习本单元知识打下了基础。
在初中化学启蒙教学中,通过自然界中最常见化合物的学习,引出了化学的基本概念、基本定律和化学反应的基本类型等。
高一化学第二章碱金属.doc
高一化学第二章碱金属基础测试一、选择题1.下列关于碱金属的叙述中正确的是()(A)随着核电荷数的减小,离子的氧化性减弱( B ) 随着核电荷数的增加,单质的熔、沸点升高(C)随着核电荷数的增加,单质与水反应的剧烈程度加大( D ) 随着核电荷数的减小, 单质的密度增大2.下列叙述正确的是()(A)钠原子不稳定,而钠离子较稳定(B)由于钠是活泼金属,所以它能从溶液中将较稳定的金属置换出来(C)钠跟硫化合时能爆炸(D)钠与氧气剧烈反应生成氧化钠3.金属钠在空气中长久放置,最终生成物是()(A)氧化钠(B)过氧化钠(C)氢氧化钠(D)碳酸钠4.金属钠着火时,能用来灭火的是()(A)水(B)煤油(C)干沙(D)泡沫灭火器5.将4.6 g 钠投入95.4 g 水中,充分反应后所得溶液中溶质的质量分数是()(A)4.6 %( B) 4 %(C)8 %(D)8.02 %6.下列物质能与水反应,生成碱和气体的是()(B)氧化钠(C)二氧化碳(D)过氧化钠7.将一小块金属钠投入到硫酸铜溶液中,不可能观察到的现象是()(A)钠熔成小球在液面上滚动(B)有无色气体生成(C)溶液底部有紫红色物质生成(D)溶液中有蓝色沉淀生成8.关于过氧化钠的叙述中,正确的是()(A)过氧化钠属于碱性氧化物(B)过氧化钠露置在空气中,由淡黄色逐渐变成白色(C)过氧化钠在反应中,只能做氧化剂(D)过氧化钠与二氧化碳反应,氧化剂与还原剂的质量比是1∶19.关于碳酸钠和碳酸氢钠的叙述中,正确的是()(A)碳酸氢钠比碳酸钠更易溶于水(B)碳酸钠与碳酸氢钠都可以受热分解,产生使澄清石灰水变浑浊的气体(C)106 g碳酸钠与84 g碳酸氢钠都和足量的盐酸反应,放出的气体一样多(D)碳酸钠能与氢氧化钙反应生成沉淀,而碳酸氢钠不行10.下列气体中使用苛性钠固体干燥的是()(A)氢气(B)氯化氢气体(C)二氧化碳(D)氧气11.下列叙述正确的是()(A)钾与钠的性质相似,在空气中燃烧的产物都仅是过氧化物(B)钠的原子半径比锂大,其化学性质不如锂活泼(C)铯还原性不如钾(D)钠和硫粉研磨时不仅反应,而且还能发生爆炸12.两种碱金属形成的合金7.8 g,与足量水反应后生成0.2 g氢气,此合金可能(A)锂-钠合金(B)钠-钾合金(C)锂-钾合金(D)锂-铷合金13.实验室中做焰色反应实验时,每次实验都要用试剂洗净铂丝,此试剂是()(A)碳酸钠溶液(B)氢氧化钠溶液(C)硫酸(D)盐酸14.下列物质中,既能与盐酸反应,又能与石灰水反应的是()(A)硫酸钠(B)碳酸氢钠(C)碳酸钠(D)碳酸钙15.某溶液中含有钾离子、钠离子、硝酸根离子和硫酸根离子,它们的个数比是1∶6∶3∶2 ,则该溶液中所含的溶质可能是()(A)硝酸钾和硫酸钠(B)硫酸钾、硝酸钠和硝酸钾(C)硝酸钾、硫酸钠和硝酸钠(D)硫酸钾、硫酸钠和硝酸钠二、填空题1.碱金属元素的原子最外电子层均有()个电子,在化学反应中容易()电子,形成()离子,它们的单质都有强()性。
第二章 碱金属(检测题)
第二章 碱金属(检测题)一、选择题:(每小题只有一个选项符合题意。
每小题3分,共30分。
)1、已知O K2、22O K 、2KO 的名称依次是氧化钾、过氧化钾、超氧化钾。
那么2BaO 的名称是( )A 、氧化钡B 、过氧化钡C 、超氧化钡D 、无法确定2、鉴别苏打和小苏打稀溶液的最好试剂是( )A 、盐酸B 、澄清石灰水C 、苛性钠溶液D 、氯化钙稀溶液3、100克质量分数为3.65%的盐酸与11.6克O XH CO Na 232 刚好完全反应,则X 值是( )A 、9B 、7C 、3D 、14、加热34HCO NH 固体,使产生的气体依次通过盛有22O Na 的干燥管、浓硫酸的洗气瓶,最后得到的气体是( )A 、2OB 、3NHC 、2COD 、2CO 和2O5、合金有许多特点,如N —K 合金为液体,据此试推测:生铁、纯铁、碳三种物质中熔点最低的是( )A 、生铁B 、纯铁C 、碳D 、无法确定6、已知干粉灭火剂是压缩的2CO 气体吹干粉(主要成分是3NaHCO )。
下列材料能用于扑灭碱金属着火的是( )A 、干冰灭火剂B 、普通沙子C 、干粉灭火剂D 、泡沫灭火剂7、下列物质与水反应最剧烈的是( )A 、LiB 、NaC 、KD 、Rb8、下列物质中不能用作实验室制取氧气的是( )A 、2NaOB 、22O NaC 、4KMnOD 、3KClO9、下列物质中,不能跟二氧化碳气体反应的是( )A 、过氧化钠B 、氢氧化钠C 、碳酸钠溶液D 、碳酸氢钠溶液10、为除去括号内的杂质,所选用的试剂或方法不正确的是( )A 、32CO Na 溶液(3NaHCO ),选用适量的NaOH 溶液B 、3NaHCO 溶液(32CO Na ),应通入过量的2CO 气体C 、22O Na 粉末(O Na 2),将混合物在空气中加热D 、32CO Na 溶液(Na2SO4),加入适量的2Ba(OH)溶液,过滤二、选择题:(每小题有一个或两个选项符合题意。
