甘薯盐胁迫诱导IbDEAD1基因的克隆、生物信息学及表达分析
正响应盐胁迫的甘蔗6-磷酸葡萄糖脱氢酶基因的克隆

正响应盐胁迫的甘蔗6-磷酸葡萄糖脱氢酶基因的克隆杨玉婷;李国印;苏亚春;郭晋隆;许莉萍【期刊名称】《福建农林大学学报(自然科学版)》【年(卷),期】2014(043)002【摘要】从甘蔗中克隆获得1个6PGDH基因的cDNA序列,记为Sc6PGDH(登录号:KF921299).该基因序列含有1个1467 bp的完整开放阅读框,推导编码488个氨基酸残基.生物信息学分析可知,Sc6PGDH基因编码的蛋白分子质量为53.6561 ku,为酸性稳定的亲水蛋白,含有信号肽,可能定位于内质网膜上,具有该类蛋白典型的保守结构域6PGD,且与分离自谷子、玉米和水稻的6-磷酸葡萄糖脱氢酶的氨基酸序列同源性分别高达96.11%、95.70%和93.24%,表明该基因在进化过程中比较保守.原核生物生长试验结果显示,甘蔗Sc6PGDH基因的表达蛋白可以显著增强大肠杆菌Rosetta菌株的耐盐性,推测该基因可能参与了生物体对盐胁迫的应答过程.【总页数】9页(P156-164)【作者】杨玉婷;李国印;苏亚春;郭晋隆;许莉萍【作者单位】福建农林大学农业部甘蔗生物学与遗传育种重点实验室,福建福州350002;福建农林大学农业部甘蔗生物学与遗传育种重点实验室,福建福州350002;福建农林大学农业部甘蔗生物学与遗传育种重点实验室,福建福州350002;福建农林大学农业部甘蔗生物学与遗传育种重点实验室,福建福州350002;福建农林大学农业部甘蔗生物学与遗传育种重点实验室,福建福州350002【正文语种】中文【中图分类】Q785【相关文献】1.甘蔗果糖-6-磷酸,2-激酶/果糖-2,6-二磷酸酯酶基因(F2KP)的克隆及其功能研究[J], 何炜;周平;张建福;逯平杰;苏轶;叶冰莹;雷美华;陈由强;陈如凯2.野油菜黄单胞菌6-磷酸葡萄糖脱氢酶基因的初步分析 [J], 谭旖宁;马增凤;陆光涛;唐纪良3.米曲霉6-磷酸葡萄糖脱氢酶基因 gsdA 的克隆及生物信息学分析 [J], 刘薇;吴晶晶;陈宏文4.玉米果糖-6-磷酸,2-激酶/果糖-2,6-二磷酸酶基因的全长cDNA克隆及表达 [J], 王东;杜喜玲;胡建广;张红生;杨金水;翟虎渠5.甘蔗果糖-6-磷酸,2-激酶/果糖-2,6-二磷酸酶基因的cDNA克隆及序列分析 [J], 何炜;叶冰莹;周平;郑钊;张积森;何文锦;林荣华;陈由强;陈如凯因版权原因,仅展示原文概要,查看原文内容请购买。
甘蔗TAD1(ScTAD1)的克隆与表达分析

甘蔗TAD1(ScTAD1)的克隆与表达分析李旭娟;字秋艳;李纯佳;刘洪博;林秀琴;徐超华;陆鑫;毛钧;刘新龙【期刊名称】《中国农业科学》【年(卷),期】2017(050)009【摘要】[目的]Tillering and Dwarf 1(TAD1)是植物株型发育的重要调控基因,该基因与腋芽的形成发育密切相关.获得甘蔗TAD1(ScTAD1)并预测其结构和功能,分析其在甘蔗不同组织部位、不同发育阶段腋芽中及在用生长素(IAA)和细胞分裂素(6-BA)处理后的蔗苗非伸长茎梢部的表达情况,以期为ScTAD1的功能分析及其在甘蔗产量分子辅助育种中的利用奠定理论基础.[方法]采用电子克隆技术并结合反转录PCR(reverse transcription PCR,RT-PCR),cDNA末端快速扩增(rapid-amplification of cDNA ends,RACE)等技术获得ScTAD1的cDNA全长,然后利用生物信息学方法对其序列结构、功能、同源性进行分析;再使用实时荧光定量PCR(real-time fluorescent quantitative PCR,qPCR)技术对该基因在甘蔗品种ROC22不同组织部位(根、茎、叶、分蘖芽、叶鞘、生长点)、茎尖生长点和不同发育阶段腋芽(幼嫩腋芽、半大腋芽、较大腋芽、成熟休眠腋芽)及叶片分别喷施IAA和6-BA不同时间点幼苗非伸长茎梢部的表达特征进行分析.[结果]获得ScTAD1的cDNA全长(GenBank登录号为KX611166),序列分析发现其包含1个1560 bp的完整开放阅读框,编码519个氨基酸残基,其编码蛋白分子量为55.57 kD,理论等电点pI为9.16.保守结构域分析表明ScTAD1包含7个WD40重复序列的保守结构域;信号肽预测结果表明ScTAD1蛋白不存在信号肽,为非分泌蛋白;三级结构预测表明ScTAD1与二穗短柄草(XP_003558934.1)、玉米(XP_008650376.1)和水稻(AAN74839.1)相关同源蛋白三级结构高度相似,且与高粱假定蛋白(XP_002468612.1)亲缘关系最近.qPCR分析结果表明ScTAD1在甘蔗根、茎、叶、分蘖芽、叶鞘、生长点等不同组织部位均有表达,其中在分蘖芽中的表达量最高,其次为叶和叶鞘,根中表达较弱;不同发育阶段甘蔗腋芽中,ScTAD1在幼嫩腋芽中表达最高;叶片喷施植物激素IAA和6-BA 36 h后该基因表达开始升高,但喷施6-BA 48 h后表达又回落到未处理水平,表明这两类激素对ScTAD1表达有调控作用.[结论]成功从ROC22中获得ScTAD1的cDNA序列,该基因在甘蔗不同组织部位均有表达,其中分蘖芽中表达量最高;推测ScTAD1可能在甘蔗腋芽形成发育早期发挥作用,其表达水平受生长素和细胞分裂素调控.【总页数】11页(P1571-1581)【作者】李旭娟;字秋艳;李纯佳;刘洪博;林秀琴;徐超华;陆鑫;毛钧;刘新龙【作者单位】云南省农业科学院甘蔗研究所/云南省甘蔗遗传改良重点实验室,云南开远 661699;云南省农业科学院甘蔗研究所/云南省甘蔗遗传改良重点实验室,云南开远 661699;云南省农业科学院甘蔗研究所/云南省甘蔗遗传改良重点实验室,云南开远 661699;云南省农业科学院甘蔗研究所/云南省甘蔗遗传改良重点实验室,云南开远 661699;云南省农业科学院甘蔗研究所/云南省甘蔗遗传改良重点实验室,云南开远 661699;云南省农业科学院甘蔗研究所/云南省甘蔗遗传改良重点实验室,云南开远 661699;云南省农业科学院甘蔗研究所/云南省甘蔗遗传改良重点实验室,云南开远 661699;云南省农业科学院甘蔗研究所/云南省甘蔗遗传改良重点实验室,云南开远 661699;云南省农业科学院甘蔗研究所/云南省甘蔗遗传改良重点实验室,云南开远 661699【正文语种】中文【相关文献】1.甘蔗脂氧合酶基因ScLOX1的克隆与表达分析 [J], 孙婷婷;李大妹;苏亚春;王文举;娄文月;刘峰;张旭;王玲;陈玉凤;阙友雄;许莉萍2.甘蔗双向糖转运蛋白ShSWEET2a基因的克隆与表达分析 [J], 黄成;张明阳;郭燕芳;王锦达3.甘蔗液泡膜二羧酸转运蛋白基因ScTDT克隆与表达分析 [J], 冯小艳;王俊刚;赵婷婷;彭李顺;王文治;冯翠莲;沈林波;张树珍4.甘蔗液泡膜二羧酸转运蛋白基因ScTDT克隆与表达分析 [J], 冯小艳;王俊刚;赵婷婷;彭李顺;王文治;冯翠莲;沈林波;张树珍5.甘蔗丙二烯氧化物环化酶基因(ScAOC)的克隆与表达分析 [J], 薛耀威;陈丽兰;王亚如;高三基;王锦达因版权原因,仅展示原文概要,查看原文内容请购买。
盐胁迫下盐穗木DNA聚合酶λ基因的克隆和表达分析

J 企项 『 I : 新瑞m点实验 0项资企“ 抽砧小盐胁迫响J 的转求朔 i 研究及亚婴 人 I 的功能摧定” ( 2 0 1 4 K L 0 0 1 ) ; N家“ 9 7 3 ” 汁划时 研究
专项“ 新疆 荒漠盐生植物耐盐的生理及分 r - # T L ¥ J , ” ( 2 0 1 2 C B 7 2 2 2 0 4)
新 疆 农 业科 学
2 0 1 7, 5 4 ( 2 ) : 3 6 1 — 3 7 0
X i n j i a n g A g r i c u l t u r a l S c i e n c e s
d o i : 1 0 . 6 0 4 8 / j . i s s n . 1 0 0 1— 4 3 3 0 . 2 0 1 7 . 0 2 . 0 2 0
烷 基化 等作 用 ,各 种 诱 导 剂诱 导 的 D N A 损 伤 可
诱导 的 D N A双 链 断裂可 能会 导致 细胞 死亡 、 遗 传
不稳 定和 癌症 。研 究表 明 , D N A聚合 酶 x 家族 主
要参与 D N A 的修 复 和 重 组 J , D N A p o l 是 D N A 聚合 酶 x 家 族 的 成 员 , 广 泛存 在 予 真 核 生 物 巾 , 哺乳 动物 的 D N A p o l 入是一 个 核 酸 外 切 酶 缺 陷 的 单一 多肽 的 D N A 聚合 酶 , 与哺乳动物的 D N A 聚
O 引 言
【 研究意义 】 植物 扎根土壤 由于不能 移动 以
及对 阳光 的依 赖 性 , 使 得其 在 维 护 基 因组 的完 整 性方 面 面临 巨大 的挑 战 , 因 为植 物 连 续 暴 露 在各 种生 物和 非生 物 的胁 迫 之 下 … , 如细菌 、 病毒 、 紫 外、 电离辐 射 、 高盐 、 化 学诱 变 剂 、 自由基 和 体 内的
甘蔗脱落酸胁迫成熟诱导蛋白基因(SoASR)的克隆和表达分析

甘蔗脱落酸胁迫成熟诱导蛋白基因(SoASR)的克隆和表达分析黄杏;杨丽涛;张保青;宋修鹏;李杨瑞;王盛【期刊名称】《生物技术通报》【年(卷),期】2013(000)002【摘要】采用同源克隆和RT-PCR技术克隆了甘蔗SoASR基因全长cDNA,GenBank登录号为JX470187,长度为753 bp,包括一个429 bp的开放阅读框,编码142个氨基酸的蛋白.同源性分析表明,甘蔗SoASR与大蕉、玉米和高粱聚为一小组,同源性分别为79%、93%和88%.将SoASR在大肠杆菌中表达,获得一个约32.0 kD的外源蛋白.实时荧光定量PCR分析结果表明,低温胁迫下该基因在抗寒性强的甘蔗品种桂糖28号(GT28)中表达量先升后降,在抗寒性弱的甘蔗品种园林6号(YL6)中则呈下降趋势;该基因的表达在两个甘蔗品种中均受ABA的诱导.这说明SoASR基因在甘蔗抗寒机制中发挥一定作用.【总页数】7页(P93-99)【作者】黄杏;杨丽涛;张保青;宋修鹏;李杨瑞;王盛【作者单位】广西大学农学院亚热带农业生物资源保护与利用国家重点实验室,南宁530005;中国农业科学院甘蔗研究中心农业部广西甘蔗生物技术与遗传改良重点实验室广西作物遗传改良生物技术重点实验室广西甘蔗遗传改良重点实验室,南宁530007;广西大学农学院亚热带农业生物资源保护与利用国家重点实验室,南宁530005;中国农业科学院甘蔗研究中心农业部广西甘蔗生物技术与遗传改良重点实验室广西作物遗传改良生物技术重点实验室广西甘蔗遗传改良重点实验室,南宁530007;广西大学农学院亚热带农业生物资源保护与利用国家重点实验室,南宁530005;广西大学农学院亚热带农业生物资源保护与利用国家重点实验室,南宁530005;广西大学农学院亚热带农业生物资源保护与利用国家重点实验室,南宁530005;中国农业科学院甘蔗研究中心农业部广西甘蔗生物技术与遗传改良重点实验室广西作物遗传改良生物技术重点实验室广西甘蔗遗传改良重点实验室,南宁530007;广西大学农学院亚热带农业生物资源保护与利用国家重点实验室,南宁530005【正文语种】中文【相关文献】1.花生温度诱导载脂蛋白基因AhTIL1的克隆和表达研究 [J], 钟瑞春;李婷婷;唐荣华;王兴军;李翠;侯蕾;赵传志2.甘蔗锌指蛋白基因的克隆和表达分析 [J], 刘金仙;阙友雄;郑益凤;许莉萍;陈如凯3.怀玉山高山马铃薯脱落酸和环境胁迫诱导蛋白基因的克隆和序列分析 [J], 尹明华;陈荣华;卢咏琪;罗怿文;潘巧玲;邱梦婷;苏格;谭佳思;涂慧;蔡红4.麻疯树中一种Ⅱ型核糖体失活蛋白基因的克隆和表达调控分析 [J], 李笑;王菲;彭婕;陈放;徐莺5.脱落酸、胁迫、成熟诱导基因研究进展 [J], 赵宏亮;徐碧玉;金志强因版权原因,仅展示原文概要,查看原文内容请购买。
小麦根中盐胁迫响应基因FBPA的克隆及鉴定的开题报告

小麦根中盐胁迫响应基因FBPA的克隆及鉴定的开题报告一、选题背景盐胁迫是常见的逆境因素之一,对植物的生长和发育产生极大的影响。
小麦作为世界上重要的粮食作物之一,其产量和质量受到环境因素的影响,而盐胁迫则是其中重要的限制因素之一。
盐胁迫会引起小麦根系中各种生理和生化过程的改变,例如导致氧化应激、离子紊乱、脱水、蛋白质合成等方面的异常。
因此,研究小麦盐胁迫响应机制,寻找抗盐基因,对小麦的耐盐育种和盐碱地的利用具有重要的意义。
二、论文目的与意义本研究旨在克隆小麦根中盐胁迫响应基因FBPA,并对其进行鉴定和功能分析,为深入研究小麦耐盐机制打下基础,为小麦的耐盐育种提供理论依据。
三、研究内容与方法1.研究内容:(1)克隆小麦根中盐胁迫响应基因FBPA;(2)对FBPA进行生物信息学分析,并进行蛋白质结构建模;(3)通过实时荧光定量PCR等方法进行FBPA的表达模式分析,并验证FBPA在盐胁迫下的表达变化;(4)利用生化和细胞学方法对FBPA的功能进行初步评估。
2.研究方法:(1)RNA抽提及cDNA合成:从小麦根中提取总RNA,并逆转录为cDNA,用于克隆和转录本分析。
(2)基因克隆与测序:对小麦根中的盐胁迫响应基因FBPA进行PCR扩增,并通过克隆、测序来验证该基因片段的长度和序列。
(3)生物信息学分析:对FBPA的序列进行基本物理化学性质、亲水性、二级结构等分析,并进行蛋白质结构建模。
(4)表达模式分析:使用实时荧光定量PCR等方法对盐胁迫下的FBPA mRNA表达水平进行定量分析。
(5)功能分析:利用生化和细胞学方法对FBPA的功能进行初步评估,如酵母互补实验、质膜分离和光学显微镜观察等。
四、预期成果与结论预计能够克隆得到小麦根中的盐胁迫响应基因FBPA,并通过生物信息学分析进行结构建模和功能预测,表达模式分析预计能够初步探究FBPA在盐胁迫下的功能调节。
同时,对FBPA进行初步评估其功能,为后续深入研究小麦耐盐机制提供理论依据。
木薯SCARECROW-LIKE(SCL)基因克隆、生物信息学及非生物胁迫下表达分析

木薯SCARECROW-LIKE(SCL)基因克隆、生物信息学及非生物胁迫下表达分析作者:樊铸硼罗兴录单忠英黄堂伟程隆祥吴美艳来源:《南方农业学报》2020年第08期摘要:【目的】克隆木薯SCARECROW-LIKE(MeSCL)基因,对其进行生物信息学分析,并检测其在非生物胁迫下的表达情况,为深入研究木薯MeSCL基因响应非生物胁迫的调控机制提供理论参考。
【方法】以木薯品种D346为材料,采用RT-PCR克隆MeSCL基因编码区(CDS)序列,并利用生物信息学分析软件进行序列特征分析,采用实时荧光定量PCR 检测其在干旱、盐、氧化和低温胁迫下木薯叶片中的表达情况。
【结果】克隆获得的MeSCL 基因编码区(CDS)序列全长1655 bp,与参考序列(GenBank登录号LOC110627921)仅存在2个碱基的差异,开放閱读框(ORF)的长度为1560 bp,编码519个氨基酸,编码蛋白分子量为57.84 kD,等电点(pI)为6.08,脂肪系数为80.46%,总平均亲水性指数为-0.195,为亲水性蛋白,含有1个信号肽、6个从内部到外部的跨膜螺旋区和5个从外部到内部的跨膜螺旋区,定位于细胞核和内质网中,属于GRAS蛋白家族成员,具有该家族的保守结构域。
MeSCL蛋白三级结构模型显示,该蛋白含有14个典型的α螺旋、10个β-折叠和36个β-转角。
MeSCL蛋白与橡树HbSCL蛋白的相似性最高,为90.80%,与蓖麻RcSCR、胡杨PeSCL、毛果杨PtSCR、可可树TcSCR和哥伦比亚锦葵HuSCL蛋白的相似性在80.00%左右。
MeSCL基因受干旱、盐、氧化和低温胁迫诱导表达量整体呈升高趋势,但在不同处理时间的表达量存在明显差异,其中,干旱和氧化胁迫下,MeSCL基因均在处理24 h时表达量最高,分别是对照的6.05和11.17倍,而盐和低温胁迫下,MeSCL基因均在处理6 h时表达量最高,分别是对照的11.76和3.80倍。
甘蔗液泡膜二羧酸转运蛋白基因ScTDT克隆与表达分析
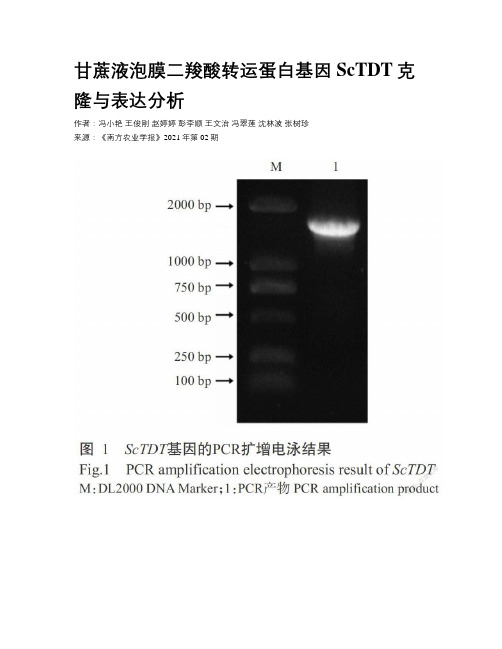
甘蔗液泡膜二羧酸转运蛋白基因ScTDT克隆与表达分析作者:冯小艳王俊刚赵婷婷彭李顺王文治冯翠莲沈林波张树珍来源:《南方农业学报》2021年第02期摘要:【目的】克隆甘蔗液泡膜二羧酸转运蛋白基因(ScTDT),并分析其在甘蔗不同组织及在铝胁迫下的表达模式,为深入研究该基因功能及抵抗铝胁迫的分子机制提供理论依据。
【方法】利用同源克隆技术从甘蔗品种ROC22中克隆ScTDT基因,利用生物信息学软件进行序列分析,采用实时荧光定量PCR技术检测该基因在甘蔗不同组织(根、茎和叶)及在铝胁迫(0、10和20 μmol/L Al3+)下的表达水平。
【结果】克隆获得的ScTDT基因,开放阅读框(ORF)全长1623 bp,编码540个氨基酸残基,蛋白相对分子量57.34 kD,理论等电点(pI)5.77,为不稳定的疏水蛋白,可能定位于质膜、液泡和/或高尔基体,其氨基酸序列与高粱(XP_002460443.1)、水稻(XP_015612609.1)和玉米(PWZ04635.1)的TDT氨基酸序列具有高度相似性,其中与高粱的TDT氨基酸序列相似性最高,达96.30%,说明ScTDT与高粱TDT的亲缘关系最近。
ScTDT基因在甘蔗根、茎和叶中均有表达,但根中表达量显著高于茎和叶(P<0.05,下同)。
在铝胁迫处理下,3个甘蔗品种(ROC22、柳城05-136和中糖1202)的根中ScTDT基因表达量较对照组(0 μmol/L Al3+)均显著升高,尤其是柳城05-136和中糖1202随着营养液中Al3+浓度增加,ScTDT基因的表达量呈显著升高趋势,说明高浓度Al3+胁迫更能诱导ScTDT基因高效表达。
3个甘蔗品种中,以中糖1202的ScTDT基因表达量变化最大,柳城05-136次之,以ROC22的变化最小。
【结论】克隆获得的ScTDT基因表达具有组织特异性,在根中高效表达可能与甘蔗抵抗铝胁迫相关,即植株通过上调根中ScTDT 基因表达,从而加快液泡中苹果酸的释放,促使苹果酸从根中分泌到土壤与Al3+反应,从而减少铝毒害,表明ScTDT基因可能参与甘蔗抵抗铝胁迫,且不同甘蔗品种的抗铝胁迫能力有所不同。
甘薯耐盐性研究进展

甘薯耐盐性研究进展郭慧慧;潘祥华;蒋元斌;林丛发;徐绍翔【期刊名称】《江苏农业科学》【年(卷),期】2024(52)8【摘要】甘薯是世界上重要的粮食、饲料及工业原料作物,具有适应性强、产量高等优良特性。
了解甘薯在盐胁迫条件下的耐盐机制,筛选耐盐种质资源,培育耐盐品种,对提高盐碱地利用率具有重要的实践意义。
本文主要从甘薯耐盐种质资源筛选与鉴定、耐盐性评价指标、耐盐性相关基因挖掘以及提高耐盐性的途径等4个方面,综述了近年来甘薯耐盐相关的研究进展。
在甘薯耐盐种质资源筛选与鉴定方面,总结了目前已报道的强耐盐、中度耐盐、弱耐盐及盐敏感甘薯种质资源。
在耐盐性评价上,将众多指标归结为形态学指标和生理生化指标两大类。
在耐盐性相关基因挖掘上,总结了参与盐胁迫响应的基因,如C2结构域脱落酸相关基因IbCAR1、磷脂酰丝氨酸合成酶基因IbPSS1、蔗糖非发酵-1-相关蛋白激酶-1基因IbSnRK1、甘薯R2R3-MYB基因IbMYB308、海藻糖-6-磷酸合成酶(TPS)基因IbTPS等。
在提高耐盐性的途径上,总结了现阶段常采用的2种方法,即施用外源物质及培育耐盐品种。
目前甘薯的耐盐性在生理代谢、耐盐基因挖掘等研究中取得诸多成果,但在提高甘薯耐盐性途径上研究较少。
针对这个问题,本文提出了相应的解决方法,以期为今后开展甘薯耐盐性研究、培育耐盐性强及综合性状优的甘薯品种提供理论参考。
【总页数】9页(P23-31)【作者】郭慧慧;潘祥华;蒋元斌;林丛发;徐绍翔【作者单位】宁德市农业科学研究所【正文语种】中文【中图分类】S531.01【相关文献】1.甘薯耐盐性及紫薯特性研究进展2.NACl胁迫下甘薯苗期叶片活性氧代谢与甘薯耐盐性的关系3.甘薯耐盐性及遗传转化研究进展4.不同甘薯品种苗期耐盐性试验5.漯系列甘薯品种苗期耐盐性评价因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
甘薯盐胁迫诱导IbDEAD1基因的克隆、生物信息学及表达分析朱明库;孟小庆;蔡敬;李格;李宗芸【摘要】DEAD-box解旋酶是植物中最大的解旋酶家族,不仅在几乎所有涉及DNA/RNA代谢的细胞过程中发挥关键作用,而且还广泛参与植物生长发育与胁迫响应过程.目前,甘薯中有关DEAD-box基因的功能研究尚未见报道.本研究以耐盐性品种徐薯22与盐敏感性品种徐薯32为研究材料,通过RNA-seq及生物信息学分析,首次从甘薯中筛选出一个受盐胁迫诱导的DEAD-box基因,命名为IbDEAD1.根据转录组分析的测序结果设计引物,从徐薯22中克隆出该基因的全长序列(GenBank登录号:MF043568).序列分析表明,IbDEAD1基因包含一个1 701bp的开放阅读框,编码566个氨基酸.序列分析显示IbDEAD1蛋白具有一个DEAD-box蛋白典型的解旋酶中心和多个磷酸化位点,且为DEAD-box RNA解旋酶.系统进化树及qRT-PCR分析均表明,IbDEAD1基因可能在甘薯盐胁迫响应过程中发挥重要作用.这些结果为进一步研究IbDEAD1基因在甘薯盐胁迫响应中的功能奠定了基础.【期刊名称】《江苏师范大学学报:自然科学版》【年(卷),期】2017(035)003【总页数】7页(P23-29)【关键词】甘薯 DEAD-box解旋酶生物信息学表达分析【作者】朱明库;孟小庆;蔡敬;李格;李宗芸【作者单位】江苏师范大学生命科学学院/江苏省药用植物生物技术重点实验室,江苏徐州221116【正文语种】中文【中图分类】Q812作为固着生物,植物经常会遭受各种环境胁迫,如高盐、干旱、低温、紫外线等,这可能会导致脂质、蛋白质和DNA损伤,从而减弱植物基因组的稳定性,严重影响植物的生长与产量[1-2].然而,有些植物品种已经进化形成特定的分子、细胞和生理机制,能够经受这些环境逆境.例如,解旋酶(helicase)在应对DNA损伤修复中扮演着重要角色.DEAD-box解旋酶是最大的解旋酶家族,广泛存在于从病毒到人类几乎所有已知生物体中,其通过催化双链DNA/RNA的解旋,在复制、重组、转录、翻译和修复等遗传过程中均发挥重要作用[3].RNA解旋酶主要参与了RNA结构形成的调控活动,包括RNA的复制、转录、剪接、蛋白质翻译、mRNA的输出及其稳定性等过程[4-5].DNA解旋酶是促使双螺旋DNA解旋的驱动蛋白,参与了DNA 的复制、重组及修复[6].解旋酶的典型特征是含有一个保守的解旋酶中心,包含了8个或9个特征性的保守基序(motif).DEAD-box解旋酶由Linder等[7]首次发现,并根据基序Ⅱ中的氨基酸序列DEAD(Asp-Glu-Ala-Asp)而命名,而根据基序Ⅱ氨基酸序列的差异,DEAD-box家族蛋白又可分为DEAD,DEAH和DEXH/D[8-10].已有研究表明,DEAD-box解旋酶除具有持家基因功能外,还广泛参与植物生长发育过程.因为DEAD-box蛋白参与RNA代谢等过程,因此在胚胎发育中必不可少,比如拟南芥AtRH7基因突变体表现出短根及根分支变少,同时胚胎和子叶发育异常[11].拟南芥ABO6(ABA overly sensitive)基因编码一个DEXH-box RNA解旋酶,该基因突变体的线粒体中会积累更多的活性氧(ROS),ROS则进一步介导了生长素和脱落酸之间的相互作用,而这个互作调控了主根的生长和种子的发芽[12].除此之外,近年研究表明,DEAD-box解旋酶还广泛参与了植物对生物及非生物胁迫的响应.自从Seki等[13]首次发现冷诱导的解旋酶基因FL2-5A4,第1次表明解旋酶可能在胁迫应答中的新功能,10多年来,研究人员通过对拟南芥、水稻、番茄等植物中解旋酶基因的功能研究表明,DEAD-box解旋酶在多种生物及非生物胁迫响应中均发挥重要作用[14-15].拟南芥STRS1/2基因编码DEAD-box RNA解旋酶,使突变体strs1和strs2的抗盐性增强,突变体中RD29A,DREB1A及DREB2A等胁迫响应基因的表达均高于野生型[16].水稻SUV3蛋白同时具有DNA和RNA 解旋酶活性,超表达SUV3基因的水稻耐盐性和抗旱性增强,同时产量不受影响[17].另外,在CBF-COR冷胁迫应答途径中,DEAD-box解旋酶基因LOS4-1能够抑制、而LOS4-2则促进CBFs及其下游靶基因的表达,说明LOS RNA解旋酶在mRNA的输出、生长发育以及对温度的胁迫响应中都发挥重要作用[18-19].之前我们研究发现,超表达SlDEAD31基因的番茄植株对盐和干旱胁迫的耐受性增强,胁迫下转基因植株存活率更高,而MDA含量降低[15].以上发现为将来利用DEAD-box解旋酶的“DNA/RNA解旋”功能来改良植物对各种生物及非生物胁迫的耐受性,进而提高作物产量提供了可能.然而,在真核生物中,许多信号转导途径被环境胁迫所激活,很难确定解旋酶在复杂的信号转导网络中的具体位置.因此,由解旋酶介导的胁迫应答机制仍待进一步研究.甘薯(Ipomoea batatas (L.) Lam.)不仅可以作为粮食、饲料和工业原料,还是重要的新兴能源和高效保健作物.我国甘薯的栽培面积和产量均居世界首位,总产量仅次于水稻、小麦和玉米.长期以来,甘薯在我国一直充当着抗灾救荒及保命粮的角色,是保证粮食安全的底线作物[20].与其他主要农作物相比,大部分甘薯品种具有耐盐碱、抗旱、耐贫瘠等特性,不存在“与人争粮、与粮争地”的问题,因此,可作为盐碱地粮食和能源作物加以开发利用.鉴于此,了解甘薯抵御盐胁迫的应答机制将会为培育高耐盐甘薯新品种(品系)奠定基础.目前,有关甘薯中DEAD-box基因的相关研究尚无报道,GenBank中也未见有甘薯DEAD-box基因的注册信息.为此,本研究利用耐盐性品种徐薯22与盐敏感性品种徐薯32在盐胁迫处理下的RNA-seq数据,首次从甘薯中筛选出一个盐胁迫诱导的DEAD-box基因,命名为IbDEAD1.根据转录组分析的测序结果设计引物,从徐薯22中克隆出该基因的全长序列,并在NCBI中完成注册(GenBank登录号:MF043568).本研究通过对IbDEAD1基因进行系统的生物信息学分析,同时利用qRT-PCR的方法检测其对盐胁迫处理的响应特性,旨在为进一步研究甘薯IbDEAD1基因在盐胁迫响应中的功能和作用机制奠定基础.1.1 材料及主要试剂本研究利用实验室已完成的耐盐性品种徐薯22与盐敏感性品种徐薯32在盐胁迫处理下的RNA-seq数据筛选出IbDEAD1基因.盐胁迫响应分析实验中,选取大小一致、发育健康的徐薯22茎蔓在1/4浓度的霍格兰培养液中水培生根,培养条件为16 h光照(28 ℃)/8 h黑暗(26 ℃).培养10 d后选取根系健康、长势接近的植株进行盐胁迫处理.通过在霍格兰溶液中加入200 mmol/L的NaCl,分别于处理后1,3,6,12,24,48,72 h收取根组织样品,对照组用不含NaCl的霍格兰溶液培养.所收取的鲜样迅速用液氮冷冻,放置于-80 ℃冰箱保存备用.基因克隆所需的Trizol试剂、PrimeScript反转录酶、PrimeSTAR® HS DNA聚合酶、pMD19-T-vector,qRT-PCR分析所需的SYBR Premix Ex Taq Ⅱ均购自大连宝生物(TakaRa)公司.DNA marker、氨苄青霉素(Amp)为Sigma公司产品.大肠杆菌菌种DH5α,由江苏省药用植物生物技术重点实验室保存.1.2 方法1.2.1 甘薯盐胁迫处理RNA-seq数据中DEAD-box基因的筛选通过用关键词“DEAD”和“helicase”在实验室已完成的耐盐性品种徐薯22与盐敏感性品种徐薯32的盐胁迫处理(150 mmol/L NaCl处理1 d)RNA-seq数据中进行检索,搜索到的所有序列信息通过生物信息学的方法进一步筛选,只有包含了解旋酶所具有的典型解旋酶中心的序列才被选出用于下一步对比分析.1.2.2 IbDEAD1基因的PCR扩增、克隆及测序以培养的徐薯22植株的根、茎和叶组织混合取样,按照Trizol试剂操作说明书提取总RNA,并合成cDNA第一链.根据RNA-seq数据库中c60154.graph_c0的序列信息设计引物F-IbDEAD1-F/R(表1),引物由上海生工生物工程股份有限公司合成.PCR步骤如下:在0.2 mL离心管中分别加入20 μL ddH2O,25 μL PrimeSTAR HS(Premix),2 μL cDNA模板及F-IbDEAD1-F/R引物各1.5 μL,于98 ℃ 10 s,58 ℃ 5 s,72℃ 2 min,30个循环.琼脂糖凝胶电泳检测后,目的片段连接到pMD-19-vector后,送上海英骏生物技术有限公司测序.1.2.3 IbDEAD1基因生物信息学分析核苷酸翻译、保守结构域检索等在NCBI网站上进行;应用CBS,ExPASy,SMART,PredictProtein和PSORT等综合软件包,预测分析IbDEAD1蛋白的理化性质、跨膜结构域、亚细胞定位和磷酸化位点等;利用ClustalX及DNAMAN软件进行序列多重比对分析,MEGA软件构建NJ系统树,参数为bootstrap replicates 1 000,poisson model及pairwise deletion.1.2.4 qRT-PCR表达分析设计合成IbDEAD1基因的定量分析特异性引物Q-IbDEAD1-F/R(表1),分别以对照和盐胁迫处理下的植株cDNA为模板,以甘薯Tubulin为内参基因,以ABI StepOne Plus仪器进行qRT-PCR分析.具体步骤如下:在0.1 mL八联管中分别加入3.2 μL ddH2O,5μL SYBR Premix Ex Taq Ⅱ,1μL cDNA模板及F-IbDEAD1-F/R引物各0.4 μL,反应程序为95 ℃ 30 s,然后95 ℃ 5 s,60 ℃ 60 s,40个循环,再进行融解曲线分析.所有样品均进行NRT(no reverse transcription control)和NTC(no template control)分析.数据采用单因素方差分析(ANOVA),差异显著性分析采用Dunnett’s test.2.1 甘薯盐胁迫响应IbDEAD1基因的筛选从徐薯22盐处理根/徐薯22盐对照的RNA-seq数据中,筛选到一条ID为c60154.graph_c0的基因序列,Swissprotein注释为DEAD-box RNA helicase(表2),经进一步的生物信息学分析确认,其包含有解旋酶所具有的典型解旋酶中心.因目前有关甘薯中DEAD-box基因的相关研究尚无报道,GenBank中也未见有甘薯DEAD-box基因的注册信息,因此将其命名为IbDEAD1.RNA-seq分析显示,IbDEAD1基因受盐胁迫处理的诱导水平为2.62倍,暗示其可能参与甘薯盐胁迫响应.2.2 IbDEAD1基因的生物信息学分析2.2.1 IbDEAD1基因及所编码蛋白的理化性质分析测序结果表明,IbDEAD1基因开放阅读框长度为1 701 bp,编码566个氨基酸(图1).IbDEAD1基因编码一个分子量为62.09 kD的蛋白,理论等电点pI为8.32,说明为碱性蛋白.其中负电荷氨基酸残基(Asp+Glu)65个,正电荷氨基酸残基(Arg+Lys)69个,分别占总氨基酸含量的11.48%和12.19%.应用ProtScale程序的Hphob./Kyte & Doolittle算法,预测IbDEAD1蛋白的平均疏水性为-0.164,表明其为亲水性蛋白,由图2可知,第282位的Glu亲水性最强(-2.967),第337位的Ala疏水性最强(2.311).分析蛋白的跨膜结构域对正确认识该蛋白的功能有重要指示意义.TMpred程序的预测结果表明,在IbDEAD1蛋白的第85~106位aa区域内具有跨膜结构.NetPhos 3.1磷酸化位点预测显示,IbDEAD1蛋白有39个Ser磷酸化位点、13个Thr磷酸化位点和3个Tyr磷酸化位点,这些磷酸化位点的存在说明IbDEAD1蛋白的翻译后磷酸化修饰在其功能实现中起着重要作用.蛋白的亚细胞定位与该蛋白所执行的功能是密切相关的.通过PSROT程序对IbDEAD1蛋白进行亚细胞定位分析,结果显示,该蛋白可能定位于细胞核(表3),这与Plant-mPLoc的预测结果相一致,进一步验证了预测结果的可信度.2.2.2 IbDEAD1蛋白二级结构、保守结构域及蛋白序列同源比对分析分析蛋白的高级结构对理解某蛋白结构与功能的相关性有重要指导意义.SOPMA预测分析表明,IbDEAD1蛋白含43.11%的α螺旋,11.13%的β转角,18.55%延伸和27.21%无规卷曲.通过ScanProsite功能域分析表明,IbDEAD1蛋白具有一个DEAD-box解旋酶典型的解旋酶中心,由2个蛋白结构域组成,即解旋酶超家族结构域(DEXDc)和C末端结构域(HELICc,图1A).IbDEAD1蛋白序列的多重序列比对分析表明,其与已知植物的DEAD-box蛋白序列具有很高的相似性(图1B),与牵牛花InDEAD22蛋白(XP_019170808)的序列相似性达到97.7%,与土豆StDEAD22蛋白(XP_006355937)的相似性为72.9%.另外,研究表明解旋酶中心包含有多个特征性的保守基序(motif),正因这些基序的存在,赋予了解旋酶的典型特征[8].其中,基序Ⅰ对于ATP酶活性和解旋酶活性的实现至关重要,DNA解旋酶含有经典的基序Ⅰ(G-X-X-X-X-G-K-T),RNA解旋酶含有变异的基序Ⅰ(A-X-X-X-X-G-K-T)[21].多序列比对显示,IbDEAD1蛋白的基序Ⅰ为“AETGSGKT”,基序Ⅱ为“DEAD”,因此,属于DEAD-box RNA解旋酶家族的DEAD类群.然而,IbDEAD1蛋白并没有DEAD-box解旋酶中保守的基序Ⅲ(SAT),说明IbDEAD1蛋白中基序Ⅲ的保守性较差.2.2.3 IbDEAD1蛋白的系统进化树构建为了揭示甘薯IbDEAD1蛋白与其他植物DEAD-box解旋酶的进化关系,20个来自拟南芥、水稻、豌豆等已报道的DEAD-box解旋酶被筛选出来进行进化树构建.图3A显示,IbDEAD1蛋白与HVD1,AtRH3以及OsBIRH1等同在一个亚组,研究发现,HVD1基因能够被低温和盐胁迫诱导表达[22],AtRH3基因被证实参与了拟南芥叶绿体发育以及盐胁迫耐力[23],而OsBIRH1基因在病原菌感染与氧化胁迫耐力方面扮演着重要角色[24],这意味着IbDEAD1基因在甘薯中也可能具有相似的功能.另外,根据已有的文献报道,各个基因的可能功能总结于图3B中.2.3 IbDEAD1基因对盐胁迫处理的表达分析我们从盐胁迫处理下的RNA-seq数据中筛选出盐胁迫诱导的IbDEAD1基因,同时生物信息学分析也显示IbDEAD1基因可能参与盐等非生物胁迫响应过程.随后,我们通过qRT-PCR验证IbDEAD1基因对盐胁迫处理的响应特性,结果表明,盐胁迫能够显著诱导IbDEAD1基因的表达(图4),这与RNA-seq数据相一致,进一步暗示其可能与甘薯耐盐性密切相关.自从1976年DNA解旋酶第1次从原核生物大肠杆菌及1978年第1次从真核生物百合植物中被发现,到目前为止已从许多物种中分离出数目众多的解旋酶[25],这为该家族基因在甘薯中的研究提供了理论和实践依据.已有研究证实,有些解旋酶在植物生长发育以及胁迫应答等方面发挥重要作用[3].然而,目前DEAD-box解旋酶在植物逆境应答等方面的功能研究依然处于起步阶段,其参与的胁迫应答机制仍待进一步研究.有关DEAD-box解旋酶在植物中的功能研究主要局限于模式植物拟南芥和水稻中,甘薯作为保证我国粮食安全的底线作物,其重要性不言而喻.当前,科学家正寻求提升甘薯耐盐等非生物胁迫抗性的生物技术途径,其分子生物学研究主要集中在以下几个方面:1) 抗氧化系统.比如,超表达甘薯POD基因swpa4提高了烟草POD活性,并增强了其对高盐、干旱及MV等胁迫的抗性[26].2) 胁迫诱导蛋白的合成.Park等[27]从甘薯脱水处理纤维根EST表达文库中分离到LEA14蛋白,超表达LEA14的转基因甘薯愈伤耐盐性和抗旱性增强,沉默LEA14的转基因愈伤则相反.3) 离子、代谢物的积累与渗透调节(细胞膜保护系统).超表达SOS的转基因甘薯耐盐能力明显增强,盐胁迫处理下其长势更好、生根能力更强[28].4) 转录因子调控.比如转IbMYB1基因的土豆对盐和干旱胁迫的抗性增强[29].值得注意的是,DEAD-box解旋酶能够通过调控“DNA/RNA解旋”的方式来提升植物抵御环境逆境的能力,这可能为培育植物抗逆新品种开辟了一条新途径[3].然而,当前有关甘薯中DEAD-box基因的相关研究尚无报道.本研究利用耐盐性品种徐薯22与盐敏感性品种徐薯32在盐胁迫处理下的RNA-seq数据,首次从甘薯中筛选出一个盐胁迫响应的DEAD-box基因,命名为IbDEAD1.随后对IbDEAD1基因进行了系统的生物信息学分析和预测,结果表明,IbDEAD1基因编码的蛋白含有DEAD-box解旋酶都具有的解旋酶中心,同时包含有解旋酶超家族结构域和C末端结构域[30].多重序列比对显示,IbDEAD1与其他已知植物的DEAD-box蛋白序列具有高度相似性,且属于DEAD-box RNA解旋酶家族的DEAD类群.然而,IbDEAD1蛋白并没有保守的基序Ⅲ,该基序与RNA解链有关[8],说明IbDEAD1蛋白中基序Ⅲ的保守性较差,这可能与其功能的特异性有关.另外,磷酸化位点预测显示,IbDEAD1蛋白具有多个Ser、Thr和Tyr磷酸化位点,说明IbDEAD1蛋白的翻译后磷酸化修饰在其功能实现中起着重要作用.根据已有研究成果,解旋酶蛋白的翻译后磷酸化修饰可能是其参与胁迫应答的途径之一,从而在转录或翻译水平上调控基因的表达[3,14].在玉米中发现缺氧胁迫可通过EIF-4A的磷酸化来抑制翻译起始[31].而由蛋白激酶C介导的磷酸化则增强了豌豆PDH47的DNA解旋酶和ATP酶活性[32].这些生物学参数为进一步研究IbDEAD1蛋白的酶学性质及其在甘薯中的作用机理奠定了理论基础.另外,在植物中,已有研究证实DEAD-box RNA解旋酶对不同的胁迫条件都有响应,如豌豆DEAD-box RNA解旋酶基因PDH45和PDH47的表达均能被盐、低温和ABA诱导,随后的转基因实验证实它们的超表达均能提高转基因植物的盐胁迫耐力[32-33].我们发现IbDEAD1基因的表达受盐胁迫处理的显著诱导,暗示其在甘薯盐胁迫响应中发挥重要作用.目前,植物转基因抗性育种方面的研究已经取得很大进展,但许多目的基因的功能趋于单一化,对转基因植株抗性的提升有限.因此,胁迫诱导型DEAD-box基因在胁迫响应途径中的调控功能为分子抗性育种提供了更为合理和高效的基因工程策略.甘薯作为重要的粮食、工业原料和新兴能源作物,其IbDEAD1基因的分子克隆、生物信息学以及对盐胁迫处理的响应特性的分析,为继续深入研究甘薯IbDEAD1基因在盐胁迫响应中的功能和分子调控机理奠定了基础.【相关文献】[1] Tuteja N,Ahmad P,Panda B B,et al.Genotoxic stress in plants:shedding light on DNA damage,repair and DNA repair helicases[J].Mutat Res,2009,681(2):134.[2] Schützendübel A,Polle A.Plant responses to abiotic stresses:heavy metal-induced oxidative stress and protection by mycorrhization[J].J Exp Bot,2002,53(372):1351.[3] Vashisht A A,Tuteja N.Stress responsive DEAD-box helicases:a new pathway to engineer plant stress tolerance[J].J Photochem Photobiol B:Biology,2006,84(2):150.[4] Tuteja N.Plant DNA helicases:the long unwinding road[J].J Exp Bot,2003,54(391):2201.[5] Phan T N,Ehtesham N Z,Tuteja R,et al.A novel nuclear DNA helicase with high specific activity from Pisum sativum catalytically translocates in the 3′→5′ direction[J].Eur J Biochem,2003,270(8):1735.[6] Lohman T M,Tomko E J,Wu C G.Non-hexameric DNA helicases and translocases:mechanisms and regulation[J].Nat Rev Mol Cell Biol,2008,9(5):391.[7] Linder P,Lasko P F,Ashburner M,et al.Birth of the D-E-A-Dbox[J].Nature,1989,337(6203):121.[8] Cordin O,Banroques J,Tanner N K,et al.The DEAD-box protein family of RNA helicases[J].Gene,2006,367:17.[9] Rocak S,Linder P.DEAD-box proteins:the driving forces behind RNA metabolism[J].Nat Rev Mol Cell Biol,2004,5(3):232.[10] Fairman-Williams M E,Guenther U P,Jankowsky E.SF1 and SF2 helicases:family matters[J].Curr Opin Struct Biol,2010,20(3):313.[11] Huang C K,Shen Y L,Huang L F,et al.The DEAD-Box RNA helicase AtRH7/PRH75 participates in pre-rRNA processing,plant development and cold tolerance in Arabidopsis[J].Plant Cell Physiol,2016,57(1):174.[12] He J,Duan Y,Hua D,et al.DEXH box RNA helicase-mediated mitochondrial reactive oxygen species production in Arabidopsis mediates crosstalk between abscisic acid and auxin signaling[J].The Plant Cell,2012,24(5):1815.[13] Seki M,Narusaka M,Abe H,et al.Monitoring the expression pattern of 1 300 Arabidopsis genes under drought and cold stresses by using a full-length cDNA microarray[J].The Plant Cell,2001,13(1):61.[14] 蔡敬,孟小庆,董婷婷,等.DEAD-box解旋酶在植物非生物胁迫响应中的功能研究进展[J].生命科学,2017,29(5):427.[15] Zhu M,Chen G,Dong T,et al.SlDEAD31,a putative DEAD-Box RNA helicasegene,regulates salt and drought tolerance and stress-related genes in tomato[J].PloS One,2015,10(8):e0133849.[16] Kant P,Kant S,Gordon M,et al.STRESS RESPONSE SUPPRESSOR1 and STRESS RESPONSE SUPPRESSOR2,two DEAD-box RNA helicases that attenuate Arabidopsis responses to multiple abiotic stresses[J].Plant Physiology,2007,145(3):814.[17] Tuteja N,Sahoo R K,Garg B,et al.OsSUV3 dual helicase functions in salinity stress tolerance by maintaining photosynthesis and antioxidant machinery in rice (Oryza sativa L.cv.IR64)[J].Plant J,2013,76(1):115.[18] Gong Z,Dong C H,Lee H,et al.A DEAD box RNA helicase is essential for mRNA export and important for development and stress responses in Arabidopsis[J].The PlantCell,2005,17(1):256.[19] Gong Z,Lee H,Xiong L,et al.RNA helicase-like protein as an early regulator of transcription factors for plant chilling and freezing tolerance[J].Proc Nat Acad SciUSA,2002,99(17):11507.[20] 马代夫,李强,曹清河,等.中国甘薯产业及产业技术的发展与展望[J].江苏农业学报,2012,28(5):969.[21] Gorbalenya A E,Koonin E V,Donchenko A P,et al.A conserved NTP-motif in putative helicases[J].Nature,1988,333(6168):22.[22] Nakamura T,Muramoto Y,Yokota S,et al.Structural and transcriptional characterization of a salt-responsive gene encoding putative ATP-dependent RNA helicase inbarley[J].Plant Sci,2004,167(1):63.[23] Lee K H,Park J,Williams D S,et al.Defective chloroplast development inhibits maintenance of normal levels of abscisic acid in a mutant of the Arabidopsis RH3 DEAD-box protein during early post-germination growth[J] Plant J,2013,73(5):720.[24] Li D,Liu H,Zhang H,et al.OsBIRH1,a DEAD-box RNA helicase with functions in modulating defence responses against pathogen infection and oxidative stress[J].J Exper Botany,2008,59(8):2133.[25] 朱明库.番茄SlNAC4和SlDEAD31基因在果实成熟及非生物胁迫响应中的功能研究[D].重庆:重庆大学,2015.[26] Kim Y H,Kim C Y,Song W K,et al.Overexpression of sweetpotato swpa4 peroxidase results in increased hydrogen peroxide production and enhances stress tolerance in tobacco[J].Planta,2008,227(4):867.[27] Park S C,Kim Y H,Jeong J C,et al.Sweetpotato late embryogenesis abundant 14 (IbLEA14) gene influences lignification and increases osmotic- and salt stress-tolerance of transgenic calli[J].Planta,2011,233(3):621.[28] Gao S,Yuan L,Zhai H,et al.Overexpression of SOS genes enhanced salt tolerance in sweetpotato[J].J Integr Agric,2012,11(3):378.[29] Cheng Y,Kim M D,Deng X,et al.Enhanced salt stress tolerance in transgenic potato plants expressing IbMYB1,a sweet potato transcription factor[J].J Microbiol Biotechnol,2013,23(12):1737.[30] Tanner N K,Linder P.DExD/H box RNA helicases:from generic motors to specific dissociation functions[J].Molec Cell,2001,8(2):251.[31] Webster C,Gaut R L,Browning K S,et al.Hypoxia enhances phosphorylation of eukaryotic initiation factor 4A in maize root tips[J].J Biological Chem,1991,266(34):23341.[32] Vashisht A A,Pradhan A,Tuteja R,et al.Cold- and salinity stress-induced bipolar pea DNA helicase 47 is involved in protein synthesis and stimulated by phosphorylation with protein kinase C[J].Plant J,2005,44(1):76.[33] Sanan-Mishra N,Pham X H,Sopory S K,et al.Pea DNA helicase 45 overexpression in tobacco confers high salinity tolerance without affecting yield[J].Proc Nat Acad Sci USA,2005,102(2):509.。
