有机化学 第四章对映异构
有机化学(上)目录

第一部分基础篇
第一章绪论
第二章烷烃
第一节链烷烃
第二节环烷烃
第三章烯烃、炔烃
第一节单烯烃
第二节共轭双烯烃
第三节炔烃
第四章芳烃
第一节苯系芳烃
第二节非苯系芳烃
第五章对映异构
第一节对映异构与分子结构的关系
第二节含手性碳原子化合物的对映异构
第三节其他手性化合物的对映异构
第四节对映体的分离
第六章卤代烃
第七章有机化合物结构的光谱分析
第一节质谱
第二节紫外光谱
第三节红外光谱
第四节核磁共振
第八章醇、酚、醚
第一节醇
第二节酚
第三节醚
第九章醛、酮
第一节醛酮的结构、分类、和命名
第二节醛酮的来源和制法
第三节醛酮的性质
第四节不饱和羰基化合物
第十章羧酸及其衍生物
第一节羧酸
第二节取代羧酸
第三节羧酸衍生物
第十一章含氮有机化合物
第一节硝基化合物
第二节胺
第三节重氮和偶氮化合物。
有机化学第四章结构的表征习题答案

第四章 结构的表征4-1 如何用IR 光谱区别下列各组化合物。
(1)异戊烷分子中有异丙基,在1370—1380cm -1 的吸收峰分裂成两峰,强度接近; (2)在3000cm -1以上无吸收峰者为丁烷; (3)在3000—3100cm -1无吸收者为环已烷; (4)在3010cm -1附近有吸收峰者为甲叉基环已烷(亚甲基环已烷); (5)在3025cm -1附近和2720cm -1处有强吸收峰者为4-已烯醛; (6)在1060cm -1附近有强吸收峰者为正戊醇;(7)在1750—1860cm-1出现两个峰,其中高频峰强于低频峰者为乙酐。
4-2 如何用1H-NMR 谱区分下列各组化合物?(1)环丁烷只有一个单峰,而甲基环丙烷有四组吸收峰; (2)新戊烷只有一个单峰,而正戊烷有三组吸收峰;(3)前者(1-氯-2-溴乙烷)有两组峰,而后者(1,2-二溴乙烷)只有一个单峰。
4-3 比较下面两化合物中所标出的质子在1H-NMR 谱中化学位移大小,并从低场到高场的顺序排列。
(1)B →A →C →D ; (2)A →B →C 。
4-4 请将下列各化合物中画线的质子的化学位移按由低场至高场的顺序排列。
(2)→(1)→(3)。
4-5将下列化合物按C=O 健伸缩振动吸收波数由大到小排列成序。
(1)→(2)→(3)。
4-6 请将下列各组化合物按紫外吸收波长由大到小的顺序排列。
(1) B →D →A →C ; (2) D →C →B →A 。
4-7根据NMR 谱推测下列化合物可能的构造式。
C CH 3CH 3H 3CBrCH 2OHCH 3CH BrCH 3(1)(2)(3)(4)CH 2CH 2CHCH 3BrBr4-8某化合物的分子式为C 4H 8O,它的红外光谱在1715cm -1有强吸收峰,它的核磁共振谱有一单峰,相当于三个H ,有一四重峰相当于二个H ,有一三重峰相当于三个H.。
试写出该化合物的构造式。
有机化学 第四章 立体异构

(二)、旋光仪和比旋光度
Nicol棱镜
旋光仪的工作原理
WXG-4圆盘旋光仪
t: 比旋光度 [ α ]λ
测定温度
比旋光度
[α] t λ=
波长
α
旋光度(旋光仪上的读数)
l × ρ
溶液的浓度(g/ml) 盛液管长度(dm)
质量浓度ρB = 1g/ml的旋光物质溶液,放在l = 1dm长的盛液管中测得的旋光度为这个物质的比
CHO H OH CH2OH COOH [O] HgO H OH CH2OH
D-(+)-甘油醛
D-(-)-甘油酸
If the —OH or —NH2 which attaches to the
chiral carbon atom lies on the right,the
molecule is called ―D‖;if on the left,i H H Cl F H
有对称中心的分子能和它的镜像重合,没有手性
一般来讲,一种分子不能重叠镜像的条件是这 种分子没有对称面,也没有对称中心。
Plane of Symmetry
对映异构体
对映体的物理性质和化学性质一般 都相同,比旋光度的数值相等,但旋光 方向相反;等量对映体的混合物称为外 消旋体(Racemate) ,用dl或(± ) 表示。 Racemic Mixtures
手性分子
Amino acid possesses a carbon with four different attached groups (R, NH2, H, COOH); there is no such carbon in propanoic acid.
华中科技大学2020年622+有机化学

华中科技大学硕士研究生入学考试《有机化学》考试大纲(专业代码622)第一部分考试说明一、考试性质全国硕士研究生入学考试是为高等学校招收硕士研究生而设置的。
其中,有机化学属我校进行命题的考试科目。
它的评价标准是:高等学校优秀毕业生能达到及格或及格以上水平,以保证被录取者具有较扎实的有机化学基础知识。
二、考试的范围考试范围包括有机化学的结构、命名、异构现象、光谱数据解析、各类有机化合物的物理性质与化学性质。
考查要点详见本纲第二部分。
三、评价目标有机化学考试在考查基本知识、基本理论的基础上,注重考查考生灵活运用这些基础知识观察和解决实际问题的能力。
考生应能:1.正确掌握和理解各有机化合物的结构、命名方法;2.熟练掌握基础有机化学反应的原理及应用范围;3.熟练掌握有机化学反应的基本理论、基本概念以及反应机理等,特别注意理解和掌握有机化学反应中的立体化学问题;4.熟悉各类重要有机合成化学反应、了解有机合成的基本概念和知识。
5.正确掌握有机化合物的结构解析方法。
6.掌握有机化学实验的基本知识和技能。
四、考生形式与试卷结构(一)答卷方式:闭卷,笔试。
(二)答题时间:180分钟。
(三)各部分内容的考查比例试卷满分为150分。
基础知识(基本概念、基本理论、基本反应)约55%有机合成约20%机理题约10%推断结构(含波谱分析)约10%实验约5%第二部分考查要点第一章绪论1.有机化学和有机化合物2.共价键的基本性质3.研究有机化合物的基本方法4.有机化合物的分类第二章烷烃1.烷烃的异构与命名2.烷烃的构型与构象3.烷烃的物理性质4.烷烃的化学性质5.卤代反应的机理,自由基的稳定性第三章环烷烃1.环烷烃的命名与异构2.环烷烃的物理与化学性质3.环烷烃的构象及构象分析4.多环烃第四章对映异构1.旋光性2.手性3.分子的手性与对称性4.含一个手性碳原子的化合物5.含几个手性碳原子的开链化合物6.碳环化合物的立体异构第五章卤代烷1.卤代烷的命名2.卤代烷的结构和物理性质3.卤代烷的化学性质4.亲核取代反应机理5.卤代烷的制法6.有机金属化合物第六章烯烃1.烯烃的结构、异构和命名2.烯烃的制法3.消去反应机理4.烯烃的物理性质5.烯烃的化学性质6.亲电加成反应机理,碳正离子的稳定性7.烯烃的来源和用途第七章炔烃和二烯烃1.炔烃的结构、异构和物理性质2.炔烃的化学反应3.炔烃的制法4.共轭作用,超共轭作用5.共轭二烯烃6.累积二烯烃第八章芳烃1.苯的结构、共振论2.苯衍生物的异构、命名及物理性质3.苯环上的亲电取代反应及机理4.苯环上亲电取代反应的定位规律5.多环芳烃6.卤代芳烃7.休克尔规律第九章醇、酚、醚1.醇的结构、命名和物理性质2.一元醇的反应3.一元醇的制法4.二元醇5.酚的结构、命名和物理性质6.一元酚的反应7.二元酚和多元酚8.醚的结构、命名和物理性质9.醚的反应10.醚的制法11.环醚第十章醛、酮、醌1.一元醛酮的结构、命名和物理性质2.醛酮的亲核加成反应3.醛酮的亲核加成反应机理4.醛酮的氧化和还原5.一元醛酮的制法6.醛酮的来源和用途7.α,β-不饱和醛酮8.醌第十一章羧酸1.一元羧酸的结构、命名和物理性质2.一元羧酸的反应3.一元羧酸的制法4.二元羧酸第十二章羧酸衍生物1.羧酸衍生物的结构和命名2.羧酸衍生物的物理性质3.酯水解反应机理4.羧酸衍生物的反应5.羧酸衍生物的用途6.烯酮7.不饱和羧酸8.取代羧酸9.乙酰乙酸乙酯和丙二酸二乙酯及其在有机合成中的应用第十三章含氮化合物1.硝基化合物的结构和命名2.硝基化合物的性质3.硝基化合物的制备4.胺的结构、命名和物理性质5.胺的化学性质6.胺的制法7.芳香族重氮化反应8.芳香族重氮盐的性质9.分子重排第十四章有机硫、磷和硅化合物1.含硫化合物2.含磷化合物3.含硅化合物第十五章杂环化合物1.杂环化合物的分类和命名2.五元杂环化合物3.六元杂环化合物4.生物碱第十六章周环反应1.周环反应理论2.电环化反应3.环加成反应4. -迁移反应第十七章碳水化合物1.单糖2.双糖3.多糖4.糖的衍生物第十八章有机合成1.逆合成分析2.有机合成设计第十九章有机波谱分析(UV、IR、1H NMR和MS等)第二十章蛋白质、氨基酸和核酸第二十一章有机化学实验(基本原理、基本操作和基本合成方法)。
有机化学课后题

)。
CH3
CH3
CH3
A.
B.
C.
CH3
CH3
H3C
CH3
CH3
D.
E.
CH3
CH3
6.芳环取代反应中,最强的间位取代定位基是( )。
A. -NH2
B. -NO2
C. -R
D. -COOH
二、是非题
1.苯分子中所有碳原子都是 sp2 杂化。
2.氯苯经氢氧化钠溶液煮沸水解,可得苯酚。
3.-OH 属于邻对位取代定位基。
D. 无变化
二、是非题
1.烯烃与 HX(HCl、HBr、HI)发生亲电加成反应,在过氧化物存在下均得到反马尔可夫
尼可夫加成产物。
()
2.凡是双键碳原子都是 sp2 杂化。
()
3.有些烯烃的顺反异构体可用顺/反或 Z/E 两套命名法命名。
()
4.碳碳双键中的两条共价键都是π键。
()
5.不饱和化ቤተ መጻሕፍቲ ባይዱ物中均存在共轭效应。
3. Cl
CH3 Br
CH2CH3
5
PDF 文件使用 "pdfFactory Pro" 试用版本创建 ÿ
4. CH3CHCH2 CH3
CH3 H
CH2CH3
5. CH3CH2
H CH CHCH3 (R,S 命名法)
CH3
HO 6. Cl
C2H5 H (R,S 命名法) H
三、命名与写结构式
() () () ()
1.
(CH3)2CH
C2H5 CH3
CH3
2.
Br
CH3
3.
Cl
CH(CH3)2
CH CH2
第四章 立体异构
Cl
C CH3
C Br
CH3
C
C H
(E)- 2-氯-1-溴丙烯
(Z)- 2-氯-1-溴丙烯
2. 次序规则
(1)将与双键碳原子直接相连的原子按原 子序数大小排列,原子ቤተ መጻሕፍቲ ባይዱ数大者为“较优”基 团;若为同位素,则质量高者为“较优”基团。
I > Br > Cl > S > P > F > O > N > C > D > H
H C CH3
这种在有双键或环状结构的分子中,由于旋转受阻 使与双键或环相连接的原子或原子团在空间的排布方式不 同所引起的立体异构现象叫做顺反异构现象。各种异构 体互称为顺反异构,又称几何异构。
2.产生顺反异构的原因和条件
产生的原因:由于双键中的π键限制了σ键 的自由旋转,使得两个甲基和两个氢原子在空间 有两种不同的排列方式。
三、含一个手性碳原子的化合物的旋光异构
1.对映体和外消旋体 H3C
C
CH3 H HO
C
HOOC
H OH
COOH
乳酸的一对对映体(透视式) 对映体:互为实物和镜像关系的异构体叫做对 映异构体,简称对映体。
外消旋体;它们的等量混合物可组成一个外消 旋体,用(±)表示 。外消旋体无旋光性。
2.构型的表示方法
构象的两种表示方法
透视式
H
H H C H H C H H
H C H H H
C H
交叉式
重叠式
纽曼投影式:
H H H H
H H
H H
HH
H H
交叉式
重叠式
交叉式构象为优势构象
乙烷处于交叉式构象时,两个碳 上的氢原子相距最远,相互排斥力最 小,因而内能最低。重叠式构象内能 最高。但二者内能相差仅12.5kJ/mol, 室温时,分子热运动所提供的能量就 能使各个构象相互转化,因而不能分 离出乙烷的某一构象异构体。
有机合成化学第四章
① 概念 1968年,Horeau等首先提出“双不对 称诱导”的概念.1985年,Masamune等将这 类反应称之为“双不对称合成”.事实上不对 称性很难加以限定.因此,人们常接受Izumi 于1977年和Heathcock于1979年提出的“双立 体差异反应”来表示这类反应.
Hematology
16.5
Antiviral
17.7
$46.6 31.7 22.0 15.6 53.9 15.4 19.1
$24.8 23.9 13.8 9.4 8.6 8.6 6.2
$26.9 23.9 14.6 10.4 9.0 9.1 6.5
TOTAL
$360.0 $390.0
$115.0 $123.3
1992年,美国食品与药品管理局(FDA)颁布手性 药物指导原则
1993-2000年世界手性药物的年销售量由356亿 美元增加至1233亿美元,达药物总销售量 (2000年3900亿美元)的三分之一
1994-2000年期间手性精细化学品(中间体)的 销售由11.35亿美元增加到66.3亿美元
Drug sales:Worldwide sales of single enantiomer drugs had past $123 billion
7.与芳基的π-π相互作用
Evans
8.杂原子导向性π-面选择性
9.手性辅基(chiral auxilarities)
采用手性辅基方法控制立体选择性是现代不对称合成 中最广泛的方法之一
Acetal and miscellaneous heterocycles Boronic esters Camphor derivatives Dienes and dienophiles for [4+2] cycloaddition Enamines and imines Hydrazones Oxathianes Oxazolidineones Oxazolines Sulfoxide
有机化学第四章1
小的碳原子写在竖线上端。
2020/8/5
使用费歇尔投影式应注意的问题:
a) 基团的位置关系是“横外竖里”
b) 不能离开纸平面翻转180°;也不能在 纸平面上旋转90°或270°,否则构型 将改变。
c) 将投影式在纸平面上旋转180°,仍为 原构型。
(S)-(+)-乳酸
镜
COOH
面
C
H
镜面 OH
CH3
(R)-(-)-乳酸
mp 53oC
mp 53oC
[]D15=+3.82
[]D15=-3.82
pKa=3.79(25oC)
pKa=3.83(25oC)
一对对映体
外消旋乳酸 (等摩尔的左旋体 和右旋体混合物)
()-乳酸 mp 18oC
[]1D5 =0
pKa=3.86(25oC)
1°当最小基团位于横线时,若其余三个基 团由大→中→小为顺时针方向,则此投影式 的构型为S,反之为R。
2°当最小基团位于竖线时,若其余三个基 团由大→中→小为反时针方向,则此投影式 的构型为R,反之为S。
2020/8/5
最小基团在横线上(变)
2020/8/5
最小基团在竖线上(不变)
2020/8/5
右旋(+)——右旋体 由旋光仪测定的旋光度,不仅取决于物质结构,而 且与测定条件有关。如:偏振光的波长、被测定液 的浓度、温度等。
2020/8/5
比旋光度
测定温度
旋光度(旋光仪上的读数)
[α
]t
λ
=
比选光度
波长
(钠光D)
α Lx C
溶液的浓度(g/ml) 盛液长度(分米dm)
有机化学
第一次交换
C2H5
第二次交换
C2H5
-Cl和-CH3交换 第三次交换
Cl H
CH3
(4)在投影式中,固定任一基团不动,其余 在投影式中,固定任一基团不动, 三个基团按顺时针或逆时针顺序依次交换位置, 三个基团按顺时针或逆时针顺序依次交换位置, 其构型不变。 其构型不变。
COOH H CH3
固固固其固固 ,其其其其其其 按按按按 依依依依依依
若将其中一个费歇尔投影式的手性碳原子 上的任意两个原子或基团交换奇数次后, 上的任意两个原子或基团交换奇数次后,得到 的投影式和原来的那个投影式互为对映体。 的投影式和原来的那个投影式互为对映体。
CH3 H C2H5
-H和-CH3交换
Cl H3C
H
-H和-C2H5交换
Cl H3C
C2H5 Cl H
2-氯丁烷的一对对映体 对映体:互为实物和镜影关系的异构体叫做对 对映体: 对映体。 映异构体,简称对映体 映异构体,简称对映体。 外消旋体; 外消旋体;它们的等量混合物可组成一个外消 旋体, 旋体,用(±)或“dl”表示 。 表示
2.构型的表示方法 描述旋光异构体分子中的原子或基团在 空间的排列方式时可用费歇尔(E.Fischer) 空间的排列方式时可用费歇尔(E.Fischer) 投影式来表示。 投影式来表示。 费歇尔投影式的投影规则如下: 费歇尔投影式的投影规则如下: (1)将碳链竖起来,把氧化态较高的碳原子 将碳链竖起来, 或命名时编号最小的碳原子放在最上端。 或命名时编号最小的碳原子放在最上端。 横前竖后: ( 2 ) 横前竖后 : 与手性碳原子相连的两个横 键伸向前方,两个竖键伸向后方。 键伸向前方,两个竖键伸向后方。 横线与竖线的交点代表手性碳原子。 (3)横线与竖线的交点代表手性碳原子。
有机化学对映异构PPT课件
(S)
H COOH COOH C3H COOH CH 3
H OH
构型改变
CH 3
(R)
H OH
构型改变
COOH
(动画6)
(S)
(三) 构型和命名法
(1) D/L构型标记法 (2) (2) R/S构型标记法
(三) 构型和命名法
(1) D/L构型标记法
D/L标记法是以甘油醛的构型为标准来进行的。
可见,当两Nicol晶轴平行时,观察到的光强度最大。
(2) 旋光物质与比旋光度
起偏镜
I0
光源
Nicol棱棱
偏振光
盛液管
检偏镜
I
观察
旋转后的 偏振光
Nicol棱棱
旋光性——某些物质能使偏振光的振动方向旋转一定角 度的性质。
右旋—— (+) ; 左旋 ——(-)
旋光度——旋光性物质使偏振光的振动平面所旋转的角 度,用α表示。
(2) 第二个手性中的产生
如果在一个旋光体分子里生成第二个手性碳原子, 生成非对映体的量是不相等的。
例如:
CH3 H Cl HH
CH3
(2S)-氯丁烷
手性环境
CH3
Cl2 H Cl Cl H
+
CH3
(2S,3S)-二氯丁烷
29%
CH3 H Cl H Cl
COOH HO H
C6H5 S-
CH3 H OH
CH=2CH S-
注 意:
R/S标记法与D/L标记法的依据不同。
R/S法依据与*C相连的四个原子或原子团的 大小顺序;
D/L法依据与D-甘油醛的构型是否相同。
(四)具有两个手性中心的对映异构
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、手性分子的判断
判断对映体的方法有三种: (1)建造一个分子和它的镜像的模型,如 果两者不能重合,就存在对映体。
(2)如果分子有对称面或对称中心,那么 它和其镜像就能重合,就不存在对映体。
(3)如果一个分子有一个手性碳原子,它 就具有对映异构现象,有一对对映体。
二、手性分子的判断
结论:
既无对称面,又无对称中心的分子才是手 性分子。 只含一个手性中心的分子一定是手性分子。 手性碳是分子产生对映异构的普遍因素。 分子是否具有手性主要是考察它是否与镜相 重合,即与分子的对称性有关。
• 立体化学是研究化合物分子在三维空间的立体形象 与其物理性质,反应性能以及生理活性之间的关系 的科学。
• 立体化学已成为化学学科的一个重要分支,研究分 子的立体结构与性能之间的关系已成为化学的一项 重要内容。
反应停事件:
20世纪50年代中期,反应停(沙利度胺, Thalidomide)作为镇静剂,有减轻孕妇清晨呕吐的 作用而被广泛应用。结果在欧洲导致1.2万例胎儿致 残,即海豹婴。于是1961年该药从市场上撤消。后 来发现沙利度胺R型具有镇静作用,而S型却是致畸 的罪魁祸首。研究人员进一步研究发现沙利度胺任一 异构体在体内都能转变为相应对映体,因此无论是S 型还是R型,作为药物都有致畸作用。
二、手性分子的判断
手性因素
使分子具有手性的几何因素有:手性中 心、手性面、手性轴。
手性中心 能引起分子具有手性的一个特定原子或 分子骨架的的中心称为手性中心(chiral center)。
二、手性分子的判断
手性碳原子(最常见的手性中心)
凡是连有4个不同原子或基团的碳原子称 为手性碳原子(chiral carbon atom),或 称手性中心(chiral center)。
对映异构体的R/S、D/L命名法以及基团的次序规则。
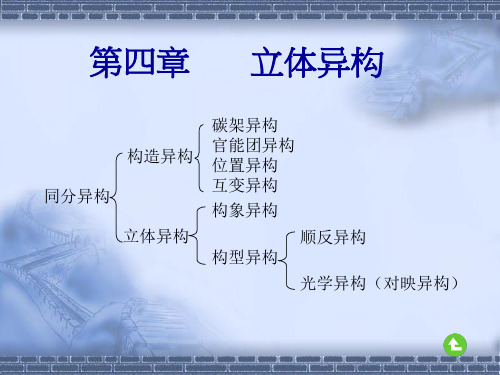
碳链异构
构造异构
位置异构 官能团异构
异构现象
互变异构
立体异构
构型异构 构象异构
顺反异构 对映异构
对映异构是立体异构中的一种,由于这种异构 和化合物的旋光性有关,故又称为光学异构或 旋光异构。
• 立体化学起源于1848年, 法国化学家巴斯德 (Pasteur)将外消旋的酒石酸铵钠的结晶,分离成左 旋体和右旋体,从而发现了对映异构现象。
一、手性和手性分子
例如:乳酸分子
镜子
CO2H
C
HO
H
H3C
CO2H
C
H
OH
CH3
存在实物和镜像关系,又不能重叠的一 对立体异构体,互为对映异构体(简称对映 体enantiomer)。
二、手性分子的判断 1.对称面:能将分子结构剖成互为实物和镜像
关系两半的平面(symmetrical plane, 符号为σ)。
一、手性和手性分子
手性(Chirality):自然界的基本属性
• 组成生命活动的基本化学物质是手性化合物! • 手性药物:一把钥匙开一把锁!
1. 氨基酸--蛋白质 2. 糖--多糖 3. 核酸--DNA
2/3以上开发中的药物为手性 市场上40%的手性药物为单一异构体
一、手性与手性分子
互为实物与镜像关系,又不能重叠的分子,称 手性分子(chiral molecule)。
目前,研究和发展新的手性技术,借此获得光学 纯的手性药物,已成为许多实验室和医药公司追 求的目标。
第一节 对映异构体的基本概念
一、手性与手性分子
有一些分子,彼此成实物与镜像的关系,但是 不能重叠,这样产生的异构称为对映异构。
象人的左、右手一样,互为实物与镜象关系, 彼此又不能重合的性质称为手性。
次序规则等。
本章重点:
手性、手性分子、非手性分子、手性碳、对称面、对称中 心的各自含义及相互关系;
对映体、非对映体、外消旋体、内消旋体的定义、判据及 它们之间的关系;
Fischer投影式的书写要点; 对映异构体的R/S、D/L命名法以及基团的次序规则等。
本章难点
对映体、非对映体、外消旋体、内消旋体的定义、判据 及它们之间的关系;
注意:在考察分子的对称因素时,应将原子 或原子团看作球形。
二、手性分子的判断
有对称面的分子与它的镜像能重合,是对称 分子,没有对映异构现象,称为非手性分子 (achiral molecule)。
二、手性分子的判断 问题:下列分子有无对称面?
H H C Cl
Cl
2个对称面
7个对称面
二、手性分子的判断
含有一个手性碳原子的化合物只有一对对 映体。
二、手性分子的判断
例:
CH3CH2C* HCH3
OH
CH3
C H HOC2H5
CH3
C
H5C2
H
OH
对映体
二、手性分子的判断
其它手性中心有N、P和S等多价原子。
如:
CH3
+★
N
C2H5
O
C6H5
C3H7
★
P C6H5
CH3
手性S原子,如:
p. 315
反应停事件
O
H
N
O
NH
O
O
(S)-thalidomide
O H
N
O
NH
O
O
(R)-thalidomide
1984年荷兰药理学家Ariens极力提倡手性药物以 单一对映体上市, 抨击以消旋体形式进行药理研 究以及上市。他的一系列论述的发表,引起药物 部门广泛的重视。
2001年诺贝尔化学奖授予了3位美日科学家,表 彰他们在手性催化氢化反应和手性催化氧化反应 领域所做出的重大贡献。
二、手性分子的判断
问题:下列化合物哪些是手性分子?
CH3CHCO2H NH2
手性分子
CH3
CH3
CC
H
H
2个对称面
CH 3
CH3
C2H5
1个对称面
Enantiomerism
本章主要内容
手性、手性分子、非手性分子、手性碳、 对称面、对称中心的各自含义及相互关系;
对映体、非对映体、外消旋体、内消旋体 的定义、判据及它们之间的关系;
左旋、右旋、比旋光度的概念; Fischer投影式的书写要点; 对映异构体的R/S、D/L命名法以及基团的
2、对称中心(i) 假若分子中有一点,在所有通过
该点的直线上在距该点等距离处,具有相同的原子或
基团,该点就叫分子的对称中心(symmetrical center) 。
Br H H
Hale Waihona Puke Br翻转180° 两者能重叠
F
H. A
H
F
H
Br
F
H
.H A
F
Br
H
结论:含对称中心的分子,与其镜像能够重合, 是对称分子,即非手性分子。
