2020届二轮复习 晶体结构与性质 专题卷(全国通用) (3)
2020(届)高考(人教)化学:物质的结构和性质二轮练习题附答案

2020(届)高考(人教)化学:物质的结构与性质二轮练习题附答案专题:物质的结构与性质1、下列说法正确的是()A.离子晶体中可能含有共价键,一定含有金属元素B.分子晶体中可能不含共价键C.非极性分子中一定存在非极性键D.对于组成和结构相似的分子晶体,一定是相对分子质量越大,熔沸点越高【答案】B【解析】2、(1)在以离子键为主的化学键中常含有共价键的成分。
下列各对原子形成化学键中共价键成分最少的是()A.Li,F B.Na,F C.Na,C1 D.Mg,O(2)下列有关物质性质,结构的表述均正确,且存在因果关系的是:A.答案AB. 答案BC. 答案CD. 答案D(3)下列说法中错误的是()A.SO2,SO3都是极性分子B.在NH4+和[Cu(NH3)4]2+中都存在配位键C.元素电负性越大的原子,吸引电子的能力越强D.原子晶体中原子以共价键结合,具有键能大,熔点高,硬度大的特性(4)已知A,B,C,D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。
A与其他4种元素既不在同一周期又不在同一主族。
B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。
D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图。
请回答:①A元素的名称是;②B的元素符号是,C的元素符号是,B与A形成的化合物比C与A形成的化合物沸点高,其原因是;③E属元素周期表中第周期,第族的元素,其元素名称是,它的+2价离子的电子排布式为;④从图中可以看出,D跟B形成的离子化合物的化学式为;该离子化合物晶体的密度为ag·cm-3,则晶胞的体积是(只要求列出算式)。
【答案】(1)B (2)B(3)A(4)①氢②F Cl 氟化氢分子间存在氢键,氯化氢分子间没有氢键③四VIIB 锰1s22s22p63s23p63d5④CaF2【解析】(1)金属性最强和非金属性最强的元素形成共价键的可能最小,选择B;(2)I2为非极性分子,水为极性分子,与分子间作用力无关,A错误;Pb的原子半径比C的大,元素的非金属性比C弱,对应的氢化物的稳定性较弱,B正确;同一主族元素的最外层电子数相同,但化合价不一定相同,如O无正价,但S 的最高正价为+6价,C错误;共价化合物类型的电解质的水溶液能导电,电解质既有离子化合物,也有共价化合物,故D错误;(3)O3中心原子是sp3杂化,空间构型是平面三角形分子,因此它是非极性分子,A错误;B正确,NH4+中一个H原子与N原子存在配位键,NH3与Cu之间以配位键连接;C正确;D正确,为原子晶体的特征;(4)①②③E是周期表中1~18列中的第7列元素, 又前36号的元素,基本推知E 为25号元素Mn,依题意D为Ca,根据晶胞结构利用均摊法可知该晶胞中有4个D,8个B。
2020年高考化学二轮复习验收测试《物质结构与性质》含答案及详细解析

绝密★启用前2020年高考化学二轮复习验收测试《物质结构与性质》本试卷共100分,考试时间90分钟。
一、单选题(共15小题,每小题4.0分,共60分)1.下列说法不正确的是()A.离子晶体的晶格能越大,离子键越强B.阳离子的半径越大则可同时吸引的阴离子越多C.通常阴、阳离子的半径越小、电荷越大,该阴阳离子组成的离子化合物的晶格能越大D.拆开1mol离子键所需的能量叫该离子晶体的晶格能2.对下列物质溶于水时破坏的作用力描述错误的是()A.氯化钠,破坏了离子键B.氯化氢,破坏了共价键C.蔗糖,破坏了分子间作用力D.二氧化碳,没有破坏作用力3.以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是( )A. HeB.C. 1s2D.4.设N A为阿伏加德罗常数的值。
下列叙述正确的是()A.在SiO2晶体中1mol硅原子形成的Si-O键为2N AB. 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1N AC.室温下,21.0 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5N A D.含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1N A 5.在[Cu(NH3)4]2+离子中NH3与中心离子Cu2+结合的化学键是() A.离子键B.非极性键C.极性键D.配位键6.下列物质中含有非极性键的共价化合物是()A. CCl4B. Na2O2C. C2H4D. CS27.有关晶体的叙述中正确的是()A.在SiO2晶体中,由Si、O构成的最小单元环中共有8个原子B.在28g晶体硅中,含Si-Si共价键个数为4N AC.金刚石的熔沸点高于晶体硅,是因为C-C键键能小于Si-Si键D.镁型和铜型金属晶体的配位数均为128.下列化合物中含有手性碳原子的是()A. C F2B. CH3CH3C.——COOHD. CH3CH2OH9.报道合成和分离含高能量的正离子N5+的化合物N5AsF6,下列叙述正确的是()A. N5+与H2S是等电子体B. N5+中氮氮原子间以共用电子对结合C. N5AsF6化合物是共价合物D. N5AsF6是极性分子10.下列化学式表示物质分子组成的是()A. NaClB. CO2C. CuD. SiO211.Co(Ⅲ)的八面体配合物为CoCl m·n NH3,若1 mol该配合物与AgNO3作用生成1 mol AgCl沉淀,则m、n的值是()A.m=1,n=5B.m=3,n=4C.m=5,n=1D.m=4,n=512.下列排序正确的是( )A.酸性:H2CO3<C6H5OH<CH3COOHB.碱性:Ba(OH)2<Ca(OH)2<KOHC.熔点:MgBr2<SiCl4<BND.沸点:PH3<NH3<H2O13.下列晶体熔沸点由高到低的顺序正确的是()①SiC②Si③HCl④HBr⑤HI⑥CO⑦N2⑧H2A.①②③④⑤⑥⑦⑧B.①②⑤④③⑥⑦⑧C.①②⑤④③⑦⑥⑧D.⑥⑤④③②①⑦⑧14.下列说法正确的是( )A.分子晶体中一定存在分子间作用力,不一定存在共价键B.分子中含两个氢原子的酸一定是二元酸C.含有金属离子的晶体一定是离子晶体D.元素的非金属型越强,其单质的活泼型一定越强15.下列分子构型为正四面体的是( )①P2②NH3③CCl4④CH4⑤H2S ⑥CO2A.①③④⑤B.①③④⑤⑥C.①③④D.④⑤二、非选择题(共4小题,每小题10.0分,共40分)16.X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,且XZ2与Y2Z互为等电子体。
2020版高考化学二轮复习题型十一物质结构与性质综合题对对练含解析
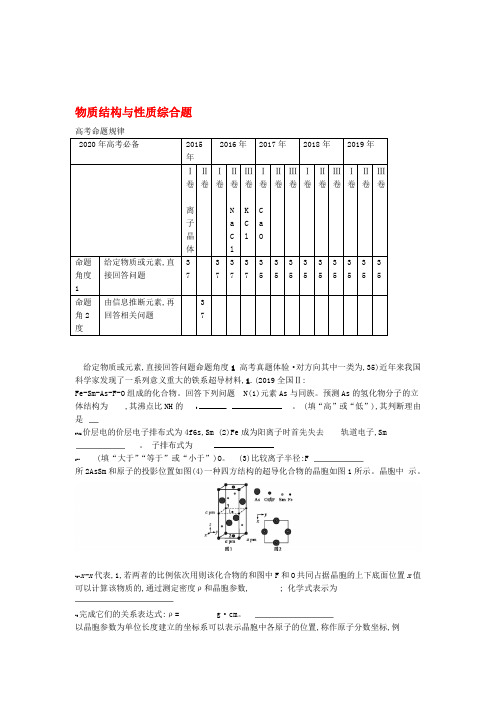
物质结构与性质综合题高考命题规律给定物质或元素,直接回答问题命题角度1高考真题体验·对方向其中一类为,35)近年来我国科学家发现了一系列意义重大的铁系超导材料,1.(2019全国Ⅱ:Fe-Sm-As-F-O组成的化合物。
回答下列问题N(1)元素As与同族。
预测As的氢化物分子的立体结构为,其沸点比NH的3。
(填“高”或“低”),其判断理由是3+26价层电的价层电子排布式为4f6s,Sm(2)Fe成为阳离子时首先失去轨道电子,Sm。
子排布式为2--(填“大于”“等于”或“小于”)O。
(3)比较离子半径:F所2AsSm和原子的投影位置如图(4)一种四方结构的超导化合物的晶胞如图1所示。
晶胞中示。
-2-x-x代表,1,若两者的比例依次用则该化合物的和图中F和O共同占据晶胞的上下底面位置x值可以计算该物质的,通过测定密度ρ和晶胞参数,;化学式表示为-3完成它们的关系表达式:ρ= g·cm。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如。
、31图1中原子的坐标为(),则原子2和的坐标分别为NH分子间存在氢键答案 (1)三角锥形低35小于(3)(2)4s 4f-) F(4)SmFeAsO xx1- -),0) ((0,0,分子的NH与AsH属于等电子体,两者结构相似,NH,解析 (1)因为N与As位于同一主族因此333NH 分子的立体结构也为三角锥形;由于NH分子间存在氢键,因此立体结构为三角锥形,则AsH333的沸点高。
2+62根据Fe首先失去最外层4s能级上的电子成为Fe;(2)铁的电子排布式为[Ar]3d4s,故3+62能级要失去最外层6s能级上的2个电子和4fSm的价电子排布式4f6s可知,由Sm生成Sm, 1个电子。
上的--2-小故离子半径F,离子半径反而越小,(3)由于F与O的核外电子排布一样,核电荷数越大2-;于O 晶胞中各原子的个数分别为(4)根据均摊法,故该化合物的化学式为=2,O共有: ×+ ×Sm:4×= ; s:4×= ;Fe: +4×=2;F和 4。
2020届高考化学二轮备考专题辅导与测试:物质结构与性质 专题检测【要点透析、提升训练】

知识像烛光,能照亮一个人,也能照亮无数的人。--培根
离子所带电荷数成正比,与离子核间距成反比,故 CaF2 晶体的晶格 能大于 CaCl2。晶格能越大,离子晶体的熔点越高,故 CaF2 的熔点高 于 CaCl2,正确。c 项,阴、阳离子个数比相同,晶体构型不一定相 同。d 项,CaF2 是离子化合物,在熔融状态下能电离产生自由移动的
胞 的 体 积 为 (0.566 × 10 - 7cm)3 , 从 而 可 知 晶 体 F 的 密 度 为
4×62 g·mol-1 (0.566×10-7cm)3×6.02×1023mol-1=2.27
g·cm-3。
答案 (1)O 1s22s22p63s23p3(或[Ne] 3s23p3)
(2)O3 O3 相对分子质量较大,范德华力大 分子晶体 离子晶 体
3 / 16
知识像烛光,能照亮一个人,也能照亮无数的人。--培根
4,故 SO24-的立体构型为正四面体。 ②[Ni(NH3)6]2+中,由于 Ni2+具有空轨道,而 NH3 中 N 原子含有孤
电子对,两者可通过配位键形成配离子。 ③由于 NH3 分子间可形成氢键,故 NH3 的沸点高于 PH3。NH3 分子
③氨的沸点________(填“高于”或“低于”)膦(PH3),原因是
______________________;氨是________分子(填“极性”或“非极
性”),中心原子的轨道杂化类型为________。
(3)单质铜及镍都是由________键形成的晶体;元素铜与镍的第
二电离能分别为:ICu=1 958 kJ·mol-1、INi=1 753 kJ·mol-1,ICu>
解析 A、B、C、D 为原子序数依次增大的四种元素,A2-和 B+具 有相同的电子构型,则 A 是 O,B 是 Na;C、D 为同周期元素,C 核外 电子总数是最外层电子数的 3 倍,则 C 是 P;D 元素最外层有一个未 成对电子,所以 D 是氯元素。
2020届高三化学二轮备考(Ⅱ卷重要题空强化练):有关晶胞的计算【考点透析 答案+解析】

Ⅱ卷重要题空强化练:——有关晶胞的计算1.立方氮化硼的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm,则立方氮化硼的一个晶胞中含有______个硼原子,立方氮化硼的密度是____g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为N A)。
解析:根据金刚石的结构可以判断出金刚石的一个晶胞中含有的碳原子数=8×1/8+6×1/2+4=8,因此立方氮化硼晶胞中应该含有4个N和4个B原子。
一个晶胞的质量为4×25 g/N A,一个立方氮化硼晶胞的体积为(361.5 pm)3,根据ρ=m/V计算密度,因此立方氮化硼的密度是25×4(361.5×10-10)3N Ag·cm-3。
答案: 425×4(361.5×10-10)3N A2.四方晶系CuFeS2晶胞结构如图所示。
(1)Cu+的配位数为__________,(2)已知:a=b=0.524 nm,c=1.032 nm,N A为阿伏加德罗常数的值,CuFeS2晶体的密度是________g·cm-3(列出计算式)。
解析:(1)晶胞结构分析可知,由面心上Cu与2个S相连,晶胞中每个Cu 原子与4个S相连,Cu+的配位数为4;(2)晶胞中亚铁离子=8×18+4×12+1=4,亚铜离子=6×12+4×14=4,硫离子=8,晶胞内共含4个CuFeS2,a=b=0.524 nm,c=1.032 nm,则晶体的密度=mV=4NA×(64+56+2×32) g (0.524×0.524×1.032)×10-21 cm3=4×64+4×56+8×32(0.5242×1.032)×10-21×N Ag·cm-3。
2020届高三化学二轮复习:物质结构与性质综合题的研究(选考):结构决定性质——解释原因类简答题
《高考12题逐题突破》:物质结构与性质综合题的研究(选考)结构决定性质——解释原因类简答题【核心突破】1.孤电子对对键角的影响(1)孤电子对比成键电子对的斥力大,排斥力大小顺序为LP—LP≫LP—BP>BP—BP(LP代表孤电子对,BP代表成键电子对)。
(2)排斥力大小对键角的影响2.范德华力、氢键、共价键对物质性质的影响3.晶体熔、沸点高低的比较(1)一般情况下,不同类型晶体的熔、沸点高低规律:原子晶体>离子晶体>分子晶体,如:金刚石>NaCl>Cl2;金属晶体>分子晶体,如:Na>Cl2(金属晶体熔、沸点有的很高,如钨、铂等,有的则很低,如汞等)。
(2)形成原子晶体的原子半径越小、键长越短,则键能越大,其熔、沸点就越高,如:金刚石>石英>碳化硅>晶体硅。
(3)形成离子晶体的阴、阳离子的电荷数越多,离子半径越小,则离子键越强,熔、沸点就越高,如:MgO>MgCl2,NaCl>CsCl。
(4)金属晶体中金属离子半径越小,离子所带电荷数越多,其形成的金属键越强,金属单质的熔、沸点就越高,如Al>Mg>Na。
(5)分子晶体的熔、沸点比较规律①组成和结构相似的分子,相对分子质量越大,其熔、沸点就越高,如:HI>HBr >HCl;②组成和结构不相似的分子,分子极性越大,其熔、沸点就越高,如:CO>N2;③同分异构体分子中,支链越少,其熔、沸点就越高,如:正戊烷>异戊烷>新戊烷;④同分异构体中的芳香烃及其衍生物,邻位取代物>间位取代物>对位取代物,如:邻二甲苯>间二甲苯>对二甲苯。
4.答题模板——结构决定性质简答题首先叙述结构,然后阐述原理,最后回扣本题结论。
【经典例题】例(2)Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。
从原子结构角度分析,原因是________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因________________________________________________________________________________________ ___。
2020届高考化学二轮复习微粒间作用力和晶体类型专题卷
焦点巩固练9 微粒间作用力和晶体类型1.下列表示正确的是 ( )A.硫原子结构示意图:B.乙炔的结构简式:CHCHC.乙烯的球棍模型:D.NaCl 的电子式:N a ··Cl ······ C 【微探究】 原子结构示意图中质子数=核外电子总数,题中给的是S 2-结构示意图,A 项错误。
官能团不可以省略,B 项错误。
注意常考球棍模型和比例模型,二者别混淆,C 项正确。
NaCl 中Na +与Cl -之间是离子键,不是共用电子对,D 项错误。
2.用化学用语表示NH 3+HCl NH 4Cl 中的相关微粒,其中正确的是 ( )A.中子数为8的氮原子:78NB.HCl 的电子式:H +[··Cl ······]- C.NH 3的结构式:D.Cl -的结构示意图:C 【微探究】 中子数为8的N 原子,其质量数为15,应写成 715N ,A 项错误;HCl 为共价化合物,电子式应为H ··Cl ······,B 项错误;NH 3的结构中一个N 原子与三个H 原子以共价键相连,C 项正确;Cl -的最外层为8个e -,应写成,D 项错误。
3.用化学用语表示Cl 2+H 2OHClO+HCl 中的相关微粒,其中正确的是 ( )A.Cl -的结构示意图:B.HClO 的电子式:H ··Cl ······O ······C.H 2O 的结构式:H —O —HD.中子数为18的氯原子:1718ClC 【微探究】 Cl 原子最外层有7个电子,获得一个电子变为Cl -,故Cl -的结构示意图为,A 项错误;HClO 分子中O 原子分别与H 原子、Cl 原子形成一个共用电子对,其电子式为H ··O ······Cl ······,B 项错误;水分子中O 原子与2个H 原子形成2个共用电子对,结构式为H —O —H ,C 项正确;中子数为18的氯原子,质量数为35,故应表示为 1735Cl ,D 项错误。
2020年高考化学二轮专题复习测试《物质结构与性质(选考)》含答案
绝密★启用前2020年高考化学二轮专题复习测试《物质结构与性质(选考)》本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分,考试时间90分钟。
第Ⅰ卷一、单选题(共10小题,每小题4.0分,共40分)1.只有阳离子而没有阴离子的晶体是()A.金属晶体B.原子晶体C.离子晶体D.分子晶体2.干冰晶体是一种面心立方结构,如图所示,即每8个CO2构成立方体,且在6个面的中心各有1个,在每个CO2周围距离为a(其中a为立方体棱长)的CO2有()A. 4个B. 8个C. 12个D. 6个3.石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。
下列说法正确的是( )A.石墨烯与石墨互为同位素B. 0.12 g石墨烯中含有6.02×1022个碳原子C.石墨烯是一种有机物D.石墨烯中的碳原子间以共价键结合4.下列物质中不含非极性共价键的是()①Na2O2②CCl4③C2H6④NH4Cl ⑤H2O2⑥Ca(OH)2A.①②③④B.④⑤⑥C.②④⑥D.②③⑤5.在乙烯分子中有5个σ键和1个π键,它们分别是()A. sp2杂化轨道形成σ键,未杂化的2p轨道形成π键B. sp2杂化轨道形成π键,未杂化的2p轨道形成σ键C. C—H之间是sp2杂化轨道形成σ键,C—C之间是未杂化的2p轨道形成π键D. C—C之间是sp2杂化轨道形成σ键,C—H之间是未杂化的2p轨道形成π键6.下列有关金属的说法正确的是()A.金属原子的核外电子在金属晶体中都是自由电子B.镁型和铜型的原子堆积方式空间利用率最高C.金属原子在化学变化中失去的电子数越多,其还原性越强D.温度升高,金属的导电性将变强7.下列各组原子中,彼此化学性质一定相似的是()A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子C. 2p轨道上只有两个电子的X原子与3p轨道上只有两个电子的Y原子D.最外层都只有一个电子的X、Y原子8.PH3一种无色剧毒气体,其分子结构和NH3相似,但P—H键键能比N—H键键能低。
高2020届高2017级高三化学二轮复习小专题训练试题及参考答案物质结构与性质
2020届届届届届届届届届届届届届——届届届届届届届1.a、b、c、d、e、f是前四周期原子序数依次增大的6种元素。
a元素的基态原子核外s能级上的电子数是p能级上电子数的2倍;c元素所组成的单质和氢化物中分别有一种具有漂白性;d是地壳中含量最高的金属元素;e的正三价基态离子的d能级为半充满结构;f的基态原子最外层只有一个电子,且内层电子排布均为全充满结构。
2.(1)b元素基态原子的价电子排布图为______。
3.(2)a、b、c三种元素的第一电离能由大到小的顺序为______。
(用元素符号回答,下同)4.(3)b与c组成的一种分子中有16个价电子,其结构式为______,其分子中含______个σ键,______个π键。
5.(4)c的氢化物中,电子总数为18的分子是______,中心原子的杂化方式为______,它是______分子(填“极性”或“非极性”)。
6.(5)已知c、f能形成两种化合物,其晶胞如图所示,甲的化学式为______,乙的化学式为______;高温时,甲易转化为乙的原因为______。
7.8.(6)e元素对应的单质在形成晶体时,采用如下图所示的堆积方式。
则这种堆积模型的配位数为______,如果e的原子半径为r pm;阿伏加德罗常数的值为N A,计算此单质的密度表达式为______g/cm3(不必化简)。
9.10.磷化硼(BP)是一种受关注的耐磨涂层材料,可作为钛等金属表面的保护薄膜。
(1)三溴化硼和三溴化磷混合物在高温条件下与H2反应可以制得BP。
①上述反应的化学方程式为______________________________________________________________;②磷原子中存在_____种不同能量的电子,电子占据的最高能层符号为_______。
③常温下,三溴化磷是淡黄色发烟液体,可溶于丙酮、四氯化碳中,该物质属于______晶体(填晶体类型)。
高考化学总复习 专题十 第3讲 晶体结构与性质练习(含解析)-人教版高三全册化学试题
第3讲晶体结构与性质一、单项选择题1.二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。
已知二茂铁熔点是173 ℃(在100 ℃时开始升华),沸点是249 ℃,不溶于水,易溶于苯、乙醚等非极性溶剂。
下列说法不正确的是( )A.二茂铁属于分子晶体B.在二茂铁结构中,C5H5-与Fe2+之间形成的化学键类型是离子键C.已知:环戊二烯的结构式为,则其中仅有1个碳原子采取sp3杂化D.C5H5-中一定含π键答案 B 碳原子提供孤电子对,铁原子提供空轨道,两者形成配位键,B项错误。
2.下列有关晶体的叙述中,不正确...的是( )A.氯化钠和氯化铯晶体中,阳离子的配位数均为6B.金刚石为空间网状结构C.金属钠晶体采用体心立方堆积,每个晶胞含2个原子,配位数为8D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子答案 A NaCl和CsCl晶体中,阳离子的配位数分别为6和8,A项错误;金刚石为空间网状结构,B项正确;金属钠的晶体采用体心立方堆积,每个晶胞含(1+8×1)个原子,配位数为8,C项正确;干冰晶体中,每2个CO2分子周围紧邻12个CO2分子,D项正确。
二、非选择题3.(2018淮阴中学高三上检测)金属钛性能优越,被誉为继Fe 、Al 后应用广泛的“第三金属”。
(1)Ti 基态原子的核外电子排布式为 。
(2)钛能与B 、C 、N 、O 等非金属元素形成稳定的化合物。
第一电离能:N (填“>”或“<”)O。
(3)月球上的岩石——玄武岩的主要成分为钛酸亚铁(FeTiO 3)。
FeTiO 3与80%的硫酸反应可生成TiOSO 4。
S O 42-的空间构型为 形,其中硫原子采取 杂化,写出S O 42-的一种等电子体的化学式: 。
(4)Ti 的氧化物和CaO 相互作用能形成钛酸盐CaTiO 3,CaTiO 3的晶体结构如图所示(Ti 原子位于立方体的顶点)。
