课题3溶液的浓度
人教版九年级下册 化学 第九单元 课题3-溶液的浓度 说课稿

人教版九年级下册化学第九单元课题3-溶液的浓度说课稿一、教材分析本课是人教版九年级下册化学第九单元的第三课时,主要内容是溶液的浓度。
通过本课的学习,学生将了解溶液的浓度概念、计算浓度的方法及浓度的应用。
教材内容简介:本课涉及的主要概念有溶液、溶质、溶剂和溶液的浓度。
通过实际例子和计算练习,帮助学生理解溶液的浓度概念以及不同浓度的溶液对物体的影响。
学情分析:九年级学生已经基本掌握了液体的基本特性和溶解的基本概念,对溶液也有一定的了解。
此前的学习中,学生通过实验和讨论认识了溶解的条件和化学反应速率与表面积、浓度的关系。
因此,学生在本课时的学习中能够迅速理解和接受本课的知识点,并能通过计算练习来巩固相关概念。
二、教学目标1.知识与技能:–熟练掌握溶液、溶质和溶剂的概念。
–掌握计算溶液浓度的方法及其应用。
2.过程与方法:–培养学生观察问题、分析问题的能力。
–培养学生合作学习、探究学习的能力。
3.情感态度与价值观:–培养学生热爱自然科学的兴趣。
–培养学生合作、分享、探究的价值观。
三、教学重难点1.教学重点:–溶液、溶质和溶剂的概念。
–计算溶液浓度的方法及其应用。
2.教学难点:–让学生理解溶液浓度的计算方法。
–培养学生合作学习的能力。
四、教学过程1. 导入新课通过一个实际生活中的例子引入本课:某饮料店调制了两杯相同口感的柠檬水,但一杯柠檬水的酸味更浓烈。
请思考一下,这两杯柠檬水哪一杯的溶液浓度更高?2. 学习新知(1) 概念解析•溶液:由溶质和溶剂组成的混合物称为溶液。
•溶质:被溶解的物质称为溶质。
•溶剂:用于溶解溶质的物质称为溶剂。
(2) 浓度的定义与计算•溶液的浓度:指的是单位体积溶液中溶质的质量。
•计算公式:浓度(C) = 溶质的质量(m) / 溶液的体积(V)。
(3) 浓度的应用•浓溶液:溶液中溶质的质量相对较大,浓度较高。
•稀溶液:溶液中溶质的质量相对较小,浓度较低。
3. 计算练习通过几个例题进行计算练习,帮助学生掌握溶液浓度的计算方法。
课题3溶液的浓度(讲义).

配置步骤:1、计算计算:需食盐:150 g× 16% = 24 g 2、称量 3、溶解例1:(溶质为固体)配制150g16%的食盐水需水: 150 g– 24 g= 126 g 称量:用天平称量 24 g食盐用量筒量取126mL水溶解:烧杯、玻璃棒实验仪器:天平(砝码)、药匙、量筒、胶头滴管、烧杯、玻璃棒
配置步骤:1、计算 2、称量 3、溶解例2:(溶质为液体)配制100克20%的硫酸计算:100 × 20% = 20 (克)纯硫酸根据98%浓硫酸密度为1.84克/毫
升,可换算为: 1毫升浓硫酸质量=1.84×98%=1.8克则需要浓硫酸为 20÷1.8=11.1(毫升)水为100 – 11.1×1.84 = 79.6(克)称量:用量筒量取 11.1毫升浓硫酸,再用量筒量取79.6毫升水溶解:烧杯、玻璃棒(注意要将浓硫酸倒入水中)实验仪器:量筒、胶头滴管、烧杯、玻璃棒。
人教版九年级化学下册第九单元课题3《溶液的浓度》PPT课件

答:需要水的质量为195g。
讲授新课
小结
有关溶液稀释问题的计算 解题依据:溶液稀释前后,溶质的质量不变。 若有某溶液Ag,其溶质的质量分数为a%,稀释后得到溶质质
量分数为b%的溶液Bg。则有:
加水质量为x
50克98%的浓硫酸 20%的稀硫酸 解法1:设稀释后溶液的质量为x。 50 g×98%=x×20%,x=245 g。 245 g-50 g=195 g。
加水后稀溶液质量 50克+x
答:把50克98%的浓硫酸稀释成20%的硫酸需要加水195克。
讲授新课
【例4】把50 g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液。需 要多少克水?
我们应该学习商家向消费者介绍产品那样明确地表示出溶液的组 成。其中表示溶液组成的方法有多种,这里主要认识溶质的质量分数 。
讲授新课
溶质的质量分数
1.定义:溶质质量与溶液质量之比
2.公式: 溶质的质量分数
溶质质量 = 溶液质量
单位要统 一
×100%
溶质质量 =
溶质质量 + 溶剂质量
×100 %
溶质质量 = 溶液质量× 溶质的质量分数 溶液质量 = 溶质的质量 / 溶质的质量分数
溶质质量/g 10 20
溶剂(水)质量 /g
90
80
现象 氯化钠溶解 氯化钠溶解
溶液中溶质的质量分数 10% 20%
讲授新课
已知200C时,氯化钠的溶解度是36g。有人说:“200C时氯化钠饱 和溶液中溶质的质量分数为36%”这种说法对吗?为什么?
溶质质量/g 36
人教版九下化学第九单元课题3溶液的浓度知识点梳理
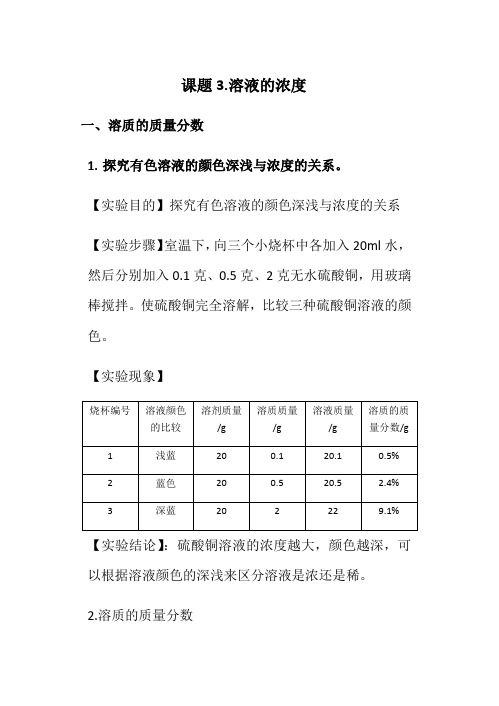
课题3.溶液的浓度一、溶质的质量分数1.探究有色溶液的颜色深浅与浓度的关系。
【实验目的】探究有色溶液的颜色深浅与浓度的关系【实验步骤】室温下,向三个小烧杯中各加入20ml水,然后分别加入0.1克、0.5克、2克无水硫酸铜,用玻璃棒搅拌。
使硫酸铜完全溶解,比较三种硫酸铜溶液的颜色。
【实验现象】【实验结论】:硫酸铜溶液的浓度越大,颜色越深,可以根据溶液颜色的深浅来区分溶液是浓还是稀。
2.溶质的质量分数(1)定义:溶质的质量分数就是溶质的质量与溶液质量之比(2)公式:=溶质质量溶质质量%100%100⨯+=⨯=溶剂质量溶质质量溶质质量溶液质量溶质质量溶质的质量分数可变形为:溶质的质量=溶液的质量×溶质的质量分数溶液的质量%100g 100⨯+=s s 分数饱和溶液中溶质的质量注意:①这里的溶质质量指的是溶解在溶液里的溶质质量不包括未溶解或者结晶析出的溶质的质量。
②代入公式计算的一定是质量,必要时用密度公式换算成质量③一定温度下饱和溶液的溶质的质量分数最大。
④除质量分数以外,人们有时也用体积分数来表示溶液的浓度。
例如:用做消毒剂的医用酒精中乙醇的溶质质量体积分数为75%,就是指100ml的医用酒精中含75ml 的乙醇。
3.溶解度与溶质质量分数的关系二、有关溶液的计算1.溶液的稀释(1)计算依据:稀释前后溶液中溶质的质量不变(2)稀释方法:加溶剂稀释或加稀溶液稀释(3)关系式:加水稀释:m浓×a%=(m 浓+m水)×b%稀加稀溶液稀释:m浓×a%浓+m稀×b%稀=(m浓+m稀)×c%(表示稀释后溶液中溶质的质量分数)2.溶液的增浓(1)增加溶质(注意:温度不变,向饱和溶液中增加溶质,溶质的质量分数不变)原溶液中的溶质与后加入的溶质质量之和等于混合后溶液中溶质的质量,即:原溶液中溶质的质量+增加的溶=混合后溶液中溶质的质量溶液的质量=原溶液的质量+增加的溶质的质量即若:设原溶液的质量为Ag,溶液质量分数为a%,加溶质为Bg后,变成溶质质量分数为b%的溶液,即:Ag×a%+Bg=(Ag+Bg)×b%(2)蒸发溶剂(无晶体析出)根据溶液蒸发溶剂后,溶质的质量不变。
课题3 溶液的浓度-九年级化学下册同步教学精品课件(人教版)

练一练
1.农业生产中常用溶质质量分数为16%的氯化钠溶液来选
种。对该溶液理解正确的是( D )
A.溶液中含氯化钠16g B.每100g水中含氯化钠16g
C.溶液质量为16g
D.每100g溶液中含氯化钠16g
2.在30 ℃时,将10 g食盐完全溶解在40 g水中,则食盐
9.把100g质量分数为98%的浓硫酸稀释为质量分数为 10%的硫酸,需要水的质量是多少?
[分析] 溶液稀释前后,溶质的质量不变
[解] 设:稀释后溶液的质量为X。
100g × 98% = X × 10%
100g × 98%
X=
10% = 980g
需要水的质量 = 980g - 100g = 880g
表示溶液浓度的方法很多,这里主要介绍溶质的质 量分数。 溶液中溶质的质量分数是溶质质量与溶液质量之比,可 用下式进行计算:
练一练
在实验2-7中,三种硫酸 铜溶液中溶质的质量分数各是 多少?把计算结果填在表中。
编号 溶剂质量/g 溶质质量/g 溶液质量/g 溶质的质量分数
1
20g
0.1g
20.1g
2
100
44
73g × 20%
X
100
44
73g × 20%
X
x 8.8=g8.8g
答:----------
二氧化碳的体积 =
=4.45L
1.977 g/L
第九单元
课题3溶液的浓度
1.掌握一种溶液组成的表示方法──溶质的质量分数。 2.能进行溶质质量分数的简单计算。
一、溶液的浓度
哪一杯更甜? 在化学中如何定量地表示溶液的浓稀呢?
《溶液的浓度》(教学设计)-【上好课】九年级化学下册同步备课系列(人教版)

课题3 溶液的浓度一、教材分析溶液是常见的混合物,本单元的教学内容与学生的生活实际有紧密联系。
第三课题要紧围绕溶液的浓、稀,即一定量的溶液中含有多少溶质这一问题展开,引出溶液中溶质的质量分数的概念,并结合这一概念进行一些简单运算,初步学习配制溶质质量分数一定的溶液。
九年级的学生己具备了一定的观看问题、分析问题和解决问题的能力,对事物的认识正处于从感性到理性的转变时期,本课程的教学应联系学生思维进展规律,采纳手动实验的方法,激发学生爱好,让学生从定性到定量地认识溶液,从感性到理性地了解浓度。
二、学情分析这个年纪的学生正处于由形象思维向抽象思维的转化阶段,逻辑思维虽占优势,但很大程度上还属于经验型,需要感性经验的直接支持。
熟练掌握有关溶质质量分数与化学方程式结合的计算题,是初中化学重要的基本技能,但由于学生对溶液认识有限,对有关溶液的计算不熟悉,对化学反应前后溶液的变化不能准确掌握,使这部分内容成了学生学习的难点。
怎样突破难点,让学生深入理解和掌握这些知识,应采用“循序渐进、提高升华”的方法帮助学生理解溶质质量分数的概念,并通过自主合作实验探究,讲练结合,微课,讨论和例题等手段加深理解,学习解答化学计算题的基本规范。
三、教学目标1. 认识溶质的质量分数的含义。
2. 能进行有关溶质质量分数的简单计算。
3. 通过溶质质量分数的简单计算,掌握基本的解题方法,提高解题能力。
4. 初步学会配制一定溶质质量分数的溶液。
四、教学重难点教学重点:溶质质量分数的公式的运用和计算。
教学难点:溶质质量分数的意义的理解。
五、教学过程【情景导入】点奶茶时,你喝的是哪种甜度?标准甜,少甜,少少甜,少少少甜还是不另外加糖?【问题】在同样多的两杯水中分别溶解一汤匙糖和两汤匙糖,你能判断出哪杯水会更甜吗?【过渡】在生活中,我们有时只要大体知道溶液的浓稀就可以了,可是在实验室或科学生产中得需要确切知道溶液中含有溶质的多少,在化学中如何定量地表示溶液的浓稀呢?为了表述这个问题,人们引入了浓度这个概念,今天我们就一起来学习一下吧!【板书】溶液的浓度【过渡】在实验室中我们要经常配制溶液,下面老师来配制三种硫酸铜溶液。
第九单元 课题3 溶液的浓度(二)(解析版)
第九单元课题3溶液的浓度(二)1.掌握一定溶质质量分数溶液的配制方法;3.学会溶液稀释的计算。
一、溶液浓缩、稀释问题计算依据:稀释(或浓缩)前后溶液中溶质的质量不变1.溶液稀释的方法:加入溶剂、加入低浓度的溶液(1)加水稀释计算方法:A·a%=B·b%或A·a%=(A+m)・b%,其中B=A+m(A代表浓溶液质量,a%是浓溶液的溶质质量分数,B 代表稀释后溶液质量,b%代表稀释后溶液的溶质质量分数,m代表加入水的质量,下同)。
(2)加入低浓度溶液计算方法:A·a%+B·b%=(A+B)·c%(c%代表混合后所得溶液的溶质质量分数)。
2.溶液浓缩的方法:加入溶质、蒸发溶剂、加入浓溶液(1)加溶质计算方法:A×a%+B=(A+B)×c%(A表示原溶液的质量,a%表示原溶液的溶质质量分数,B表示加入的溶质质量,c%表示加入溶质后所得溶液的溶质质量分数)。
(2)蒸发溶剂计算方法:A×a%=(A-B)×c%(A表示原溶液的质量,a%表示原溶液的溶质质量分数,B表示蒸发的溶剂的质量,c%表示蒸发溶剂后所得溶液的溶质质量分数)。
(3)与同种溶质的浓溶液混合计算方法:A×a%+B×b%=(A+B)×c%(A表示原溶液质量,a%表示原溶液中溶质的质量分数,B表示浓溶液质量,b%表示浓溶液中溶质的质量分数,c%表示混合后所得溶液的溶质质量分数二、溶液的配制1.配制一定溶质质量分数的溶液(用固体药品配制溶液)①步骤:计算、称量、溶解、装瓶贴标签。
②仪器:天平、药匙、量筒、胶头滴管、烧杯、玻璃棒。
2.用浓溶液稀释(用浓酸配制稀酸)①步骤:计算、量取、稀释、装瓶贴标签。
②仪器:量筒、胶头滴管、烧杯、玻璃棒。
具体配制步骤:(1)计算:配制50g溶质质量分数为6%的氯化钠溶液需氯化钠3g;水47g。
九年级化学下册第九单元溶液课题3溶液的浓度(第1课时)教学课件(新版)新人教版
3.溶质质量=溶液质量______溶液中溶质的质量分数。
知识点二:有关溶液中溶质质量分数的简单计算
1.现有某温度下的硝酸钾溶液35 g,若将其蒸干,得到
20% 。
7 g硝酸钾,则该溶液中溶质的质量分数为_____
2.若将上述溶液取出2 mL,则剩余溶液的溶质质量分数
20%
为______。
3.若往上述溶液中加入21 g水,所得溶液的溶质质量分
化学 九年级下册 人教版
第九单元
溶 液
课题3 溶液的浓度
第1课时
1.溶质的质量分数的含义。(重点)
2.有关溶液中溶质质量分数的计算。(重点)
知识点一:溶质质量分数的含义
溶质
溶液
1.溶液中溶质的质量分数是______质量与______质量之
比。
÷
2.溶液质量=溶质质量______溶液中溶质的质量分数。
据是什么?对于有色溶液,可以根据颜色来粗略地
颜色越深
区分溶液是浓还是稀。一般来说, ______
___,溶
液越浓。
探究问题二:溶质的质量分数的计算
完成课本P43实验9-8,填写下表:
溶质质量/ g
溶剂(水)质量/ g
现象
10
90
完全溶解
10%
20
80
完全溶解
20%
溶质的质量分数
【交流讨论】已知20 ℃时,氯化钠的溶解度为36 g
12.5% 。
数为______
探究活动一:溶质的质量分数
完成课本P42实验9-7,填写下表:(1 mL水的质量约
为1 g)
烧杯 溶液颜色 溶剂质量 溶质质量 溶液质 溶质的质
/g
/g
课题3溶液的浓度
答:需要水的质量为880g。
作业
1.把6g铁样品放入100g稀硫酸中,反应停止 后生成0.2g氢气,求反应后所得溶液中溶质 质量分数? 2.把12.5g石灰石样品放入100g稀盐酸中, 反应停止后,剩余物质的总质量是108.1g, 求反应后所得溶液中溶质质量分数?
=195g
答:需要加水的质量为195g。
练习:课后习题
练习:1(课本P45)把100g质量分数为98%的浓硫酸 稀释成10%的稀硫酸,需要水的质量是多少? 【解】设:稀释后溶液的质量为X。 100g × 98% = X × 10% X = 980g 需要水的质量 = 980g - 100g = 880g
答:略Βιβλιοθήκη 4、饱和溶液溶质质量分数的计算
溶质的质量分数36% 是指:100g溶液中含有 36g溶质。 溶质T0C时溶解度36g是指:在T0C 时,100g 溶剂中最多溶解该溶质36g。 T0C时饱和溶液 的溶质质量分数 =
溶解度(g)
100g+溶解度(g)
某温度下某物质的溶解度为ag,则同温下它饱和 小于 溶液中溶质质量分数_____a%( 填大于,小于或等于)
浓溶液和稀溶液
溶液的“浓”和“稀”与质量分数的关系——溶 液越浓,溶质质量分数越大。
试管 编号 1 2 3 溶液颜 色比较 浅蓝色 蓝色 深蓝色 溶剂质 溶质质 量/g 量/g 10 0.5 溶液质 量/g 10.5 11 溶质的质 量分数 4.8%
10
1
9.1%
2 10 12 16.7% 规律:对有色溶液来说,溶液中溶质的质量分数 越大,溶液的颜色就越深。
溶液组成的表示方法很多,通常用 溶液中溶质的质量分数来表示溶液的组 成。
一、溶质的质量分数
课题3 溶液的浓度教学设计与反思
学科化学年级九年级教师
所在学校
版本、册数、
课目名称
人教版、九年级化学下册、第九单元课题3 溶液的浓度
教学目标
1、认识浓溶液和稀溶液;
2、理解溶液的溶质质量分数;
3、能计算溶液的溶质质量分数,体会化学在生活中的重要性。
教学重点、难
点及措施
重点:关于溶液的溶质质量分数方面的计算;
难点:溶质质量分数在化学方程式中的计算。
教学过程
复习提问:
1、什么叫饱和溶液?
2、KNO3不饱和溶液怎样变成饱和溶液?
引入:展示3支颜色深浅不同的硫酸铜溶液
一、浓溶液和稀溶液
判断依据:一定量溶液里,所含溶质的多少。
思考:溶液的浓稀和溶液的饱和与否的关系?
【实验9-7】在三个烧杯中各加入20mL水,然后分别加入约
0.1g、0.5g、2g无水硫酸铜,用玻璃棒搅拌,使硫酸铜全部溶
解。
比较三种溶液的颜色。
(学生完成表格填写,讨论如何计
算3种溶液的溶质质量分数?)
二、溶质的质量分数
1、概念:溶质质量与溶液质量之比。
2、计算公式:
溶质的质量分数== ×100%
溶液质量=溶质质量+溶剂质量
【学生】列式计算实验9-7中3种溶液的溶质质量分数。
溶质质量
溶液质量。
