欧盟 动物源产品 病毒安全指导书
控制PED病毒需要一个完善的生物安全策略

控制PED病毒需要一个完善的生物安全策略作者:廖学文姜美建来源:《国外畜牧学·猪与禽》2015年第01期猪流行性腹泻(Porcine Epidemic Diarrhoea,PED)是一种只影响养猪生产的疾病,对人类健康没有影响。
猪流行性腹泻(Porcine Epidemic Diarrhoea,PED)是一种只影响养猪生产的疾病,对人类健康没有影响。
PED于20世纪70年代开始在欧洲暴发,之后传播到东南亚与中国。
美国的首次发病于2013年4月发生在俄亥俄州,之后传播到墨西哥与加拿大。
此病的重要性在于能造成养猪业令人揪心的经济损失,如,美国养猪业于该病暴发后在不到一年的时间内损失了500多万头猪。
PED由冠状病毒科的一种病毒引起,但是与同属于冠状病毒科的传染性胃肠炎病毒具有不同的基因型。
1 严重脱水PED会造成患病猪严重的腹泻与脱水,病毒主要通过口-粪途径传播。
发病率可高达100 %;在发病期间,幼龄猪的死亡率为80 %~100 %,会影响整个猪群的生产指标。
目前尚无经过实践证明行之有效的商用疫苗,因此养猪生产者在这个时期绝不能忽视生物安全,并且应该采取额外的预防措施来阻止PED病毒的传播。
该病毒在粪便中存活可超过28 d,在水中的存活时间可超过13 d。
另外,需要重点指出的是,它具有高度传染性。
业已证明,在实验条件下将1 mL PED病毒感染过的排泄物用100 000 L水稀释后仍可引起猪暴发PED。
感染猪可以通过粪便排出病毒5 d~9 d。
研究证明,该病毒也可经鼻途径排出。
例如,2~3日龄仔猪每毫升粪便可排出109个病毒。
这意味着100 mL粪便将含有100×109个病毒。
假定一个中等的生物安全策略表现出99.999 %的有效性,则仍将有106个病毒保持活力。
生物安全在阻止PED病毒在猪场间与猪场内的传播上起着重要的作用。
然而,为了阻断该病的传播,确定生物安全的漏洞以及采取正确的措施来优化生物安全策略显得非常重要。
浅议克隆动物食品及其食品安全性

浅议克隆动物食品及其食品安全性摘要:克隆动物是什么?克隆动物食品的前景如何?社会上议论纷纷,究竟可以接受克隆动物食品吗?它会给我们带来什么利害呢?让我们一起探讨,一起期待吧!关键词:克隆动物食品、安全性Abstract: What’s animal cloning?How is the foreground of animal cloning food ? It is talked about in succession at world. However, can we accept the animal cloning food? What will it give us advantages or disadvantages? Let’s discuss and wait together.Keywords:animal Cloning food、security克隆动物和克隆动物食品:时下流行克隆:动物克隆、植物克隆。
连电脑都出现Ghost——克隆软件!可见克隆已经深深影响我们人类社会了!但你是否知道:什么是克隆动物呢?克隆动物食品又是什么呢?克隆动物和克隆动物食品克隆动物是指不经过有性繁殖,通过对母本动物进行基因复制而得到的一模一样的另一只动物,它和母本动物就像不同时出生的双胞胎。
世界上第一只体细胞克隆动物是1996年出生于英国的克隆羊多利,随后克隆牛、克隆猪等不断诞生。
克隆动物技术可以使一些优良动物品种快速产出大量“后代”,比起传统培育和繁殖方法,采用这种技术有时间和数量上的优越性。
而克隆动物食品是指通过基因技术进行复制,以后代作为来源所制造的食品。
多涉及克隆的牛、羊和猪等。
克隆动物的发展历程:1952年:科学家证明,他们能把细胞核从一枚青蛙卵子中取出,然后把另一个青蛙胚胎细胞的细胞核注入这个卵子中,并让这个卵子孵化为一条蝌蚪。
这种“核转换”可以把一个动物的基因注入一个卵子。
这条蝌蚪就是提供了细胞核的那个胚胎细胞的克隆产物。
外来动物疫病的主要危害及防控启示

随
萎 莒
近 年来 ,该 病 已蔓 延 至 我 国 的周 边 国家
新加坡 、印度 、缅甸 、泰国、柬埔寨和
繁 、进 出境 动 物 及 其 产 品数 量 与 批 次 的 孟加拉等国。我 国与多个已暴 发尼 帕病
逐年增多 ,外来动物疫病传人我 国的风 的国家 比邻 ,边界线漫长 ,气候条件相 险与 E 增。如何有效地将外来动物疫 近 ,且具有该病毒 的天然宿主 ,具备该 l 俱
病 阻 挡 于 国 门之 外 ,维 护 我 国畜 牧 业 的 病传播与流行的基本 条件 。随着我国与
ቤተ መጻሕፍቲ ባይዱ
健康发展 和国民身体健康 ,已成为 当务 这 些 国家之 间商 贸及 人员 往来 的 日益
之急 。
频繁 ,我 国正面临着 巨大 的传人风险。
裂 谷 热 ( iv l ye e , V 【】 Rf al fv r R F)2 t e
尼 帕 病 ( p h ie s 。ND ) Nia ds a e 是 热主要发生于非 洲大 陆,如肯尼亚 和埃
由尼 帕 病 毒 引 起 的 一 种 烈 性 人 畜 共 患 及 等。2 世纪以来 ,裂谷热 的流行范 围 g fv r HF) 由埃 博拉病毒 引起 1 i e e ,E c 是
我 国从 非 洲等 国家 引进猴 子 等实验 动 而 引起 马 、牛 、猪 等哺 乳 动物发 生 的 得 以基本控制 ,但 时至今 日非洲猪瘟仍 物数 量及 批次 均有 增加 ,存在 疫情 跨 境传 人风 险。
调研 世 界 I s a c Re e h r
近牟謇! 我国参与 嚣葵易冒蕈糖繁 塞动 堕瘸传入我国的风险强益增加 防控形努十 一 分严霉 本文练述了 我国近年幂外来动 熏鼙瘴妥 物 类 及防琏体累中存在的问籀 进而
欧盟FAMI
欧盟FAMI-QS认证介绍1 背景随着社会的发展,作为食品链前端的动物饲料的卫生平安问题,越来越受到国际组织和世界各国饲料加工商的关注和重视。
欧盟有关组织提出“饲料平安就是食品平安”的观点。
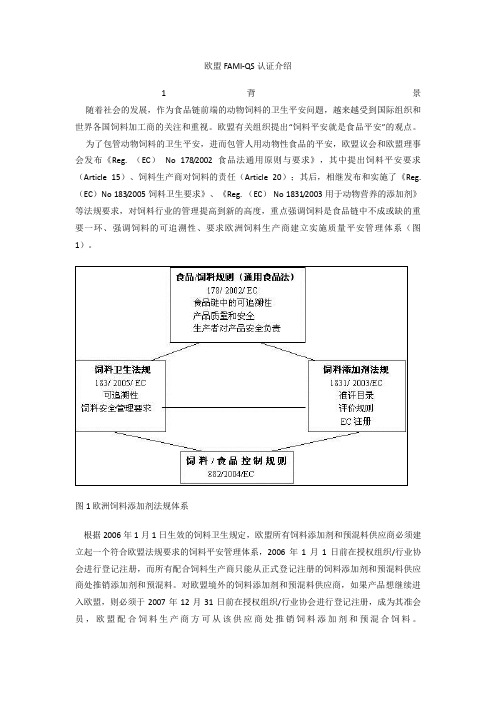
为了包管动物饲料的卫生平安,进而包管人用动物性食品的平安,欧盟议会和欧盟理事会发布《Reg. (EC)No 178/2002食品法通用原则与要求》,其中提出饲料平安要求(Article 15)、饲料生产商对饲料的责任(Article 20);其后,相继发布和实施了《Reg.(EC)No 183/2005饲料卫生要求》、《Reg. (EC) No 1831/2003用于动物营养的添加剂》等法规要求,对饲料行业的管理提高到新的高度,重点强调饲料是食品链中不成或缺的重要一环、强调饲料的可追溯性、要求欧洲饲料生产商建立实施质量平安管理体系(图1)。
图1 欧洲饲料添加剂法规体系根据2006年1月1日生效的饲料卫生规定,欧盟所有饲料添加剂和预混料供应商必须建立起一个符合欧盟法规要求的饲料平安管理体系,2006年1月1日前在授权组织/行业协会进行登记注册,而所有配合饲料生产商只能从正式登记注册的饲料添加剂和预混料供应商处推销添加剂和预混料。
对欧盟境外的饲料添加剂和预混料供应商,如果产品想继续进入欧盟,则必须于2007年12月31日前在授权组织/行业协会进行登记注册,成为其准会员,欧盟配合饲料生产商方可从该供应商处推销饲料添加剂和预混合饲料。
2 FAMI-QS的实施组织FAMI-QS(欧洲饲料添加剂和预混合饲料质量体系)就是欧洲饲料添加剂生产商协会(FEFANA)根据上述法规制定的关于饲料添加剂和预混合饲料的质量管理体系。
图2 欧洲饲料添加剂管理机构体系FEFANA成立于1963年,是欧盟饲料添加剂和预混合饲料行业非营利性行业自律管理组织,是饲料添加剂和预混合饲料行业与饲料欧盟当局之间的纽带。
它由欧盟饲料添加剂和预混合饲料商及相关利益方代表组成,目前有14个国家协会会员和70多个企业会员。
农产品质量安全法

热必斯、富士上号、粉锈宁、百菌 清、多菌灵、灭病威、瑞毒雷锰锌、 DT乳剂——杀菌剂
禾大壮、农得时、威罗生、优克稗 方丁草胺、克草胺、杀草丹、恶草 灵、苯达松、都尔、拉索、氟禾灵、 精稳杀得、拿捕条)
第一条 为保障农产品质量安全, 维护公众健康,促进农业和农村经济 发展,制定本法。
立法目的 第二条 农产品、农产品质量安 全的定义。
第三条 县级以上人民政府农业 行政主管部门负责农产品质量 安全的监督管理工作;县级以 上人民政府有关部门按照职责 分工,负责农产品质量安全的 有关工作。
有机农药。有机农药包括天然 有机农药和人工合成农药两大 类。
天然有机农药是来自于自然 界的有机物,环境可溶性好, 一般对人毒性较低,是目前大 力提倡使用的农药;可在生产 无公害食品、绿色食品、有机 食品中使用。如植物性农药、 园艺喷洒油等。
人工合成农药即合成的化学 制剂农药;种类繁多,结构复 杂,大都属高分子化合物。
百威、氯氰菊酯、杀螟丹等 。
杀螨剂:速螨酮、三唑锡等。
杀菌剂:井冈霉素、春雷霉素、链霉素 多菌灵、三唑酮等、 。
除草剂:灭生除草剂(即非选择性除草 剂)指在正常用药量下能将作物和杂草无 选择地全部杀死的除草剂。
如百草枯、草甘膦 。
选择性除草剂只能杀死杂草而不伤害 作物,甚至只杀某一种或某类杂草的除草 剂,如敌稗、乙草胺、丁草胺。
毒杀芬:10天后还有44%
高效农药:杀虫剂每亩田施用有效 成份50克,其防治效果大于90%; 杀菌剂每亩田喷洒有效成份100克, 其防治效果大于70%;除草剂每亩 田施用有效成份250克,其防治效 果大于70%。如氯氰菊酯在幼虫23龄期用药,防治菜青虫,小菜蛾 等亩用有效成份0.25-0.5克;
动物源食品安全与检测:成功反诉国外进口食品安全预警 不再是天方夜谭——从“莫西菌素”事件,看我国

第一反应是 . 该方法从技术的角度不能
提 供 分 子 的 结 构 信 息 , 可能 因为基 质 有 干扰而 出现 假 阳性 检 测 结果 。 有 了这样 的J疑 , l 不 我们开 始组 织相关
相 关 检 测 标 准 . 关部 门也 尚未 开 展 此 相
莫 西菌素 事件, 最终 以欧盟撤 销对
莫 西菌 素 ( x et , D是 一种 链 Moi ci MX ) d n
霉菌 ( C anores nnyngns 发 S ynegin ocao eu) s
采 取 严 密检 查 措 施 。 而复 得 的 欧盟 市 失 场 , 次 面临 被 封 关 的威 胁 。 再 事 实上 , 年 来 我 国动 物 源 性 产 品 近 出 口, 直 面 临极 大挑 战 , 国 、 一 美 日本 、 欧 盟 等 国家和 地 区对 肉类 产 品的 技术 壁
中 国出 口禽 肉的 预 警 完 美 收 场 。 这 次 在 较 量 中 , 坊 出入 境 检 验 检 疫 局 可 潍 谓 立下 了汗 马功 劳 。 见 失 而 复 得 的 欧 眼 盟 市 场 再 次 面 临 被 封 关 的 局 面 , 坊 出 潍
项目的检测工作。
然而 , 就在 2 0 年1 ,2 日. 0 9 2 2 国家 质 q 检 总 局 接 到 欧 盟 官 方 预 警 . 报 德 国官 通 方 实验 室在 山东潍 坊乐 港 食 品股 份 有 限
预 警, 欧盟采用什 么方法检测出莫西菌
素 7 到 预 警后 . 坊 出入 境 检 验 检 疫 接 潍 局 的 第一 反 应 是什 么 7
是 目前被 广泛 用于兽 医临床 的广 谱、
高效 、 新型 大环内酯类驱 虫抗生 素。 1 9 年 6 2 欧 盟 2 7/9 规 0 9 月 6日 37 0
如何规避动物源性饲料的安全隐患

降 低 成 了新 的 问题 。脂 全性 。另一方面 , 我国动 无意在饲 料中添加使用 , 的疾病 。 肪 含量 高是 大 多 数 动物 物源 性 饲 料 生产 企 业 大 反刍 动物 食 用 同类动 物 如 何 降 低 动 物源 性 源 性 饲 料 的 另 一 特 点 , 多为 中小型企业 , 其普遍 源性 饲料现 象普遍存在 , 饲料产品安全隐患 在 高 温 条 件 下 脂 肪 很 存 在 生产 工 艺 、设 备 简 使 疯 牛 病和 痒 病 风 险增 降 低 动物 源 性 饲 料 容 易 氧 化 酸 败 , 产 生 陋 、 并 生产 环 境 差 、 业 人 大 。农业 部 20 年 组织 产 品安 全 隐患 是 一个 系 从 05 有 害物 质 , 降 低 饲 料 员素质低等 问题 , 产品 的一次抽查 , 在 使 共抽 检鱼粉 统 工程 ,涵盖动物屠 宰 、 适 口性 、 养 价 值 的 同 质量难 以得到 有效保障 。 等动 物源 性 饲 料 和 反刍 加 工 、 购 、 输 、 用 营 收 运 使 时 ,可 能对 动 物 体 内酶 动物 源 性 饲 料 无标 签 标 动 物饲料 样 品 40 00多批 等各 生 产环 节 ,涉及 屠 活 性 、免 疫 力 产 生不利 识或 标 签 不 规 范 问题 严 次 , 牛羊源性 成分检出率 宰 、畜 牧 、饲 料加工 、 兽 影响 。 重, 消费者无法获得相 关 为 33 。疯牛病疫区 国 医 、 府等各行各业 。而 . % 政 动 物 源性 饲 料 不规 正确信息 , 同时给掺 杂者 家或产地 不详的骨粉 、 肉 生产 企 业和 广大 养 殖 户 范生产现 象严重 以可乘之机 。 粉、 肉骨粉样 品检出率高 作 为动 物源 性 饲 料 产 品 在 我 国现 实 条 件 下 , 养 殖 户 使 用 方 法 不 达 3%。 果 动 物 采 食 含 的 生 产 和 消 费 环 节 , 减 0 如 在 动物 源 性饲 料 的原 料大 规范 这 些 有朊 病 毒 的动 物 性 低使用风险的过程 中作用 多来 源 于 食 品加 工 副产 使 用 环 节 是 动 物源 产 品 , 可能 引起 人和动物 尤为 重要。( 下转 6 7页 )
欧洲药典总体结构中参考PPT

11
注意事项 (7)
• 什么是强制的?
– 除非另有说明,都是强制要求的, – “Should” = 参考性的或建议性的 (即非强制要
求的):
– “本章节为提供参考和指导用”
12
注意事项 (8)
• 人用与兽用
– 专论包含了人用和兽用两种用途,除非另作 说明
– 当同一物质既在人用产品中使用,也在兽用 产品中使用时,应该采用相同的质量标准
• 遵循 5.2.8章, 它是CPMP/CVMP指南注 释的转载
• 欧盟法规对符合CPMP/CVMP指南注释 是强制要求的
• 个论的适用性证书可以用来证明该产品 符合药典要求
• 适用于整个生产线
22
病毒安全性
• 新的总论人或动物源的物质 (草稿刊登在 Pharmeuropa 15.2上)
• 不适用于生物技术产品、疫苗、免疫血 清、血液制品
19
发酵产品
• 个论需要总论的支持,特别是变更控制 • 适用于间接基因产品,特别是抗生素,
一些氨基酸 • 在认证过程中评估符合性
重组DNA制品
• 上游的研发和试验是决定产品质量的根 本因素,不能完全用对终产品的检验来 替代
• 专论为成品物质提供了质量标准,需要 总论来支持
21
有传递TSE风险的产品
确定适用于我们产品的其他总的方法
• 目的是协调主管当局颁布的方法 • 风险评估是主要方面
23
剂型
• 欧洲药典没有关于特殊制剂产品的专论 ,除了疫苗、血液制品、免疫血清、放 射性药物、胰岛素制剂
• 关于剂型的总论适用于所有剂型
24
疫苗
• 用于公众免疫的产品,专论提供了获取的公 共标准
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
The European Agency for the Evaluation of Medicinal ProductsHuman Medicines Evaluation Unit
7 Westferry Circus, Canary Wharf, London E14 4HB, UKSwitchboard: (+44-171) 418 8400 Fax: (+44-171) 418 8551E_Mail: mail@emea.eudra.org http://www.eudra.org/emea.html
London, 14 February, 1996CPMP/BWP/268/95
COMMITTEE FOR PROPRIETARY MEDICINAL PRODUCTS(CPMP)
NOTE FOR GUIDANCE ON VIRUS VALIDATION STUDIES:THE DESIGN, CONTRIBUTION AND INTERPRETATION OFSTUDIES VALIDATING THE INACTIVATION AND REMOVALOF VIRUSES
Revised *
DISCUSSION IN THE BIOTECHNOLOGY WORKING PARTY (BWP)3-4 July 1995TRANSMISSION TO THE CPMP11-13 July 1995TRANSMISSION TO INTERESTED PARTIES12 July 1995DEADLINE FOR COMMENTS1 November 1995RE-SUBMISSION TO THE BIOTECHNOLOGY WORKING PARTY5-6 February 1996RE-SUBMISSION TO THE CPMP12 February 1996APPROVAL BY THE CPMP14 February 1996PROPOSED DATE FOR COMING INTO OPERATION14 August 1996
* Note:This guideline has been rewritten taking into consideration the International Conference of
Harmonisation (ICH) guideline “Quality of biotechnological products: viral safetyevaluation of biotechnological products derived from cell lines of human or animal origin(ICH Topic Q5A, Step 3 document) (CPMP/ICH/295/95)VIRUS VALIDATION STUDIES:THE DESIGN, CONTRIBUTION AND INTERPRETATION OF STUDIESVALIDATING THE INACTIVATION AND REMOVAL OF VIRUSES
Note for Guidance[EMEA status as of 13 March 1996]
CONTENTSSectionPage1.Introduction22.Sources of Viral Contamination33.The Validation Process44.The Choice of Viruses for Validation55.Design of Validation Studies66.Interpretation of Data77.Limitations of Validation Studies98.Re-evaluation Studies10
Appendix I:Statistical evaluation of virus titres11Appendix II:Calculation of reduction factors12Table of viruses used in validation studies131.INTRODUCTION1.1This guideline discusses the need for and the contribution of viral validation studiestowards the viral safety of biological products. The principal aims of the guideline are toprovide guidance on the design of a validation study including the choice of viruses to beused and on the interpretation of the ensuing data especially with respect to defining aprocess step which can be considered to be effective in the inactivation and/or removalof viruses.
1.2The guideline concerns the validation of virus inactivation and/or removal proceduresfor all categories of medicinal biological products for human use with the exception oflive viral vaccines including genetically engineered live vectors. The type of productscovered include:
• products derived from in vitro culture of cell lines of human or animal origin,• products derived from in vivo culture of cell lines, or from organs or tissues ofhuman or animal origin,
• products derived from blood or urine or other biological fluids of human or animalorigin.
1.3The risk of viral contamination is a feature common to all biologicals whose productioninvolves the use of material of animal or human origin. Viral contamination of abiological may arise from the source material, e.g. cell banks of animal origin, humanblood, human or animal tissues, or as adventitious agents introduced by the productionprocess, e.g. the use of animal sera in cell culture.
1.4In the past, a number of biologicals administered to humans have been contaminatedwith viruses. In several instances, the virus was only identified many years after theproduct had been introduced into the market since contamination occurred prior toadequate knowledge concerning the presence of the infectious agents. The primarycause of these viral transmissions has been contamination of the starting or sourcematerials. Examples include Yellow Fever vaccine which was contaminated by avianleukosis virus by virtue of its production in naturally infected hens eggs, whilst SV40 wasa contaminant of poliovirus and adenovirus vaccines prepared in the 1950’s on primarycultures of kidney cells obtained from Rhesus monkeys naturally harbouring a clinicallyinapparent infection with SV40. In addition, viruses present in human plasma, e.g., HIVand HCV, have contaminated blood products whilst human growth hormone extractedfrom the pituitaries of cadavers has been implicated in the transmission of theaetiological agent responsible for Creutzfeldt-Jakob disease. Contamination of abiological can also arise from the use of infected material during production or as anexcipient. Perhaps the most notable was Yellow Fever vaccine contaminated with HBVpresent in human serum used as a stabiliser in the 1940's.
