有机化学第八章PPT
合集下载
有机化学第八章醛酮醌

• 也可用希腊字母表示靠近羰基的碳原子,其次为、 、…...
例如:
2、芳香醛、酮的命名,常将脂链作为主链,芳环为 取代基:
3、 比较简单的酮还常用羰基两边烃基的名称来命名:
4、 二元酮命名时,两个羰基的位置除可用数字标明外, 也可用、、…表示它们的相对位置, 表示两个羰 基相邻, 表示两个羰基相隔一个碳原子:
(1)碳碳双键加成
2,3,5,6-四溴环己二酮
(2)1,4-加成 — 苯醌可与氢卤酸 , 氢氰酸和胺发生 1,4-加成,生成1,4-苯二酚的衍生物.
(3) 羰基加成 ——对苯醌能与一分子羟胺和二分子羟 胺生成单肟或双肟。
•与羟胺反应
•苯醌单肟( wo) 与对 亚硝基苯酚的互变
互变异构体
(4)还原反应 •对苯醌与对苯二酚可通过还原与氧化反应互变。
• 羰基碳原子上同时连有两个烃基的叫酮。
O R H an aldehyde
O R R an ketone
一、醛、酮的结构
易受亲核试剂进攻, 发生亲核加成
示意图
二、 醛、酮的命名
1、脂肪族醛酮命名: 以含有羰基的最长碳链为主链,支 链作为取代基,主链中碳原子的编号从靠近羰基的 一端开始(酮需要标明位次):
(5)与氨及氨的衍生物反应
(A)醛酮与氨的反应:
• 亚胺极不稳定,极容易水解成原来的醛酮。 (B)醛酮与伯胺的反应——生成取代亚胺(希夫碱)
• 希夫碱还原可得仲胺。在有机合成上常利用芳醛与伯 胺作用生成希夫碱,加以还原以制备仲胺。
(C)醛酮与羟胺(NH2OH)的反应:
羟胺
肟(wò )
(D)醛酮与2,4-二硝基苯肼的反应:
三、 醛酮的物理性质
1 、室温下,甲醛为气体, 12 个碳原子以下的醛 酮为液体,高级醛酮为固体。 2、低级醛有刺鼻的气味,中级醛(C8~C13)则有 果香。 3 、低级醛酮的沸点比相对分子量相近的醇低。 (分子间无氢键)。 4 、低级醛酮易溶于水,醛酮都能溶于水。丙酮 能溶解很多有机化合物,是很好的有机溶剂。
有机化学第8章卤代烃

在SN2反应中
进攻试剂是从离去基团的背面进攻碳原子的。 进攻试剂是从离去基团的背面进攻碳原子的。 当Nu与碳原子接近时,C-Nu之间的化学键逐渐形成,而C-X之间的 Nu与碳原子接近时,C Nu之间的化学键逐渐形成,而C 化学键逐渐变弱,三者基本在同一直线上,形成了反应的过渡态,中心 碳由sp 转化为sp 碳由sp3转化为sp2杂化状态, Nu继续接近碳原子并与碳原子完全键合,离去基团完全离去,由过渡状 Nu继续接近碳原子并与碳原子完全键合,离去基团完全离去,由过渡状 态变为产物。
1)被羟基取代 加热 R-X + KOH(NaOH,水溶液) KOH(NaOH,水溶液) 2)被烷氧基取代 R-X + R`ONa R-O-R` +NaX R此反应也称为Wiliamson合成反应 合成反应。 此反应也称为Wiliamson合成反应。 3)被NH3取代 R-X + NH3 R-NH2(胺) + HX 胺是有机碱,它与反应生成的HX成盐 成盐, 胺是有机碱,它与反应生成的HX成盐,RNH3+XR-OH + KX
查依采夫规律
一般叔卤代烷最易消去,而伯卤代烷最难。 一般叔卤代烷最易消去,而伯卤代烷最难。仲或叔卤代烷 氢可以消去,因而产物不同。 有几个β氢可以消去,因而产物不同。 1875年俄国化学家查依采夫根据大量事实指出 年俄国化学家查依采夫根据大量事实指出: 1875年俄国化学家查依采夫根据大量事实指出:在β-消 去反应中主要产物是双键碳原子上烃基最多的烯烃, 去反应中主要产物是双键碳原子上烃基最多的烯烃,即得 到最稳定的烯烃。-- 。--查依采夫规律 到最稳定的烯烃。--查依采夫规律
溴甲烷在NaOH溶液中反应生成甲醇,反应时OH 溴甲烷在NaOH溶液中反应生成甲醇,反应时OH-从背面接近中 心碳原子,必须克服三个氢原子的阻力,同时三个C 心碳原子,必须克服三个氢原子的阻力,同时三个C-H键的偏 转使键角发生变化,因而体系的能量升高。达到过渡状态时,能 量也达到最高点。随着溴离子的进一步离去和C 量也达到最高点。随着溴离子的进一步离去和C-O键的进一步 形成,体系的能量逐渐降低,最后形成产物。
有机化学8光学异构ppt课件
C2
F FB
F
C3
C4
C5
C6
象上述一些含对称轴的化合物都是非手性 化合物,这是由于它们分子中同时含有对称面和 对称中心的缘故。但有些含对称轴的化合物,却 不含对称面和对称中心,也具有手性。例如,反 -1,2-二氯环丙烷分子中有二重对称轴,但没有对 称面和对称中心,具有旋光性,是手性分子。
因此有无对称轴不能作为判断分子有无手性的标准。在 手性分子结构中,往往允许有象对称轴的对称因素存在。
COOH
H
OH
CH2OH
1 COOH
HO
H
CH2OH
3
CH2OH
HO
H
COOH
2 OH
HOCH2
COOH
H
4
此外,对映体的构型还可用楔形表示:
COOH
C OH
H
CH3
OH
HO C
H3C
H
在上式中,手性碳原子和以实线相连的原子
或原子团在纸面上,用楔形实线表示的基团在纸 平面的前方,楔形虚线相连的在纸面后方,这种 表示法比较生动形象,但缺点是书写不方便。
OH H3C COOH
H
(R)-乳酸
OH HOOC CH3
H
(S)-乳酸
(2)若最小位次基团处于横键时,其它三个原 子或基团按次序规则顺时针则排列为S型,反时 针为R构型。
COOH
COOH
HO H CH3
H OH CH3
(S)-乳酸
(R)-乳酸
§8-5 含两个手性碳原子 化合物的对映异构
在有机化合物分子中,随着手性碳原子数目 的增加,其立体异构现象也愈益复杂。当分子中 含有两个手性碳原子时,根据它们所连四个基团 是否相同,可以分为不相同和相同的两类。
有机化学课件第八章不饱和碳氧双键化合物

O C C C O N C C C OR C C C N C C C
等
,
,
,
O
产生碳负离子的体系(G-C-H)有:
CH2(COOEt)2, CH3COCH2COOR , CH3NO2 , NCCH2COOR , PhCH2CN , RMgX , R2CuLi
O
Michael加成产物的结构为:
C G
C
Chapter 8 不饱和碳氧双键化合物
本 章内容
1
2 3 4 5
不饱和羰基化合物 碳酸衍生物
1,3-二羰基化合物在合成中的应用
碳氧双键化合物的分析 碳氧双键化合物的制备
8.1 不饱和羰基化合物
8.1.1 不饱和羰基化合物的分类
根据种类分类
不饱和醛酮 不饱和羧酸 不饱和羧酸衍生物 醌
不饱和羰基 化合物
OCOR CH3 C OR CH3 C O O
NHR RMgX CH2 C R OMgX H2O
NHR CH3 C R O
工业上乙烯酮可由乙酸或丙酮热解制备。
CH3 C OH CH3 C CH3 O O 700℃ AlPO4 800℃ Fe CH2 C O + CH 4 CH2 C O + H2O
1,2-加成产物
O CH3 CH CH C CH3 R H
Michael 加成产物
O R2C CH CR' + LiCuR''2
1) Et 2O 2) H2O
O R2C R'' CH H CR'
R2CuLi与α,β-不饱和羰基化合 物只发生1,4-加成
O
O 1) PhMgX,干醚 CH CH C C(CH3)3 2) H2O
等
,
,
,
O
产生碳负离子的体系(G-C-H)有:
CH2(COOEt)2, CH3COCH2COOR , CH3NO2 , NCCH2COOR , PhCH2CN , RMgX , R2CuLi
O
Michael加成产物的结构为:
C G
C
Chapter 8 不饱和碳氧双键化合物
本 章内容
1
2 3 4 5
不饱和羰基化合物 碳酸衍生物
1,3-二羰基化合物在合成中的应用
碳氧双键化合物的分析 碳氧双键化合物的制备
8.1 不饱和羰基化合物
8.1.1 不饱和羰基化合物的分类
根据种类分类
不饱和醛酮 不饱和羧酸 不饱和羧酸衍生物 醌
不饱和羰基 化合物
OCOR CH3 C OR CH3 C O O
NHR RMgX CH2 C R OMgX H2O
NHR CH3 C R O
工业上乙烯酮可由乙酸或丙酮热解制备。
CH3 C OH CH3 C CH3 O O 700℃ AlPO4 800℃ Fe CH2 C O + CH 4 CH2 C O + H2O
1,2-加成产物
O CH3 CH CH C CH3 R H
Michael 加成产物
O R2C CH CR' + LiCuR''2
1) Et 2O 2) H2O
O R2C R'' CH H CR'
R2CuLi与α,β-不饱和羰基化合 物只发生1,4-加成
O
O 1) PhMgX,干醚 CH CH C C(CH3)3 2) H2O
有机化学-第8章:卤代烷

Zn + HCl
CH3(CH2)14CH2I
CH3(CH2)14CH3
RX HI RI HI
-HX
RH + I2
卤代烷的还原
2 中性还原剂
催化氢化
RX (or ArX) H2 / Pd*
RH (orArH) * PdC, Ni, Pt
O
OH
CH2CCH3
CH2CHCH3
O2N
C=N H2 / Pd C H2N
H Br H
CH2 = CHCH2CH3+ CH3CH=CHCH3
19%
81%
CH3 CH3CHCHCH2
H Br H
叔卤代烷
C2H5ONa, C2H5OH
CH3
CH3 CH= C(CH3)2+ CH3CH2C=CH2
71%
29%
消除反应 ( E )
Saytzeff(查依采夫)规律
(1875年俄国化学家Saytzeff总结了当时已知的大量实验事实, 得出以下经验结论.)
(3) ( 4S )-4-甲基-5-乙基-1-溴庚烷 CH3 H
CH3CH2CH C CH2CH2CH2Br C2H5
(2) ( 2S,3S )-2-氯-3-溴丁烷
H Br Cl H CH3 C C CH3
4. (1R,3R)-1,3-二溴环己烷
Br H
H Br
卤代烷的普通命名法
CH3CH2CH2CH2Cl
H2 H1
慢
Br
-
HO
C
-
Br
快
HO
H1 C H2
Br-
H3
定义:
H3ห้องสมุดไป่ตู้
有机化学 第八章卤代烃

对SN2的影响
空间效应
H2C CH CH2X Ph CH2 X
注意:
H H
Nu H L H
〉SN2反应速度最快
p-π共轭,稳定过渡态, △E活化低快
知识点 苄基 (苯甲基)> 烯丙基 > CH3 > 1º > 2º > 3º
对SN1的影响 SN1的速控步骤:
电子效应 空间效应
RX R+ + X-
R1 2 HO C R R3 R1 R2 C OH R3
第一步生成平面三角形碳正离子, OH-从平面的两边进攻的机会均等。 例:
H3CO + CH3COOH O H2O/O O CH O C CH3 H3CO CH OH SN1
大多亲核取代反应既非完全转化,也非完全外销旋化。
例:
C6H5
CH CH3 + H2O/丙酮 Cl
凡是能稳定C+的因素,也稳定生成它的过渡态。
△E ----反应快( SN1 主要考虑电子效应)
例:
H3CO CH2 X
p-π共轭,稳定C+
空间效应也有影响:
H3C O CH2+
对SN1的影响
电子效应 空间效应
空间效应
3º最拥挤,解除拥挤的要求最强—易形成C+ CH3相反,解除拥挤的要求最小—难形成C+
亲核试剂 Nu
-
R CH2 Nu + X 离去基团
底物
Nucleophilies
反应是由带负电荷(或孤队电子)的试剂进攻带正
电荷的C原子引起的——亲核取代(SN) Substitution Nucleophilic
常见的亲核取代反应:
有机化学第08章
3,3二甲基2丁酮 (pinacolone)
优先发生能够生成稳定碳正离子的过程
31
➢ 不对称邻二醇的例子:
OH OH H3C C C H
CH3 H 2-甲基-1,2-丙二醇
机理:
OH OH H3C C C H
CH3 H
H2SO4
H2SO4
CH3 O H3C C C H
H
2-甲基丙醛
OH
H3C C C H CH3 H
PCC PCC
O
H 醛
Me O
Me
O 2°
O 酮
15
(2) Oppenauer氧化
OH
O
R1
R2 H
+
Al(OR)3
O
OH
+
R1 R2
环状过渡态:
i-PrO Oi-Pr
Al
O
O
R2
H
R1
OH
O
Al(Oi-Pr)3
丙酮
16
(3) 有机氧化试剂氧化
➢ Swern 氧化
OH 1°
➢ Dess-Martin 氧化
H2CrO4
CH3CH2CH2COOH 羧酸
OH CH3CH2CHCH3
2° OH
2°
CrO3 aq. H2SO4
(Jones试剂)
O CH3CH2CCH3
酮
O
Na2Cr2O7
aq. H2SO4 酮
13
Sarett试剂:温和,不氧化C=C双键
CrO3 + 2 N
OO N Cr N
O
Sarett试剂
H3C
Br CH3
CH3 OH 1) TsCl
优先发生能够生成稳定碳正离子的过程
31
➢ 不对称邻二醇的例子:
OH OH H3C C C H
CH3 H 2-甲基-1,2-丙二醇
机理:
OH OH H3C C C H
CH3 H
H2SO4
H2SO4
CH3 O H3C C C H
H
2-甲基丙醛
OH
H3C C C H CH3 H
PCC PCC
O
H 醛
Me O
Me
O 2°
O 酮
15
(2) Oppenauer氧化
OH
O
R1
R2 H
+
Al(OR)3
O
OH
+
R1 R2
环状过渡态:
i-PrO Oi-Pr
Al
O
O
R2
H
R1
OH
O
Al(Oi-Pr)3
丙酮
16
(3) 有机氧化试剂氧化
➢ Swern 氧化
OH 1°
➢ Dess-Martin 氧化
H2CrO4
CH3CH2CH2COOH 羧酸
OH CH3CH2CHCH3
2° OH
2°
CrO3 aq. H2SO4
(Jones试剂)
O CH3CH2CCH3
酮
O
Na2Cr2O7
aq. H2SO4 酮
13
Sarett试剂:温和,不氧化C=C双键
CrO3 + 2 N
OO N Cr N
O
Sarett试剂
H3C
Br CH3
CH3 OH 1) TsCl
中国农业大学有机化学课件第八章 对映异构
练习: 练习 用系统命名法命名下列化合物
COOH H C Br C6H5 H C2H5 I CH3 H
NH2
Ph H H Br CH3 Cl H
Br
CH3 H Br
Ph
8.3.5 Stereochemistry of cyclic compounds
H H H COOH COOH H H H COOH H 反式(E) ) H H COOH HOOC H COOH H H
8.5.1 Asymmetric synthesis
CH3 CH H CH2 CH3 H5C2 Cl Cl2 CH3 C H
CH3 Cl C H5C2 H
CH3 C Cl H5C2 H
CH 3 H CH 3 Cl H C C H H H CH 3 CH 3 Cl CH 3 H H H Cl Cl Cl H CH 3 CH OOC H
8.4.2 含手性面的分子
(CH2)8 O HOOC O O
(CH2)8 O COOH
把手化合物( 把手化合物(Ansa-compounds) )
(CH2)10 Br O Br O O
(CH2)10 Br O Br
8.4.3 螺旋手性分子
R R'
R'R
8.4.4 含其他手性原子的化合物
mp139℃ ℃
顺式(Z) )
mp175℃ ℃
H
H COOH COOH H
COOH COOH H
反式 – 1,2 – 环己二甲酸的对映异构体 ,
COOH H COOH H COOH COOH H H H HOOC H COOH
(Ⅰ) Ⅰ
H H COOH COOH
(Ⅱ) Ⅱ
有机化学课件:第8章 氧化还原反应
还原态物质失电子,在反应中做还原剂 2、氧化态物质的氧化能力越强,其对应的
还原态物质的还原能力就越弱; 氧化态物质的氧化能力越弱,其对应的 还原态物质的还原能力就越强。
2 MnO4 + 10 Cl + 16 H+ = 2 Mn2+ + 5Cl2 + 8 H2O
Cl Cl2
MnO4 H Mn2 H2O
氧化值是人为的定义;
氧化值与化合价的区别
化合价:表示元素的原子结合成分子时,原子 数目的比例关系。从分子结构来看,化合价是 指形成共价化合物时所形成的共价键的数目。 只能是正整数。
CH4 、CH3Cl 、CH2Cl2 、CHCl3 CCl4 化合价均为4 氧化值分别为:-4、-2、0、+2、+4
二、氧化还原反应
氧化半反应
还原半反应
电池反应:原电池中发生的总的氧化还原反应 Zn + Cu2+ Cu + Zn2+
盐桥的作用
盐桥:饱和KCl溶液+琼胶,其中离子可自由迁移。
负极: Zn Zn2+ + 2eZn2+过剩,显正电性,阻 碍半反应继续进行,盐桥 中的Cl-中和过量的正电荷。
正极的情况与之相反。
盐桥的作用
元素的氧化值发生变化的反应
Cu2++Zn
Zn2++Cu
在氧化还原反应中, 氧化(oxidation):元素的氧化值升高的过程
还原(reduction):氧化值降低的过程 氧化剂(oxidant): 氧化值降低 的物质 还原剂(reductant):氧化值升高的物质
Cu2+ + Zn
氧化剂 还原剂
还原态物质的还原能力就越弱; 氧化态物质的氧化能力越弱,其对应的 还原态物质的还原能力就越强。
2 MnO4 + 10 Cl + 16 H+ = 2 Mn2+ + 5Cl2 + 8 H2O
Cl Cl2
MnO4 H Mn2 H2O
氧化值是人为的定义;
氧化值与化合价的区别
化合价:表示元素的原子结合成分子时,原子 数目的比例关系。从分子结构来看,化合价是 指形成共价化合物时所形成的共价键的数目。 只能是正整数。
CH4 、CH3Cl 、CH2Cl2 、CHCl3 CCl4 化合价均为4 氧化值分别为:-4、-2、0、+2、+4
二、氧化还原反应
氧化半反应
还原半反应
电池反应:原电池中发生的总的氧化还原反应 Zn + Cu2+ Cu + Zn2+
盐桥的作用
盐桥:饱和KCl溶液+琼胶,其中离子可自由迁移。
负极: Zn Zn2+ + 2eZn2+过剩,显正电性,阻 碍半反应继续进行,盐桥 中的Cl-中和过量的正电荷。
正极的情况与之相反。
盐桥的作用
元素的氧化值发生变化的反应
Cu2++Zn
Zn2++Cu
在氧化还原反应中, 氧化(oxidation):元素的氧化值升高的过程
还原(reduction):氧化值降低的过程 氧化剂(oxidant): 氧化值降低 的物质 还原剂(reductant):氧化值升高的物质
Cu2+ + Zn
氧化剂 还原剂
有机化学第8章 醇、酚、醚
8.11.3过氧化物的生成
醚对氧化剂比较稳定,但是,遇空气长期接触,却能被空气中 的氧逐渐氧化生成过氧化物。一般认为氧化是首先发生在 -C-H键上,然后再转变成结构更为复杂的过氧化物。
■另外,氧上电子云密度降低,使O-H键极性增加,酚羟基中H的
酸性增加。 共轭的结果使得:
1.酚羟基氢易于以质子的形式离去使酚显酸性;
2.苯环上的电子云密度增高易于进行亲电取代反应。
8.5.2命名
8.6酚的物理性质(自学)
8.7酚的化学性质
酚中羟基与苯环形成大的p—π共轭体系,由于氧的给电子共轭
醚键对强酸不稳定,遇强酸会发生醚键断裂,但HCl、HBr断裂
较难,需要催化剂;使醚键断裂最有效的试剂是浓的氢碘酸(HI)。 醚键的断裂是醚在HI中,先形成洋盐,然后,I-再作为亲核试 剂进攻-C而发生醚键断裂。 醚键断裂的顺序:30烷基>20烷基>10烷基>芳烃基
I-有两种进攻方向,但从电子效应和空间效应两方面看,都是
I-进攻甲基碳有利。所以,在混醚断键时,总是先从碳链较 小的一端断裂。如果 HI过量,则生成的醇可进一步生成碘代烃。
芳香混醚与浓HI作用时,总是断裂烷氧键,生成酚和碘代烷。
总结:
◆反应活性:HI>HBr>HCl ◆伯烷基醚按SN2机制断裂, ◆叔烷基醚按SN1机制断裂, ◆芳基烷基醚总是烷氧键断裂
碱性溶液中与烃基化剂(硫酸二甲酯、卤代烃等)作用生成。
羧酸与醇在酸催化下可以成酯,由于酚羟基中的氧与苯环发 生了p_π共轭其反应活性减小,与羧酸难于成酯。但可与活 性较大的酰基化试剂酰氯或酸酐成酯。
8.7.2芳环上的亲电取代反应
8.7.2.1卤代反应
反应很灵敏,很稀的苯酚溶液就能与溴水生成沉 淀。故此反应可用作苯酚的鉴别和定量测定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
教学难点:
1.构型的标记(特别是R/S标记法)。 2.Fischer投影式的书写方法。
立体化学主要研究分子的立体结构(三维
空间结构)及其立体结构对其物理性质及化学 性质的影响。
立体异构是指具有相同的分子式、相同的原
子连接顺序,不同的空间排列方式引起的异构。
立体异构包括顺反异构、对映异构、构象异 构。
λ——所用光源的波长; t——测定时的温度; c——溶液的浓度,单位为g·mL-l;
L——盛液管的长度,单位为分米。
若所测物质为纯液体,则有:
t
Ld
d——纯液体密度(g/ml)
比族光度是旋光性物质的一种物理常数, 而且每种旋光性物质的比旋光度是固定不变的。 测定旋光度可用于鉴定旋光性物质,也可确定 旋光性物质的纯度和含量。
B
D'
C
C'
D
B'
A'
普通光
Nicol棱晶
A
A' 平面偏振光
⑵ 物质的旋光性
如果在镜轴平行的两个尼可尔棱镜之间,放 一支玻璃管,在玻璃管中分别放入各种有机物的溶 液,然后用一光源由第一个棱镜向第二个棱镜的方 向照射,并在第二个棱镜后面观察,可以发现:
① 当玻璃管中放有乙醇、丙酮等物质时,光的亮 度没有改变;
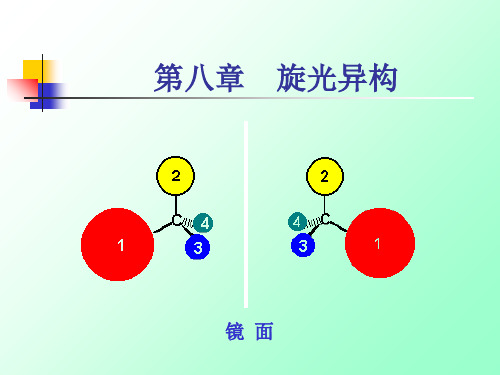
镜面
& 费Βιβλιοθήκη 尔(Fischer)投影式费歇尔为19世纪德国有机化学家。1902 年获诺贝尔化学奖(第二个获奖者,由于研 究糖和嘌呤类生命物质而获奖),是第五个 诺贝尔奖获得者Baeyer(拜尔,德国有机化学 家,由于合成靛蓝而获奖)的学生。
碳架异构
官能团位置异构 构造异构
官能团异构
同分异构
构型异构 构象异构
互变异构(CH2=CHOH
CH3CHO )
顺反异构
对映异构
(旋光异构)
立体异构
本章主要讨论对映异构
如果把左手放在一面镜
子前,可以观察到镜子里
的镜像与右手完全一样。
所以,左手和右手具有互
为实物与镜像的关系,两
者不能重合。
左手
镜 右手
⑵ 旋光仪
测定化合物的旋光度是用旋光仪,旋光仪主
要部分是有两个尼可尔棱晶(起偏棱晶和检偏棱 晶),一个盛液管和一个刻度盘组装而成。
A
A
B
D'
C
D
B'
A'
A'
起偏镜
乳酸
旋光性物质
盛液管
α
目镜(亮)
检偏镜
⑶ 旋光度的大小和方向的影响因素
旋光性物质的旋光度的大小和方向 主要决定于该物质的分子结构,并与测 定时所用溶液的浓度、盛液管的长度、 测定温度、光波的波长以及溶剂的种类 等因素有关。
② 而当玻璃管中放有乳酸、丙氨酸、酒石酸等的 溶液时,则在第二个棱镜后面见到的光的亮度 就减弱,但如将第二个棱镜向左或向右转动一 定角度以后,又能见到最大亮度的光。
A
B
D'
C
C'
D
B'
A'
A
乙醇
A'
不旋光物质
A
B
D'
C
C'
D
B'
A'
A
乳酸
α
A'
旋光性物质
旋光性: 物质能使偏振光的振动平面发生旋转的 性质称为旋光性或光学活性。
手性碳原子(不对称碳原子),用“*C”表示。
一、物质的旋光性和比旋光度
⒈ 平面偏振光和物质的旋光性
光是一种电磁波,光波振动方向的与其前 进的方向垂直。普通光的光波是在与前进方向 垂直的平面内,以任何方向振动。
光源
(1 )光的前进方向与振动方向
光束前进方向
A
B
D'
C
C'
D A' B'
(2)普通光的振动平面
旋光性物质: 具有旋光性的物质叫做旋光性物 质,也称光学活性物质。
右旋体:使偏振光振动平面向右旋转(顺时针方 向)的物质称右旋体,用“+”表示;
左旋体:使偏振光振动平面向左旋转(反时针方向) 的物质称左旋体,用“-”表示。
⒉ 旋光度和比旋光度
⑴ 旋光度:旋光性物质使偏振光的振动平面旋 转的角度即旋光度,以“α”表示。
图 6-1 光的传播
⑴ 平面偏振光
如果使普通光通过一个特制的叫做尼可尔棱镜的晶 体,那么,只有在和棱镜的轴平行的平面上振动的光才 能通过,而把其它平面振动的光挡住。因此,透过棱镜 的光就只有在一个平面(方向)内振动了。
偏振光:仅在某一平面(方向)上振动的光,就 叫做平面偏振光,或简称偏振光。
晶轴
A
为了比较各种不同旋光性物质的旋光 度的大小,一般用比旋光度来表示。
⑷ 比旋光度
一定温度下,一定波长(通常为钠光灯, 波长为589 nm)的入射光,通过长度为 1dm 盛满浓度为1g•ml-1旋光性物质的盛液 管时,所测得的旋光度,称作比族光度。用
表t 示:
α——由旋光仪测得的旋光度;
= [α]t α λ C×L
二、分子的对称性
分子与其镜象不能完全重合是手性分 子的特征。分子能否与其镜象重合,与分 子的对称性有关,所以判断分子有无手性, 需考察其是否存在对称因素。
⒈ 分子的对称因素
——可以是一个点、一个轴或一个平面。
⑴ 对称面 假如有 一个平面能够把分子分
割成两部分,其中一部分正好是另一部分 的镜象,该平面就是这个分子的对称面。
第八章 对映异构
(4学时)
学习目标:
1.掌握分子的手性、手性碳原子、对映体、外 消旋体和内消旋体的概念。
2.掌握Fischer投影式的书写方法及注意事项。 3.掌握构型的标记方法(D/L法和R/S法)。 4.掌握含一个、两个手性碳原子的光学异构。
教学重点:
1.构型的标记(特别是R/S标记法)。 2.含有一个手性碳原子的化合物的对映异构。
手性:如人的左右手互为镜像和实物、彼此又不能
重合的现象称为手性。
手性分子和对映体:互为实物与镜象关系又不能 重合的分子称为手性分子。凡是手性分子都具有旋 光性和对映异构现象。这种异构体叫做对映异构体, 简称对映体。
当分子中sp3 杂化碳上连接四个不同的原子或基
团时,该分子为手性分子。
C
C
凡是连有4个不同的原子或基团的碳原子——
⑵ 对称中心 设想分子中有一点,从分子的任一
原子或原子团向该点作一直线,再将直线延长 出去,在距该点等距离处,仍是相同的原子或 原子团,这个点就叫做分子的对称中心。
⒉ 分子的手性和旋光性
凡具有对称面或对称中心等任何一个对称 因素的分子,称为对称分子;对称性的分子 无手性;非手性分子不存在对映异构, 没有旋 光性。
凡不具有任何对称因素的分子,称为不对 称分子;不对称分子有手性;手性分子都存 在对映异构, 都有旋光性。
不对称分子——手性分子——有旋光性。 对称分子——非手性分子——无旋光性。
三、含有一个手性碳原子化合 物的对映异构现象
⒈ 构型的表示方法
两种不同类型的对映异构体,其构型可用 分子模型、立体结构式(楔形式和透视式) 或费歇尔(E·Fischer)投影式来表示。
1.构型的标记(特别是R/S标记法)。 2.Fischer投影式的书写方法。
立体化学主要研究分子的立体结构(三维
空间结构)及其立体结构对其物理性质及化学 性质的影响。
立体异构是指具有相同的分子式、相同的原
子连接顺序,不同的空间排列方式引起的异构。
立体异构包括顺反异构、对映异构、构象异 构。
λ——所用光源的波长; t——测定时的温度; c——溶液的浓度,单位为g·mL-l;
L——盛液管的长度,单位为分米。
若所测物质为纯液体,则有:
t
Ld
d——纯液体密度(g/ml)
比族光度是旋光性物质的一种物理常数, 而且每种旋光性物质的比旋光度是固定不变的。 测定旋光度可用于鉴定旋光性物质,也可确定 旋光性物质的纯度和含量。
B
D'
C
C'
D
B'
A'
普通光
Nicol棱晶
A
A' 平面偏振光
⑵ 物质的旋光性
如果在镜轴平行的两个尼可尔棱镜之间,放 一支玻璃管,在玻璃管中分别放入各种有机物的溶 液,然后用一光源由第一个棱镜向第二个棱镜的方 向照射,并在第二个棱镜后面观察,可以发现:
① 当玻璃管中放有乙醇、丙酮等物质时,光的亮 度没有改变;
镜面
& 费Βιβλιοθήκη 尔(Fischer)投影式费歇尔为19世纪德国有机化学家。1902 年获诺贝尔化学奖(第二个获奖者,由于研 究糖和嘌呤类生命物质而获奖),是第五个 诺贝尔奖获得者Baeyer(拜尔,德国有机化学 家,由于合成靛蓝而获奖)的学生。
碳架异构
官能团位置异构 构造异构
官能团异构
同分异构
构型异构 构象异构
互变异构(CH2=CHOH
CH3CHO )
顺反异构
对映异构
(旋光异构)
立体异构
本章主要讨论对映异构
如果把左手放在一面镜
子前,可以观察到镜子里
的镜像与右手完全一样。
所以,左手和右手具有互
为实物与镜像的关系,两
者不能重合。
左手
镜 右手
⑵ 旋光仪
测定化合物的旋光度是用旋光仪,旋光仪主
要部分是有两个尼可尔棱晶(起偏棱晶和检偏棱 晶),一个盛液管和一个刻度盘组装而成。
A
A
B
D'
C
D
B'
A'
A'
起偏镜
乳酸
旋光性物质
盛液管
α
目镜(亮)
检偏镜
⑶ 旋光度的大小和方向的影响因素
旋光性物质的旋光度的大小和方向 主要决定于该物质的分子结构,并与测 定时所用溶液的浓度、盛液管的长度、 测定温度、光波的波长以及溶剂的种类 等因素有关。
② 而当玻璃管中放有乳酸、丙氨酸、酒石酸等的 溶液时,则在第二个棱镜后面见到的光的亮度 就减弱,但如将第二个棱镜向左或向右转动一 定角度以后,又能见到最大亮度的光。
A
B
D'
C
C'
D
B'
A'
A
乙醇
A'
不旋光物质
A
B
D'
C
C'
D
B'
A'
A
乳酸
α
A'
旋光性物质
旋光性: 物质能使偏振光的振动平面发生旋转的 性质称为旋光性或光学活性。
手性碳原子(不对称碳原子),用“*C”表示。
一、物质的旋光性和比旋光度
⒈ 平面偏振光和物质的旋光性
光是一种电磁波,光波振动方向的与其前 进的方向垂直。普通光的光波是在与前进方向 垂直的平面内,以任何方向振动。
光源
(1 )光的前进方向与振动方向
光束前进方向
A
B
D'
C
C'
D A' B'
(2)普通光的振动平面
旋光性物质: 具有旋光性的物质叫做旋光性物 质,也称光学活性物质。
右旋体:使偏振光振动平面向右旋转(顺时针方 向)的物质称右旋体,用“+”表示;
左旋体:使偏振光振动平面向左旋转(反时针方向) 的物质称左旋体,用“-”表示。
⒉ 旋光度和比旋光度
⑴ 旋光度:旋光性物质使偏振光的振动平面旋 转的角度即旋光度,以“α”表示。
图 6-1 光的传播
⑴ 平面偏振光
如果使普通光通过一个特制的叫做尼可尔棱镜的晶 体,那么,只有在和棱镜的轴平行的平面上振动的光才 能通过,而把其它平面振动的光挡住。因此,透过棱镜 的光就只有在一个平面(方向)内振动了。
偏振光:仅在某一平面(方向)上振动的光,就 叫做平面偏振光,或简称偏振光。
晶轴
A
为了比较各种不同旋光性物质的旋光 度的大小,一般用比旋光度来表示。
⑷ 比旋光度
一定温度下,一定波长(通常为钠光灯, 波长为589 nm)的入射光,通过长度为 1dm 盛满浓度为1g•ml-1旋光性物质的盛液 管时,所测得的旋光度,称作比族光度。用
表t 示:
α——由旋光仪测得的旋光度;
= [α]t α λ C×L
二、分子的对称性
分子与其镜象不能完全重合是手性分 子的特征。分子能否与其镜象重合,与分 子的对称性有关,所以判断分子有无手性, 需考察其是否存在对称因素。
⒈ 分子的对称因素
——可以是一个点、一个轴或一个平面。
⑴ 对称面 假如有 一个平面能够把分子分
割成两部分,其中一部分正好是另一部分 的镜象,该平面就是这个分子的对称面。
第八章 对映异构
(4学时)
学习目标:
1.掌握分子的手性、手性碳原子、对映体、外 消旋体和内消旋体的概念。
2.掌握Fischer投影式的书写方法及注意事项。 3.掌握构型的标记方法(D/L法和R/S法)。 4.掌握含一个、两个手性碳原子的光学异构。
教学重点:
1.构型的标记(特别是R/S标记法)。 2.含有一个手性碳原子的化合物的对映异构。
手性:如人的左右手互为镜像和实物、彼此又不能
重合的现象称为手性。
手性分子和对映体:互为实物与镜象关系又不能 重合的分子称为手性分子。凡是手性分子都具有旋 光性和对映异构现象。这种异构体叫做对映异构体, 简称对映体。
当分子中sp3 杂化碳上连接四个不同的原子或基
团时,该分子为手性分子。
C
C
凡是连有4个不同的原子或基团的碳原子——
⑵ 对称中心 设想分子中有一点,从分子的任一
原子或原子团向该点作一直线,再将直线延长 出去,在距该点等距离处,仍是相同的原子或 原子团,这个点就叫做分子的对称中心。
⒉ 分子的手性和旋光性
凡具有对称面或对称中心等任何一个对称 因素的分子,称为对称分子;对称性的分子 无手性;非手性分子不存在对映异构, 没有旋 光性。
凡不具有任何对称因素的分子,称为不对 称分子;不对称分子有手性;手性分子都存 在对映异构, 都有旋光性。
不对称分子——手性分子——有旋光性。 对称分子——非手性分子——无旋光性。
三、含有一个手性碳原子化合 物的对映异构现象
⒈ 构型的表示方法
两种不同类型的对映异构体,其构型可用 分子模型、立体结构式(楔形式和透视式) 或费歇尔(E·Fischer)投影式来表示。
