2019版高考化学一轮复习 第17讲 化学能与热能作业
2019-2020学年度2017级化学高考一轮复习《化学能与热能》过关检测试题(Word版含解析)

2017级高考一轮复习《化学能与热能》过关训练试题(考试时间:50分钟,满分:100分)一、单项选择题:本题包括7小题,每小题6分,共42分1.下列与化学反应能量变化相关的叙述正确的是()A.生成物总能量一定低于反应物总能量B.放热反应的反应速率总是大于吸热反应的反应速率C.应用盖斯定律,可计算某些难以直接测量的反应焓变D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同答案 C解析根据生成物总能量和反应物总能量的相对大小,把化学反应分为吸热反应和放热反应,吸热反应的生成物总能量高于反应物总能量,放热反应的生成物总能量低于反应物总能量;反应速率是单位时间内物质浓度的变化,与反应的吸热、放热无关;同温同压下,H2(g)和Cl2(g)的总能量与HCl(g)的总能量的差值不受光照和点燃条件的影响,所以该反应的ΔH 相同。
2.下列热化学方程式书写和表示正确的是(ΔH的绝对值均正确)()A.2SO 2(g)+O2(g)2SO3(g) ΔH=-196 kJ·mol-1(反应热)B.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1(燃烧热)C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1(中和热)D.2NO2===O2+2NO ΔH=-116.2 kJ·mol-1(反应热)答案 A解析二氧化硫与氧气反应生成三氧化硫是放热反应,焓变为负值,且标注了物质的聚集状态和反应焓变,符合热化学方程式的书写原则,故A项正确;燃烧热是1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,选项中生成的气态水不是稳定氧化物,故B项错误;酸碱中和反应是放热反应,焓变为负值,故C项错误;热化学方程式中物质的聚集状态未标注,故D项错误。
3.在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)(已知:2SO2+O2 2SO 3),反应过程中的能量关系如图所示(图中的ΔH表示生成1 mol产物的数据)。
高考化学一轮复习 专题6 第17讲 化学反应中的热效应练习 苏教版
第17讲化学反应中的热效应课时作业1.能源分类相关图如图所示,下列四组选项中,全部符合图中阴影部分的能源是( )A.煤炭、石油、沼气B.水能、生物能、天然气C.太阳能、风能、潮汐能D.地热能、海洋能、核能解析:A中煤炭、石油都是不可再生能源,B中天然气是不可再生能源,D中核能是不可再生能源。
答案:C2.巴黎气候大会揭开了发展低碳经济的宏伟序幕,下列有关说法正确的是( )A.太阳能、地热能、核能、化石燃料等均属于“新能源”B.减少含碳物质做燃料符合“低碳”理念C.图中转化途径不能体现“节能减排”的思想D.节约用电不能减少CO2的排放量解析:化石燃料属于传统能源,A项错误;减少含碳物质做燃料,就可以减少空气中碳元素的含量,符合“低碳”理念,B项正确;从题图可知,HCl循环利用,排出的水无污染,符合“节能减排”思想,C项错误;目前发电主要是火力发电,节约用电就能减少CO2的排放量,D项错误。
答案:B3.下列反应中符合图示能量变化的是( )A.电解Al2O3得到Al和O2B.Ba(OH)2·8H2O与NH4Cl反应C.铝热反应D.灼热的炭与CO2反应解析:根据图示可知反应物的总能量高于生成物的总能量,反应发生时会释放能量,故反应是放热反应。
电解Al 2O 3得到Al 和O 2的反应是吸热反应,与图像不符,故A 错误;Ba(OH)2·8H 2O 与NH 4Cl 的反应是吸热反应,与图像不符,故B 错误;铝热反应是放热反应,反应物的总能量高于生成物的总能量,与图像相符,故C 正确;灼热的炭与CO 2反应产生CO ,该反应是吸热反应,与图像不符,故D 错误。
答案:C4.下列有关氢原子(用H 表示)与氢分子的说法错误的是( ) A .化学能:2 mol H>1 mol H 2 B .H 原子间发生碰撞就可转化为H 2 C .稳定性:H<H 2D .H 2―→2H 的过程是吸热反应解析:由H 转化为H 2时要形成化学键,而形成化学键的过程会放出热量,故产物所具有的能量比反应物的低,物质具有的能量越低越稳定,A 、C 、D 对;只有粒子间的有效碰撞才能引发反应,B 错。
2019高考化学一轮复习 主题14 化学能与热能(3)(含解析)

主题14:化学能与热能李仕才考点二热化学方程式1.概念:表示参加反应的①和②的关系的化学方程式。
2.意义:不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。
3.热化学方程式的书写步骤【答案】①物质的量②反应热1.下列关于反应4NH3(g)+5O2(g)4NO(g)+6H2O(g)ΔH=-905 kJ·mol-1的叙述不正确...的是( )。
A.生成物的总能量小于反应物的总能量B.化学方程式中的化学计量数表示分子数C.该反应为放热反应D.该反应中每4 mol NH3(g)被氧化,放出905 kJ热量【解析】4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH=-905 kJ·mol-1,该反应是放热反应,反应物的总能量高于生成物的总能量,A、C两项均正确;热化学方程式中的化学计量数只表示物质的量,不能表示微粒数,B项错误;依据元素化合价变化分析可知,4 mol NH3被氧化放出905 kJ热量,D项正确。
【答案】B2.实验测得:101 kPa 时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。
下列热化学方程式的书写正确的是( )。
①CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol-1②CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1③CH4(g)+2O2(g)CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1④2H2(g)+O2(g)2H2O(l) ΔH=-571.6 kJ·mol-1A.②B.②④C.②③④D.①④【解析】1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量,则热化学方程式为CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,故①③均错误,②正确;1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量,则热化学方程式为2H2(g)+O2(g)2H2O(l) ΔH=-571.6 kJ·mol-1,故④正确。
最新届高考化学一轮复习-化学能与热能化学能与热能作业资料

核心素养提升练十六化学能与热能(25分钟50分)一、选择题(本题包括3小题,每题7分,共21分)1.碳酸钙分解的反应需要在高温下持续加热,根据如图所示的反应判断下列说法中错误的是( )A.CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量B.该反应为吸热反应C.该反应中有离子键断裂,也有共价键断裂,化学键断裂吸收能量,化学键生成放出能量D.由该反应可推出凡是需要加热才发生的反应均为吸热反应【解析】选D。
因为碳酸钙受热分解是吸热反应,所以CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量,故A、B正确;在CaCO3中,Ca2+和C之间存在离子键,C中C与O之间存在共价键,故反应中有离子键断裂也有共价键断裂,旧化学键断裂吸收能量,新化学键形成放出能量,C正确;需要加热才发生的反应不一定为吸热反应,如碳的燃烧需要加热,但该反应是放热反应,D错误。
【加固训练】(2019·沧州模拟)关于下图所示转化关系(X代表卤素),说法不正确的是 ( )A.2H(g)+2X(g)2HX(g) ΔH 3<0B.生成HX的反应热与途径无关,所以ΔH1=ΔH2+ΔH3C.F、Cl、Br的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多D.F2、Cl2分别发生反应Ⅰ,则焓变,前者小【解析】选C。
C项,F、Cl、Br的非金属性依次减弱,则途径Ⅱ吸收的热量应依次减小。
D项,F2和H2反应放出热量更多,焓变更小。
2.铁系氧化物材料在光催化、电致变色、气敏传感器以及光电化学器件中有着广泛的应用和诱人的前景。
实验室中可利用FeCO3和O2为原料制备少量铁红,每生成160 g固体铁红放出130 kJ热量,则下列有关该反应的热化学方程式书写正确的是 ( )A.2FeCO 3+O2Fe2O3+2CO2ΔH=-130 kJ·mol-1B.4FeCO 3(s)+O2(g)2Fe2O3(s)+4CO2(g) ΔH=+260 kJ·mol-1C.4FeCO 3(s)+O2(g)2Fe2O3(s)+4CO2(g) ΔH=-260 kJ·mol-1D.4FeCO 3(s)+O2(g)2Fe2O3(s)+4CO2(g) ΔH=+130 kJ·mol-1【解析】选C。
高考化学一轮复习课时作业:19化学能与热能

2 21.下列有关焓变与反应热的说法,正确的是()A . 反 应 热 和 焓 变 的 单 位 都 是 kJB .如果反应是在恒温恒压条件下进行的,此时的反应热与焓变相等C .如果反应是在恒温恒容条件下进行的,此时的反应热与焓变相等D .任何化学反应的反应热均可通过实验直接测定解析:选 B 。
反应热和焓变的单位都是 kJ·mol -1,A 错误;恒温恒压时的反应热与焓变相等,B 正确,C 错误;有些反应的反应热不能通过实验直接测定,如 C 不完全燃烧生成 CO ,故 D 错误。
2.对热化学方程式 C(s)+H O(g)===CO(g)+H (g) ΔH =+131.3 kJ·mol -1最准确的理解是( )A .碳和水反应吸收 131.3 kJ 热量B .1 mol 碳和 1 mol 水反应生成一氧化碳和氢气,同时放出 131.3 kJ 热量C .1 mol 碳和 1 mol 水蒸气反应生成 1 mol CO 和 1 mol H 2,同时吸收 131.3 kJ 热量D .1 个固态碳原子和 1 分子水蒸气反应吸热 131.1 kJ解析:选 C 。
热化学方程式的系数表示物质的量,故 A 、D 错误;B 的说法不准确,未强调 “水蒸气”,且应为吸收热量。
3.(2014·豫西五校联考)下列说法错误的是( )A .化学反应中的能量变化都表现为热量变化B .需要加热才能发生的反应不一定是吸热反应C .向醋酸钠溶液中滴入酚酞试液,加热后若溶液红色加深,则说明盐类水解是吸热的D .反应物和生成物所具有的总能量决定了反应是放热还是吸热解析:选 A 。
化学反应中的能量变化除了表现为热量变化外,还可以表现为电能和光能等。
4.(2014·温州联考)已知热化学方程式(Q 1,Q 2均为正值): C(s)+1 2O 2(g)===CO(g) ΔH =-Q 1 kJ ·mol-1, C(s)+O (g)===CO (g) ΔH =-Q kJ·mol -1,有关上述反应的叙述错误的是()22 2A .Q 1<Q 2B .生成物总能量均高于反应物总能量C .由 1 mol C 反应生成 1 mol CO 气体时放出 Q 1 kJ 热量D .1 mol CO 2 气体具有的能量大于 1 mol 干冰具有的能量解析:选 B 。
2021年高考化学一轮复习课时作业17化学能与热能
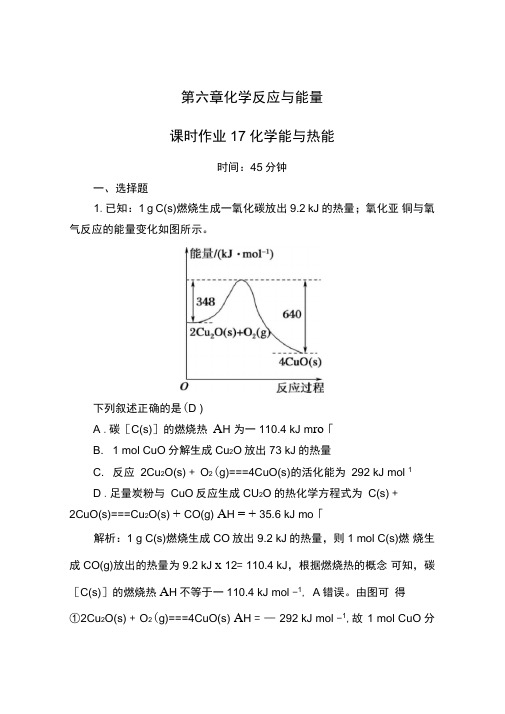
第六章化学反应与能量课时作业17化学能与热能时间:45分钟一、选择题1.已知:1 g C(s)燃烧生成一氧化碳放出9.2 kJ的热量;氧化亚铜与氧气反应的能量变化如图所示。
下列叙述正确的是(D )A .碳[C(s)]的燃烧热A H 为一110.4 kJ m ro「B. 1 mol CuO分解生成Cu2O放出73 kJ的热量C. 反应2Cu2O(s) + O2(g)===4CuO(s)的活化能为292 kJ mol 1D .足量炭粉与CuO反应生成CU2O的热化学方程式为C(s) +2CuO(s)===Cu2O(s) + CO(g) A H = + 35.6 kJ mo「解析:1 g C(s)燃烧生成CO放出9.2 kJ的热量,则1 mol C(s)燃烧生成CO(g)放出的热量为9.2 kJ x 12= 110.4 kJ,根据燃烧热的概念可知,碳[C(s)]的燃烧热A H不等于一110.4 kJ mol -1, A错误。
由图可得①2Cu2O(s) + O2(g)===4CuO(s) A H = —292 kJ mol -1,故1 mol CuO分解生成Cu2O吸收73 kJ热量,B错误。
由B项分析可知反应2Cu2O(s) + O2(g)===4CuO(s)的反应热为—292 kJ mol」,无法判断活化能的值,C错误。
C(s)燃烧生成CO(g)的热化学方程式为②2C(s) +1 O2(g)===2CO(g) A H = —220.8 kJ mol—1,根据盖斯定律,由②X ^ —1①^2 可得C(s) + 2CuO(s)===Cu 2O(s) + CO(g)的A H = (—220.8 kJ mol1 1—1) X ^—(—292 kJ mol —1) X 空=+ 35.6 kJ mol-—1, D 正确。
2 .已知热化学方程式2NO2(g) N2O4© A H = —56.9 kJ/mol ,则关于热化学方程式“ N2O4(g) 2NO2(g) A H o”的说法中正确的是(B )A .热化学方程式中的化学计量数表示分子数B .该反应A H o>0C.该反应A H0= —56.9 kJ/molD .该反应可表示1 mol N2O4投入容器中分解时的热效应解析:A H o = + 56.9 kJ/mol,化学计量数表示物质的量,由于该反应为可逆反应,1 mol N2O4不可能完全分解,所以D项错误。
2019-2020学年度2017级高考化学一轮复习《化学能与热能》基础检测试题(Word版含解析)
2017级高考一轮复习《化学能与热能》基础过关试题(测试时间:50分钟 满分:100分)一、判断正误:正确的打“√”,错误的打“×”。
每小题1分,共10分。
(1)酒精可用作燃料,说明酒精燃烧是放热反应( √ )(2)随着科技的发展,氢气将成为主要能源之一( √ )(3)催化剂的使用可以降低反应的活化能,加快反应速率,但焓变ΔH 不改变。
( √ )(4)S(s)+32O 2(g)===SO 3(g) ΔH =-315 kJ·mol -1(燃烧热) (ΔH 的数值正确)( × ) (5)NaHCO 3+H 2储氢释氢HCOONa +H 2O 反应中,储氢、释氢过程均无能量变化。
( × )(6)葡萄糖的燃烧热是2 800 kJ·mol -1,则12C 6H 12O 6(s)+3O 2(g)===3CO 2(g)+3H 2O(l) ΔH =-1 400 kJ·mol -1( √ ) (7)已知稀溶液中,H +(aq)+OH -(aq)===H 2O(l) ΔH =-57.3 kJ·mol -1,则稀醋酸与稀氢氧化钠溶液反应生成1 mol 水时放出57.3 kJ 的热量( × )(8)CO(g)的燃烧热是283.0 kJ·mol -1,则2CO 2(g)===2CO(g)+O 2(g)反应的 ΔH =+2×283.0 kJ·mol -1( √ ) (9)已知:Fe 2O 3(s)+3C(石墨)===2Fe(s)+3CO(g) ΔH =489.0 kJ·mol -1 CO(g)+12O 2(g)===CO 2(g) ΔH =-283.0 kJ·mol -1 C(石墨)+O 2(g)===CO 2(g) ΔH =-393.5 kJ·mol -1 则4Fe(s)+3O 2(g)===2Fe 2O 3(s) ΔH =-1 641.0 kJ·mol -1( √ ) (10)500 ℃、300 MPa 下,将0.5 mol N 2和1.5 mol H 2置于密闭容器中充分反应生成NH 3(g),放热19.3 kJ ,其热化学方程式为N 2(g)+3H 2(g)2NH 3(g)ΔH =-38.6 kJ·mol -1( × )二、单项选择题:本题包括13小题,每小题4分,共52分。
化学能与热能新高考化学大一轮复习习题教学课件
________C_H_4_(_g_)+__2_O__2(_g_)=_=_=__C_O_2_(_g_)+__2_H_2_O__(l_) __Δ__H_=__-__8_9_0_.3__k_J·_m__o_l-_1___ (3)0.3 mol 乙硼烷(分子式 B2H6)在氧气中燃烧,生成固态三氧化二硼和
液态水,放出 649.5 kJ 的热量,则其热化学方程式为
_______B_2_H_6_(_g_)+__3_O__2(_g_)=_=_=__B_2_O_3_(s_)_+__3_H_2_O_(_l)___Δ_H_=__-__2__1_6_5_k_J_·m__o_l_-_1 __
化学能与热能新高考化学大一轮复习 习题课 件
解析:A 项,由能量—反应过程图像中状态Ⅰ和状态Ⅲ知,CO 和 O 生成 CO2 是放热反应,错误;B 项,由状态Ⅱ知,在 CO 与 O 生成 CO2 的过程中 CO 没有 断键形成 C 和 O,错误;C 项,由状态Ⅲ及 CO2 的结构式 O===C===O 知,CO2 分子中存在碳氧极性共价键,正确;D 项,由能量—反应过程图像中状态Ⅰ(CO 和 O)和状态Ⅲ(CO2)分析,状态Ⅰ→状态Ⅲ表示 CO 和 O 原子反应生成 CO2 的过 程,错误。
[重点提醒] 常见的放热反应和吸热反应
1.放热反应:①可燃物的燃烧;②酸碱中和反应;③大多数化合反应; ④金属跟酸的置换反应;⑤物质的缓慢氧化等。
2.吸热反应:①大多数分解反应;②盐的水解和弱电解质的电离; ③Ba(OH)2·8H2O 与 NH4Cl 反应;④碳和水蒸气、C 和 CO2 的反应等。
人教版高考化学一轮总复习课时分层练习-化学能与热能
化学能与热能一、选择题1.2019年6月5日是第48个世界环境日,下列有关环境和能源的说法不正确的是( )A.太阳能、地热能、生物质能和核聚变能均属于“新能源”B.“低碳”是指采用含碳量低的烃类作为燃料C.如图,甲烷经一氯甲烷生成低碳烯烃的途径体现了“节能减排”思想D.让煤变成合成气,把煤“吃干榨尽”,实现了煤的清洁、高效利用【解析】选B。
太阳能、地热能、生物质能和核聚变能是“新能源”,A项正确;“低碳”主要是指控制二氧化碳的排放量,B项错误;从题图分析,HCl循环利用,排出的水无污染,符合“节能减排”思想,C项正确;让煤变成合成气,能提高能源利用率,节能减排,D项正确。
2.(2019·浙江省学业水平考试)反应N2(g)+O2(g)2NO(g)的能量变化如图所示。
已知:断开1 mol N2(g)中化学键需吸收946 kJ能量,断开1 mol O2(g)中化学键需吸收498 kJ能量。
下列说法正确的是( )A.N2(g)+O2(g)2NO(g) ΔH=-180 kJ·mol-1B.NO(g)N2(g)+O2(g)ΔH=+90 kJ·mol-1C.断开1 mol NO(g)中化学键需要吸收632 kJ能量D.形成1 mol NO(g)中化学键可释放90 kJ能量【解析】选C。
A项该反应为吸热反应,N2(g)+O2(g)2NO(g) ΔH=+180 kJ·mol-1,故A错误;B项正反应为吸热反应,逆反应则为放热反应,则NO(g)N2(g)+O2(g) ΔH=-90 kJ·mol-1,故B错误;C项反应热等于反应物键能之和减去生成物的键能之和,ΔH=[(946 kJ·mol-1+498 kJ·mol-1)-2×E(N-O)]= +180 kJ·mol-1,E(N- O)=632 kJ·mol-1,则断开1 mol NO(g)中化学键需要吸收632 kJ能量,故C正确;D错误。
1高三化学一轮复习测试专题《化学能与热能》含答案
绝密★启用前山东省济南市高新区新高三化学2019-2020学年一轮复习测试专题《化学能与热能》一、单选题(共20小题,每小题3.0分,共60分)1.已知2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1,则下列关于方程式2H2O(l)===2H2(g)+O2(g)的说法中正确的是()A.方程式中的化学计量数表示分子数B.该反应ΔH大于零C.该反应ΔH=-571.6 kJ·mol-1D.该反应可表示36 g水分解时的热效应2.美国迄今最大的太阳能发电站——德索托下一代太阳能中心正式投入使用,美国总统奥巴马亲临现场参观。
21世纪人类正由“化石能源时代”逐步向“多能源时代”过渡,下列不属于新能源的是()A.太阳能B.核能C.氢能D.电力3.含Ba(OH)217.1 g的稀溶液与足量稀盐酸反应,放出11.46 kJ热量,表示该反应中和热的化学方程式正确的是()A. Ba(OH)2(aq)+2HCl(aq)===BaCl2(aq)+2H2O(l)ΔH=-114.6 kJ·mol-1B . Ba(OH)2(aq)+2HCl(aq)===BaCl 2(aq)+2H 2O(l) ΔH =114.6 kJ·mol -1C .12Ba(OH)2(aq)+HCl(aq)===12BaCl 2(aq)+H 2O(l) ΔH =-57.3 kJ·mol -1D .12Ba(OH)2(aq)+HCl(aq)===12BaCl 2(aq)+H 2O(l) ΔH =57.3 kJ·mol -14.在密闭容器中充入4 mol SO 2和3 mol O 2,一定条件下建立平衡2SO 2(g)+O 2(g)2SO 3(g)ΔH =-Q kJ·mol -1,测得SO 2的转化率为90%,则在此条件下,反应放出的热量为( ) A . 1.8Q kJ B . 2Q kJ C .Q kJ D . 0.9Q kJ5.下列说法不正确的是( )A . 物质发生化学反应的反应热仅指反应放出的热量B . 热化学方程式中各物质的化学计量数只表示物质的量,不表示分子的个数C . 所有的燃烧反应都是放热的D . 热化学方程式中,化学式前面的化学计量数可以是分数6.各物质能量变化关系如图所示,则下列热化学方程式正确的是( )A . C(金刚石,s)+O 2(g)===CO 2(g) ΔH 1=a kJ·mol -1(a <0)B . C(石墨,s)+O 2(g)===CO 2(g) ΔH 2=b kJ·mol -1(b >0)C . C +O 2===CO 2(g) ΔH 3=c kJ·mol -1(c <0)D. C(金刚石,s)===C(石墨,s)ΔH4=d kJ·mol-1(d>0)7.下列对H2(g)+Cl2(g)===2HCl(g)ΔH(298 K)=-184.6 kJ·mol-1的叙述正确的是()A. 1分子H2和Cl2反应,放出热量184.6 kJB. 1 mol H2(g)完全反应生成2 mol HCl(g),放出的热量为184.6 kJC.在101 kPa、25 ℃的条件下,1 mol H2(g)和1 mol Cl2(g)完全反应生成2 mol HCl(g)放出的热量为184.6 kJD.在101 kPa、25 ℃的条件下,1 mol H2(g)和1 mol Cl2(g)完全反应生成2 mol HCl(g)吸收的热量为184.6 kJ8.国际能源网报道:金属燃料可能成为新能源,可能带来结束化石能源时代的希望,是一种理想的储能方式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
教育资料 教育资料(一) 第17讲 化学能与热能
A组 基础题组 1.(2017北京朝阳期中,8)联氨(N2H4)是一种应用广泛的化工原料,可用作火箭燃料。已知: ①N2H4(l)+1/2N2O4(l) 3/2N2(g)+2H2O(l) ΔH=-546.45 kJ/mol ②H2O(g) H2O(l) ΔH=-44.0 kJ/mol 则2N2H4(l)+N2O4(l) 3N2(g)+4H2O(g)的ΔH是( ) A.-916.9 kJ/mol B.-458.45 kJ/mol C.+916.9 kJ/mol D.+458.45 kJ/mol 2.(2017北京西城期末,6)2SO2(g)+O2(g) 2SO3(g) ΔH=a kJ·mol-1,反应过程中的能量变化如图所示。下列说法中,不正确...的是 ( )
A.a<0 B.过程Ⅱ可能使用了催化剂 C.使用催化剂可以提高SO2的平衡转化率 D.反应物断键吸收能量之和小于生成物成键释放能量之和 3.(2018北京西城期末)下列属于吸热反应的是( ) A.氧化钙与水反应 B.铁丝在氧气中燃烧 C.NaOH溶液与盐酸反应 D.Ba(OH)2·8H2O晶体与NH4Cl晶体反应 4.(2017北京海淀期中,8)已知:2H2O2(l) 2H2O(l)+O2(g) ΔH=-98 kJ·mol-1。在含少量I-的溶液中,H2O2
的分解过程为:
ⅰ.H2O2(l)+I-(aq) H2O(l)+IO-(aq) ΔH1 ⅱ.H2O2(l)+IO-(aq) H2O(l)+O2(g)+I-(aq) ΔH2 下列说法不正确的是( ) A.ΔH1+ΔH2=ΔH B.I-是H2O2分解反应的催化剂 教育资料 教育资料(一) C.欲分解2 mol H2O2(l),至少需要提供98 kJ的热量
D.若生成1 mol O2,则反应ⅱ转移电子的物质的量为2 mol 5.(2017北京房山一模,9)处理燃烧产生的烟道气CO和SO2,方法之一是在一定条件下将其催化转化为CO2和S。 已知:①2CO(g)+O2(g) 2CO2(g) ΔH=-566.0 kJ/mol ②S(s)+O2(g) SO2(g) ΔH=-296.0 kJ/mol 下列说法中正确的是( ) A.转化①有利于碳参与自然界的元素循环 B.转化②中S和O2属于不同的核素 C.可用澄清的石灰水鉴别CO2与SO2 D.转化的热化学方程式是:2CO(g)+SO2(g) S(s)+2CO2(g) ΔH=+270 kJ/mol 6.(2017北京丰台期末,8)工业上可以利用水煤气(H2、CO)合成二甲醚(CH3OCH3),同时生成CO2。 2H2(g)+CO(g) CH3OH(g) ΔH=-91.8 kJ/mol 2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ/mol CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.3 kJ/mol 下列说法不正确...的是( )
A.二甲醚与乙醇互为同分异构体 B.CH3OCH3中只含有极性共价键 C.CH3OH和乙醇均可发生消去反应 D.水煤气合成二甲醚的热化学方程式为3H2(g)+3CO(g) CH3OCH3 (g)+CO2(g) ΔH=-248.4 kJ/mol 7.(2017北京朝阳二模,11)NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如左下图;研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如右下图。
下列说法正确的是( ) A.NH3催化还原NO为吸热反应 B.过程Ⅰ中NH3断裂非极性键 C.过程Ⅱ中NO为氧化剂,Fe2+为还原剂
D.脱硝的总反应为:4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g) 8.(2018北京海淀期末)已知:H2(g)+Cl2(g)2HCl(g)反应的能量变化示意图如下: 教育资料 教育资料(一) 下列说法正确的是( ) A.点燃条件和光照条件下,反应的ΔH不同 B.反应的ΔH约为[2c-(a+b)] kJ/mol C.“假想的中间物质”的总能量低于起始态H2和Cl2的总能量 D.反应涉及的物质中,既有含极性键的物质,也有含非极性键的物质
B组 提升题组 9.(2015北京理综,9)最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列说法正确的是( ) A.CO和O生成CO2是吸热反应 B.在该过程中,CO断键形成C和O C.CO和O生成了具有极性共价键的CO2 D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 10.(2017北京东城一模,26)半水煤气是工业合成氨的原料气,其主要成分为H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
H2、CO、CO2、N2、H2O(g)H2、N2、CO2H2、N2 (1)步骤Ⅰ,CO变换反应的能量变化如下图所示:
①CO变换反应的热化学方程式是 。 教育资料
教育资料(一) ②一定条件下,向体积固定的密闭容器中充入a L半水煤气,发生CO变换反应。测得不同温度(T1、T2)下氢气
的体积分数φ(H2)与时间的关系如下图所示。
ⅰ.T1、T2的大小关系及判断理由是 。 ⅱ.请在上图中画出其他条件相同时,起始充入0.5a L半水煤气,T2温度下氢气的体积分数φ(H2)随时间的变化曲线。 (2)步骤Ⅱ,用饱和Na2CO3溶液作吸收剂脱除CO2时,初期无明显现象,后期有固体析出。 ①溶液中离子浓度关系正确的是 (选填字母)。
a.吸收前:c(Na+)>c(C)>c(OH-)>c(HC) b.吸收初期:2c(C)+2c(HC)+2c(H2CO3)=c(Na+) c.吸收全进程:c(Na+)+c(H+)=2c(C)+c(HC)+c(OH-) ②后期析出固体的成分及析出固体的原因是 。 ③当吸收剂失效时,请写出一种可使其再生的方法(用化学方程式表示): 。 11.从古至今,铁及其化合物在人类生产、生活中的作用发生了巨大变化。 (1)古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是 (填字母序号)。 a.Fe b.FeO c.Fe3O4 d.Fe2O3 (2)现代利用铁的氧化物循环裂解水制氢气的过程如下图所示。整个过程与温度密切相关,当温度低于570 ℃时,Fe3O4(s)和CO(g)反应得到的产物是Fe(s)和CO2(g),阻碍循环反应的进行。
①已知:Fe3O4(s)+CO(g) 3FeO(s)+CO2(g) ΔH1=+19.3 kJ·mol-1 3FeO(s)+H2O(g) Fe3O4(s)+H2(g) ΔH2=-57.2 kJ·mol-1 C(s)+CO2(g) 2CO(g) ΔH3=+172.4 kJ·mol-1 铁的氧化物循环裂解水制氢气的总反应的热化学方程式是 。 教育资料 教育资料(一) ②下图表示其他条件一定时,Fe3O4(s)和CO(g)反应达平衡时CO(g)的体积百分含量随温度的变化关系。
ⅰ.反应Fe3O4(s)+4CO(g) 3Fe(s)+4CO2(g)的ΔH 0(填“>”“<”或“=”),理由是 。 ⅱ.随温度升高,反应Fe3O4(s)+CO(g) 3FeO(s)+CO2(g)的平衡常数的变化趋势是 ;1 040 ℃时,该反应的化学平衡常数的数值是 。 (3)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:
复分解反应ⅱ的离子方程式是 。 ② 如今基于普鲁士蓝合成原理可检测食品中的CN-,方案如下:
若试纸变蓝,则证明食品中含有CN-,请解释检测时试纸中FeSO4的作
用: 。 教育资料
教育资料(一) 答案精解精析 A组 基础题组 1.A 根据盖斯定律,由2×①-4×②可得目标方程式,则ΔH=(-546.45 kJ/mol)×2+44.0 kJ/mol×4=-916.9 kJ/mol。 2.C A项,根据图像知,该反应中反应物的总能量高于生成物的总能量,属于放热反应,则a<0;B项,加入催化剂,能够降低反应的活化能,因此过程Ⅱ可能使用了催化剂;C项,使用催化剂,平衡不移动,不能提高SO2的平衡转化率;D项,该反应为放热反应,则反应物断键吸收能量之和小于生成物成键释放能量之和。 教育资料 教育资料(一) 3.D A项,氧化钙与水反应是放热反应;B项,铁丝在氧气中燃烧是放热反应;C项,氢氧化钠与盐酸发生中和反
应,属于放热反应;D项,Ba(OH)2·8H2O晶体与NH4Cl晶体反应是吸热反应。 4.C A项,由盖斯定律知,ΔH1+ΔH2=ΔH;B项,I-是H2O2分解反应的催化剂;C项,分解2 mol H2O2(l)放出98 kJ热量;D项,生成1 mol O2,反应ⅱ转移电子的物质的量为2 mol。 5.A B项,核素是指具有一定数目质子和一定数目中子的一种原子,转化②中S和O2属于单质,不是核素;C项,CO2与SO2都能使澄清石灰水变浑浊,不能用澄清石灰水鉴别;D项,利用盖斯定律,由反应①-反应②可得,2CO(g)+SO2(g) S(s)+2CO2 (g) ΔH=-270 kJ/mol。 6.C A项,二甲醚与乙醇的分子式相同,但结构不相同,互为同分异构体;B项,CH3OCH3中只含有C—H、C—O极性共价键;C项,CH3OH不能发生消去反应;D项,将已知热化学方程式依次编号为①、②、③,根据盖斯定律,由①×2+②+③得:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) ΔH=-248.4 kJ/mol。 7.D A项,由左图可知,反应物总能量高于生成物总能量,故NH3催化还原NO的反应为放热反应;B项,过程Ⅰ中NH3断裂的是N—H极性键;C项,过程Ⅱ中铁元素的化合价没有变,Fe2+不是还原剂;D项,分析反应的过程,可
以得出总反应为:4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g)。 8.D A项,ΔH与反应条件无关,故点燃条件和光照条件下,反应的ΔH相同;B项,依据反应热的计算方法知,该反应的ΔH约为(a+b-2c) kJ/mol;C项,由于旧键断裂吸热,新键形成放热,所以“假想的中间物质”的总能量高于起始状态H2和Cl2的总能量;D项,反应涉及的物质中,H2和Cl2都含有非极性共价键,HCl含有极性共价键。
B组 提升题组 9.C A项,CO和O生成CO2是放热反应;B项,观察反应过程的示意图知,该过程中,CO中的化学键没有断裂形成C和O;C项,CO和O生成的CO2分子中含有极性共价键;D项,状态Ⅰ→状态Ⅲ表示CO与O反应的过程。 10.答案 (1)①CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-36 kJ·mol-1 ②ⅰ.T2>T1;相同条件下,温度越高反应速率越快,达到化学平衡状态的时间越短
