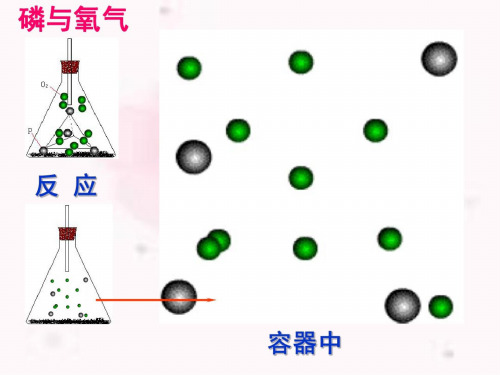
九年级化学磷与氧气
白磷与氧气反应

白磷与氧气反应白磷与氧气的反应是一种剧烈而火爆的化学反应。
白磷是一种黄白色的固体,具有毒性和高度易燃性,而氧气是空气中存在的气体。
当白磷与氧气接触时,会迅速发生化学反应,产生大量的热量和光亮。
这个反应过程被称为白磷燃烧。
白磷燃烧是一种氧化反应,它的化学方程式可以表示为P4 + 5O2 → 2P2O5。
在这个反应中,白磷和氧气发生了强烈的化学结合,生成了二氧化磷。
这个反应释放出的热量非常大,可以引燃周围的物质,产生明亮的火焰和浓烟。
白磷燃烧的火焰呈现出明亮的白色,非常耀眼。
它的燃烧温度非常高,可以达到1500摄氏度以上。
白磷燃烧时会发出剧烈的爆炸声,并产生大量的烟雾。
这些烟雾中含有许多有毒物质,对人体健康有害。
白磷燃烧不仅可以在空气中进行,还可以在水中进行。
当白磷与水接触时,也会发生剧烈的反应。
白磷会迅速被氧化成磷酸,生成大量的热量和磷酸氢根离子。
这个反应非常剧烈,会产生大量的气泡和烟雾。
白磷燃烧的反应速度非常快,燃烧过程中会释放出大量的能量。
这种能量释放的方式是通过化学键的断裂和形成。
在白磷分子中,有四个磷原子相互连接,形成一个环状结构。
当白磷与氧气反应时,这些磷原子会与氧原子发生化学结合,形成更稳定的化合物。
白磷与氧气反应的结果是生成二氧化磷。
这是一种无色的化合物,具有强烈的刺激性气味。
它是一种强酸,可以与水反应生成磷酸。
磷酸是一种常见的无机化合物,广泛应用于农业和化工工业中。
白磷与氧气的反应是一种剧烈而火爆的化学反应。
它的燃烧温度很高,产生的火焰明亮而耀眼。
白磷燃烧时会产生大量的烟雾和有毒物质,对人体健康有害。
因此,在进行白磷实验或处理白磷时,必须采取严格的安全措施,以防止意外事故的发生。
白磷与氧气反应的化学方程式

白磷与氧气反应的化学方程式白磷是一种非常特殊的元素,可以与氧气发生剧烈的化学反应。
这种反应可以用以下化学方程式表示:P4 + 5O2 → 2P2O5在这个方程式中,白磷(P4)与氧气(O2)反应生成了五氧化二磷(P2O5)。
这个反应是一种氧化反应,也被称为燃烧反应。
这个方程式简洁明了地展示了反应物和生成物的种类和数量。
白磷与氧气的反应非常激烈,产生了大量光和热能。
当白磷暴露在空气中时,它会发出绿白色的烟雾,这是因为白磷分子结构中的P4四面体形状被氧气中的氧分子破坏,形成了更稳定的分子P2O5。
这个过程非常迅速,因此我们通常看到的是一闪而过的火焰。
白磷与氧气反应的热和光能量释放是巨大的,因此它被广泛应用于火药和炸药的制造中。
火药是由白磷、硝酸盐和石碱(例如木炭)组成的混合物,白磷作为氧化剂发挥着重要的作用。
当白磷与氧气接触时,它释放出的能量优势能够迅速引燃其他可燃物质,形成爆炸。
除了火药和炸药,白磷与氧气反应还在其他领域中发挥着重要作用。
例如,它被广泛用作制造草酸、磷酸和无机磷肥的原料。
在制造这些化学物质的过程中,白磷与氧气反应生成的五氧化二磷是重要的中间产物。
然而,白磷与氧气反应也带来了一些危险性。
由于这个反应释放出大量的热和光能量,在不恰当的条件下可能导致火灾和爆炸。
因此,在处理白磷时必须采取严格的安全措施,例如使用防火设备、确保通风和遵循正确的操作规程。
总而言之,白磷与氧气反应是一种充满活力和激烈的化学反应。
通过这种反应,白磷释放出大量热和光能量,可以用于制造火药、炸药和其他化学品。
但同时,由于反应的强烈性质,我们必须对其进行谨慎处理,并确保安全操作,以避免危险事件的发生。
磷在空气中燃烧的化学方程式

磷在空气中燃烧的化学方程式磷是一种非金属元素,其在空气中可以燃烧产生氧化物。
磷的燃烧是通过与空气中的氧气反应发生的化学反应。
磷的燃烧可以分为两个阶段,分别是初始点燃和继续燃烧。
在初始点燃阶段,磷与空气中的氧气反应产生磷的氧化物,同时释放出能量。
在继续燃烧阶段,磷的氧化物继续与空气中的氧气反应,形成更高级的氧化物。
磷的燃烧化学方程式可以被表示为以下两个反应:1.初始点燃反应:4P+5O2->2P2O5在这个反应中,四个磷原子与五个氧气分子反应,生成两个磷的氧化物分子,即二氧化磷(P2O5)。
这个反应释放出大量的能量,磷开始燃烧,产生火焰和烟雾。
2.继续燃烧反应:4P2O5+O2->4P2O3在这个反应中,四个二氧化磷分子与一个氧气分子反应,生成四个三氧化磷分子(P2O3)。
三氧化磷是一种高级氧化物,其形成过程伴随着更多的能量释放。
这个反应是燃烧过程的继续,并且可以持续进行下去,直到磷完全燃烧殆尽。
需要注意的是,这里的化学方程式仅仅是简化的表示,并没有考虑到反应的累积效应和速率。
实际上,磷的燃烧过程是一个复杂的反应链,涉及到多个中间产物和反应步骤。
此外,磷的燃烧过程还会产生大量的烟雾和火焰。
磷燃烧时释放出的氧化磷在空气中与水蒸气反应形成液态磷酸,而液态磷酸在空气中迅速蒸发形成白色烟雾。
火焰的颜色通常是白色或淡黄色,与磷的燃烧产生的光谱特性有关。
总的来说,磷在空气中的燃烧是一种剧烈而有趣的化学反应。
通过分析磷的燃烧化学方程式,我们可以更好地了解磷燃烧的过程及其相关的能量变化。
磷与氧气反应

磷与氧气反应
磷是一种十分活跃的元素,它和氧气反应可以产生各种有趣的化学反应。
当磷接触到氧气时,它会产生一种叫做磷酸的化合物,这种化合物会放出热量,并产生一种白色的烟雾。
磷和氧气反应还可以产生一种叫做磷酸钠的化合物,它是一种白色的固体,具有腐蚀性。
当磷和氧气反应时,还会产生一种叫做磷酸铵的化合物,它是一种淡黄色的固体,具有抗菌性。
综上所述,磷和氧气反应可以产生多种有趣的化学反应,这些反应产生的化合物具有不同的性质,可以用来制造各种有用的物质。
九年级化学磷与氧气_1260
克声、嗑瓜子声、小孩子的哭闹声、售货员的叫卖声,都是平凡岁月里的静时光。而我,爱极了窗外流窜的风景,远去的树木,远去的风车,远去的荒山,还有越走越远的家乡。
今天被疫情困了一个春天的人们,大概也在心里爱死了那些与陌生人亲密接触的乱时光。就连火车晚点,大概也是可以愉快等待的事情了吧?
朱自清的背影,对于父子、橘子、车站的描写,深度刻画了民国时期一个普通父亲深邃含蓄又伟大的爱。由此,南京浦口火车站,也被后人深深的车拥挤,站票比坐票还要多。过道里的大包裹,重行李,蛇皮袋子,横扫通道,你要想泡个面,去个厕所,那是要费上一番功夫的。糟糕的是,当你跨过千山万水,走 到车厢尾的时候,才发现,厕所已经被人群攻陷。
多少年来,这样简朴的列车,就是这样来来往往地送了一程又一程的人们。无论你到哪里去,无论你从哪里来,总会在这里停留,看也许当时,你厌弃的风景,听当时你也许烦心的吵嚷声。
磷和氧气反应的化学现象

磷和氧气反应的化学现象哎呀,你知道吗?磷和氧气反应,那可真是一场奇妙的“魔法秀”!有一天,在化学实验室里,老师给我们演示了磷和氧气反应的实验。
我和小伙伴们都瞪大了眼睛,好奇得不得了。
老师先拿出了一小瓶红磷,那红磷看起来就像红色的小颗粒,安静地躺在瓶子里。
接着,老师又准备好了一个氧气瓶,里面装满了让磷能“兴奋起来”的氧气。
当老师把红磷放在燃烧匙里,然后在酒精灯上加热,哇塞!那红磷一下子就“着魔”了,开始冒出白白的烟,就像一个神秘的小精灵在施展魔法,这烟雾缭绕的,难道不像神话故事里的仙境吗?然后,老师把燃烧着的红磷迅速伸进氧气瓶中,“呼”的一下,那火变得更旺啦,发出了黄白色的光,亮堂堂的,把整个实验室都照得好像白天一样!而且呀,那产生的白烟就像冬天的雪花一样,纷纷扬扬地飘洒着。
这场景,难道不比放烟花还精彩吗?这时候,我旁边的小明忍不住叫了起来:“哇,太神奇啦!这是怎么回事呀?”老师笑着说:“这就是磷和氧气在发生化学反应呢!”我心里想,这化学反应就像是两个好朋友,一见面就激动得不行,然后紧紧地拥抱在一起,发生了巨大的变化。
再看看周围的同学们,一个个都看得目瞪口呆,嘴巴张得大大的,眼睛里满是惊讶和好奇。
小红还不停地问老师:“老师,那这些烟到底是什么呀?”老师耐心地解释说:“这烟是生成的五氧化二磷小颗粒哦。
”你想想看,磷就像是一个调皮的孩子,平时乖乖的,一遇到氧气这个“小伙伴”,就立刻变得活泼起来,又是发光又是冒烟的。
这不就跟我们在学校里,平时安安静静的,一到体育课就撒欢儿跑闹一样嘛!经过这次实验,我算是彻底记住了磷和氧气反应的化学现象。
这奇妙的化学世界,就像一个充满惊喜的大宝藏,等着我们去不断挖掘和探索。
我觉得呀,化学真是太有趣啦,每次的实验都能让我们看到不一样的神奇变化,难道你不这么认为吗?。
红磷和氧气的化学方程式
红磷和氧气的化学方程式红磷和氧气的化学方程式可以表示为P4 + 5O2 → 2P2O5。
红磷是一种固体物质,呈现出红棕色,是磷的一种同素异形体。
红磷的分子式为P4,其中有4个磷原子组成一个环状分子。
红磷相对于白磷来说比较稳定,在室温下不会自燃。
它主要用于制造磷酸盐肥料、农药、合成有机化合物等。
氧气是一种无色、无味、无臭的气体,化学式为O2。
它是地球大气中最常见的元素之一,占空气总体积的约20.95%。
氧气是生命活动所必需的,用于细胞呼吸和能量产生。
红磷和氧气在一定条件下可以发生化学反应,生成磷酸五氧化二磷(P2O5)。
这个反应是一个氧化反应,红磷被氧气氧化成了更高氧化态的磷。
红磷和氧气反应的化学方程式为P4 + 5O2 → 2P2O5。
在这个方程式中,P4表示红磷的分子,5O2表示5个氧气分子,2P2O5表示2个磷酸五氧化二磷分子。
这个方程式表明,在反应中,每4个红磷分子需要5个氧气分子参与反应,最终生成2个磷酸五氧化二磷分子。
从化学式可以看出,红磷和氧气的摩尔比为4:5,生成的磷酸五氧化二磷的摩尔比为2:1。
红磷和氧气的反应是一个放热反应,释放出大量的热能。
这是因为红磷和氧气之间的化学键较弱,而生成的磷酸五氧化二磷有更强的化学键,能够释放出能量。
红磷和氧气的反应速度较慢,在常温下需要外部能量的引入才能发生。
一旦反应开始,它会迅速放出热能,产生火焰,并且会继续自我加热,形成自燃的现象。
因此,红磷在储存和运输时需要注意防火防爆措施。
磷酸五氧化二磷是一种固体物质,呈白色结晶状。
它是一种强酸性氧化物,可以与水反应生成磷酸(H3PO4)。
磷酸五氧化二磷主要用于制造无机磷肥、磷酸盐、草木灰等。
此外,它还可以用作脱水剂、吸湿剂、催化剂等。
总结一下,红磷和氧气的化学方程式为P4 + 5O2 → 2P2O5。
这是一个氧化反应,红磷被氧气氧化成了磷酸五氧化二磷。
这个反应放出大量的热能,是一个放热反应。
磷酸五氧化二磷是一种固体物质,具有多种应用。
红磷燃烧实验原理
红磷燃烧实验原理红磷燃烧实验是一种常见的化学实验,其原理是红磷与氧气发生化学反应,产生磷酸根离子并放出大量的热能。
下面我将详细介绍红磷燃烧实验的原理。
红磷是一种固体物质,化学式为P4,它的分子由四个磷原子组成。
在常温下,红磷相对稳定,不会自然燃烧。
但当加热红磷或者用火柴点燃时,它能够和空气中的氧气发生反应。
当红磷与氧气发生反应时,会生成磷酸根离子(PO4 3-)和一定的热能。
化学反应的反应方程式如下:P4 + 5O2 →P4O10 + ΔH当红磷燃烧时,磷原子先通过与周围空气中的氧气分子发生反应,生成了P4O6和P4O10两种不同的氧化物。
这两种氧化物与空气中的水蒸气反应,生成磷酸(H3PO4)。
这个过程中的总反应方程式如下:P4 + 10O2 + 6H2O →4H3PO4红磷燃烧的反应过程是一个放热反应,即放出大量的热能。
这是因为红磷在与氧气反应时,强烈氧化,氧化过程是一个放热反应。
燃烧过程中,磷的氧化态由+4转变为+5,每个磷原子需要与5个氧气分子结合形成两个不同的氧化物P4O6和P4O10。
红磷燃烧实验的过程如下:首先,将一定质量的红磷放置在适当的容器中,使用火柴点燃红磷。
起初,红磷开始燃烧,产生一道明亮的明火,火焰有时会呈现绿色或紫色。
在红磷燃烧的过程中,磷酸根离子释放出白烟,并且放出大量的热能,容器的温度也会明显升高。
在实验过程中,我们可以通过一些现象来观察和分析红磷燃烧的特点。
首先,红磷燃烧火焰很亮,但时间很短暂。
这是因为红磷的燃烧速度相对较快,因此燃烧过程也比较迅速。
其次,在实验过程中产生了大量的白色烟雾,这是磷酸根离子与空气中的水蒸气反应产生的。
最后,我们可以通过观察容器的温度变化来判断红磷燃烧的放热性质。
实验中,可以使用温度计等工具来测量容器的温度变化,可以发现燃烧过程中容器会显著升温。
红磷燃烧实验的原理是红磷与氧气反应,释放出大量的热能。
这种实验常用于教育实验室和化学教学中,可以帮助学生理解化学反应、热能释放等基本概念。
磷在空气和氧气中燃烧的实验现象
磷在空气和氧气中燃烧的实验现象磷是一种常见的化学元素,广泛应用于农业、医药和工业领域。
在化学实验中,引起了科学家们的广泛关注。
通过对磷在不同条件下燃烧的实验研究,可以深入了解磷的化学性质以及燃烧反应的机制。
磷在空气中燃烧时,会产生一种刺鼻的气味,并且放出明亮的火焰。
这些观察结果表明磷在空气中燃烧时会发生剧烈的化学反应,产生大量的热能和光能。
磷在氧气中燃烧时也会呈现类似的现象,但反应更为剧烈,火焰更为明亮。
实验结果表明,磷在氧气中的燃烧速度比在空气中更快,热量释放更为剧烈。
磷在空气和氧气中燃烧的实验现象揭示了磷的化学性质和燃烧反应的特点。
磷是一种活泼的化学元素,容易发生化学反应。
在燃烧过程中,磷与空气或氧气中的氧气发生氧化反应,生成氧化磷的化合物。
这种化合物在燃烧过程中会释放大量的热能和光能,形成火焰并产生烟雾。
磷在空气和氧气中燃烧的实验现象不仅仅是一种视觉上的现象,背后蕴含着丰富的化学知识。
研究人员可以通过分析燃烧反应的速率、产物和特性,深入了解磷和氧气之间的化学反应机制。
通过实验数据的分析和比较,科学家们可以推断磷在不同条件下的燃烧特点,为磷的应用和燃烧反应提供重要参考。
磷在空气和氧气中燃烧的实验现象还揭示了燃烧反应对环境和生命的影响。
磷燃烧释放的热量和烟雾会对周围环境产生一定的影响,可能导致空气污染和健康问题。
因此,在进行磷燃烧实验时,科学家们需采取相应的防护措施,减少对环境和人体的危害。
通过对磷在空气和氧气中燃烧的实验现象的深入研究,可以更好地了解磷的化学性质和燃烧反应的机理。
这不仅为磷的应用提供了重要参考,也有助于人们更好地认识和利用磷这种重要的化学元素。
希望未来能有更多的科研人员投入到磷燃烧实验的研究中,探索更多有关磷的化学奥秘。
白磷与氧气反应的化学方程式(二)
白磷与氧气反应的化学方程式(二)白磷与氧气反应的化学方程式1. 白磷与氧气反应的公式白磷(化学式:P4)与氧气(化学式:O2)发生反应,生成五氧化二磷(化学式:P4O10):P4 + 5O2 → P4O102. 反应过程解释在这个反应中,白磷和氧气发生氧化还原反应,白磷被氧气氧化形成五氧化二磷。
具体解释如下:1.白磷分子(P4)由四个磷原子组成,每个磷原子都共享三对电子。
这使得白磷相对不稳定,在空气中容易被氧气引燃。
2.氧气分子(O2)由两个氧原子组成,每个氧原子都共享两对电子。
3.在反应中,氧气中的氧原子与白磷中的磷原子发生氧化还原反应。
氧原子从白磷中夺取电子,使其氧化为磷的正离子,同时自身被还原为氧化物。
4.反应产物为五氧化二磷(P4O10),它由四个磷原子和十个氧原子组成,呈白色结晶状。
3. 示例说明示例一:假设有10克的白磷与足够的氧气发生反应,求反应后生成的五氧化二磷的质量。
根据化学方程式,1 mol的白磷反应生成1 mol的五氧化二磷。
白磷的摩尔质量为 g/mol,五氧化二磷的摩尔质量为 g/mol。
首先计算白磷的摩尔数:10 g / ( g/mol) = mol。
由于反应中1 mol的白磷生成1 mol的五氧化二磷,所以生成的五氧化二磷的摩尔数也为 mol。
然后计算五氧化二磷的质量: mol * ( g/mol) = g(保留三位小数)。
因此,10克的白磷与足够的氧气反应后,生成大约克的五氧化二磷。
示例二:当白磷燃烧时,会生成白磷烟。
该烟中主要含有氧化的磷化合物、五氧化二磷和其他燃烧产物。
化学方程式中的反应示例:P4 + 5O2 → P4O10这个方程式描述了理论上的反应,并没有详细考虑其他可能的副产物。
结论白磷与氧气的反应生成五氧化二磷的化学方程式为P4 + 5O2 → P4O10。
这个方程式描述了白磷被氧气氧化形成五氧化二磷的过程。
在实际应用中,白磷与氧气反应通常会生成其他副产物,例如白磷烟。
