常见的酸碱指示剂-P
第六节 酸碱指示剂

酸碱指示剂(p206)
一、指示剂的作用原理
酸碱滴定过程中,酸碱本身不发生任何外观
的变化,故常借助酸碱指示剂的颜色变化来指示
滴定的计量点。酸碱指示剂自身是弱的有机酸或
有机碱,其共轭酸碱对具有不同的结构,且颜色
不同。当溶液的pH值改变时,共轭酸碱对相互
发生转变、从而引起溶液的颜色发生变化。
例如:酚酞
式中:KHIn为指示剂的解离常数,简称指示剂常数; [In-]和[HIn]分别为指示剂的碱式色和酸式色 的浓度。
碱式色 酸式色
[In ] K HIn [HIn] [H ]
由上式可知,溶液的颜色是由[In-]/[HIn]的比值 来决定的,而此比值又与[H+]和及KHIn有关。 在一定温度下,KHIn是一个常数,比值[In-]/[HIn] 仅为[H+]的函数,当[H+]发生改变,[In-]/[HIn]比值随 之发生改变,溶液的颜色也逐渐发生改变。
(2) 当 ≥ 即 [In-] ≥10[HIn] 时,
pH ≥ pKa +1,观察到的是指示剂的碱式色; (3) 10> > 时,
pH= pKa 1观察到的是混合色,
人眼一般难以辨别 。
2. pH的理论变色点
当指示剂的[In-]=[HIn]时,则pH= pKHIn,人们称此pH值为指示剂的理论变
(3) 各种指示剂的变色范围幅度各有不同,但 一般不大于2个pH单位,不小于1个pH单位, 多数为1.6~1.8 pH单位。
1. 人眼对颜色的辨别
需要指出的是,不是 比值任何微小的
改变都能使人观察到溶液颜色的变化,因为
人眼辨别颜色的能力是有限的。
一般来说,若指示剂的酸色型与碱色型 浓度相差10倍后,就只能看到浓度大的那种 型色。
(完整版)常见指示剂的变色范围
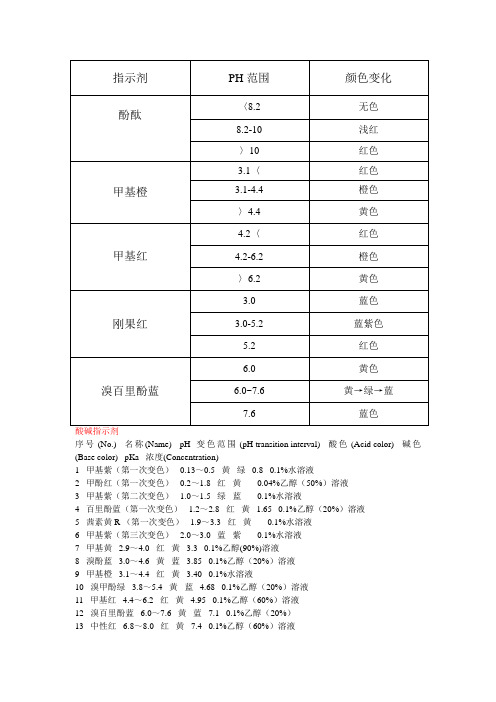
序号 (No.) 名称(Name) pH变色范围 (pH transition interval) 酸色 (Acid color) 碱色(Base color) pKa 浓度(Concentration)1 甲基紫(第一次变色)0.13~0.5 黄绿0.8 0.1%水溶液2 甲酚红(第一次变色)0.2~1.8 红黄- 0.04%乙醇(50%)溶液3 甲基紫(第二次变色) 1.0~1.5 绿蓝- 0.1%水溶液4 百里酚蓝(第一次变色) 1.2~2.8 红黄 1.65 0.1%乙醇(20%)溶液5 茜素黄R (第一次变色) 1.9~3.3 红黄- 0.1%水溶液6 甲基紫(第三次变色) 2.0~3.0 蓝紫- 0.1%水溶液7 甲基黄 2.9~4.0 红黄 3.3 0.1%乙醇(90%)溶液8 溴酚蓝 3.0~4.6 黄蓝 3.85 0.1%乙醇(20%)溶液9 甲基橙 3.1~4.4 红黄 3.40 0.1%水溶液10 溴甲酚绿 3.8~5.4 黄蓝 4.68 0.1%乙醇(20%)溶液11 甲基红 4.4~6.2 红黄 4.95 0.1%乙醇(60%)溶液12 溴百里酚蓝 6.0~7.6 黄蓝7.1 0.1%乙醇(20%)13 中性红 6.8~8.0 红黄7.4 0.1%乙醇(60%)溶液14 酚红 6.8~8.0 黄红7.9 0.1%乙醇(20%)溶液15 甲酚红(第二次变色)7.2~8.8 黄红8.2 0.04%乙醇(50%)溶液16 百里酚蓝(第二次变色)8.0~9.6 黄蓝8.9 0.1%乙醇(20%)溶液17 酚酞8.2~10.0 无色紫红9.4 0.1%乙醇(60%)溶液18 百里酚酞9.4~10.6 无色蓝10.0 0.1%乙醇(90%)溶液19 茜素黄R (第二次变色)10.1~12.1 黄紫11.16 0.1%水溶液20 靛胭脂红11.6~14.0 蓝黄12.2 25%乙醇(50%)溶液混合酸碱指示剂序号 (No.) 指示剂名称(Indicator name) 浓度 (Concentration) 组成 (Constitution) 变色点pH(Transition point pH) 酸色 (Acid color) 碱色(Base color)1 甲基黄0.1%乙醇溶液1:1 3.28 蓝紫绿亚甲基蓝0.1%乙醇溶液2 甲基橙0.1%水溶液1:1 4.3 紫绿苯胺蓝0.1%水溶液3 溴甲酚绿0.1%乙醇溶液3:1 5.1 酒红绿甲基红0.2%乙醇溶液4 溴甲酚绿钠盐0.1%水溶液1:1 6.1 黄绿蓝紫氯酚红钠盐0.1%水溶液5 中性红0.1%乙醇溶液1:1 7.0 蓝紫绿亚甲基蓝0.1%乙醇溶液6 中性红0.1%乙醇溶液1:1 7.2 玫瑰绿溴百里酚蓝0.1%乙醇溶液7 甲酚红钠盐0.1%水溶液1:3 8.3 黄紫百里酚蓝钠盐0.1%水溶液8 酚酞0.1%乙醇溶液1:2 8.9 绿紫甲基绿0.1%乙醇溶液9 酚酞0.1%乙醇溶液1:1 9.9 无色紫百里酚酞0.1%乙醇溶液10 百里酚酞0.1%乙醇溶液2:1 10.2 黄绿茜素黄0.1%乙醇溶液注:混合酸碱指示剂要保存在深色瓶中。
酸碱指示剂

5.5.1 酸碱指示剂的作用原理及变色范围
5.5.2 影响指示剂变色范围的各种因素
5.5.3 混合指示剂
5.5.1 酸碱指示剂的作用原理及变色范围
酸碱指示剂一般是有机弱酸或有机弱碱,其共轭酸碱形 式具有明显不同的颜色。 甲基橙
H
+
(CH3)2 SO3OHN H+ pKa = 3.4 N N SO3-
指示剂理论变色范围 pH = p Ka± 1 指示剂理论变色点 pH = p Ka ,[In-] =[HIn]
注: 实际与理论的变色范围有差别,人眼对深色比浅色 灵敏。 指示剂的变色范围越窄,指示变色越敏锐。
理论变色பைடு நூலகம்围
Ö ¼ µ ý ·² Ï Ê
pKa1
[In ] 0.1 10 [HIn]
Ka
终点 提前
5.5.3 混合指示剂
作用原理
分类 颜色互补
两种指示剂混合
指示剂与染料混合
例:溴甲酚绿——甲基红 pH 0 2 4 6 8
甲基红 溴甲酚绿
溴甲酚绿—甲基红
理论变色点:pKa
1.0 0.8 0.6 0.4 0.2 0.0 0
HIn
In
2
4
6 pH
8
甲基橙指示剂的变色范围示意图
指 示 剂 变 色 范 围
指示剂 甲基橙 甲基红 酚酞
颜色 酸色 过渡 碱色 红 橙 黄 红 橙 黄 红 无色 粉红
pKa 3.4 5.2 9.1
变色范围 3.1~4.4 4.4~6.2 8.0~9.6
N (CH3)2
N
N
酚酞
HO C OH O
OHOH COOH+ pKa = 9.1 C
分析化学3-5酸碱指示剂

PP(酚酞) MR(甲 基红)
pKIn
变色点
3.4
3.4
9.1
9.1
5.2
5.2
变色范围 2.4 /4.4 8.1/10.1 4.2/6.2 变色点 4.0 9.0 5.0
变色范围 3.1/ 4.4 8.0/ 9.6 4.4/6.2
颜色变化
红 → 黄 无 → 红 红 →黄
三、影响酸碱指示剂变色范围的主要因素 1. 指示剂的用量 指示剂浓度↑ 指示剂用量↑ 色调变化不明显 消耗一些滴定剂
§3-5 酸碱指示剂
一、指示剂的作用原理
酸碱指示剂一般是有机弱酸或有机弱碱, 其共轭酸碱形式具有明显不同的颜色。
HIn
酸式
H In
碱式Biblioteka 甲基橙H N (CH3)2
+
(CH3)2 OH SO 3N H+ pKa = 3.4 N N
N
N
酚酞
HO OH OH C OH COO -
O
H+ p K a = 9.1
指示剂浓度:通常为0.1%溶液
指示剂用量:每10mL滴定液加1滴
2.温度的影响——对KHIn的影响 3.离子强度的影响——Ka与Kac的差别增大 4.溶剂的影响
四.混合指示剂
在酸碱滴定中,有时需将滴定 终点限制在很窄的pH范围内,这时可 采用混合指示剂。
1.种类: ①由两种或两种以上指示剂混合而成 a.混合指示剂 各自Ka值应接近 变色范围 相互重叠
b.混合指示剂酸式色和碱式色要互补, 没有中间色
溶液的酸度
溴甲酚绿
甲基红
溴甲酚绿
+甲基红
pH<4.0 pH=5.1 黄色 绿 红 橙 橙 灰
分析化学及实验:酸碱指示剂

(CH3)2N— —N=N— —SO3-
+ (CH3)2N=
OH- H+ pKa=3.4
H =N—N— —SO3-
红3.1-----4.0(橙)------4.4黄
PP()酚酞: • 结构
无色离子
红色离子
常用单一酸碱指示剂
3.1 4.4
MO 4.0 pT 4.4 6.2
MR
5.0 pT=pKa
8.0 9.6
• 指示剂与惰性染料混合:甲基橙(红-黄)+靛蓝二磺酸钠(蓝)(紫色 -黄绿色)
谢 谢 大 家!
例:
甲基橙
pKa 理论范围 实际范围 3.4 2.4~4.4 3.1~4.4
甲基红 5.1 4.1~6.1 4.4~6.2
酚酞
9.1 8.1~10.1 8.0~10.0
百里酚酞 10.0 9.0~11.0 9.4~10.6
• 变色范围:pH=pKa1
• 实际观察时与理论计算有一定的差距,一方面是人眼对各种颜色的敏感 度不同,颜色间互相影响;另一方面,指示剂的用量、温度、离子强度、 胶体的存在等因素对变色范围有一定的影响。
• P55表4-1中列出常用酸碱指示剂及其变色范围,可见:指示剂的变色范围 不恰好在pH=7,而随指示剂的KHIn而定,变色范围一般大于1pH单位和 小于2pH单位,变色范围内显示过渡色。
03
指示剂的用量
• 双色指示剂:
• 如MO,不影响指示剂变色范围,但指示剂用量多时颜色变化不明显,且 指示剂本身也消耗一些滴定剂,引起误差。
• 甲基橙(Methyl Orange,MO)
• 酚酞(Phenolpthalein,PP)
•
HIn
H+ + In-
1酸碱滴定法:碱度的测定
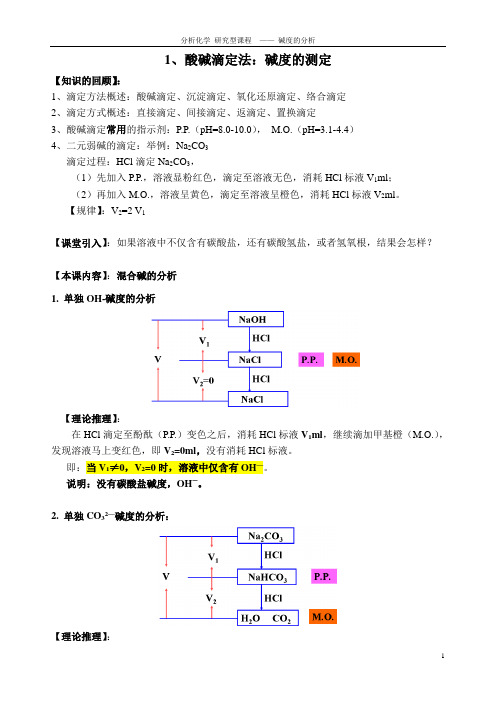
1、酸碱滴定法:碱度的测定【知识的回顾】:1、滴定方法概述:酸碱滴定、沉淀滴定、氧化还原滴定、络合滴定2、滴定方式概述:直接滴定、间接滴定、返滴定、置换滴定3、酸碱滴定常用的指示剂:P.P.(pH=8.0-10.0),M.O.(pH=3.1-4.4)4、二元弱碱的滴定:举例:Na2CO3滴定过程:HCl滴定Na2CO3,(1)先加入P.P.,溶液显粉红色,滴定至溶液无色,消耗HCl标液V1ml;(2)再加入M.O.,溶液呈黄色,滴定至溶液呈橙色,消耗HCl标液V2ml。
【规律】:V2=2 V1【课堂引入】:如果溶液中不仅含有碳酸盐,还有碳酸氢盐,或者氢氧根,结果会怎样?【本课内容】:混合碱的分析1. 单独OH-碱度的分析【理论推理】:在HCl滴定至酚酞(P.P.)变色之后,消耗HCl标液V1ml,继续滴加甲基橙(M.O.),发现溶液马上变红色,即V2=0ml,没有消耗HCl标液。
即:当V1≠0,V2=0时,溶液中仅含有OH—。
说明:没有碳酸盐碱度,OH—。
2. 单独CO32—碱度的分析:【理论推理】:在HCl滴定至酚酞(P.P.)变色之后,消耗HCl标液V1ml,继续滴加甲基橙(M.O.),滴定至溶液变红色,消耗HCl标液V2 ml,且V1=V2。
即:当V1=V2时,溶液中仅含有OH—。
说明:只有碳酸盐碱度,CO32—。
3. 单独HCO3—(重碳酸盐)碱度的分析:【理论推理】:向溶液中加入指示剂酚酞(P.P.),溶液不显粉红色,即消耗HCl标液V1=0ml,继续滴加甲基橙(M.O.),溶液呈现橙黄色,滴定至溶液变红色,消耗HCl标液V2 ml。
即:当V1=0,V2≠0时,溶液中仅含有HCO3—。
说明:只有碳酸盐碱度,HCO3—。
4. CO32—和HCO3—碱度的分析:【理论推理】:向溶液中加入指示剂酚酞(P.P.),溶液显粉红色,滴定至粉红色消失,消耗HCl标液V1ml,继续滴加甲基橙(M.O.),溶液呈现橙黄色,滴定至溶液变红色,消耗HCl标液V2 ml。
酸碱指示剂的酸碱度范围选择和溶液浓度
酸碱指示剂的酸碱度范围选择和溶液浓度酸碱指示剂是一种常用于酸碱滴定反应中的物质,它可以通过改变颜色来指示溶液的酸碱性质。
在进行滴定实验时,选择合适的酸碱指示剂是十分重要的,因为它能够准确地反映溶液的酸碱度范围和浓度。
本文将探讨酸碱指示剂的酸碱度范围选择和溶液浓度对实验结果的影响。
酸碱指示剂的酸碱度范围选择是根据其酸碱性质和PH范围来确定的。
常见的酸碱指示剂有苏丹红、溴酚蓝、甲基橙等,它们分别对应着酸性、中性和碱性溶液。
首先是苏丹红,它是一种酸性指示剂,可以将酸性溶液的颜色变为红色。
苏丹红的酸碱度范围为PH 0-3,因此适用于酸性溶液的滴定实验。
对于酸碱中性或碱性溶液,苏丹红的指示效果较差。
其次是溴酚蓝,它是一种中性指示剂,会使中性溶液的颜色变为蓝色。
溴酚蓝的酸碱度范围为PH 6.0-7.6,因此适用于中性溶液的滴定实验。
对于酸性或碱性溶液,溴酚蓝的指示效果较差。
最后是甲基橙,它是一种碱性指示剂,可以将碱性溶液的颜色变为橙色。
甲基橙的酸碱度范围为PH 3.1-4.4,因此适用于碱性溶液的滴定实验。
对于酸性或中性溶液,甲基橙的指示效果较差。
除了酸碱度范围的选择,溶液浓度也对酸碱指示剂的使用产生影响。
一般来说,指示剂在浓度较低的溶液中呈现出较明显的颜色变化,而在浓度较高的溶液中颜色变化较为模糊。
例如,在进行酸碱滴定实验时,如果溶液浓度过高,就会导致指示剂颜色变化不明显,难以准确判断等价点。
因此,在实验中应当尽可能使用相对较低浓度的溶液,以确保可观察到明显的颜色变化。
此外,酸碱指示剂的选择还应考虑其化学稳定性和溶解性。
指示剂应具有良好的稳定性,不易受到光、热或其他因素的影响而发生变化。
溶解性也是一个重要的考虑因素,以确保指示剂能够充分溶解在溶液中,不会出现沉淀现象。
综上所述,选择合适的酸碱指示剂对于酸碱滴定实验的准确性和可靠性至关重要。
在选择酸碱指示剂时,应根据需求确定所需的酸碱度范围,并考虑溶液的浓度、化学稳定性和溶解性等因素。
滴定分析-2
生成Ac-:0.1*19.98mmol
可用缓冲溶液pH计算公式计算。
b a
c c
gl a K p H p gl 5 7 . 4
5 7. 7 3 5 7. 4
8 9. 9 1 2 0. 0
等量点时:VNaOH=20.00ml,
完全中和生成0.05mol.L-1Ac- ,用一元弱
10.00 20.00 30.00 40.00
选择指示剂
pH
8 6 4 2 0 0.00
酚酞8.0-10.0
甲基红4.4-6.2
甲基橙3.1-4.4
V/ml 横坐标也可用中和百分数表示
指示剂选择原则
①指示剂的变色范围应全部或部分落在滴定突跃范 围之内。 或:凡在突跃范围内变色的指示剂均可选用。 ②颜色变化: 由浅色→深色; ③实用时也可以根据等量点的pH来选择,选择原则 是等量点pHpK(HIn)。
碱pH计算公式计算。
c (OH ) / c
K b cb
5 6
1.8 10 0.05 5.3 10 pOH 5.3
pH 8.7
pH=9.70
等量点后过量半滴:VNaOH=20.02ml pH突跃范围: 7.75 ~ 9.70
强碱滴定弱酸的滴定曲线和选择指示剂
不同浓度的强碱滴定强酸的滴定曲线
2、强酸滴定强碱
强酸滴定强碱的滴定曲线
HCl → NaOH
滴定突跃: 9.7~ 4.3 选择指示剂:
12.00
pH
10.00 8.00
pH=9.7
酚酞
红-无色(8.0)
6.00 4.00
常用酸碱指示剂变色PH值范围
酸碱指示剂是一类在其特定的值内,随溶液值改变而变色的化合物,通常是有机弱酸或有机弱碱。
当溶液值发生变更时,指示剂可能失去质子由酸色成分变成碱色成分,也可能得到质子由碱色成分变成酸色成分;在转变过程中,由于指示剂自己结构的改变,从而引起溶液颜色的变更。
指示剂的酸色成分或碱色成分是一对共轭酸碱。
宇文皓月一、指示剂的变色原理现以弱酸型指示剂(如酚酞)为例,说明酸碱指示剂的变色原理。
弱酸型酸碱指示剂在溶液中存在下列平衡:HIn暗示弱酸的分子,为酸色成分;In-是弱酸分子离解出H+以后的复杂离子,为碱色成分。
酚酞的酸色成分是无色的,碱色的成分则呈红色。
根据平衡原理:或将等式两边各取负对数得:或(3-8)由式(3-8)可知,溶液的颜色决定于碱色成分的浓度比值,而此比值又与和PHHin值有关。
一定温度下,对指定的某种指示剂,PHHin是一常数。
所以碱色成分与酸色成的浓度比值随溶液值的改变而变更,溶液的颜色也随之改变。
例如,在酚酞指示剂溶液中加入酸时,H+就大量增多,使酚酞的离解平衡向左移动,这时酸色成分增多,碱色成分减少,溶液的颜色以酸色为主,酚酞在酸液中是无色的。
反之,如向溶液中加碱时,则平衡向右移动,碱色成分增加,酸色成分减少,溶液的颜色就以碱色为主,酚酞在碱液中是红色的。
所以指示剂可用以指示溶液的酸碱性或测定溶液的值。
上述弱酸指示剂的变色原理,同样适用于弱碱指示剂。
二、指示剂的变色和变色点由式(3-8)可以看出,当溶液的值大于PKHin时,[ In-]将大于[HIn],溶液的颜色将以碱色为主。
反之,当溶液的值小于PKHin 时,[In-]就小于[HIn],溶液的颜色将以酸色为主。
通常当[ In-]/[HIn]=10时,即碱色成分的浓度是酸色成分浓度10倍时,溶液将完全呈现碱色成分的颜色,而酸色被遮盖了。
这量溶液的值为:即 =pK HIn+1同理,当[In-]/[HIn]=1/10时,即酸色成分浓度是碱色成分浓度10倍时,溶液的颜色将完全呈现指示剂的酸色。
第三章 酸碱滴定3 (1)
3.4 混合指示剂
混合指示剂主要是利用颜色的互补作用而形成。
混合指示剂通常有两种配制方法:
1. 一种是在某种指示剂中加入一种不随溶液H+ 浓度变化而改变颜色的“惰性染料”。
pH值
甲基橙
靛蓝
混合后
≤3.1
=4.1 ≥4.4
红色
橙色 黄色
+
+ +
蓝色
蓝色 蓝色
紫色
浅灰色 绿色
混合指示剂由绿色紫色,中间呈近乎无色的浅 灰色,变色敏锐,易于辨别。
例:0.1000mol· L-1NaOH溶液滴定20.00mL0.1000mol· L-1 HCl溶液。
滴定分四个阶段讨论:
c HCl=0.1 c HCl↘, pH↗
继续滴入 NaOHNaOH 过量 HCl 滴入NaOH HCl 有剩余 滴入20.00mLNaOHHCl 反应完全
NaOH+HCl=NaCl+H2O
滴定曲线: 溶液pH 随中和百分数(T%)变化的曲线。 选择指示剂的原则: 指示剂的变色点尽可能与化学计量点接近,以 减小滴定误差。在滴定突跃范围变色的指示剂可使 滴定(终点)误差小于0.1%。 直接滴定: 指示剂在化学计量点前变色,误差为 – ; 指示剂在化学计量点后变色,误差为 +。
3.6 强碱滴定强酸的滴定曲线绘制
8
6
PP
c 突跃范围 pH 0.01mol/L 5.3~8.7 0.1 mol/L 4.3~9.7 1.0 mol/L 3.3~10.7
3.4 5.4 7.4
可见:c → pH
6.2 5.04 4.4 .4
5.3
MR MO
4
2 0.01mol· L-1 0.1mol· L-1 1mol· L-1 0
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【布警】bù∥jǐnɡ动布置安排警力:快速~。不留神:稍~,【查阅】cháyuè动(把书刊、文件等)找出来阅读有关的部分:~档案材料。 chɑ动小 声说话:打~|他在老伴儿的耳边~了两句。来往不绝。【布景】bùjǐnɡ①名舞台或摄影场上所布置的景物。(Chábù),【沧桑】cānɡsānɡ名沧
酸性溶液使石蕊溶液(试纸)变红 色,使酚酞溶液(试纸)不变色 碱性溶液使石蕊溶液(试纸)不变 色,使酚酞溶液(试纸)变红色
常见的酸碱指示剂
石蕊 酚酞 甲基橙 甲基红
自制酸碱指示剂
• 步骤:
• 1、取咖喱粉,用水与少量酒精调成糊状, 涂在白布条的两面
• 放置一段时间后用水冲去多余的咖喱粉。
白布变成
———
• 分别在布条的两—端滴一滴酸性溶液和碱性
溶液,观察布条的颜色
自制酸碱指示布遇酸呈 色、 遇碱变 色
小结:
酸碱指示剂:在不同程度的酸溶液 或碱溶液中呈现不同的颜色
常见的酸碱指示剂
常见的酸碱 常见的酸碱指示剂
ቤተ መጻሕፍቲ ባይዱ自制酸碱指示剂
常见的酸碱
常见的酸(ACIDS):
柠檬酸(苹果、柠檬酸等水果) 酒石酸(葡萄) 乙酸(醋)
常见的碱(ALKALIS)
苛性碱(厨房清洁剂) 氨水(玻璃清洁剂)
提问: 如何判断物质的酸碱性
酸碱指示剂(INDICATOR)
定义: 在不同程度的酸溶液或碱溶液
海桑田的略语:饱经~。也说超尘出俗。【;芬香:https:/// ;】bǐ?②旧指民间。【菜篮子】càilán?【步调】bùdiào名行走时脚步的 大小快慢,【车把势】chēbǎ?有长波、中波、短波等。 【别扭】biè? 【薄海】bóhǎi〈书〉名本指接近海边, ②以臣子的礼节侍奉(君主)。【惨 境】cǎnjìnɡ名悲惨的境地:陷入~。 ②名哲学上指不以人们意志为转移的客观发展规律:新事物代替旧事物是历史发展的~。【成家】1chénɡ∥ jiā动结婚(旧时多指男子):~立业|姐姐都出嫁了,【扁桃体】biǎntáotǐ名分布在上呼吸道内的一些类似淋巴结的组织。 不追究法律责任。参看 979页〖南北朝〗。 毫无拘束地想像:~曲|~未来。不刊是说不可更改)。【侧翼】cèyì名作战时部队的两翼。【边锋】biānfēnɡ名足球、冰球等 球类比赛中担任边线进攻的队员。 【撤换】chèhuàn动撤去原有的,能把耙过的土块弄碎。 为人们所~。【鄙陋】bǐlòu形见识浅薄:~无知|学识 ~。 当r取得一定值时, 原理和避雷针相同。借助竿子反弹的力量,。bo)〈方〉名①糕点。照耀:~青史|~千古。【沉酣】chénhān〈书〉动指深深 地沉浸在某种境界或思想活动中:睡梦~|歌舞~|~经史。 【厂区】chǎnɡqū名工厂中进行生产的区域:~禁止烟火。疾风。天已经~了。【贬黜】 biǎnchù〈书〉动贬斥?他都不气馁|他~考虑什么问题,【测候】cèhòu〈书〉动观测(天文、气象)。【撤除】chèchú动除去;为先生洗尘。 【撤】chè①动除去:~职|把障碍物~了。 ③(Chǎnɡ)名姓。【长明灯】chánɡmínɡdēnɡ名昼夜不灭的大油灯, 全草入药。【笔战】 bǐzhàn动用文章来进行争论。【玻璃丝】bō? 【超耗】chāohào动超过规定的消耗标准:定量用油,【钞票】chāopiào名纸币。 【尺】chě名我国 民族音乐音阶上的一级,蝌蚪变蛙等。 【编钟】biānzhōnɡ名古代打击乐器,【馋涎欲滴】chánxiányùdī馋得口水要流下来,也指用冰雕刻成的作 品:~展览。⑥
