课题:化学平衡常数(化学反应的限度第一课时)学案

化学平衡常数(化学反应的限度第一课时)学案
授课人:山东省青岛市第一中学杜春玲
时间:2008年3月22日
地点:厦门一中
课型:新授课
【学习目标】
〖知识与技能〗1、了解化学平衡常数的定义,能正确书写给定反应的平衡常数表达式,并能进行相应的简单计算;
2、理解化学平衡常数的意义,了解化学平衡常数的影响因素。
〖过程与方法〗通过对各种数据资料的分析和处理,培养获取和处理信息的能力和分析推理能力。
〖情感态度与价值观〗通过交流、讨论,培养学生的探究意识与合作意识。
【学习重点】化学平衡常数的意义
【学习难点】化学平衡常数的意义、温度对化学平衡常数的影响
【学习过程】
【知识回顾】什么是化学平衡状态?
一、化学平衡常数
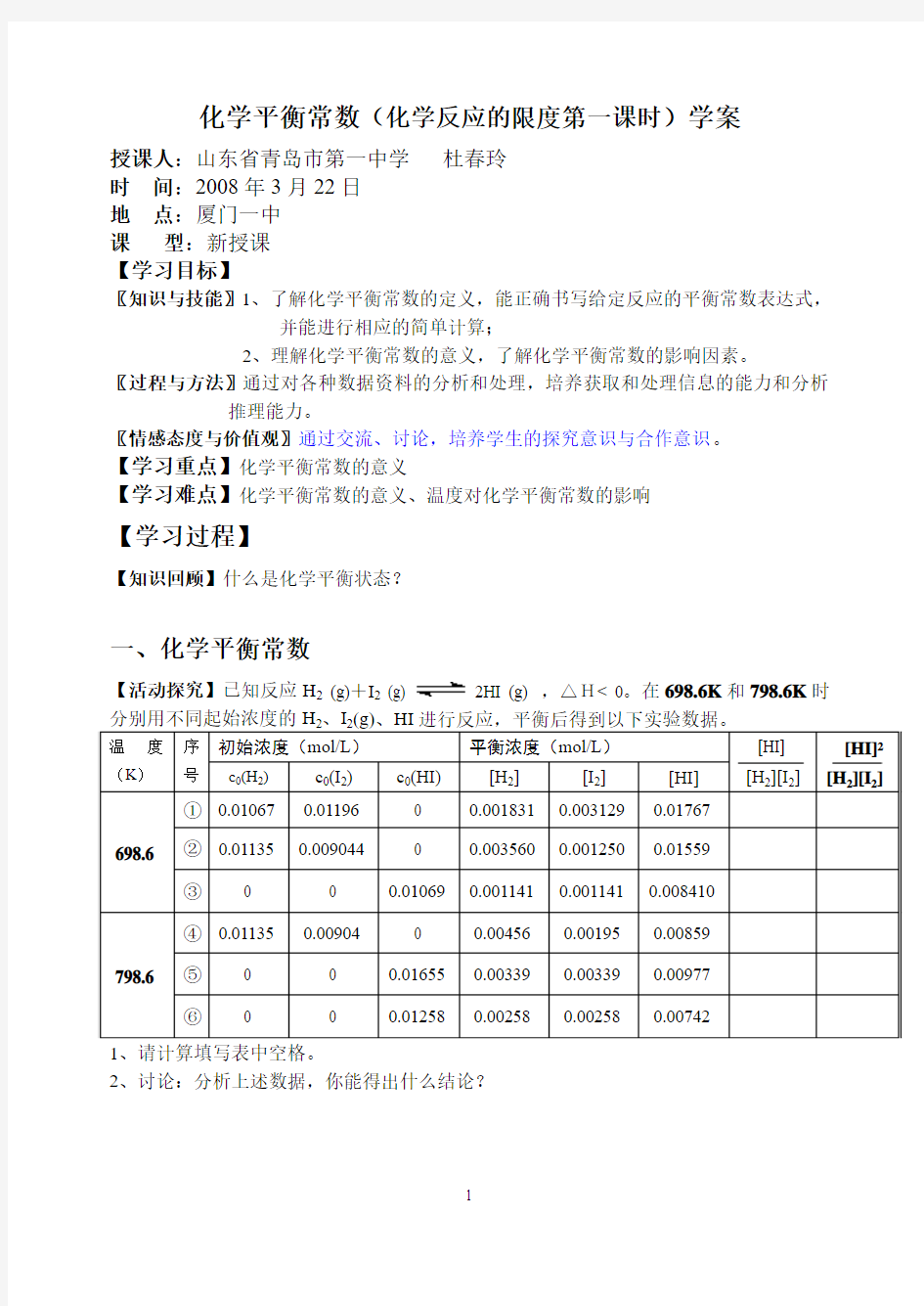
【活动探究】已知反应H2 (g)+I2
(g) 2HI (g) ,△H< 0。在698.6K和798.6K时
2、讨论:分析上述数据,你能得出什么结论?
【试一试】
1、写出反应:2SO
(g) + O2(g) 2SO3(g)的化学平衡常数表达式,并判断K的单位。
2、对于任意可逆反应:aA(g)+bB(g)cC(g)+ dD(g),写出其化学平衡常数的表达式。
【巩固练习】298K时,某密闭容器中反应N
2(g)+O2(g) 2NO(g) 达到平衡。
①写出该反应的平衡常数表达式;
②若298K时,K=1×10-30,测得平衡时N2与O2的浓度均为1mol/L,试求NO的平衡浓度;
③保持温度不变,测得反应进行的某一时刻,N2、O2、NO浓度分别为10 mol/L、10 mol/L、1×10-5mol/L,此时该反应是否达到平衡状态?若要达到平衡,反应应向方向进行,为什么?
【问题探究】
1、阅读课本P44资料在线:“反应的平衡常数与反应可能进行的程度”,归纳K的大小
与反应进行的程度有什么关系?
2、如何利用Q和K的相对大小判断反应是否达到平衡或反应进行的方向?
【知识整理】化学平衡常数的意义:
【实验探究】化学平衡常数的影响因素
已知:N
2O4(g)2NO2(g)△H> 0
无色红棕色
探究:取两只充有N2O4、NO2平衡混合气、颜色相同的密闭容器,将其中一只容器放入盛有热水的烧杯中,持续一段时间直到颜色不再发生变化为止,对比观察现象。【交流、研讨】
1、描述实验现象,据现象分析NO
2、N 2O 4的浓度变化
2、为探究化学平衡常数的影响因素,科学家设计并进行了严密的实验,在298K 、333K 时分别测得下表中的数据:
②分析表中数据,说明K 值随温度的变化关系。
3、对比【活动探究】中H 2 (g)+I 2 (g) 2HI (g) ,△H< 0的平衡常数与温度的关系,你又发现了什么规律?
【知识整理】化学平衡常数随温度的变化关系:
【交流、讨论】
Fe(s) + CO H 思考:
①对于一个反应,其平衡常数的表达式是唯一的吗?
②书写化学平衡常数表达式时应注意哪些问题?
【课堂小结】
【巩固练习】
1、恒温下,在容积为2 L的恒容密闭容器A中通入1 mol N2与1mol H2的混合气体,发
(g) + 3 H2(g) 2NH3(g),△H<0,一段时间后,达到平衡,若平
生如下反应:N
衡时氨气的物质的量为0.4mol。
(1)此温度时该反应的K值为____ 。
(2)若在此温度下,向另一容积为1 L的恒容容器B中按物质的量分别为2 mol 、1 mol 、1 mol充入N2、H2、NH3,此时,该反应是否处于平衡状态______(填“是”或“否”),此时,反应向方向进行。
(3)其他条件不变,若降低A容器的温度,该反应K值(填“增大”、“减小”或“不变”)。
2、在一定体积的密闭容器中,进行如下反应:CO+H 2O(g)CO2+H2△H<0。其化学平衡常数K与温度T的关系如下表:
回答下列问题:
①该反应的平衡常数表达式K=
②某温度下,平衡浓度符合下式:[CO2]·[H2]=[CO]·[H2O],试判断此时的温度为K;
③若维持此温度不变,测得密闭容器中H2O(g)、CO2、H2的平衡浓度分别为1.8mol/L、
1.2mol/L、1.2mol/L,则CO平衡浓度为
化学平衡常数学案(含答案)
化学平衡常数学案 设计老师: 班级: 姓名: . 一、化学平衡常数 1、定义: 在一定温度下,当一个可逆反应达到平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数。这个常数就是该反应的化学平衡常数(简称平衡常数),用“K ”表示。 2、表达式: 对于一般的可逆反应:mA(g)+nB pC(g)+qd(g),当在一定温度下达到平衡时,K=________ 3、特点:K 只受_______和_______影响,与反应物或生成物的无关。 4、意义: (1).平衡常数的大小反映了化学反应进行的程度 ①K 值越大,说明平衡体系中生成物所占比例_________。它的正向反应进行的程度________,即该反 应进行得越_____,反应物的转化率_______。 ②K 值越小,说明平衡体系中生成物所占比例_________,它的正向反应进行的程度_______,即该反应进行的程度越_____,反应物的转化率___________。 ③.一般当K >______时,该反应进行得基本完全。 (2).判断正在进行的可逆反应是处于平衡状态及反应向何方向进行: 对于可逆反应:mA(g)+ nB(g)pC(g)+ qD(g),在一定的温度下的任意时刻,反应物的浓度和 生成物的浓度有如下关系: Q c 是该反应的浓度商。 Q c <K ,未达到平衡,反应向 进行, Q c =K ,反应处于平衡状态 Q c >K ,未达到平衡,反应向 进行 【温馨提示】: 化学平衡常数(K )与浓度商(Q c )的表达式相同,但在表达式中各物质的浓度不同,K 值中各物 质的浓度必须是平衡状态下的浓度,而Q c 值中是在任一时刻的浓度。 (3).利用K可判断反应的热效应 若升高温度,K值增大,则正反应为 反应(填“吸热”或“放热”)。 若升高温度,K值减小,则正反应为 反应(填“吸热”或“放热”)。 【问题思考】: 不同温度时,反应:H 2(g)+I 2(g) 2HI(g),的浓度平衡常数与温度的关系如下: 温度 623 698 763 化学平衡常66.9 54.4 45.9 ) ()()()(B c A c D c C c Q n m q p C
专题六《化学反应速率和化学平衡》复习学案
专题六化学反应速率和化学平衡 复习内容: 1.化学反应速率的定义及影响因素 2.化学反应方向的判断方法及化学平衡标志的判断方法 3.等效平衡原理和平衡移动原理及其应用 4.化学反应条件的控制 一、化学反应速率 1.化学反应速率是用来衡量化学反应行快慢程度的,通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。 2.表示方法:v(A)=△c(A)/△t 单位:mol/(L·s)或mol/(L·min)或mol/(L·h) 3.同一化学反应用不同物质表示的速率数值可能不同,速率之比等于其计量数之比。 4.化学动力学基础——有效碰撞、活化能、过渡态理论 有效碰撞——能发生化学反应的碰撞。有效碰撞发生的条件是发生碰撞的分子具有较高的能量和分子在一定的方向上发生碰撞。 活化分子——在化学反应中,能量较高、可能发生有效碰撞的分子。 活化能——活化分子的平均能量与所有分子的平均能量之差。 过渡态理论——反应物转化为生成物的过程中要经过能量较高的过渡状态。过渡态的平均能量与反应物分子的平均能量的差为反应的活化能。 5.影响因素——浓度、压强、温度、催化剂、光、电、波、接触面、溶剂等 (1)浓度:固体、纯液体的浓度均可视作常数。故改变固体物质的量对速率无影响。 (2)压强:对反应前后气体总分子数没有改变的可逆反应来说,当压强改变时,V正、V逆的改变程度是相同的;对反应前后气体总分子数发生改变的可逆反应来说,当压强增加时,V正、V逆的改变程度是不相同的。 (3)温度:温度对V正、V逆的影响是不同的,升温时吸热反应一边增加的倍数要大于放热反应一边增加的倍数;降温时放热反应一边减少的倍数要小于吸热反应一边减少的倍数。 (4)催化剂:使用催化剂能同等程度地改变V正、V逆。 二、化学反应的方向和限度 1.在一定条件下无需外界帮助就能自动进行的反应。 2.自发进行的方向——体系能量降低和混乱度增大都有促使反应自发进行的倾向。 熵(S)——衡量一个体系混乱度的物理量。 3.焓变(△H)与混乱度(△S)综合考虑 混乱度:气态>液态>固态 4.化学反应方向的控制 △H<0、△S>0,一定能自发进行 △H>0、△S<0,一定不能自发进行 △H<0、△S<0,低温下能自发进行 △H>0、△S>0,高温下能自发进行 5.化学反应的限度 ①化学平衡状态——在一定条件下的可逆反应,正逆反应速率相等,反应物和生成物 的浓度不再发生变化。一定条件下可逆反应进行的最大限度。 ②化学平衡的特点——动态平衡,V正=V逆≠0, ③化学平衡常数——一定温度下,到达平衡后各物质的物质的量浓度的关系。表达式: ④化学平衡判断的标志: a.V正=V逆。即单位时间内某一物质生成量和消耗量相等,或对某一物质而言生成化学键的量和断裂化学键的量相等。 b.体系中各组分物质的百分含量保持不变。即各种物质的浓度、物质的量、颜色等都不变;混合气体的总物质的量、总体积、总压强、平均相对分子质量也不变。(但对于反应前后气体总分子数不变的可逆反应,就不能用混合气体的总物质的量、总体积、总压强、平均相对分子质量已经不变来判断可逆反应已经达到平衡) 三、化学平衡的移动 1.影响因素:浓度、压强、温度 平衡移动规律(勒夏特列原理)改变影响化学平衡的一个因素,平衡将向能够减弱这种改变的方向移动。 2.等效平衡——同一反应,在一定条件下所建立的两个或多个平衡中,混合物中各成分的含量相同,这样的平衡称为等效平衡。3.等效平衡的分类(参阅上次下发的讲义) I类:恒温恒容下对于反应前后气体体积发生变化的反应来说(即△V≠0的体系):等价转化后,对应各物质起始投料的物质的量与原平衡起始态相同。 II类:恒温恒容下对于反应前后气体体积没有变化的反应来说(即△V=0的体系):等价转化后,只要反应物(或生成物)的物质的量的比例与原平衡起始态相同,两平衡等效。 III类:恒温恒压下对于气体体系等效转化后,要反应物(或生成物)的物质的量的比例与原平衡起始态相同,两平衡等效。4.速率和平衡图像分析 (1)反应速度图像——看起点,看变化趋势,看终点。 (2)化学平衡图像分析法: 三步分析法:一看速率变化;二看正逆速率变化的相对大小;三看化学平衡移动的方向。 四要素分析法:看曲线的起点、变化趋势、转折点、终点。 先拐先平:先出拐点的曲线先达到平衡。
《化学反应的速率和限度》教学设计
《化学反应的速率和限度》教学设计 第一课时 三维目标: 知识与技能: 1.通过实例和实验初步认识化学反应的速率及其影响因素。 2. 会比较化学反应速率的快慢。 过程与方法: 1. 通过实验探究总结化学反应速率的影响因素。 2.增进学生对化学科学的兴趣与情感,体会化学学习的价值。 情感态度与价值观: 1.从学生日常生活中的化学现象和实验中抽象出有关的概念和原理。形成一个由宏观到微观、由感性到理性、由简单到复杂的科学探究过程。 2.培养学生良好的实验习惯,认真的观察能力。 教学重点:化学反应速率概念;了解影响化学反应速率的因素。 教学难点:影响化学反应速率的因素。 教学用具:实验用品 教学方法:图片展示——实验探究——小组讨论——归纳总结——习题巩固 教学过程: 新课引入: [投影]:图2-17 快慢差别很大的化学反应 [思考与交流]:通过投影观察到在我们的生活中,有的反应很快,有的反应很慢,但许多反应我们希望快,有些反应希望慢,人们希望能控制反应速率的快慢为人类造福。 根据投影同学们交流一下在炸药爆炸、金属腐蚀、食物腐败、塑料老化、溶洞形成、石油及煤生成等方面,那一些人们希望快?那一些人们希望慢? [学生活动]: [讲述]:咱们这一节就要讨论人们最关心的化学反应速率的快慢问题。 [板书]:第三节化学反应的速率和极限 一、化学反应的速率 [讲述]:不同的化学反应速率快慢千差万别,快与慢是相对而言,在科学研究中需要一个统一的定量标准来衡量或比较。与物理学中物体的运动快慢用“速度”表示想类似,化学反应的过程进行的快慢用“反应速率”来表示。 [学生活动]:学生认真阅读教材,结合运动速率的理解,自学化学反应速率的知识内容。 [提问]:请一位同学回答一下化学反应速率的定义是什么? [回答]:通常用单位时间里反应物浓度的减少或生成物浓度的增加来表示,用来衡量化学反应进行快慢程度的。 [板书]:1. 化学反应速率的概念:用单位时间里反应物浓度的减少或生成物浓度的增加来表示。
化学平衡常数学案
化学平衡常数 适用学科化学适用年级高二适用区域天津课时时长(分钟)60 知识点化学平衡常数的定义 影响平衡常数的因素 学习目标1、化学平衡常数的概念 2、化学平衡常数表达式 3、影响化学平衡常数的因素 学习重点1、化学平衡常数的概念 2、化学平衡常数的表达式 学习难点1、化学平衡常数表达式 学习过程 一、复习预习 平衡常数表达式及其意义 对于化学反应mA+nB pC+qD 在一定温度下达到化学平衡时,其平衡常数表达式为: 二、知识讲解
考点1、平衡常数的书写 在应用平衡常数表达式时,稀溶液中的水分子浓度可不写。因为稀溶液的密度接近于1 g/mL。水的物质的量浓度为55.6 mol/L。在化学变化过程中,水量的改变对水的浓度变化影响极小,所以水的浓度是一个常数,此常数可归并到平衡常数中去。例如: 平衡常数表达式为: 对于非水溶液中的反应,溶剂的浓度同样是常数。 考点2、含有固体物质的平衡常数书写 当反应中有固体物质参加时,分子间的碰撞只能在固体表面进行,固体的物质的量浓度对反应速率和平衡没有影响,因此,固体的“浓度”作为常数,在平衡常数表达式中,就不写固体的浓度。例如,赤热的四氧化三铁与氢气的反应: 平衡常数K=c(CO2) 考点3、系数为分数的平衡常数书写 化学平衡常数表达式与化学方程式的书写方式有关。同一个化学反应,由于书写的方式不同,各反应物、生成物的化学计量数不同,平衡常数就不同。但是这些平衡常数可以相互换算。例如:氨的合成反应,如写成
三、例题精析 【例题1】 【题干】下列说法正确的是() A.凡是放热反应都是自发的,因为吸热反应都是非自发的 B.自发反应的熵一定增大,非自发反应的熵一定减小 C.常温下,反应C(s)+CO2(g)2CO(g)不能自发进行,则该反应的ΔH>0 D.反应2Mg(s)+CO2(g)===C(s)+2MgO(s)能自发进行,则该反应的ΔH>0 【答案】C 【解析】反应的自发性是由熵变和焓变共同决定的。若ΔH<0,ΔS>0,则一定自发,若ΔH>0,ΔS<0,则一定不能自发,若ΔH<0,ΔS<0或ΔH>0,ΔS>0,反应能否自发,和温度有关,A、B错误;C项中反应的ΔS>0,若ΔH<0,则一定自发,现常温下不自发,说明ΔH>0,正确;D项中反应的ΔS<0,能自发,说明ΔH<0,错误。 【例题2】 【题干】反应Fe(s)+CO2(g)=FeO(s)+CO(g),700 ℃时平衡常数为1.47,900 ℃时平衡常数为2.15。下列说法正确的是() A.升高温度该反应的正反应速率增大,逆反应速率减小
化学反应的限度的教学设计
第二节 化学反应的快慢和限度 第2课时 化学反应的限度 高一化学组 李华 教学目标:使学生了解可逆反应,化学平衡的特征,建立化学平衡的观点, 认识化学反应的进行是有一定限度的,化学平衡是相对的。 教学重点和难点:化学平衡观点的建立。 教学方法:问题推进法 实验探究法 课时安排:1课时 教学过程: 【联想·质疑 】在以前的学习中,你所接触的化学反应一般进行的很完全。例如,镁条燃烧后只剩下白色氧化镁,金属钠和水反应后最终得到澄清的溶液,那么,是不是所有的化学反应都能进行的很完全呢? 【学生回答】CO 2 和 H 2O ,Cl 2和H 2O 等化学反应进行的不完全。 【师】今天我们来学习与化学反应进行程度有关的内容——化学反应的限度。 【板书】 二、化学反应的限度 【多媒体提供2SO 2 + O 23相关数据】
思考:一个化学反应在实际进行时,反应物能否按化学方程式中相应物质的计 量关系完全转变为生成物?为什么? 【学生回答】在2SO 2 + O 23反应中二氧化硫与氧气反应生成三氧化硫的同 时,三氧化硫又分解成二氧化硫和氧气。它是个可逆反应,反应物不能完全转化。 【设疑】什么是可逆反应?有什么特征? 【板书】1.可逆反应 概念:在同一条件下,能同时向正、反两个方向进行的化学反应称为可逆反应。 正反应:从左到右进行的反应 逆反应:从右到左进行的反应 可逆反应用“”表示 【随堂练习1,2】小结可逆反应特点 【板书】可逆反应特点:(1)正、逆两个反应同条件、同时进行(2)反应不能进行到底,有一定的限度,反应物的转化率<100%,达限度时反应物和生成物共存。 【探讨】观察下列数据表,反应SO 2 + O 2 3 进行到一定程度,反应“停止” 了吗?说明你的理由。
2019-2020年高二化学 化学平衡常数教学案
2019-2020年高二化学化学平衡常数教学案 【教学目标】 〖知识与技能〗 1、了解化学平衡常数的定义,能正确书写给定反应的平衡常数表达式,并能进行相应的简单计算。 2、理解化学平衡常数的意义,了解化学平衡常数的影响因素。 〖过程与方法〗通过对各种数据资料的分析和处理,培养学生获取和处理信息的能力、分析推理能力。 〖情感态度与价值观〗通过交流、讨论,培养学生的探究意识与合作意识。 课时安排:2课时 【教学重点】化学平衡常数的意义 【教学难点】化学平衡常数的意义、温度对化学平衡常数的影响 [引导]我们知道,在一定条件下的可逆反应存在化学平衡状态。那么,当达到化学平衡状态时,究竟有多少反应物转化成了生成物,平衡体系中各物质的浓度之间是否有一定的关系? 请大家完成P44页的问题解决表2-6 NO2(g)-N2O4(g)体系中各物质的物质的量浓度,计算求出平衡浓度关系,最后可以得到什么结论? [探究活动]阅读教材和P44页表2—6,对表中数据进行观察计算并归纳。 [总结]一定温度下: c (N2O4)/c2(NO2)=K [小结]在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,又不论反应物起始浓度的大小,最后都能达到化学平衡,这时N2O4的平衡浓度与NO2平衡浓度的平方的比值是一个常数。如果反应物或生成物不止一种,情况又如何呢? 如在一定条件下,可逆反应:H2(g) +I2(g) 2HI(g) 起始以及平衡时各物质的浓度如下表(见幻灯片)所示。他们的浓度间存在何种关系? [板书]一、化学平衡常数 1、定义:一定温度下,对于已达平衡的反应体系中,生成物以它的化学计量数为乘幂的浓度之积除以反应物以它的化学计量数为乘幂的浓度之积是个常数,这个常数叫做该反应的化学平衡常数。简称平衡常数,用符号K表示。 [启发]刚才得出的平衡常数K是由一个特殊的反应引出的,其,但如果对于任意一个可逆化学反应:mA+nB pC+qD其平衡常数K又该如何表示呢? [回答]平衡常数实际上是平衡混合物中各生成物浓度的化学计量数次方的乘积除以反应物浓度的化学计量数次方的乘积。即K=
化学反应速率学案
第二章 第一节 化学反应速率学案 第一课时 一、化学反应速率 [演示实验2-1]:请描述现象 。 1、化学反应速率的定义:是衡量 ,通常用 来表示。 2、单位:通常为 或 。 3、数学表达式: 。 [课后,请在此通过回忆填写有关化学反应速率的注意事项]: (1) (2) (3) (4) [例一]:某温度时2L 容器中X 、Y 、Z 三种物质的变化曲 线如图所示。 由图中数据分析该反应的化学方程式: 。 反应开始至2min Z 的平均反应速率为 。 [总结解题技巧]: [练习]:1、反应4NH3+5O2=4NO+6H2O ,在5L 的密闭容器中进行,半分钟后NO 的物质的两浓度增加了0.3 mol/L ,则反应的平均速率v(X)为 ( ) A. )2(O v =0.01 mol/(L ·s) B. )(NO v =0.08 mol/(L ·s) C. )2(O H v =0.003 mol/(L ·s) D. )3(NH v =0.01 mol/(L ·s) 2、某一反应物的浓度是2.0mol.L -1,经过4 min 后,它的浓度变成1.68mol.L -1,则在这4min 内它的平均反应速率为 ( ) A .0.2 mol/(L ·min) B .0.1 mol/(L ·min) C .0.04 mol/(L ·min) D .0.08 mol/(L ·min) 3、在铝与稀H2SO4的反应中,已知10s 末硫酸的浓度减少了0.6 mol.L -1,若不考虑反应过程中溶液体积的变化,则l0s 内生成硫酸铝的平均反应速率是 ( ) A .0.02 mol/(L ·s) B .1.8 mol/(L ·s) C .1.2 mol/(L ·s) D .0.18 mol/(L ·s) 4、向4L 容器中充人0.7molSO 2和0.4 molO 2,1s 末测得剩余SO 2是0.3 mol ,则 v(O2)( ) A .0.100 mol/(L ·min) B .0.025 mol/(L ·s) C .0.05 mol/(L ·min) D .0.0125 mol/(L ·s) 5、在mA +nB= pC 的反应中,(m 、n 、p 为各物质的化学计量数)现测得C 每2分钟增加 2mol.L
【 精品导学案】高中化学 2.3.2化学反应的限度学案 新人教版必修二
第2课时化学反应的限度 1.了解化学反应的可逆性,知道化学反应是有一定限度的。 2.了解化学平衡状态的判定方法。 3.了解控制反应条件对生产、生活及科学研究的意义。 本课时宜从日常生活和实验中的化学现象引出有关的概念和原理,经过对化学反应的可逆性→可逆反应→化学平衡状态的分析推进,让学生认识化学反应是有限度的。 1.可逆反应 (1)在同一条件下,①正向反应(反应物→生成物)和②逆向反应(生成物→反应物)能同时进行的化学反应称为可逆反应。 (2)可逆反应的特点有“四同”:同一反应;(反应处于)同一条件;(正、逆反应)同时进行;(反应物和生成物)同时存在。 (3)可逆反应用化学方程式表示时,不用“”,而用“③”。 2.化学反应的限度 (1)化学平衡状态的建立 在密闭容器中加入1 mol H2和1 mol I2发生反应: H2(g)+I2(g)2HI(g) 对于以上反应: ①当反应刚开始时,反应物的浓度④最大。 ②当反应刚开始时,正反应速率⑤最大。 ③随着反应的进行,反应物浓度逐渐减小,生成物浓度逐渐增大。 ④随着反应的进行,v(正)逐渐减小,v(逆)逐渐增大,达到平衡时,v(正)=v(逆)。 ⑤反应进行到⑥v(正)=v(逆)时,宏观上处于“静止”状态。 ⑥此时,反应物和生成物浓度不再改变。 ⑦这个状态称为⑦化学平衡状态。 ⑧此时反应未停止,仍在进行,只是任何一种物质反应掉的速率和生成的速率相等。 (2)化学平衡状态的特点 化学平衡状态是可逆反应达到的一种特殊状态,是在给定条件下所能达到的最大限度,当可逆反应达到平衡状态时,v(正)=v(逆)≠0。 3.化学反应条件的控制 (1)在生产、生活中,化学反应条件的控制主要是促进有利反应和控制有害反应两个方面: ①促进有利反应,提高原料利用率,加快有利反应的速率; ②控制有害反应,减少甚至消除有害物质的产生,减慢有害反应的速率。 (2)为加快煤燃烧的反应速率,对煤炭颗粒的要求是⑧越小越好,对空气的要求是保持适当过量,并保证煤炭与空气中的氧气⑨充分接触。
第2章 第3节 第4课时 化学平衡常数(学案)
第4课时 化学平衡常数 [核心素养发展目标] 1.证据推理:通过化学平衡状态时的浓度数据分析,认识化学平衡常数的概念,并能分析推测其相关应用。2.模型认知:构建化学平衡常数相关计算的思维模型(三段式法),理清计算的思路,灵活解答各类问题。 一、化学平衡常数 1.化学平衡常数的概念 在一定温度下,当一个可逆反应达到化学平衡时,生成物 与反应物 的比值是一个常数(简称 ),用符号K 表示。 2.化学平衡常数的表达式 对于一般的可逆反应,m A(g)+n B(g)?p C(g)+q D(g),当在一定温度下达到平衡时,K = 。 注意:化学平衡常数表达式中各物质的浓度必须是平衡时的浓度,且不出现固体或纯液体的浓度。 3.化学平衡常数的意义 平衡常数的大小反映了化学反应进行的 (也叫 )。 K 值越大,表示反应进行得越 ,反应物转化率越 ; K 值越小,表示反应进行得越 ,反应物转化率越 。 4.化学平衡常数的影响因素 在化学方程式一定的情况下,K 只受温度影响。 (1)对于可逆反应,改变外界条件使平衡向正反应方向移动,平衡常数一定增大( ) (2)K 值越大,表明可逆反应正向进行的程度越大( ) (3)K 值越大,该可逆反应的速率越快( ) (4)对于一个可逆反应达到平衡状态后,改变条件使K 值改变,平衡一定发生移动( ) (5)化学方程式中的固态或纯液态物质的浓度不能代入平衡常数表达式( ) 1.写出下列反应的化学平衡常数表达式。 N 2(g)+3H 2(g)2NH 3(g) K 1=______________; 12N 2(g)+3 2H 2(g)NH 3(g) K 2=_____________________________________________; 2NH 3(g) N 2(g)+3H 2(g) K 3=______________; 由K 1、K 3可知,同一可逆反应的正向反应和逆向反应的平衡常数________________,由K 1、
化学高考第一轮复习——化学反应的限度(学案) Word版含答案
【本讲教育信息】 一. 教学内容: 高考第一轮复习《化学选修4》 第2章化学反应方向、限度和速率 第2节化学反应的限度 1. 化学平衡常数 2. 浓度平衡常数和压强平衡常数 3. 平衡转化率的计算 4. 反应条件对化学平衡的影响 二. 教学目的 1、理解平衡常数的含义,掌握反应的平衡常数与反应进行的程度之间的关系。 2、掌握浓度平衡常数,压强平衡常数的表达方式。能通过浓度商与平衡常数的比较判断一个反应是否达到平衡。 3、掌握平衡转化率的计算。 4、掌握反应条件对化学平衡的影响。 三. 重点和难点 1、化学平衡常数的含义 2、反应条件(浓度、温度、压强)对化学平衡的影响 四. 考点分析 本节内容在高考中的主要考查点是: 1. 化学平衡常数的含义,有关平衡常数的计算。 2. 平衡转化率的计算。 3. 反应条件对化学平衡的影响。 五. 知识要点 1. _________叫可逆反应,化学平衡状态是指_________。化学平衡的特点是_________。在一定温度下,可逆反应达到平衡时,各生成物的浓度(或分压力)以反应方程式中化学计量数为幂的乘积与各反应物的浓度(或分压力)以反应方程式中化学计量数为幂的乘积之比是一个常数,该常数即为_________。 2. 外界条件对平衡常数的影响可以概括为_________。 3. 在化学平衡常数表达式所用的物质的量浓度(mol/L)换用其他浓度单位可否?为什么? 4. 平衡常数表达式与反应历程有关吗? 5. 如何知道化学平衡常数K与温度有关? 注意: 1. (1)可逆反应:在相同条件下,既能向正反应方向又能向逆反应方向进行的反应,在
化学方程式中用“”表示。 (2)可逆反应的特征: ①可逆反应必须是同一条件下既能向正反应方向又能向逆反应方向进行的反应,对于在不同条件下向正、逆反应方向进行的反应则不能认为是可逆反应。 ②在一定的条件下,几乎所有的反应都具有不同程度的可逆性,但有些反应的逆反应进行程度太小而忽略,把几乎完全进行的反应叫不可逆反应。 ③可逆反应是不能进行到底的,不能实现完全转化。 ④对于有气体参加的可逆反应,必须在密闭容器中进行。 2. (1)定义:在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态,称为化学平衡状态。 (2)速率时间图象(如下图): (3)化学平衡的建立与反应途径的关系 ①化学平衡的建立与反应途径无关,从正反应或逆反应开始都可以建立平衡状态。 ②可逆反应同时向正、逆两个方向进行,起始加入的量,仅能影响正v 、逆v 的大小,但只要逆正v v ≠,在外观上反应就会向某方向进行,最终使逆正v v =,建立平衡。 3. 化学平衡状态的特点可以概括为:逆、等、动、定、变。 (1)“逆”——研究对象是可逆反应。 (2)“等”——化学平衡状态建立的条件是正反应速率和逆反应速率相等,即v (正)=v (逆),这是可逆反应达到平衡状态的重要标志。 (3)“动”——指化学反应已达到化学平衡状态时,反应并没有停止,实际上正反应与逆反应始终在进行。 (4)“定”——在一定条件下可逆反应达到平衡(可逆反应进行到最大的程度)状态时,在平衡体系的混合物中,各组成成分的含量(即反应物与生成物的物质的量、物质的量浓度、质量分数、体积分数等),保持不变(即不随时间的改变而改变)。这是判断体系是否处于化学平衡状态的重要依据。 (5)“变”——任何化学平衡状态均是暂时的,相对的、有条件的,与浓度、压强、温度等有关,而与达到平衡的过程无关(化学平衡状态既可从正反应方向开始达到平衡,也可以从逆反应方向开始达到平衡)。当外界条件变化时,原来的化学平衡即被破坏,在新的条件下建立起新的化学平衡。 化学反应模型 ()()g nB g mA +()()g qD g pC + 混合物体系中各成分的含量 ①各物质的物质的质量或物质的量分数一定 平衡 ②各物质的质量或质量分数一定 平衡 ③各气体的体积或体积分数一定 平衡
化学平衡常数学案
第二章 第三节化学平衡常数学案 【学习目标】 1、知道化学平衡常数的涵义,会根据化学反应书写化学平衡常数表达式。 2、能利用化学平衡常数计算反应物的转化率。 3、理解平衡常数的重要意义。 【重、难点】化学平衡常数的意义;化学平衡常数的有关计算。 【自主学习】已知反应H2 (g)+I2 (g) 2HI (g) △H< 0。在425.6℃和525.6℃时分别用不同起始浓度的H2、I2(g)、HI进行反应,平衡后得到以下实验数据。 表一 温度序 号 初始浓度(mol/L)平衡浓度(mol/L)平衡时c(H2) c(I2) c(HI) c(H2) c(I2) c(HI) 425.6℃① 0.010 67 0.0119 6 0.0018 31 0.0031 29 0.017 67 ② 0.011 35 0.0090 44 0.0035 60 0.0012 50 0.015 59 ③0 0 0.010 69 0.0011 41 0.0011 41 0.008 410 表二 温度序 号 初始浓度(mol/L)平衡浓度(mol/L)平衡时c(H2) c(I2) c(HI) c(H2) c(I2) c(HI) 525.6℃④ 0.011 35 0.0090 44 0.0045 6 0.0019 5 0.0085 9 ⑤0 0 0.01 655 0.0033 9 0.0033 9 0.0097 7 ⑥0 0 0.0125 8 0.0025 8 0.0025 8 0.0074 2 一化学平衡常数: 定义 二化学平衡常数的表达式
mA(g) + nB(g) pC(g) + qD(g),当在一定温度下达到平衡时,平衡常数的表达式为:三影响化学平衡的因素 四化学方程式的书写 化学反应K表达式 1 1/2N2(g)+3/2H2(g) NH3(g)△H<0 K1 = 2 N2(g)+3H2(g) 2NH3(g)△H<0 K2 = 3 2NH3(g) N2(g)+3 H2(g)△H>0 K3 = 4 CaCO3(s)CaO(s)+CO2(g) △H>0 K4 = 5 Cr2O72-(aq)+ H2O(l)2CrO42- (aq)+ 2H+(aq) K5= 6 FeCl3(aq)+3KSCN(aq)Fe(SCN)3(aq)+3KCl(aq) K6= 思考:① K1和 K2, K2和 K3的之间的关系是什么? ②书写化学平衡常数表达式时应注意哪些问题? 五化学平衡的意义 (1)判断可逆反应进行的程度 表格一:下表为25 ℃时,卤化氢生成反应的平衡常数 化学方程式平衡常数K F2+H2 2HF 6.5×1095 Cl2+H2 2HCl 2.57×1033 Br2+H2 2HBr 1.91×1095 I2+H2 2HI 8.67×102 形成规律 (2)判断可逆反应是否达到平衡及反应进行的方向
(完整版)化学反应工程习题
化学反应工程习题 第一部分:均相反应器基本理论 1、试分别写出N 2+3H 2=2NH 3中用N 2、H 2、NH 3的浓度对时间的变化率来表示的该反应的速率;并写出这三种反应速率表达式之间的关系。 2、已知某化学计量式为 S R B A 2 121+=+的反应,其反应速率表达式为B A A C C r 5 .02=,试求反应速率B r =?;若反应的化学计量式写成S R B A +=+22,则此时反应速率A r =?为什么? 3、某气相反应在400 o K 时的反应速率方程式为2 21061.3A A P d dP -?=- τ h kPa /,问反应速率常数的单位是什么?若将反应速率方程改写为2 1A A A kC d dn V r =?-=τ h l mol ./,该反应速率常数k 的数值、单位如何? 4、在973 o K 和294.3×103Pa 恒压下发生下列反应:C 4H 10→2C 2H 4+H 2 。反应开始时,系统中含丁烷为116kg ,当反应完成50%时,丁烷分压以235.4×103Pa /s 的速率发生变化, 试求下列项次的变化速率:(1)乙烯分压;(2)H 2的摩尔数;(3)丁烷的摩尔分率。 5、某溶液反应:A+B →C ,开始时A 与B 摩尔数相等,没有C ,1小时后A 的转化率为75%,当在下列三种情况下,2小时后反应物A 尚有百分之几未反应掉? (1)对A 为一级、B 为零级反应; (2)对A 、B 皆为一级反应; (3)对A 、B 皆为零级反应。 6、在一间歇反应器中进行下列液相反应: A + B = R A + R = S 已知原料组成为C A0 = 2 kmol/m 3,C B0 = 4 kmol/m 3,C R0 = C S0 = 0。反应混合物体积的变化忽略不计。反应一段时间后测得C A = 0 .3 kmol/m 3,C R = 1.5 kmol/m 3。计算这时B 和S 的浓度,并确定A 的转化率、生成R 的选择性和收率。 7、一级可逆反应A = R 在等温下进行。已知C A0 = 500mol/m 3,C R0 = 0。若该反应在一间歇反应器中进行,且在反应温度下667.0=Ae x 。经480 s 后测得333.0=A x 。(1)试确定此反应的动力学方程;(2)计算A x 分别达到0.6和0.65所需的反应时间;(3)比较计算结果,你有什么体会?
影响化学反应速率的因素(第2课时)学案
第二章化学反应速率和化学平衡 第二节影响化学反应速率的因素(第二课时) [教学目标] 1.知识目标 (1)理解浓度、压强、温度和催化剂等条件对化学反应速率的影响。 (2)使学生能初步运用有效碰撞、碰撞的取向和活化分子等来解释浓度、压强、温度和催化剂等条件对化学反应速率的影响。 2.能力和方法目标 (1)掌握运用浓度、压强、温度和催化剂等条件比较反应速率大小的方法; (2)运用探究式教学,通过识别有关化学反应速度与压强、温度或浓度等的图像,提高识图析图能力,培养从图像中挖掘化学信息的能力。 [教学重点、难点]用活化分子理论解释外界条件对化学反应速率的影响 【教学过程】 化学反应是物质运动的一种形式,那么决定这种运动形式运动速率的因素是什么?影响因素是什么? 1.决定因素:参加化学反应的物质的性质(即反应能否发生) 2.影响因素:⑴浓度;⑵温度;⑶压强⑷催化剂;⑸其他因素 一、浓度对化学反应速率的影响 〖思考〗从有效碰撞的角度分析原因? 反应物浓度增大,单位体积内活化分子数增多,有效碰撞的频率增加,反应速率增大 二、压强对化学反应速率的影响 〖思考〗从有效碰撞的角度分析原因? 增大压强,反应物浓度增大,单位体积内活化分子数目增多,反应速率加快。结论:其它条件不变时,有气体参加的反应中,增大压强,反应速率加快;减小压强,反应速率减慢。 〖思考〗:压强对于任意化学反应的速率都有影吗? 注意: 1、压强对反应速率的影响适用于有气体参加的反应。 2、由于固体、液体粒子间的空隙很小,增大压强几乎不能改变它们的浓度,因此对只有固体或液体参加的反应,压强的变化对于反应速率的影响可以忽略不计。
高中化学《第二节化学反应的快慢和限度》导学案
高中化学《第二节化学反应的快慢和限度》导学案 【考纲要求】 1.了解化学反应速率的概念。 2.了解催化剂在生产、生活和科学研究领域中的重大作用。 3.了解化学反应的可逆性。 4.了解化学平衡建立的过程。 5.理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响。 6.了解化学反应速率和化学平衡的调控在生活生产和科学研究领域中的重要作用。 第一课时化学反应速率 【学习目标】 1、1.了解化学反应速率的概念,使学生知道浓度、温度和催化剂等条件对化学反应速率的影响,初步了解如何调控化学反应的快慢。 “催化剂对化学反应速率的影响”等探究活动,培养学生设计2、。通过“认识化学反应的快慢” 半定量实验方案的能力,以及分析和处理实验数据的能力。 3、通过“催化剂与化学工业”等资料介绍,使学生了解控制反应条件在生产和 科学研究中的作用。 重点:影响化学反应速率的因素 难点:影响化学反应速率的因素 【课前预习区】 [问题思考] 1.展示塑料袋,塑料袋给我们的生活带来了很大的方便,也给我们带来无限麻烦。为什么? 2.物体运动有快有慢,我们可以用速率描述其快慢。化学反应有快有慢,我们是如何描述其快慢呢?又有哪些因素影响着化学反应的快慢呢?我们能否控制反应的快慢呢? 【课堂互动区】
为学生提供阅读材料——硫酸制造业的发展, 提高化学反应速率是化学反应研究的又一重要内容,思考: [问题组1] 1、在化学反应过程中还有哪些物理量发生了改变? 2、怎样表示某一化学反应的速率? [整理归纳]一、化学反应的快慢 1、化学反应速率: 表达式: [活动探究] 课本P41 试剂与药品:表面积大致相同的镁条、铁片、H2O2(3%),盐酸(0.5 mol/L),盐酸(3 mol/L),块状碳酸钙,碳酸钙粉末,MnO2粉末 仪器:试管,药匙,镊子,胶头滴管,酒精灯,水槽,量筒,试管夹,导管。 [问题组2] 1.压强对反应速率有没有影响呢?如果有影响,将是如何影响的?
高三二轮专题复习:化学平衡常数(教学设计)
高三二轮专题复习教学设计 化学平衡常数 考纲要求: (6)化学反应速率和化学平衡 ①了解化学反应速率的概念、反应速率的定量表示方法。 ②了解催化剂在生产、生活和科学研究领域中的重要作用。 ③了解化学反应的可逆性。 ④了解化学平衡建立的过程。了解化学平衡常数的含义,能利用化学平衡常数进行相关的计算。 ⑤理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识并能利用相关理论解析其一般规律。 ⑥了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。 高考分析: 化学反应速率和化学平衡是高考的必考容,其主要命题的容有: ①化学反应速率影响因素及其计算; ②化学平衡状态的判断及其影响因素; ③应用平衡移动的原理判断反应进行的方向; ④化学反应速率和化学平衡的图像分析; ⑤转化率、平衡常数的含义及相关计算 将化学反应速率和化学平衡移动的原理与化工生产、生活实际相结合的题目是最近几年高考命题的热点,特别是化学平衡常数的影响因素及其计算是新教材增加的容,高考的热点。 学情分析: 从解题得分的统计可以发现:学生不能灵活的利用平衡移动的规律解决有关平衡的问题,特别是复杂点的问题往往感到触手无策;对平衡常数的理解仅停留在概念定义层面,不能充分发挥它解决平衡问题的功能。 复习目标: 1.加深学生对化学平衡常数的理解,并熟练的利用化学平衡常数进行相关的计算,提高解题技能。 2.帮助学生将化学平衡、平衡常数等知识点进行系统化、网络化。 教学过程: 1.展示考纲要求: 化学反应速率和化学平衡 ①了解化学反应速率的概念、反应速率的定量表示方法。 ②了解催化剂在生产、生活和科学研究领域中的重要作用。 ③了解化学反应的可逆性。 ④了解化学平衡建立的过程。了解化学平衡常数的含义,能利用化学平衡常数进行相关的计算。 ⑤理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识并能利用相关理论解析其一般规律。 ⑥了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。 讲解: 化学平衡常数的影响因素及其计算是新教材增加的容,是高考的热点。2013、2014年新课标全国Ⅰ卷、Ⅱ卷均考查了化学平衡常数这一知识点。
化学反应工程基本概念
第一章 1. 化学反应工程是一门研究 (化学反应个工程问题)的科学。 2. 所谓数学模型是指 (用数学方法表达各变量间的关系)。 3. 化学反应器的数学模型包括 (动力学方程式、 物料横算式子、 热量衡算式、 动量衡算式 和 参数计算式) 4. 所谓控制体积是指 (能把反应速率视作定值的最大空间范围)。 5. 模型参数随空间而变化的数学模型称为 ( 分布参数模型)。 6. 模型参数随时间而变化的数学模型称为 (非定态模型)。 7. 建立物料、热量和动量衡算方程的一般式为 (累积量=输入量-输出量)。 第二章 1. 均相反应是指 (在均一的液相或气相中进行的反应)。 2. 对于反应aA + bB → pP + sS ,则r P =( p/a )r A 。 3.着眼反应物A 的转化率的定义式为(转化率Xa=转化了的物料A 的量/反应开始的物料A 的量)。 4. 产物P 的收率ΦP 与得率ХP 和转化率x A 间的关系为( Xp/Xa )。 5. 化学反应速率式为r A =k C C A αC B β,用浓度表示的速率常数为k C ,假定符合理想气体状态方 程,如用压力表示的速率常数k P ,则k C =[ (RT)的a+B 次方]k P 。 6.对反应aA + bB → pP + sS 的膨胀因子的定义式为 (P+S )-(A+B))/A 。 7.膨胀率的物理意义为 (反应物A 全部转化后系统的体积变化率)。 8. 活化能的大小直接反映了 (反应速率) 对温度变化的敏感程度。 9. 反应级数的大小直接反映了(反应速率) 对浓度变化的敏感程度。 10.对复合反应,生成主产物的反应称为 (主反应),其它的均为(副反应)。 11. 平行反应A → P 、A → S 均为一级不可逆反应,若E 1>E 2,选择性S p 与 (A 的浓度) 无关,仅是 (A 的浓度) 的函数。 12. 如果平行反应A → P 、A → S 均为一级不可逆反应,若E 1>E 2,提高选择性S P 应(提到 温度)。 13. 一级连串反应A → P → S 在平推流反应器中,为提高目的产物P 的收率,应(降 低)k 2/k 1。 14. 产物P 的收率的定义式为 (生成的全部P 的物质的量/反应掉的全部A 的物质的量) 15. 产物P 的瞬时收率φP 的定义式为(生成的物质的量/反应的A 的物质的量) 16. 产物P 的选择性S P 的定义式为(单位时间内产物P 的物质的量/单位时间内生成产物S 的物质的量) 17. 由A 和B 进行均相二级不可逆反应αA A+αB B = αS S ,速率方程为: r A =-dC A /dt=kC A C b 。 求: (1)当C A0/C B0=αA /αB 时的积分式 (2)当C A0/C B0=λ≠αA /αB 时的积分式 18. 反应A → B 为n 级不可逆反应。已知在300K 时要使A 的转化率达到20%需12.6min ,而在340K 时达到同样的转化率仅需3.20min ,求该反应的活化能E 。 第三章 1. 理想反应器是指(理想混合反应器 平推流反应器)。 2. 全混流反应器的空时τ是 (反应器容积) 与(进料的体积流量)之比。 3. 全混流反应器的放热速率Q G ={ 00()A A Hr Ft y x ? }。 4. 全混流反应器的移热速率Q r ={ 012()pm Ft C T T - } 5. 全混流反应器的定常态操作点的判据为{ G r Q Q = }。 6. 全混流反应器处于热稳定的定常态操作点的判据为{ G r Q Q = G r dQ dQ dT dT > }。
高中化学必修二化学反应速率学案
高中化学必修二化学反 应速率学案 Coca-cola standardization office【ZZ5AB-ZZSYT-ZZ2C-ZZ682T-ZZT18】
第二章第一节化学反应速率 1.了解化学反应速率的概念,反应速率的定量表示方法。 2.理解外界条件(浓度、温度、压强、催化剂等)对反应速率的影响,认识其一般规律。 3.了解催化剂在生产、生活和科学研究领域中的重大作用。 4.了解化学反应速率的调控在生活、生产 、判断以下反应的“快”与“慢”: ●炸药爆炸●中和反应●金属锈蚀 ●塑料老化●食物腐败●溶洞形成 2、以上仅仅是“定性”表示出化学反应的 v 1、意义:表征化学反应进行的。 2、表示方法:用单位时间内_____________________或 _____________________来表示。 3、表达式: 4、单位: 例1、在某一化学反应里,反应物A 的浓度在10s 内从L 变成L 。在这10s 内A 的化学反应速率为多少 练习1、在一定条件下,向1L 密闭容器中加入2molN 2和10molH 2,发生反应N 2+3H 2≒2NH 3,两分钟末时,测得剩余氮气为 1mol 。计算V(N 2)为多少V(H 2)、V(NH 3)呢 组内探讨: 1、化学反应速率在取值上有何特点 2、所有的反应物或者生成物是否都可用来表示化学反应速率 3、v =△c/△t ,此处化学反应速率是瞬时速率还是平均速率 4、用不同物质表示同一反应的化学反应速率时,数值是否相同,它们有何数值关系 思考:同一反应在不同条件下测得化学反应速率,如何对它们进行大小比较 练习2、反应A (g )+3B (g )=2C (g )+2D (g ),在不同的情况下测得反应速率如下,其中反应速率最大的是() A . v (D )=() B . v ( C )=() C . v (B )=() D . v (A )=() 小结:同一反应在不同条件下进行的反应,当进行速率大小比较时,可。 二、化学反应的快慢的影响因素 【活动-探究】 实验目的:影响化学反应快慢的因素 探究内容: 1、预测影响反应快慢的因素 2、设计实验方案,并利用所给试剂和仪器进行实验探究 【方法导引】 怎样比较和判断反应的快慢 1、气泡放出的速度 2、反应物消耗的速度 3、沉淀生成的速度 4、颜色变化的快慢等 注意:在探讨外界条件对反应速率的影响时,是在其他条件不变的情况下,去改变其中的一个条件。 试剂:锌片;盐酸(·L -1、3mol ·L -1);锌粉 仪器:试管、药匙、镊子、胶头滴管、试管夹
