水文地球化学PPT总结(东华理工大学)
最新同位素水文地球化学ppt课件

14C的T1/2为5730±40a,地下水定年的上限为(5~6) ×104a。
⑵ 14C定年和14C浓度单位及标准 ① 14C定年公式
t=1/λ㏑(A/A0)
λ=0.693/λ=1.029×10-4a-1
A—— 测得含碳样品的14C产生的放射性,单
位为每分钟每克碳衰变次数(dpm/g)
A0——同一样品与大气平衡时的放射比度 ② 14C相对浓度单位和标准
E. 化学沉淀或生物沉淀的碳酸钙样品的14C含
量对局部比与大气处于平衡的植物的14C含量对局
部条件依赖的程度要高的多。
⑷ 14C年龄误差来源及修正 ① 测量误差;
② 大气中14C含量的变化:P33 图1—2 ③ 利用标准样品及δ13C的变化关系消除系 统误差
⑸ 14C法测定含碳样品的年龄的步骤:
同位素水文地球化学
同位素水文地球化学, 是直接或间接地应用水和
水溶 物质中保存的与水体 来源、形成环境和演化历 史有关的天然同位素信息, 去揭示各种水体的成因、
赋存条件及演化规律 ,为 查明水和水资源服务的学
科。
(2) 地下水氚的定年:
①在一定条件下,地下水流中任意一点 的 滞留氚时(间T)(t)含有量关与,氚其的关输系式入为量:(T0)和水的
上升:1954~1956,1964~1966时期两个高峰期,最
高氚浓度达2000Tu。
(4) 大气降水中的氚的各种效应 ① 纬度效应:氚浓度随纬度的增高而增高;
② 大陆效应:在同一纬度带上,氚浓度随远离 海岸线而逐步升高;
原因:赤道的宇宙射线中子强度变小,极地最 大,因而平流层各处氚的生产率有差别;大气环流 作用的影响;海洋表面的交换和稀释作用;人工氚 来源的加入。
水文地球化学导论.ppt

硒地方病-大骨节病
是一种以软骨坏死为主要改变 的地方性变形性骨关节病,研 究表明可能主要与缺硒有关。
主要发生于儿童和少年,临床 表现为关节疼痛、增粗变形, 肌肉萎缩,运动障碍。
本病在我国分布于由东北斜向 西南的宽带状地域内,包括14 个省、市、区的302个县
中国大骨节 病分布
硒地方病-大骨节病
砷中毒
地方性甲状腺肿
俗称“大粗脖”,以甲状腺肿 大为主要病症
分布很广
– 世界约有16亿人生活在碘严重缺乏地区,中国就有4.25亿 – 亚洲的喜马拉雅山地区——非洲的刚果河流域——南美的
安第斯山区——欧洲的阿尔卑斯山区——北美的美国和加 拿大之间的大湖盆地周围以及太平洋新西兰的一些地区 – 我国除上海市以外,各省、自治区、直辖市都有不同程度 的地方性甲状腺肿流行区
II
地下水起源与 岩浆水
Ⅰ—海洋水 Ⅱ—沉积盖层 Ⅲ—地壳的晶质岩 Ⅳ—岩浆源 Ⅴ—地幔岩 Ⅵ—大陆冰盖
I
III
I
V
IV
1—幔源初生水;2—返回地幔的水;3—重结晶脱出水(再生水);4—沉积水;5— 埋藏水;6—地内水循环;7—小循环;8—大循环;9—地下径流;10—地表径流
HGC的研究意义
实际意义
– 2 CaCO3 (灰岩) + MgCl2 = CaMg(CO3) 2 (白云岩) + CaCl2
HGC是在水文地质学与地球化学的基础上发展 起来的一门独立学科
HGC
– 奠基人是地球化学家维尔纳茨基 – 创始人是水文地质学家奥弗琴尼柯夫
地球化学VS HGC
– 是研究地球元素的迁移、富集规律的一门学科,是研究地球 的化学组成、化学作用及化学演化的科学
第4章 水文地球化学参数

第四章水文地球化学参数水文地球化学参数有三类:物性水文地球化学参数,条件水文地球化学参数,综合性水文地球化学参数。
第一节物性和条件水文地球化学参数一、物性水文地球化学参数物性水文地球化学参数是反映事物的性质(物质的性质和物质间相互作用时的质量和能量关系)的参数。
如平衡常数,反应速度常数,分配系数,吸附容量,自由能,焓,熵,标准电子活度或标准电极电位,离子电位,离子半径和价态,以及原子结构和其外层的价电子层结构都是反映事和物内在本性的参数。
这些参数反映的是事物的本性,或反映的仅仅是事物在理想状态时的特征。
事物在理想条件下的状态与实际条件下是有一定的差距的。
在研究客观具体事物时还需根据具体条件作具体分析。
但尽管如此,收集和掌握这些参数对水文地球化学研究无疑是非常必要和有益的,因为这些参数是对事物进行分析判断的基础,是对事物进行理论计算和实践设计必不可少的参数。
二、条件水文地球化学参数条件水文地球化学参数是反应体系及其环境所处的条件的参数,是用来描述事物或体系与环境的外观状态的参数,当然也是进行水文地球化学计算时所需要的基本数据。
它们主要有水化学组分,含量,pH,pE或Eh,温度,压力等。
无疑这些参数是水文地球化学研究和计算中必不可少的重要参数,因而也是我们野外和实验室工作中必须取得的主要资料。
第二节参比和综合性水文地球化学参数上面已提及,仅有物性水文地球化学参数是不能对水岩体系的客观状态和变化作出确定性的定量回答,也是无法对水岩体系进行具体的水文地球化学计算。
但是仅仅依靠条件水文地球化学参数也是不够的,因为同一个客观具体条件对不同的事物的影响显然是不尽相同的。
对一个事物要作出既科学又符合客观实际的回答,必须将理论与实践相结合,也就是说,将事物的条件状态与该条件下事物发生变化的边界状态相比较,才能对事物的状态、发展结果和将可能发生的事件作出正确的论断。
反映实际条件与该具体条件下的边界条件相比较的结果的参数便是综合性的参数,如饱和指数、反应条件指数等。
地球化学-东华理工大学地球化学课件6(2)- TJH共29页
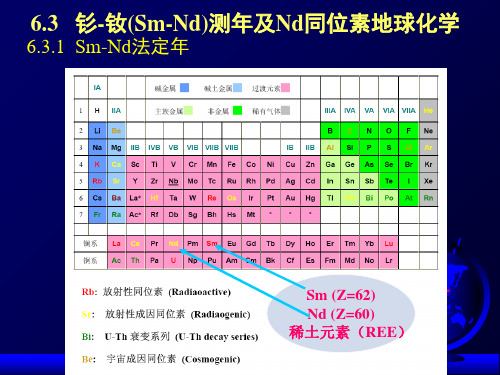
低变质相火山岩定年
1.Sm-Nd同位素系统的封闭性在低变质作用 过程中不易被改变;
2.矿物及岩石的Sm-Nd同位素系统的封闭温 度较高(相对于Rb-Sr而言);
3.最早的Sm-Nd定年研究主要集中于太古宙 火山岩的结晶年龄的测定。
6.3.2 Sm-Nd同位素模式年龄
假设未发生分异作用的原始地幔岩浆库 是一个具有球粒陨石Sm/Nd比值的均一 岩浆库(CHUR),并假定地壳岩石的 Sm/Nd比值变化只发生在从CHUR源区 分离的时刻,其后Sm/Nd比值保持不变 ,则地壳岩石在一个时间为t的 (143Nd/144Nd)0值就是CHUR源区在时间为 t的演化值.
对于球粒陨石:
(143Nd/144Nd)CHUR(t)=(143Nd/144Nd)CHUR-(147Sm/144Nd)CHUR (eλt-1) (1) 式中:(143Nd/144Nd)CHUR(t)为CHUR在时间为t时的比值;
(143Nd/144Nd)CHUR 和(147Sm/144Nd)CHUR分别为CHUR的现代值,其中 (143Nd/144Nd)CHUR=0.512638,(147Sm/144Nd)CHUR=0.1967。
147Sm的衰变常数较小,因此Sm-Nd法只适合对 古老岩石的定年。
自然界中,各岩石的Sm/Nd比值变化范围 较小(一般变化于0.1-0.5之间),而酸性 岩类其Sm/Nd比值变化范围更小。因此, Sm-Nd全岩等时线法不宜对酸性岩进行年 龄测定,主要应用于对基性岩、超基性岩 等岩类的年龄测定,而对于基性和超基性 的结晶岩,往往应用全岩+矿物等时线法 进行年龄测定效果更好 。
上式中,TCHUR称样品相对CHUR的Nd同位素模式年龄,代表地壳物质从 CHUR中分离的时间或壳幔发生分异的时间。
水文地球化学电子教案ppt课件

病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
二、植物-土壤影响阶段
土壤的氧化还原条件改变金属元素的价态
– 氧化条件下
As、Fe、Mn形成难溶化合物,阻碍其随地下水迁移,并减小了对 农作物的危害
Cr、Zn、Cu、Cd形成易溶化合物,有利于其随地下水迁移,并 加强了对农作物的危害
– 水文地球化学分带性——地下水化学成分在空间变 化的规律性
自然地理分带——水平分带 地质分带 ——垂直分带
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
表生带地下水的平均化学成分特征
渗入成因的溶滤潜水
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
表生带地下水化学成分特征
表生带地下水的分带性受下列因素影响
– 一级因素:气候 – 二级因素:植被 – 三级因素:岩性
气候是控制表生带地下水分带性最宏观一级的 因素
二、植物-土壤影响阶段
经过植物-土壤的地下水的特征
– 含有数量可观的碳酸 – 未被氧化的有机化合物的进一步分解将使水中碳酸进一步提高 – 相对于碳酸盐矿物与原生铝硅酸盐矿物,远未达到饱和状态,
即具有强溶解能力;
上述特征决定了地下水具有很强的与围岩介质发 生反应的能力。
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
第四讲 地下水化学成分的形成与特征
水文地球化学ppt

02
ONE
河流水文地球化学
1河流水文地球化学
河流水文地球化学是研究河流水体的综合性水文地球化学研究。它研究的对象 是河流,研究的内容包括水体的物理性质、化学性质、生物性质等,以及水文 地球化学过程的发生机制。
2河流水文地球化学的研究方法
01
(1)水体物理性质研 究:包括河流的流量、 温度、溶解氧、溶解氮、 溶解磷、pH值、浊度、
河流水文地球化学的研究结果可以应用于水资源保护、水环境改善、河流治理、水质监测等 方面。
1、水资源保护:通过河流水文地球化学的研究,可以明晰河流的水质变化规律,提出河流 水质的安全标准,以保护河流水质。
2、水环境改善:通过河流水文地球化学的研究,可以掌握河流水体的水质特征,提出合理 的水环境改善方案,以改善河流水环境。
一、概述
演讲人 2023-01-16
目录
01
Hale Waihona Puke 概述02河流水文地球化学的应用
03
河流水文地球化学
04
总结
水文地球化学ppt
01
ONE
概述
1什么是水文地球化学?
水文地球化学是研究地球上的水资源,包括河流、湖泊、海 洋、地下水和其他水体的水文和地球化学组成的学科。它研 究的对象是地球上的水体,研究的内容包括水体的物理性质、 化学性质、生物性质等,以及水文地球化学过程的发生机制。
3、河流治理:通过河流水文地球化学的研究,可以为河流的治理提供理论依据,提出合理 的河流治理方案,最大限度地提高河流的水质水量,并保护河流的生态系统。
4、水质监测:通过河流水文地球化学的研究,可以掌握河流水体的水质变化规律,为河流 水质的监测提供依据,以更有效地监测河流水质。
地球化学-东华理工大学地球化学课件4 -TJH
共生呢?
酸性岩主要是K、Na、Si、Al、Be、Th等形 成的矿物组合,基性岩主要是Fe、Mg等形 成的矿物组合;
不同矿石、矿物元素组合方式千变万化,但 同一类型岩石中特定元素则相伴出现 (why??)。 反映自然界元素之间存在一定的结合倾向和 规律,即:元素存在形式和共生规律。
一 自然作用体系和自然作用产物
一 自然作用体系及自然作用产物
(3)具多变度单向发展演化特征的开放体系
具多变度单向发展演化特征。体系与环境之间存在充分 物质和能量交换,因外来成分加入或内部组分排出不断 改变系统内作用性质和条件; 碳酸钙在盐酸中的分解反应: CaCO3+2HCl→Ca2++2Cl+H2O+CO2,实验室中可以CO2不能逃逸的方式进行,反应 达到平衡, 过量CO2和HCl共存而不反应。自然条件下 由于CO2逃逸到空气中,反应不能达到平衡。 地表条件下气体逃逸或离子或分子被地下水带走,化学 反应可能不会达到平衡。自然界一些反应速率非常缓慢 不易达到平衡;
1.2 受前述各方面的因素影响,自然作用产物的特 征有: (1) 自然作用形成的稳定相 ( 矿物 ) 及各种流体相的 总数有限 迄今发现的矿物总数约有3000多种(不包括天然有 机化合物),矿物化合物只有7大类,矿物总族数不 过200。 实验室中人工制取的化合物总数达三十万种,动植 物总数达数万种。 显然地球的组成和物理化学条件有限的范围控制着 矿物种数和种类。
一 自然作用体系及自然作用产物
(4) 自发进行的不可逆过程。反应进行的方向、 速率、限度受能量效应制约;
由于作用能源来自地球本身,因此地球热量的空 间分布控制着地球化学过程进行的规模和强度。 同时由于自然体系为多相多组分复杂体系,化学 反应还受动力学因素制约,作用过程具有不彻底 性。
地球化学-东华理工大学地球化学课件3 - TJH-PPT精品文档
(2)通过对大区域出露的不同岩石进行系统取样 和分析.
在区域内采集不同时代的不同类型岩石的代表性 样品,对所获得的样品进行分析测试,然后按照各 类岩石在区域内所占的比例,求出该区域的元素丰 度。
世界上迄今为止只有加拿大地盾和中国东部两 个地区。 优点:1、是上地壳元素丰度研究的最可靠办法;2、 可以同时研究所有主量元素和微量元素的唯一方法。
2)泰勒和麦克伦南(Taylor和McLennan,1985)提出 细粒碎屑沉积岩,特别是泥质岩,可作为源岩出露区上 地壳岩石的天然混合样品,用后太古宙页岩平均值扣除 20%计算上部陆壳元素丰度。
(3)细粒碎屑沉积岩法
缺点:不能给出大陆上地壳主量元素的丰度,对微量元 素的研究也仅限于不溶元素和中等程度的不溶元素。
第三章
地球的化学组成
本章内容
1、地球的结构 2、大陆地壳的结构和组成特征 3、大洋地壳 4、地壳的元素丰度 5、地幔的组成 6、地核的组成 7、地球外部圈层的组成 8、地球的化学组成
1、地球的结构
地震横波:在固态中传播,在液态中不能传播。传播速度慢。 地震纵波:在固态、液态中均可以传播,传播速度快。
人们已获得对大陆地壳研究的认识
1. 大多数地区地壳由上、中、下地壳三层组成。 2. 随深度增加,温度和压力增大,变质程度升高,因此不 同深度的岩石对应不同的变质相。 上地壳:未变质相至绿片岩相岩石和花岗岩侵入体组成 (花岗质)
中地壳:英云闪长岩-奥长花岗岩-花岗闪长质片麻岩为主 的角闪岩相岩石组成(英云闪长质)
鉴别大陆地壳剖面的标志为(Fountain and Salisbury, 1981):
(4)地表出露的被确认为下地壳的岩石可直接延伸至地壳深部。 根据地震波速与岩石类型和化学成分之间的关系,可由地震测深 结构推测深部岩石组成。
地球化学-东华理工大学地球化学课件2-TJH-精选文档
二、陨石的化学成分
1、陨石(Meteorite):是从外层空间落到 地球上的固体物质,质量大小从几克 到几十吨不等. 陨石和流星(meteor)都 来自流星体(meteoroid),当流星 体足够大,并能够受住大气层的严峻 考验落到地面,即为陨石。
2、陨石的研究意义
陨石是空间化学研究的重要对象,具有重要 的研究意义: ① 它是认识宇宙天体、行星的成分、性质及 其演化的最易获取、数量最大的地外物质; ② 也是认识地球的组成、内部构造和起源的 主要资料来源; ③ 陨石中的60多种有机化合物是非生物合成 的“前生物物质”,对探索生命前期的化学演 化开拓了新的途径; ④ 可作为某些元素和同位素的标准样品(稀 土元素,铅、硫同位素)。
体系中元素的丰度(abundance)值实际上只能对这 个体系里元素真实含量的一种估计,它只反映了元素 分布特征的一个方面,即元素在一个体系中分布的一 种集中(平均)倾向。 元素在一个体系中的分布(distribution) ,特别是 在较大体系中决不是均一的。因此,元素的分布还包 含着元素在离散程度(不均一)的特征,因此元素的 分布: ①元素的相对含量(平均含量)= “丰度”;② 元素含量的不均一性(分布离散特征数、分布所服从 统计模型)。 需要指出的是,从目前的情况来看,地球化学对元 素特征所积累的资料(包括太阳系、地球、地壳)都 仅限于丰度的资料,关于元素分布的离散程度及元素 分布统计特征研究,仅限于少量范围不大的地球化学 体系内做一些工作。
花岗岩
华南燕山早期 花岗岩体分布图
地球
估算地球化学体系总体化学组成的方法: ① 用主体代表整体。如用太阳的组成代表太 阳系的组成。 ② 若已知系统各部分的成分后,可用加权平 均法求整体的化学组成。如用上中下地壳 的组成求整体地壳的化学组成。 ③ 在拟定的模型基础上,求系统的化学组成 。如用陨石对比法求地球的化学组成。
水文地球化学PPT总结(东华理工大学)
第一章绪论第二章水溶液的物理化学基础一、水的结构2. 水分子的内部结构原子结构理论表明,H2O分子呈V形结构,H-0键的夹角为104° 45',键长为0.96? (1?=10-10m )2. 水分子的内部结构由于氧的电负性为 3.5,氢的电负性为 2.1,(中性原子接受电子的能力,称为电负性)这种差异导致了H、O形成共价键。
由于氧的电负性大,所以共价电子偏向氧原子,这样使氧带有部分负电性,氢还有部分正电性,这就造成了极性共价键。
由这种极性共价键所形成的分子称为极性分子。
3. 电负性(E)电负性就是原子在化合成分子时把价电子吸引向自己的能力。
规定氟的电负性为 4.0,并以此为标准求出其它元素的电负性。
电负性小于2.0时,多数元素显金属性,大于2时,多数元素显非金属性。
铀的电负性为 1.7,显金属性。
U4+的电负性为1.4, U6+为1.9 , U4+的金属性较U6+强。
电负性差值大于2的两个元素化合时,多数形成离子键化合物,电负性差值小于2时,多数形成共价键的化合物。
由于电负性影响化合物的键性,而化学键的性质又影响到化合物的许多物理化学性质,如硬度、光泽,溶解度等,所以电负性对元素的迁移和沉淀也有影响。
3. 水分子间的联结水分子间是靠氢键联结起来的。
所谓氢键是一种因静电吸引作用而产生的附加键,所以一个水分子中的氢原子,在保持同本分子中氧原子的共价键的同时,又能同相邻水分子中的氧原子产生一种静电吸引力。
这样水分子就有具有了两种类型的键:(1)存在于水分子内部的极性共价键;(2)存在于水分子之间的氢键。
3.水分子间的联结水分子间的氢键联结,使水分子相互缔合形成巨型分子( H2O) n,水分子的这种缔合强度取决于温度,一般温度越低,缔合程度越稳定,4C时,水的缔合程度最大,此时达到最大密度。
在250〜300C时,n接近1,即水具有H2O形式。
水分子在缔合过程中不会引起化学性质的变化。
这种由单分子水结合成多分子水而不引起水的化学性质改变的现象,称为水分子的缔合作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章绪论第二章水溶液的物理化学基础一、水的结构2.水分子的内部结构原子结构理论表明,H2O分子呈V形结构,H-O键的夹角为104°45′,键长为0.96Å(1Å=10-10m)2.水分子的内部结构由于氧的电负性为3.5,氢的电负性为2.1,(中性原子接受电子的能力,称为电负性)这种差异导致了H、O形成共价键。
由于氧的电负性大,所以共价电子偏向氧原子,这样使氧带有部分负电性,氢还有部分正电性,这就造成了极性共价键。
由这种极性共价键所形成的分子称为极性分子。
3.电负性(E)电负性就是原子在化合成分子时把价电子吸引向自己的能力。
规定氟的电负性为4.0,并以此为标准求出其它元素的电负性。
电负性小于2.0时,多数元素显金属性,大于2时,多数元素显非金属性。
铀的电负性为1.7,显金属性。
U4+的电负性为1.4,U6+为1.9,U4+的金属性较U6+强。
电负性差值大于2的两个元素化合时,多数形成离子键化合物,电负性差值小于2时,多数形成共价键的化合物。
由于电负性影响化合物的键性,而化学键的性质又影响到化合物的许多物理化学性质,如硬度、光泽,溶解度等,所以电负性对元素的迁移和沉淀也有影响。
3.水分子间的联结水分子间是靠氢键联结起来的。
所谓氢键是一种因静电吸引作用而产生的附加键,所以一个水分子中的氢原子,在保持同本分子中氧原子的共价键的同时,又能同相邻水分子中的氧原子产生一种静电吸引力。
这样水分子就有具有了两种类型的键:(1)存在于水分子内部的极性共价键;(2)存在于水分子之间的氢键。
3.水分子间的联结水分子间的氢键联结,使水分子相互缔合形成巨型分子(H2O)n,水分子的这种缔合强度取决于温度,一般温度越低,缔合程度越稳定,4℃时,水的缔合程度最大,此时达到最大密度。
在250~300℃时,n接近1,即水具有H2O形式。
水分子在缔合过程中不会引起化学性质的变化。
这种由单分子水结合成多分子水而不引起水的化学性质改变的现象,称为水分子的缔合作用。
液态、固态水均以巨型分子形式存在,汽态水才以单分子的形式存在。
二. 水的特异性质1.水具有独特的热力学性质(1)水的生成热很高:水的稳定性很好,在2000K的高温下,水的离解度仅为0.588%,保证了水在地下深部高温状态下可广泛参与水文地球化学作用过程。
(2)水具有很高的沸点和达到沸点以前的极长液态阶段:这一性质保证了地球上大量液态水的存在,而高沸点是由于水分子间的氢键强度大而产生的。
(3)水的热传导、热容及热膨胀性能几乎比其它所有液体都高:这一性质使水对自然界起到良好的调节作用,利于人类和各种生物生存2.水具有较大的表面张力(1)液体中,除汞以外,水的表面张力最大。
水的表面张力随温度的升高而剧减。
(2)水的表面张力对研究包气带地下水的地球化学作用将具有重要意义。
水具有较小的粘滞性和较大的流动性水的粘滞性小,流动性大,从本质上说,仍是由于水分子的极性共价键和氢键联结所决定的。
4.水具有高的介电效应(1)在水中,盐类离子晶体发生离解时,一些水分子围绕着每个离子形成一层抵消外部静电引力(或斥力)的“绝缘”外膜,它会部分中和离子的电荷,并阻止正负离子间的再行键合。
这种绝缘效应(或屏蔽效应)称为介电效应。
(2)介电常数:表征在某介质中电荷之间的吸引力比在真空中减少的倍数。
水的介电常数在常温下为81,0℃时为88,100℃时为56。
这意味着正负离子在水中的相互吸引力比在真空中减少81倍。
5.水具使盐类离子产生水合作用的能力(1)水分子由于具有较强的极性,所以它可借助于较强的静电引力来吸引和牵制水中的离子。
(3)水分子正极(氢端)吸引水中阴离子,而负极(氧端)吸引阳离子。
这种水中离子和水分子之间能相互吸引作用,使水中正负离子周围为水分子所包围的过程称为离子的水合作用。
(3)离子的水合作用减弱了正负离子间的相互引力,这是多数盐类溶解于水的重要原理。
6.水具有良好的溶解性能一. 热力学基本原理活度与活度系数(1)活度的定义指实际参加化学反应的物质浓度,或指所研究的溶液体系中化学组分的有效浓度。
(2)活度系数的计算对于矿化度<100mg/L的天然水,ri=1,浓度=活度;对于矿化度>100mg/L的天然水,ri有两种情况:对于矿化度>100mg/L的天然水,离子强度< 0.1mol/L,采用Debye-Huckel公式(迪拜-休2.逸度活度用于气体和蒸汽时,叫逸度或挥发度,3.质量作用定律与平衡常数在地下水化学平衡的研究中,“质量作用定律”非常有用。
它的基本含义是,一个化学反应的驱动力与反应物及生成物的浓度有关。
4.自由能与平衡常数关系(1)自由能定义:指一个反应在恒温恒压所做的最大有用功,用G表示。
△Gf0:指在标准状态下(25℃,1atm=1巴=105Pa)标准生成自由能,即在标准状态下由最稳定的单质生成1mol纯物质的自由能变化(查表)。
元素和单质的△Gf0:按热力学规定为零。
在标准状态下,反应自由能变化称为“反应的标准自由能变化”:(1)饱和指数的概念饱和指数是确定水与矿物处于何种状态的参数,以符号“SI”表示。
(2)标准氧化还原电位(Eo)指在标准状态下,金属与含有该金属离子且活度为1mol/L的溶液相接触的电位,称为该金属的标准电极电位:++2e=Pb Eo Pb2+/Pb=-0.126v以氢的标准电极电位为零测定)由于标准电极电位表示物质的氧化及还原能力的强弱,所以又称为标准氧化还原电位,以符号Eo表示,其单位为V。
半反应中物质的氧化态和还原态称为相应的氧化还原电对。
如Pb2+-Pb,表示为Eo Pb2+/Pb Eo 越大,氧化能力越强在水文地球化学研究中,我们常常通过绘制Eh-pH图(或pE-pH图)来定性或定量地评价水中化学组分的优势范围,解释和预测地下水成矿及热液矿床中矿物的分布及稳定性等,制作的具体步骤和方法:⑴写出有关的反应式,它们包括:表示水的稳定范围的化学式;被研究物质的物种形式转换化学式,它们可以是水解反应式、离解反应式、氧化还原反应式等。
⑵根据质量作用定律写出上述有关化学反应式的边界条件计算方程式。
⑶用计算法或作图法求出有关边界线之交点,划出各条化学反应边界线,并消去边界线段交点以外不需要的多余的部分。
由于自由电子与质子具有相反的电性,它们势必为互为消长的关系。
换句话说,在氧化环境(高pE)将为酸性环境(低pH),而在还原环境(低pE)将为碱性环境(高pH)。
因此,pE-pH直线都是向右倾斜的。
1.质量摩尔浓度(molality)一千克溶剂中溶质的物质的量,旧名为重量克分子浓度。
其单位符号为摩尔/千克(mol/kg)。
此单位在应用中最为精确,在质量计算过程中不会发生问题。
物质的量的浓度(molar)每升溶液中溶质的物质的量,也叫物质的量的浓度,旧名容量克分子浓度。
采用摩尔/升(mol/L)的符号,它是水化学中经常使用的浓度单位。
在低矿化度水中用这种单位可满足计算的一般要求,但对高矿化度水进行质量计算时,就会出现较大的误差。
如海水中1 mol/L的钠只相当于0.97 mol/kg的钠,因为一公升海水的质量不是一公斤,而是1.035千克。
3.质量浓度在天然水研究中使用得最普遍的质量浓度单位是mg/L。
以上三种单位皆是国际单位制单位(单位制)。
以下是水文地球化学研究中还经常出现的一些非国际单位制单位。
当量浓度及其单位当量浓度(eql)是每升溶液中溶质的克当量数(N),其单位符号为eq/L。
克当量数等于克分子量(M)数乘以溶质的价态(Z)。
百万分率(ppm)每百万克溶液中溶质的克数。
ppm = 溶质的克数/106克溶液。
对于非咸水来说,1ppm = 1mg/L,但是对咸卤水来说,1ppm 1mg/L。
第三章地下水的无机化学成分3.1 地下水中的大量组分一、氯离子(Cl-)、迁移性能;Cl-具有很强的迁移性能,其原因有三个方面:(1)不形成难溶化合物。
(2)不被胶体所吸附。
(3)不被生物所吸附。
、分布规律地下水中的Cl-含量随地下水矿化度的增高而增高。
在高矿化度水中,占阴离子首位,形成氯化物水。
、来源;(1)有机来源;(2)无机来源(盐、矿物);(3)大气降水二、硫酸根(SO42-)、迁移性能迁移性能较强,仅次于Cl- ,其迁移性能受下列四个因素控制:(1)水中SO42-易与Ca2+、Ba2+、Sr2+等离子形成难溶盐。
(2)热带潮湿地区土壤中的Fe(OH)2-、Al(OH)22+胶体可以吸附SO42-。
(3)吸被生物吸收,硫是蛋白质的组成部分。
(4)脱硫酸作用:在缺氧、有脱硫酸菌存在的情况下,SO42-被还原成H2S等的过程。
、分布规律(1)SO42-含量随地下水矿化度增高而增加,但增加速度明显落后于Cl-。
在中等矿化度水中,常成为含量最多的阴离子。
(2)在某些特殊情况下,地下水中含量可达到很高,例如硫化矿氧化带中的矿坑水,石膏层地下水。
、来源(1)石膏、硬石膏及含硫酸盐的沉积物。
(2)硫化物及天然硫的氧化。
(3)火山喷发物中的硫和的氧化。
(4)大气降水中的SO42- 。
(5)有机物的分解。
(6)生活、工业、农业废水。
三、HCO3-和CO32-1、碳酸平衡及其与pH值的关系地下水中的碳酸以三种化合物形态存在:(1)游离碳酸,它以溶解的CO2(aq)或H2CO3形态存在,习惯上记为“H2CO3”。
(2)重碳酸根,即HCO3(3)碳酸根,即CO3可以推出pH值与各碳酸组分之间的关系:由这两个关系可求出CO2溶于水后各溶解类型占优势的pH值范围,在25℃,1atm条件下:pH<6.4 ,占优势;6.4<pH<10.3 ,占优势;pH>10.3,占优势。
2、分布规律(2)来源①大气中CO2的溶解;②各种碳酸盐类及胶结物的溶解和溶滤;③非碳酸盐的火成岩的生物风化作用④深成CO2的加入:一半来自CO2,一半来自碳酸四、硅酸―地下水中的SiO2、地下水中SiO2的存在形式(1)硅酸的形式在地下水中的硅酸有以下几种:H4SiO4(正硅酸),H2SiO3(偏硅酸),H2Si2O5(二偏硅酸),H6Si2O7(焦硅酸),H2SiO3因其形式简单,常以它代表水中的硅酸。
(2)地下水中SiO2的存在形式在大多数的地下水中,SiO2以不离解的H4SiO4形式存在,但在强碱性条件下,水中会出现H3SiO4-。
在强碱性条件下(pH>9),H4SiO4往往会发生聚合,形成硅胶溶液。
1、地下水中SiO2的存在形式(2)地下水中SiO2的存在形式SiO2在地下水中的存在形式归纳为:①在一般的地下水中,SiO2以H4SiO4(单体硅酸)或硅酸钠钾盐的分子分散状态存在,硅胶出现极少。
②在碱性地下水中,SiO2部分以H4SiO4形式存在,部分以H3SiO4-形式存在,部分以硅胶形式存在。
