费歇尔投影式是1891年德国化学家费歇尔
费歇尔试剂

费歇尔试剂费歇尔试剂(Fehling's reagent)是一种常用于检测还原糖的化学试剂。
它由费歇尔试剂A和费歇尔试剂B两部分组成。
费歇尔试剂A是含有硫酸铜的溶液,而费歇尔试剂B则是含有碱性碘化钠的溶液。
这两种试剂混合后可以产生一种明亮的红色沉淀物。
费歇尔试剂是由德国化学家费歇尔于1849年发现的,他通过实验发现,还原糖能够将费歇尔试剂中的铜离子还原为氧化铜沉淀。
这个发现为检测还原糖提供了一种简便而有效的方法。
在实际应用中,费歇尔试剂常用于检测葡萄糖、果糖等还原糖的存在。
当还原糖存在于溶液中时,与费歇尔试剂发生反应后会生成红色的沉淀物,从而可以判断溶液中是否含有还原糖。
这种检测方法被广泛应用于食品工业、生物化学等领域。
费歇尔试剂的使用方法相对简单。
首先,将费歇尔试剂A和费歇尔试剂B按照一定的体积比例混合,形成费歇尔试剂溶液。
然后,将待检测的溶液与费歇尔试剂溶液混合反应,观察是否产生红色沉淀物。
如果产生红色沉淀物,则说明溶液中存在还原糖。
需要注意的是,费歇尔试剂对于非还原糖是没有反应的。
非还原糖是由两个或更多糖分子通过糖苷键结合而成的,无法将费歇尔试剂中的铜离子还原为氧化铜沉淀。
因此,在使用费歇尔试剂进行检测时,需要先将非还原糖水解成还原糖,然后再进行检测。
费歇尔试剂的反应结果也可以通过观察溶液的颜色变化来判断。
当溶液中存在还原糖时,费歇尔试剂溶液会从蓝色变为绿色,再逐渐转变为红色,并伴随有红色沉淀物的生成。
而如果溶液中不存在还原糖,则费歇尔试剂溶液的颜色不会发生明显的变化。
费歇尔试剂在化学分析中的应用十分广泛,除了用于检测还原糖外,还可以用于定量分析。
通过测量沉淀物的质量或溶液中铜离子的减少量,可以计算出还原糖的含量。
费歇尔试剂是一种常用的检测还原糖的化学试剂。
它的使用简便、结果明显,被广泛应用于食品工业、生物化学等领域。
通过费歇尔试剂的使用,我们可以快速准确地检测出溶液中是否含有还原糖,为科学研究和生产实践提供了重要的帮助。
透视式、纽曼投影式与费歇尔投影式的相互转化方法

透视式、纽曼投影式与费歇尔投影式的相互转化方法构象透视式、纽曼投影式与费歇尔投影式的相互转化方法的讨论*1 纽曼式转化成费歇尔式1.1 手性原子对应关系的确定根据纽曼式,画出费歇尔式的框架,并确定对应关系。
纽曼式中朝向自己的手性原子和后面的手性原子分别对应于费歇尔投影式中下面的手性原子和上面的手性原子。
伸开右手的拇指与食指,使拇指与食指在水平方向且指向纸面前方,即面向自己,恰好和费歇尔式的横键相对应,即食指代表左侧横键,拇指代表右侧横键,手腕代表竖键。
如图1,1所示。
图1,1 纽曼式转化成费歇尔式步骤一1.2 确定费歇尔式中手性碳原子上所连的原子或原子基团先确定费歇尔式中手性碳2 上所连的原子或原子基团。
纽曼式中碳2 上连有H、Br、CH3 和碳1。
由于碳1 已确定,现主要确定H、Br、CH3 在费歇尔式中的位置。
根据费歇尔式的书写规则,图1,2 纽曼式转化成费歇尔式步骤二要将分子的主碳链直立,并使命名编号小的碳原子处在上方,如图1,1 所给结构。
由此可知,甲基应放在费歇尔式中的竖键上。
如图1,2 所示,即手腕代表甲基了。
将手平移至纽曼式上,在纸面上逆时针或顺时针转动手腕,使拇指、食指和手腕分别与碳2上的3 个原子或原子基团重合。
食指对应Br,而拇指对应H,就可以在费歇尔式中左侧横键处写Br,右侧横键处写H。
如图1,3 所示。
图1,3 纽曼式转化成费歇尔式步骤三根据费歇尔式的书写规则可知,甲基应放在竖键上。
同理,可利用上述方法确定碳1 横键上的原子或原子基团。
所确定的费歇尔式如图1,4所示。
图1,4 纽曼式转化成费歇尔式步骤四2 透视式转化成费歇尔式2.1 手性原子对应关系的确定如图2,1 所示,透视式中朝向自己的手性原子对应于费歇尔式中下面的手性原子;透视式中后面的手性原子对应于费歇尔式中上面的手性原子。
图2,1 透视式转化成费歇尔式步骤一2.2 费歇尔式中手性碳2 上所连原子或原子基团的确定同上,根据费歇尔式的书写规则可知,甲基放在竖键上,如图2,2 所示。
维生素C有左旋、右旋之分吗?功效有差别吗?

维⽣素C有左旋、右旋之分吗?功效有差别吗?维⽣素C ⼜称抗坏⾎酸,英⽂名是VitaminC,是⼀个含有6个碳原⼦的酸性多羟基化合物。
在⾃然界中植物能从葡萄糖和果糖中合成维⽣素C;多数动物也可利⽤葡萄糖的碳链经过四步酶的催化⽣成维⽣素C;但是⼈类及其他灵长类哺乳动物及某些鸟类编码最后⼀个催化酶的基因发⽣了突变,导致体内缺乏葡萄糖酸内脂酶⽽不能⾃⾝合成,必须由外界⾷物供给来满⾜机体需要。
纵观历史,我们知道维⽣素C的缺乏曾经严重威胁着⼈类的健康,特别是远航⼈员尤为严重,但是⼈类这个有创造⼒的物种终于在1933年成功合成了维⽣素C,也解决了因维⽣素C缺乏导致的相关疾病。
但是围绕维⽣素C所引发的争议则远远没有结束,⽐如我们今天将要谈论的左旋维⽣素C与右旋维⽣素C。
为了让⼤家看的更明⽩些,我们先来了解⼀些概念:旋光性、左旋、右旋、对应异构及D-L标记法我们⽇常见到的太阳光或电灯泡的光可以看作是由⼀些微⼩的波构成的,这些波可以在任何⼀个平⾯上振动,它们的振动⽅向可能均匀地分布在所有各个⽅向上,这些光通过尼可尔棱镜后,其振动平⾯就只有⼀个和镜轴平⾏的平⾯。
这种仅在某⼀平⾯上振动的光,叫平⾯偏振光,简称偏振光。
能使偏振光发⽣偏转的性质称之为旋光性,那么具有这种旋光性的物质,称为旋光性物质。
使偏振光振动平⾯向右旋转(顺时针⽅向)的叫右旋,⽤“d”表⽰,向左旋转(反时针⽅向)的叫左旋,⽤“l”表⽰。
“d”与“l”分别是 dextro 和 levo 的缩写,意思就是右和左。
那么为什么会出现这种差异呢?经过研究发现是由于构成旋光物质的分⼦结构的不对称性引起的。
有⼀些化合物组成他们的元素相同,但其空间结构排列⽅式可能不同,彼此互为镜像,不能重叠,⽴体化学上称为⼿性。
但凡为⼿性分⼦就⼀定有互为镜像的两种构型,其中的任何⼀种形态是另⼀种形态的镜像,互为镜像的两种构型的异构体叫做对映体,此异构称为对映异构。
异构的产⽣是⼿性碳原⼦所连接的原⼦或原⼦团在空间的分布不同产⽣的。
Pasteur提出分子旋光性与手性分子所含螺旋结构有关联

Pasteur提出分⼦旋光性与⼿性分⼦所含螺旋结构有关联旋光异构与⼏何异构统称为⽴体异构(stereo isomerism)。
判断分⼦的⽴体异构是为了便于确认结构是怎么回事。
旋光性属于物理性质,需要⽤旋光仪测定才能知道⼀个分⼦到底是左旋还是右旋。
有机化学的分⼦结构⽴体异构,跟实际的旋光性有没有直接的联系?为了向化学家们提供⽤以区分右旋物质和左旋物质的参照物或对⽐标准,德国化学家E.费歇尔选择了⾷糖的近亲,即称之为⽢油醛的简单化合物。
它是当时研究得最为透彻的旋光性化合物之⼀(其实费歇尔没有⽤“旋光仪”)。
费歇尔任意地(指定羟基)将⽢油醛的⼀种形态规定为是左旋的,称之为L-⽢油醛,⽽将它的镜像化合物规定为是右旋的,称之为D-⽢油醛。
任何⼀种化合物,只要能⽤适当的化学⽅法证明(这是⼀项相当细致的⼯作)它具有与L-⽢油醛类似的结构,那么,不管它对偏振光的作⽤是左旋的还是右旋的,都被认为属于L系列,并在它的名称前冠以L。
后来发现,过去认为是左旋形态的酒⽯酸原来属于D系列,⽽不属于L系列。
现在,凡在结构上属于D系列⽽使光向左转动的化合物,我们就在它的名称前⾯冠以D(-);同样,有些化合物则要冠以D(+)、L(+)和L(-)。
1955年,荷兰化学家⽐杰沃特终于确定了什么样的结构会使偏振光左旋,什么样的结构会使偏振光右旋。
⼈们这才知道,在左旋形态和右旋形态的命名上,E·费歇尔只不过是碰巧运⽤了“左右”术语⽽已。
以1860年Pasteur提出的旋光性与⼿性分⼦所含螺旋结构有关联的设想为模型,许多学者剖析了某些光学活性分⼦。
表明Pasteur的设想是符合实际情况的,即右螺旋呈现右旋光性,左螺旋呈现左旋光性。
同时,通过螺旋模型和旋光⽅向与Brewster 的基团可极化性序列相结合,则可以推导出⼿性碳原⼦的构型。
螺旋理论认为,⼏乎所有的有机化合物结构中都存在螺旋,螺旋结构是导致旋光性的根本原因。
左⼿螺旋左旋;右⼿螺旋右旋。
l-构型和D-构型与rs构型

l-构型和D-构型与rs构型L-构型和D-构型为了避免任意指定构型所造成的混乱,19世纪末,费歇尔建议用甘油醛为标准来确定对映体的构型。
它们的投影式如下:指定:(Ⅰ)代表右旋甘油醛,-OH在手性碳原子的右边,这种构型被定为D-型;(Ⅱ)代表左旋甘油醛,-OH在手性碳原子的左边,被定为L-型。
因此(Ⅰ)是D-(+)-甘油醛,(Ⅱ)是L-(-)-甘油醛。
D和L分别表示构型。
而(+)和(-)则表示旋光方向。
这样的规定,可能完全符合事实,也可能与事实相反。
在选定了以甘油醛这样的构型为标准后,就可以通过一系列的化学反应,把其他旋光性化合物与甘油醛联系起来,以确定它们的构型。
例如:以上各反应都只是分别在C-1和C-3两个官能团上进行的,并没有改变和手性碳原子相连的-H和-OH的空间排列关系,即-OH都处在手性碳原子右边。
因而都和D-(+)-甘油醛具有相同的构型,都属于D-型。
必须注意构型和旋光方向没有一定关系,从上式可以看出,D-甘油醛是右旋的,而D-乳酸却是左旋光的。
对于一对对映体而言,如果D-型是左旋体,那么L-型一定是右旋体。
反之也如此。
通过像上面所说的化学方法确定的构型,是以甘油醛人为指定的构型为标准的,并不是直接测定出来的,所以称为“相对构型”。
至于两种甘油醛的“绝对构型”(真正的构型),直到20世纪50年代初才得到解决。
1951年,毕育特(Bijvoet)利用特种χ射线结晶法,直接确定了右旋酒石酸铷钠的绝对构型,证实了它的相对构型就是绝对构型。
因而也证实了过去任意指定的甘油醛的构型也正是它们的绝对构型。
这样一来,相对标准变成了绝对标准。
凡用甘油醛为标准所确定的旋光化合物的相对构型,也就是它们的绝对构型。
D、L-构型表示法有其局限性,只适用于有一个手性碳原子化合物。
对于含多个手性碳原子的化合物就难于表示。
但由于习惯的原因,目前在糖和氨基酸类物质中仍较普遍采用。
R-构型和S-构型由于D、L-构型表示法有局限性,1970年,IUPAC建议根据绝对构型的观点,对对映异构体的构型提出了另一种表示方法,即R、S-构型表示法,这种方法不需选定什么化合物作为标准,而是直接对化合物的立体结构或其透视式甚至投影式进行处理。
有机化学旋光异构

l 为旋光仪使用的光源的波长(通常用钠光( l =589.3nm),以D表示)。
比旋光度表示: 盛液管为1分米长,被测物浓度为1g/ml时的
旋光度。 比旋光度:旋光性物质的一个物理常数,可以定量地表示物质的 旋光能力。像其他物理常数一样,是旋光性物质的一种属性。
旋光仪:测定物质旋光度的仪器
光源
起偏镜 (尼科尔棱镜)
手性与分子的对称性 (1). 对称面
分子的手性(而不是手性碳)是其 具有旋光性和对映异构现象的充分 必要条件
:
假如有一个平面可以把分子分割成两部分,而一部分 正好是另一部分的镜像,这个平面就是分子的对称面。
具有对称面的分子与其镜像能够重合,因而无手性。
甲烷CH4有六个对称面,即通过四面体每条棱与中心碳 原子的平面。 三氯甲烷CHCl3有三个对称面,即通过四面体和氢原子 相连的每条棱与中心碳原子的平面。
CH3 H
=
HO
=
H3C H
OH
(4)对调任意两个基团的位置,对调偶数次构型不变,对 调奇数次则为原构型的对映体。例如:
CHO HO H CH2OH 同一构型 CHO HO H CH2OH H CHO OH CH2OH 对映体 OH与 H对 一 调 次 H CHO CH2OH OH OH与 H对 一 调 次 CH 对 一 CHO与 2OH调 次
如果在两个棱镜之间放一个盛液管,里面装入两种不同的物质:
亮
α 丙 酸
暗 亮
乳酸
结论:
(1)旋光性物质——能使偏振光振动平面旋转了一 定的角度的性质,叫做旋光性;具有旋光性的物质, 叫做旋光性物质。 (2)非旋光性物质——不具有旋光性的物质,叫做 非旋光性物质。
旋光性物质使偏振光旋转的角度,称为旋光度, 以“”表示。
[化学]第三章立体化学
![[化学]第三章立体化学](https://img.taocdn.com/s3/m/709be4fddd3383c4ba4cd248.png)
C NH2 C OH
12
3
5
4
CH2OH
6
第三节 顺反异构
定义:有机物分子中如具有双键或环的存在,键的自由旋 转会受到阻碍,当双键或环上连接不同的原子或基团时, 就会产生顺式和反式的结构,这种异构现象称为顺反异构
(一) 碳碳双键的顺反异构 以丁烯二酸为例,HOOCCH=CHCOOH
沸点 3.5℃ 顺-丁烯二酸
CH3 H Br
CH3
Br
H
C2H5
C2H5
(四)构型和命名法
D,L-构型表示法: 以甘油醛为标准,人为规定:羟基在碳链右边 的为D型,它的对映体为L型。
CHO
H
OH
CH2OH
D-甘油醛
CHO
HO
H
CH2OH
L-甘油醛
CHO H C OH [O]
C H2O H
D-(+)甘油醛
COOH [H]
H C OH
CH2 Cl > CH2 OH > CH2 NH2
3. 对于含有双键或叁键的原子,可看成连有两个 或三个相同的原子。
C=Y
CY (Y) (C)
Y为C、O、N等常见原子,是几重键就相当于连几 个相同的原子。
H (C) CH CH2 相当于 C C H
(C) H
H(C) H(C)
相当于 (C)
H
( C)
丁烷
CH3 CH3 CH CH3
异丁烷
构造异构
官能团位置 异构
CH3CH2CH3
OH
异丙醇
CH3CH2CH2OH
丙醇
官能团异构
CH3OCH3
甲醚
CH3CH2OH
第五章对映异构资料
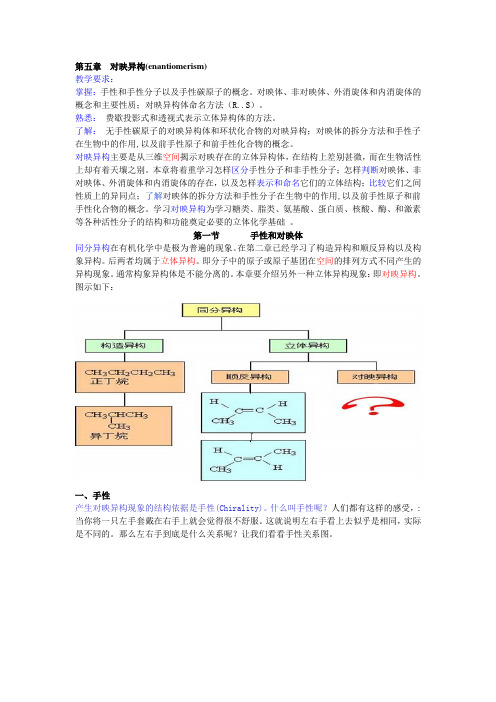
第五章对映异构(enantiomerism)教学要求:掌握:手性和手性分子以及手性碳原子的概念。
对映体、非对映体、外消旋体和内消旋体的概念和主要性质;对映异构体命名方法(R..S)。
熟悉:费歇投影式和透视式表示立体异构体的方法。
了解:无手性碳原子的对映异构体和环状化合物的对映异构;对映体的拆分方法和手性子在生物中的作用,以及前手性原子和前手性化合物的概念。
对映异构主要是从三维空间揭示对映存在的立体异构体,在结构上差别甚微,而在生物活性上却有着天壤之别。
本章将着重学习怎样区分手性分子和非手性分子;怎样判断对映体、非对映体、外消旋体和内消旋体的存在,以及怎样表示和命名它们的立体结构;比较它们之间性质上的异同点;了解对映体的拆分方法和手性分子在生物中的作用,以及前手性原子和前手性化合物的概念。
学习对映异构为学习糖类、脂类、氨基酸、蛋白质、核酸、酶、和激素等各种活性分子的结构和功能奠定必要的立体化学基础。
第一节手性和对映体同分异构在有机化学中是极为普遍的现象。
在第二章已经学习了构造异构和顺反异构以及构象异构。
后两者均属于立体异构。
即分子中的原子或原子基团在空间的排列方式不同产生的异构现象。
通常构象异构体是不能分离的。
本章要介绍另外一种立体异构现象:即对映异构。
图示如下:一、手性产生对映异构现象的结构依据是手性(Chirality)。
什么叫手性呢?人们都有这样的感受,:当你将一只左手套戴在右手上就会觉得很不舒服。
这就说明左右手看上去似乎是相同,实际是不同的。
那么左右手到底是什么关系呢?让我们看看手性关系图。
图3-1 手性关系图这种左右手互为镜像与实物关系,彼此又不能重合的现象称为手性。
自然界中有许多手性物,例如:足球、剪刀、螺丝钉等都是手性物。
微观世界的分子中同样存在着手性现象。
有许多化合物分子具有手性。
二、手性分子和对映体图3-2是一对互为镜像关系的乳酸分子的立体结构式(透视式):a和b两个立体结构式之间有何种关系?它们代表相同的分子?还是代表不同的分子?不妨观察上述乳酸分子的两个立体结构式的球棍模型图示(见图3-3)图3-3-1乳酸球棍模型图示图3-3-2 乳酸球棍模型为什么乳酸存在一对对映体?仔细观察图3-2的两个乳酸分子的结构,可发现分子中有一个碳原子(C2)所连的四个基团(COOH,OH,CH3,H)均不相同。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
费歇尔投影式是1891年德国化学家费歇尔(Fischer)提出用投影方法所得到的平面式。
这是有机化学中常用的一种投影式。
其方法是把分子和球棒模型照规定的方向投影到纸平面上。
例如乳酸分子模型的投影式如图3-1所示
费歇尔投影式投影的方法是:球棒模型(Ⅰ)放置的方法是将竖键指向后,横键伸向前再进行投影。
连接在球棒模型中心的碳原子在纸面上,其上下方向的原子或原子团(竖键上)是指向纸平面的后方,投影到纸面上用虚线表示。
其左右方向的原子或原子团(横键上)是伸向纸平面的前方,投影到纸面上用楔形线表示。
如图3-1中的(Ⅱ)式。
为了书写简便常不用虚线和楔形线表示,而直接用实线表示,见图3-1的(Ⅲ)式。
但我们必须清楚的知道在费歇尔投影式中原子和原子团的空间关系是竖键指向后方,横键伸向前方。
一个模型可以写出多个费歇尔投影式。
图3-1这种碳链竖放、按命名规则编号小的碳原子放在上方,是多种投影式中的一种。
1 纽曼式、透视式与Fischer 投影式的互换
1.1 重叠式的纽曼式、透视式与Fisher 投影式的互换
互换口诀:左中右一致。
即左对左,中对中,右对右;中位:前对上,后对下(或上对上,下对下)。
1.2 交叉式的纽曼式、透视式与Fischer 投影式的互换
互换口诀:中位:上对上,下对下。
两边:近位(离观察者近的位置)左右不变,远位(离观察者远的位置)左右对调。
2 楔形式与Fischer 投影式的互换
互换口诀:实线对中位,上对上,下对下;楔线对左右,左
对左,右对右。
(“实线”指实线上的基团;“楔线”指虚楔线和实楔线上的基团。
)
例如:
3 透视式、纽曼式与楔形式的互换
要将透视式和纽曼投影式转换成楔型式,可先按照1 中的方
法判断出透视式和纽曼投影式的R/S 构型,再按照2 中的方法将其反转换成楔型式。
例如:
4. Fischer投影式中的苏式、赤式的含义
在Fischer投影式中,两个手性碳原子上连的相同的基团在同一侧则为赤式,在异侧苏式。
如下图
苏式
赤式
石瑞峰有机化学。
