谷胱甘肽含量测定
氧化型谷胱甘肽测定方法

氧化型谷胱甘肽测定方法引言:氧化型谷胱甘肽(oxidized glutathione, GSSG)是一种重要的抗氧化物质,它在细胞内起到清除自由基和保护细胞免受氧化损伤的作用。
因此,准确测定氧化型谷胱甘肽的含量对于了解细胞氧化状态和维持细胞正常功能具有重要意义。
本文将介绍几种常用的氧化型谷胱甘肽测定方法。
一、梅尔二硫代苯酚法梅尔二硫代苯酚法是一种常用的氧化型谷胱甘肽测定方法。
该方法利用氧化型谷胱甘肽与2,2'-二硫代苯酚反应生成深黄色化合物,通过比色法测定其吸光度来计算氧化型谷胱甘肽的浓度。
该方法简单、快速,且具有较高的灵敏度和准确性。
二、高效液相色谱法高效液相色谱法是一种常用的氧化型谷胱甘肽测定方法。
该方法利用高效液相色谱仪对氧化型谷胱甘肽进行分离和测定。
首先将样品中的氧化型谷胱甘肽与还原剂还原生成还原型谷胱甘肽,然后通过高效液相色谱仪进行分析。
该方法具有分离效果好、灵敏度高、准确性高的优点,但操作复杂,需要专门的仪器设备。
三、酶联免疫吸附测定法酶联免疫吸附测定法是一种基于酶标记技术的氧化型谷胱甘肽测定方法。
该方法利用特异性抗体与氧化型谷胱甘肽结合,然后通过酶标记的二抗与抗体结合,最后通过底物的酶促反应生成产物,通过测定产物的光吸光度来计算氧化型谷胱甘肽的浓度。
该方法具有高灵敏度、高特异性和较强的抗干扰能力,但需要较长的操作时间。
四、电化学法电化学法是一种常用的氧化型谷胱甘肽测定方法。
该方法利用电极对氧化型谷胱甘肽进行氧化还原反应,并通过测定电流的变化来计算氧化型谷胱甘肽的浓度。
该方法具有快速、准确、灵敏度高的优点,但需要专门的电化学仪器设备和操作技术。
结论:氧化型谷胱甘肽测定方法有多种选择,每种方法都有其特点和适用范围。
选择合适的测定方法需要根据实际需求和条件来决定。
无论采用哪种方法,都需要严格控制实验条件和操作步骤,以确保测定结果的准确性和可靠性。
希望本文介绍的几种常用的氧化型谷胱甘肽测定方法对读者有所帮助。
氧化型谷胱甘肽(GSSG)检测试剂盒(DTNB 比色法)说明书
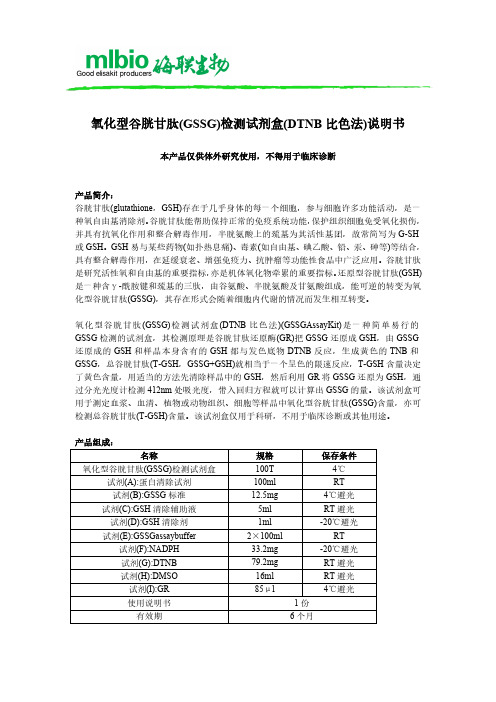
氧化型谷胱甘肽(GSSG)检测试剂盒自备材料:1、匀浆器或研钵、离心管或小试管、低温离心机、水浴锅2、蒸馏水、PBS或生理盐水、70%乙醇3、分光光度计、比色皿操作步骤(仅供参考):1、配制GSSG标准储存液:取12.5mgGSSG标准加入2mlddH2O,溶解并混匀,即为GSSG 标准储存液(10mM)。
一部分立即使用,其余适当分装后-20℃保存。
2、配制GSH清除剂工作液:在1mlGSH清除剂中加入9ml70%乙醇,溶解并混匀,即为GSH 清除剂工作液。
3、配制NADPH工作液:在33.2mgNADPH中加入4mlddH2O,即成NADPH工作液,一部分立即使用,其余适当分装后-20℃保存。
4、配制DTNB储存液:在79.2mgDTNB中加入16mlDMSO,溶解并混匀,即为DTNB储存液(12.5mM)。
一部分立即使用,其余适当分装后-20℃保存。
5、配制GR工作液:按GR:GSSGassaybuffer=1:49的比例混合,即为GR工作液。
-20℃保存,1个月有效。
注意:试剂(I)量较少,使用前应先4℃离心后再使用。
6、配制标准品:把GSSG标准储存液(10mM)用蛋白清除试剂稀释成50μM标准溶液,然后依次稀释成25、12.5、6.25、3.125μMGSSH标准溶液,取空白、3.125、6.25、12.5、25、50μMGSSG标准溶液6个点作标准曲线。
注意:由于GSSG标准在蛋白清除试剂中不太稳定,用蛋白清除试剂配制的GSSG溶液必须新鲜配制后使用,不可冻存后再使用。
7、准备样品:①红细胞或血浆样品:取新鲜血液,600r/min离心10min,沉淀为红细胞,上清为血浆。
对于红细胞,用PBS洗涤两次,取约50μl红细胞沉淀或血浆,加入50μl蛋白清除试剂,充分Vortex振匀。
4℃或冰浴放置10min,4℃10000r/min离心10min,取上清,用于GSSG测定,样品需暂时4℃保存备用,不立即测定的样品可以-70℃保存,但不宜超过10天。
还原型谷胱甘肽(GSH)与氧化型谷胱甘肽(GSSG)的测定

还原型谷胱甘肽(GSH)与氧化型谷胱甘肽(GSSG)的测定关键词:还原型谷胱甘肽GSH氧化型谷胱甘肽GSSG测定2009-04-24 00:00 来源:互联网点击次数:6147GSH和GSSG 参照Anderson等(1992)。
取0.5 g样品,加入3 mL冰冷的6%的偏磷酸(含1 mmol•L-1 EDTA ,pH 2.8),冰浴研磨,匀浆液以20,000 g,4 ℃离心15 min,取上清液来马上测定GSH和GSSG的含量或储存在-20 ℃下等待测定。
总的GSH和GSSG含量测定如下:200 μL提取液加 1.2 mL反应液包含400 μL反应液1(110 mmol•L-1 Na2HPO4•7H20,40 mmol•L-1NaH2PO4•H2O,15 mmol•L-1EDTA,0.3 mmol•L-15,5‘-dithiobis-(2-nitrobenzoic acid)DTNB,0.04% BSA)、320 μL反应液2 (1 mmol•L-1 EDTA,50 mmol•L-1 imidazole 咪唑solution and 0.02% BSA)、400 μL反应液3(5% Na2HPO4,pH 7.5的溶液稀释50倍)、80 μL 9.0 mmol•L-1 NADPH。
测定OD412下的吸收值。
GSSG 含量测定如下:200 μL提取液加入1 mL的2-2乙烯嘧啶(稀释50倍)在25°C下水浴1 h再测定OD412下的吸收值。
GSH的含量可以从总的GSH和GSSG含量中减去GSSG含量获得。
GSH测定方法:取样品0.5 g,加入预冷的5%磺基水杨酸2.5 ml和少许石英砂,充分冰预研磨,转入离心管中,于4℃下20,000×g离心20min,将上清液分装,液氮冷冻后于-20℃保存或直接进行抗氧化剂分析。
取50 μL上清液,用5% 磺基水杨酸定容至100 μL (即加入5% 磺基水杨酸50 μL),加入24 μL 1.84 mol•L-1三乙醇胺triethlene diamine以中和样液,加入50 μL 10% 乙烯吡啶Polyvinyl pyridine (用70% 乙醇配制),25℃水浴1 h,以除去GSH,到时加入706 mL 50 mmol•L-1磷酸缓冲液,pH 7.5,内含2.5 mmol•L-1 EDTA,加入20 μL 10 mmol•L-1 NADPH 和80 μL 12.5 mmol•L-1 DTNB(二硫硝基苯甲酸),混匀,25℃保温10 min,到时加入20μL 50 U•mL-1 GR,总体积为1 mL,立即混匀,读出3 min时的OD值。
3, 5-二硝基水杨酸比色法

3, 5-二硝基水杨酸比色法
3,5-二硝基水杨酸比色法是一种化学方法,主要用于检测生物组织或细胞中还原型谷胱甘肽的含量。
其原理是利用谷胱甘肽与3,5-二硝基水杨酸反应生成有色物质,通过比色法测定该有色物质的吸光度,从而计算出谷胱甘肽的含量。
该方法具有灵敏度高、操作简便、结果准确等优点,被广泛应用于生物医学、药物研发等领域。
在生物医学领域,该方法可用于研究疾病的发生发展过程中谷胱甘肽含量的变化,为疾病的诊断和治疗提供依据。
在药物研发领域,该方法可用于评估药物对谷胱甘肽含量的影响,为新药研发提供参考。
GSH含量测定

GSH含量测定一、原理还原性谷胱甘肽(GSH)是植物细胞重要的抗氧化剂之一,是一个良好的表示氧化胁迫的指标。
GSH+TDBN在pH=7时生成黄色物质,其颜色深浅与GSH的浓度成线性关系。
即:在巯基化合物的存在下,无色的DTNB将被转变成黄色的5-巯基-2-硝基苯甲酸。
由于5-巯基-2-硝基苯甲酸在412 nm处具有最大吸收,DTNB的吸收光谱并不干扰巯基的测定。
二、材料、试剂、仪器1、材料:小麦叶片2、试剂(1)GSH标准溶液:称取10mg 分析纯GSH,溶于蒸馏水中,并定容于10ml,即为1mg/ml 之标准母液,用稀释10倍(0.1mg/ml GSH);(2)5%偏磷酸;(3)0.2mol/L 磷酸钾缓冲液,pH7.0;(4)TDNB试剂:称取39.6mg二硫代双-二硝基苯甲酸(TDNB),用0.2mol/L磷酸钾缓冲液溶解并定容于100ml;(5)1mol/L NaOH溶液。
2、仪器(1)可见分光光度计:4台;(2)离心机:1台(10000转/分);(3)1/千天平-2台;(4)离心管:3支×16(10ml)(5)刻度试管:4×16支;(10或15ml)(6)普通试管(刻度试管):7支×4(15*150 标准曲线)(7)刻度吸管:0.5ml-8支; 1ml-8支; 2ml-16支; 5ml-8支;(8)研钵:1×16个;(9)比色杯4套;(10)吸水纸适量;(11)剪刀8把;(12)玻棒8支;三、方法步骤:1、制作标准曲线:取7支刻度试管,编号,按表加入试剂:将上述溶液混合均匀,在室温下显色5min。
在412nm波长下测定吸光度。
以标准溶液中GSH浓度为X,吸光度为y,制作标准回归方程,(并求出GSH含量。
)2 、样品测定:称取植物鲜样0.204g加入少量5%偏磷酸研磨提取,并用5%偏磷酸定容到10ml。
10000rpm 离心10min。
离心后取上清液2 ml,同标准曲线操作。
(整理)谷胱甘肽中文概述

谷胱甘肽1谷胱甘肽(GSH)结构与功能1.1 GSH 的结构特征1.2 GSH的生理功能和应用1.3 总谷胱甘肽测定方法2几种谷胱甘肽的检测方法2.1 比色法2.2 荧光法2.3 高效液相色谱法(HPLC )2.4DTNB法2.5 碘量法3几种谷胱甘肽的制备方法3 . 1溶剂提取法3 . 1 . 1谷胱甘肽的提取3 . 1 . 2谷胱甘肽的分离纯化3 . 2化学合成法3 . 3酶合成法3 . 4发酵法谷胱甘肽(Glutathione)1谷胱甘肽(GSH)结构与功能1.1GSH 的结构特征GSH 由谷氨酸、半胱氨酸和甘氨酸通过肽键形成,分子中有一特殊的γ-肽键,即由谷氨酸的γ-COOH 与半胱氨酸的α-NH2缩合成的肽键,它不同于蛋白质分子中的普通肽键。
GSH 为白色晶体,易溶于水、低浓度乙醇水溶液、液氨和二甲基甲酰胺。
2分子GSH脱氢后以二硫键相连形成氧化型谷胱甘肽(GSSG),又称谷胱甘肽二硫化物,多以水合物形式存在,是溶于水的白色晶体。
胱甘肽的相对分子质量为307 . 33;熔点为189~193 ℃(分解) ;溶于水、稀醇、液氨和二甲基甲酰胺,不溶于醇、醚和丙酮;谷胱甘肽固体较为稳定,水溶液在空气中则易被氧化[ 5 ]。
两分子GSH的活泼巯基氧化脱氢转变为一分子GSSG,但只有GSH才具有生理活性。
1.2 GSH的生理功能和应用GSH分子含有γ-谷氨酰基和活性巯基,是GSH许多重要生理功能的结构基础。
GSH在红细胞中作为巯基缓冲剂存在,维持血红蛋白和其它红细胞蛋白质的半胱氨酸残基处于还原状态。
GSH 还广泛存在于其它正常细胞中,有很强的亲和力,能与多种化学物质及其代谢物结合,清除体内氧自由基及其它自由基,具有保护肝细胞膜、促进肝酶活性、抗氧化、解毒等作用,是人体细胞内的主要代谢调节物质。
GSH 还在蛋白质和DNA 合成、物质运输、酶活性、新陈代谢及细胞保护等生物学功能中起着直接或间接的作用。
还原型谷胱甘肽 (reduced glutathione,GSH)含量测定试剂盒使用说明
还原型谷胱甘肽(reduced glutathione,GSH)含量测定试剂盒使用说明产品简介:GSH/GSSG是细胞内最重要的氧化还原对之一。
因此,测定细胞内GSH和GSSG含量以及GSH/GSSG比值,能够很好地反映细胞所处的氧化还原状态。
DTNB与GSH反应生成复合物,在412nm处有特征吸收峰;其吸光度变化与GSH含量成正比。
试验中所需的仪器和试剂:可见分光光度计、低温离心机、水浴锅、可调节移液器、1ml比色皿、双蒸水产品内容:试剂一×1支,充分溶解于100ml双蒸水,4℃保存试剂二×1支,充分溶解于50ml试剂一中,4℃保存试剂三×1支,充分溶解于10ml双蒸水中,4℃避光保存操作步骤:一、样品前处理:取组织约0.1g,加1ml试剂二,冰上充分研磨,8000rpm4℃离心10min,取上清。
(如上清不清澈,再离心3min)GSH测定操作:测定前将试剂一于25℃水浴20min按每100mg组织加入1000µL生理盐水的比例进行匀浆。
8000g4℃离心10分钟,取上清,置冰上待测。
对于非哺乳动物组织:按每100mg组织加入1000µL提取液的比例进行匀浆。
8000g 4℃离心10分钟,取上清,置冰上待测。
(2)血清(浆)样品:直接检测。
二、测定操作表:测定管空白管样本0.1ml/试剂一0.7ml0.7ml蒸馏水/0.1ml试剂三0.2ml0.2ml 迅速混匀,于412nm测吸光值,并记录第60s的OD值GSH含量计算:GSH标准曲线公式:y=0.0015x+0.0818(x为GSH浓度,y为吸光值)液体中GSH(µmol/L)=[(OD测定管-OD空白管)-0.0818]/0.0015×样品稀释倍数组织中GSH计算:①GSH(µmol/mg prot)=[(OD测定管-OD空白管)-0.0818]/0.0015×样品稀释倍数÷样品蛋白浓度(Cpr)②GSH(µmol/g mass)=[(OD测定管-OD空白管)-0.0818]/0.0015×样品稀释倍数÷样品质量(g)注意事项:(1)样品处理等过程均需要在冰上进行,且须在当日测定酶活力,以免影响其活力测定时,除试剂一外,其它试剂均需放置在冰上;(2)样本测定前先取1-2个样做预实验,如吸光值太高(超过标准曲线范围,即y >0.2时),应先用试剂二稀释到适当倍数,使得吸光值在标准曲线范围内。
长白山野生蓝莓中还原型谷胱甘肽含量的测定
长白山野生蓝莓中还原型谷胱甘肽含量的测定谷胱甘肽(L-γ-谷氨酰-L-半胱氨酰-甘氨酸,Glutathione)是一种同时具有γ-谷氨酰基和巯基的生物活性三肽化合物,作为生物体内的非蛋白巯基化合物,谷胱甘肽主要有还原型(GSH)和氧化型(GSSG)两种形态,在机体中大量存在并起主要作用的是还原型谷胱甘肽。
临床上,谷胱甘肽可以迅速提高机体免疫力,在抗氧化、抗辐射、清除自由基、解毒、促进铁质吸收等方面具有良好的效果且无副作用;在食品加工领域,谷胱甘肽具有增强食品营养价值和强化食品风味等功能。
科学家们一直研究它在各种生物体内的生理作用,其中GSH在人体各种组织细胞中的含量以及与各种疾病、组织损伤的关系至今仍然是研究的热点[1-2]。
蓝莓,又称笃斯、越橘,俗称都柿,为杜鹃花科越橘属野生落叶灌木,其果实为浆果,成熟后为蓝紫色,球形或椭圆形,果皮有白霜。
蓝莓的果味鲜美、营养丰富,英国权威营养学家将蓝莓列为15种健康食品之首,联合国粮农组织也将蓝莓列为人类五大健康食品之一。
本研究采用DTNB作为GSH的衍生化试剂进行超声波细胞破壁,这种操作可以对蓝莓粉末破壁的同时又可以給衍生化试剂充分的反应时间进行衍生化反应而生成稳定的GSH衍生化产物。
其目的是利用衍生化试剂所进行的化反应来避免巯基化合物从细胞内流出时而被外界的其他化学环境破坏,从而生成稳定的产物,利用其产物的颜色来进行分光光度分析而得到样品中的GSH含量及定性信息。
1 材料与方法1.1实验材料、试剂与仪器1.1.1材料蓝莓购于延吉市千盛超市。
1.1.2试剂与药品5,5-二疏基-2,2-二硝基苯甲酸/DTNB、还原型谷胱甘肽、磷酸氢二钠、氢氧化钠、石油醚、海砂。
1.1.3实验仪器JA-3100精密电子天平(深美仪器有限公司);FA1004电子天平(上海良平仪器仪表有限公司);CX-100高速多功能粉碎机(上海市晟喜制药机械有限公司);DHG-*****-Ⅲ电热恒温鼓风干燥箱(上海新苗医疗器械制造有限公司);KQ-500DE型医用数控超声波清洗器(昆山市超声仪器有限公司);TDL-5000B冷冻离心机(上海安亭科学仪器厂);PHS-3CpH计(上海仪电科学仪器股份有限公司);UV-1800紫外/可见分光光度计(上海美谱达仪器有限公司);SJ-2028R榨汁机(佛山市顺德区金宜美电器有限公司);80目网筛;索氏提取器。
【doc】几种谷胱甘肽的检测方法
几种谷胱甘肽的检测方法2007.3(总第146期)几种谷胱甘肽的检测方法陈俭梅周琳(1.山东师范大学生科院济南250014)(2.山东大学医学院济南250014)摘要测定谷胱甘肽含量的方法有多种,目前还没有一种既快速,稳定,特异,又十分灵敏,经济的测定方法.本文对谷胱甘肽的各种测定方法作一综述.关键词谷胱甘肽检测GSH存在于所有生物细胞中,而以酵母,谷物种子胚芽,人体和动物的心脏,肝脏,肾,红细胞和眼睛晶状体中含量较高.正常人体内还原型谷胱甘肽和氧化型谷胱甘肽(GSSG)的比例为100:1,全血中GSH的正常浓度约为371mg/dl,人体的肝脏和肾脏是GSH主要的合成,代谫}和排泄器官.谷胱甘肽的主要生物学功能是保护生物体内蛋白质的巯基进而维护蛋白质的正常生物活性,同时它又是多种酶的辅酶和辅基.GSH的重要生物学功能与谷胱甘肽的分子结构有密切关系,例如GSH分子中的巯基参与中和氧自由基,解毒等重要助能;所含的Y一谷氨酰胺键能维持分子的稳定性并必参与转运氨基酸;GSH中的甘氨酸和半胱氦酸残基参与胆酸的代谢等….近年来,随着对GSH的生理,乍化等_片面研究的深入,GSH在医学,食品,保健,防衰老等方面正引起人们日益广泛的注意.谷胱甘肽(GSH)用途广泛,用基因工程微生物生物合成方法是生产谷胱甘肽的主要方式.作为前之一?,胱氯酸的浓度较高,对谷胱甘肽的测定有干扰.已有几种方i=_去用于半胱氨酸存在时谷胱甘肽的测定:酶分析方法可测高达1000倍半胱氨酸存在时谷胱甘肽的含量,结果较准确,但需价格昂贵的辅酶Ⅱ和谷胱甘肽还原酶,并且后者活力变化严重影响测量结果;色谱法冗长费时;Jocelyn采用将样品仁硫酸中煮沸lh的方法,不太安全;Wronski方法效果较好,但需用对羟基汞苯甲酸和萤光黄;荧光法容易受干扰,误差较大;乙二醛酶法需要复杂的技术和殴备J.日前测定谷胱甘肽含量的方法有多种,如嗨循环法,比色法,荧光光度法,流式细胞仪法,滴定法,高效毛细管电泳法和近些年发展的高压液相色谱法等,这些方法备有其优点,但也都有不足,日前还没有一种既快速,稳定特异,又…t分敏,经济的测定方法,谷胱甘肽的测定方法有待进…步的发展和完善.下面埘日前常用的儿种主要的测定方法做?介绍,比较和评价.1酶循环法其测定原理为氧化一还原反应:GSH被DTNB(5,5一dithiobis一2一nitrobenzoicacid;5,5一二巯一2一硝基苯酸)氧化,生成GSSG和稳定的TNB(5一thio一2一nitrobenzoicacid;5一巯基一2一硝基苯酸); GSSG与GSSG还原酶及NADPH(还原型烟酰胺嘹嘿呤■核苷酸磷酸)反应,还原成GSH.在NADPH与GSSG还原酶维持GSt?l总最不变的条件下,GSH和DTNB反应生成TNB的速率与样本中总谷胱甘肽成比.TNB于412nm波长处有最大吸光度,可以通过分光光度计来测定总谷胱甘肽水平(GSH+GSSG)-31.酶法测定谷胱甘肽,样本的制备要迅速,为GSH很容易氧化而使其浓度降低.本法还可测定GSSG水平.酶循环法最初由Owen和Belcher提出,之后由Shandon9FocdFerrnerH童tion246…期)…一一一…………………一.~一……一业堕邑蹩+ Tietze和Griffith进行了改进.酶衢环法是一种灵敏,快速的方法,其最火优点是灵敏度高,可测定含量仪0.1mol/L的样品,【收率93%一j06%.Manju等认:为此方法灵敏度高,但特异性不高,这是由于DTNB可与许多含性巯基基团物质反应.但此法不足之处在于其测定的是谷恍甘肽总量(GSH+GSSG),不能分GSH和GSSG;另外样本的准备电比较严格,要求控制采血至测定时问『卣J隔在3min内,否则将影响测定,使实际应受到很大限制.MargaretA.Baker等将酶循环『去与微量滴定板技术相结合,设计了一种快速,敏感,简便的测定大数量生物样本的GSH,GSSG的方法.其最大优点是可时测定大量的样本.为I'提高灵敏度,TamaraMourad等寻酶循环法与生物发光检测技术相结合,测定GSSG,灵敏度达pm(10.)7k平.2比色法郭黎平等_60测定大豆提取液中谷胱肽的含量时,发现在铜(Ⅱ)一新铜试齐JJ一谷胱甘肽一乙醇体系中测定谷胱甘肽的含量,乙醇具有叫显的增敏作用.采用CuSO.溶液和新铜试剂混合液[Cu一新铜试剂(1:2.5,摩尔比)]作为显色剂,检测波长为456nm,枪测限为2.0ug/ml,线性范围为2.0~24ug/ml,【收牢为99.54%,RSD为0.76%.赵旭东等I}艮据甲醛同谷胱甘肽和常见含笳基物质反应速度的不,提出了在含有其它巯基物磺溶液中测定谷胱甘肽含量的方法,通过控制两个相同供试品和甲醛的不『亩J反应时间,测定两者在波长为412nm时的吸收度,根据两者不同的吸收度值得出谷胱汁肽的含量.线性范为0.19~0.95g/L,回收率为96.7%,方法的结果误差小于0.5%.该方法实验成本低,分析快速,简,适于测定生物合成反应液中谷胱廿肽的含量.3荧光法曹新志等I噪用邻苯l¨_:甲醛(o—phthaldialdehyde, OFt)作为络合剂,住磷酸缓冲液(pH8.0)中,应用荧光分光光度讣来测定黄瓜中恍肽的含量.检测限为0.1ug/ml,线性范为0.1~40ug/ml,回收率为99.73%,RSD为1.24%.Hissin等选用OPT作荧兜剂,采用偏磷酸一磷酸钠一EDTA缓冲溶液(pH8.0),用以测定哺乳动物心脏和肝脏中谷胱甘肽的含量,谷胱甘肽的检测限为0,05umol,线性范围为0.05~0.8umol,RSD为4%.张建莹等探讨了金属离子对还原型谷胱"肽(GSH)一邻苯二甲醛(OPA)体系荧光信号的影响,实验结果表明Zn对体系的荧光信号有增强作用,而且zn能够提高GSH—OPA体系的稳定性,据此建立了一种以Zn作为荧光增强剂,快速简便测定还原型谷胱甘肽的新方法.GSH在1.3×10~1.4×10mol/L的范围内其浓度与体系相对荧光强度有良好的线性关系,检出限为1.1×10mol/L.本实验方法比较适合生物样中还原型谷胱甘肽浓度的测定.4高效液相色谱法(HPLC)HPLC是近年测定复杂牛物样本中各种毓基物的最好£法.HPLC过程足溶质住固定相和流动相之问由于分配系数,吸附能力,亲和力,分子大小不同,进行连续分离的过程.HPLC法优点是可以区分开GSH,GSSG及20多种含巯基氨基酸衍生物.其足是灵敏度高,样本中GSH含量不得低于50umol/L;且样本的前处理过程耗时,测定大样本时不方便,所用的桂特殊. ARodrigueuz—Ariza等州介绍丫一种结合电化学法快速测定谷胱甘肽水平的方法.该法应用一套双通道电化学测定仪,可同时测定GSH,GSSG,还可测定PSSG(蛋白结合谷恍}_f'肽),具有高灵敏度,高选择性,高效的优点.Chung—shiYang等介绍了一种将HPLC与微透析联机测定谷胱甘jj太. 此法缩短r分析测定时间,简化了样本的准备过程,并提供了连续的监测程敬君等采刚KCIi容液一HCI溶液一甲醇一EDTA为流动相,电化学检测器(工作电极为玻碳电极,参比电极为Ag/AgCI,l丁作电为0.9V),测定鼠脯徽透析液中咣甘肽的含,枪测限为10nmol/L,叫收率为87_3%,RSD为1.8%. Brent等用甲醇和乙酸钠溶液(pH7)作为流动相,列'苯■醛(Orthophthalaldehyde,OPA)和恍甘肽络合生成一种高荧光的元环衍生物,荧光检Snar@ongFoodFerrnentatio,,27山东食品发酵2007.3(总第146期)测器,检测限为0.1pmol,线性范围0.1-200pmol,谷胱甘肽的回收率为99.2%,RSD为1.2%.该方法线性范围较宽,而且稳定性较高,适于测定混合组分中谷胱甘肽含量…】.5高效毛细管电泳法(HPCE)HPCE有非常好的分离效果.Frassanito等】采用HPCE测定生物供试品中谷胱甘肽的含量,紫外/可见检测器检测限为0.2ug/ml,线性范围为0.2~100ug/ml,RSD为1%.1987年,有人对HPCE中的电化学检测技术作了改进,克服了紫外-可见吸收检测器所遇到的光程太短的问题.1993年, Thomas等在测定鼠脑组织中谷胱甘肽的含量时,在HPCE系统中采用了Hg修饰Au电极,以pH5.5, 10mmol/L的2.(N.吗啉).乙基磺酸作为缓冲液,在0.15V(VSAg/AgC1)的电势下,检出限为0.53fmol, RSD为2.1%.6流式细胞仪法应用染色剂标记GSH形成GSH的荧光化合,同时使染色剂尽量对其他巯基物产生最小影响,以便判断染色背景的程度及其线形关系,根据GSH含量与荧光强度的一定的比例关系,从而得到GSH的值.对GSH进行标记的最理想染色剂应具有很好的专一性,另外,要求能够进行定量分析测定.而这些染色剂的专一性是相对的,一个常见问题是它们还可标志细胞内的其他巯基物,尤其是蛋白巯基.Durand和Olive通过对流式细胞仪巯基染色探针的早期研究,表明monobromobimane对GSH具有合理的专一性.Treumer研究了0一phthaldialdehyde(0PT),表明OPT同时与GSH与蛋白巯基结合形成荧光化合物,RiCe介绍了monobromobimane,目前来讲,这是一个最专一的GSH探针.流式细胞仪的特点是在短时间内可获得大最数据,统计学意义明显,能进行多参数相关测定.7亚硝基铁氰化钠法GSH在NHOH存在下,与亚硝基铁氰化钠发生巯基反应,生成红色化合物.测定中加入硫酸铵可以增加颜色反应的强度.具体操作参照文献.谷胱甘肽在反应显色后,其生成的色泽很不稳定,50-60秒钟时其光密度即见减低.因此规定比色需在30秒内完成.谷胱甘肽含量达100mg/ 100ml时,一般其浓度与光密度仍符合比尔定律.半胱氨酸的存在会严重干扰GSH的测定,使测定值明显偏高.刘娟等¨对此方法应用于发酵液中还原型谷胱甘肽的测定稍作改进如下:在测定管中加入1.0g硫酸铵粉末(以使体系中硫酸铵达到过饱和),1m1分析样品,3mL硫酸铵饱和溶液,摇匀.DHo.5mL亚硝酸基铁氰化钠试剂,随UlJDH入0.7mL8mol/L的NHOH溶液,混合,立即用分光光度计在525nm进行比色,读取各管光密度.通过计算或从标准曲线上得出GSH浓度.8四氧嘧啶法GHS在实验条件下与四氧嘧啶作用的生成物在305nm有最高吸收峰,本法也称四氧嘧啶305 法.具体操作参照文献】.四氧嘧啶法中,反应显色后30min以内光密度未见降低,显色稳定.相对误差可以控制在2%以内,相对标准偏差可以控制在4%以内,说明这种方法的准确度和精密度较高,且半胱氨酸不干扰测定结果.刘娟等对此方法应用于发酵液中还原型谷胱甘肽的测定稍作改进如下:在测定管中加入1mL分析样品,1mL0.1mol/L的四氧嘧啶溶液,混合,加入0.5molpH值7.5磷酸盐缓冲液和0.1mol/LNaOH溶液各1 mL,随即混合.计时开始6min,加入1mol/LNaOH溶液,混合后,用紫外分光光度计在305nm测定光密度,读取各管读数.通过计算或从标准曲线上得出GSH浓度.鉴于文献¨中测定的是血液中GSH的浓度,因此采用四氧嘧啶法在测定前需用三氯乙酸或偏磷酸除去蛋白.测定酵母提取液中GSH的浓度,在提取GSH时采用温差破碎细胞,酵母中的蛋白可以以沉淀形式除去,离心后GSH提取液中已经不含有蛋白.因此可以省略原方法中三氯乙酸或偏磷酸除蛋白的过程,原测定步骤也相应简化.9DTNB法28——ShandongFoodFermentation2007.3(总第146期)山东食品发酵GSH和DTNB反应生成黄色的5一硫代一2硝基苯甲酸,在412nm波长有最大吸收峰.方法:样品1式2份,pH8.0条件下分别和甲醛反应2min和60min,各取lmL加入5mLDTNB溶液,25℃反应5min后分别测定在波长412nm的吸光度,算出2者的差值△A,代入标准曲线计算得出谷胱甘肽含量.得到谷胱甘肽浓度在0.19-0.95gL.之间线性关系良好,回归方程为:Y=0.7154X一0.0004,r=0.9999,最大误差不超过6%.本方法成本低廉,简单易行, 特别适合于有干扰物质存在时还原型谷胱甘肽浓度的分析.DTNB法中,反应显色后30min以内光密度未见降低,显色稳定.相对误差可以控制在2%以内,相对标准偏差可以控制在4%以内,说明这种方法的准确度和精密度较高,且半胱氨酸不干扰测定结果.刘娟等¨对此方法应用于发酵液中还原型谷胱甘肽的测定稍作改进如下:将分样品0.5mL加入1.5mL0.15mol/LNaOH溶液中, 摇匀,加入体积分数=0.03,甲醛0.5mL,摇匀,静置2min.加入2.5mLDTNB分析溶液,摇匀,在25℃水浴保温5min,测定在波长412nm处的吸光度A,通过计算或从标准曲线上得出相应GSH 浓度.DTNB法经改进后,其灵敏度比原先提高了三倍.另外,蓝金贵等报道了一种快速,简便和廉价的谷胱甘肽(GSH)含量测定的新方法.利用GSH的还原性将磷钼杂多酸还原成磷钼杂多蓝, 在710nm最大吸收波长处测其吸光度,吸光度与GSH的浓度在3.3×10..一1.3×104mol/L范围内呈线性关系,相关系数r=O.9982,方法检测限为1.6×10..mol/L,相对标准偏差RSD=1.1% (n=6),回收率为97.1%一103.5%.该法应用于药品中GSH含量的直接测定,结果满意.综上所述,目前对于谷胱甘肽的测定还没建立一个既十分灵敏,特异,又十分快速,稳定,经济的方法.谷胱甘肽的各种测定方法各有其优点,有的灵敏度高,有的快速可靠,有的可区分开各种成分;同时也存在各自的不足,有的样本准备过程复杂,有的测定各成分分离不佳,有的需要昂贵设备.一个快速,稳定,特异,灵敏,经济的测定方法,有待进一步建立.参考文献[1]沈亚领,李爽等,谷胱甘肽的应用与生产,工业微生物,2000,30(2):4l一45[2]赵旭东,魏东芝,万群,等,谷胱甘肽的简便测定法[J].药物分析杂志,2000,20(1):34—37[3]AndersonME.Determinationofglutathioneandglu—tathionedisulfideinbiologicalsamples[J].Methodsin enzymology,1985,l13:548—555[4]MouradT,MinKL,SteghensJP.Measurementofoxi—dizedglutathionebyenzymaticrecyclingcoupledtO ioluminescentdetection[J].AnalyticalBiochenistry,2000, 283.:146—152[5]攀跃平,于健春等,谷胱甘肽的生理意义及其各种测定方法比较,评价,中国临床营养杂志,2003,l1(2): 136—139【6]郭黎平,刘国良,张卓勇,等.铜(II)一新铜试剂一谷胱甘肽乙醇体系显色反应研究[J].光谱学与光谱分析, 2000,20(30):4l2-4l4.[7]曹新志,陈彦.荧光法测定黄瓜中的谷胱甘肽【Jl'资源开发与市场,2000,l6(5):272—273.【8】HissinPJ,HilfR.Afluorometricmethodfordetermina—tionofoxidizedandreducedglutathioneintissue【J】.Anal Biochem,1976,74:2l4—226.[9]张建莹,齐剑英等,锌离子增强荧光光谱法测定谷胱甘肽[J].暨南大学,2004,25(1):88—91[10]ArizaAR,ToribioF,BareaJL-Rapiddeterminationof glutathionestatusinfishLiverusinghigh??performanceliq??uidchromatographyandelectrochemicaldedection[J].Jour—nalofChromatographyB.1994.656:311—318【l】]杨培慧,齐剑英,冯德雄,蔡继业.谷胱甘肽的应用及其检测方法[JJ'中国生化药物杂志,2002,23(1):52—54 [12】FrassanitoR,RossiM,DraganiLK,eta1.Newand simplemethodfortheanalysisoftheGlutathioneadduct ofatrazine[J].JournalofChromatographyA,l998,795: 53—60[13]ThomasJ,SheaO,LunteSM.Selectivedetectionof freethiolsbycapillaryelectr0ph0resis—electrochemistryUS—ingagold/mercuryamalgammicr0electr0de[J].AnalChem, 1993.65(3):247—250[14]上海市医学化验所.临床生化检验(上)[M】.上海:上海科技出版社,l979[15]刘娟,王雅琴等.发酵液中还原型谷胱甘肽三种测定方法的改进及其比较[JJ.北京化工大学,2004,31(3): 35—38ShandongFoodFermentation——29。
还原型谷胱甘肽(GSH)检测
还原型谷胱甘肽(GSH)检测
谷胱甘肽(Glutathione,GSH)是由谷氨酸、半胱氨酸及甘氨酸组成,含有巯基的三肽,广泛存在于动、植物中,在生物体内有着重要的作用,如抗氧化作用、整合解毒作用。
谷胱甘肽在体内以还原型谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)两种形式存在,其活性成分为还原型谷胱甘肽,可参与体内三羧酸循环,激活各种酶,对不稳定的眼晶状体蛋白质巯基有抑制作用,从而抑制白内障的发展,抑制角膜及视网膜病变,在角膜损害时能促进上皮组织的修复。
迪信泰检测平台采用高效液相色谱(HPLC)和液质联用(LC-MS)法,可高效、精准的检测还原型谷胱甘肽的含量变化。
此外,我们还提供其他氨基酸及其代谢物检测服务,以满足您的不同需求。
HPLC和LC-MS测定还原型谷胱甘肽样本要求:
1. 请确保样本量大于0.2g或者0.2mL。
周期:2~3周
项目结束后迪信泰检测平台将会提供详细中英文双语技术报告,报告包括:
1. 实验步骤(中英文)
2. 相关质谱参数(中英文)
3. 质谱图片
4. 原始数据
5. 还原型谷胱甘肽含量信息。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
谷胱甘肽含量测定
谷胱甘肽含量测定
植物生理学模块实验指导
李玲主编
科学出版社
还原型谷胱甘肽含量的测定方法(分光光度计法)
【实验目的】
了解植物组中中抗坏血酸-谷胱甘肽循环代谢过程,学习还原型谷胱甘肽含量的测定原理和方法。
【实验原理】
谷胱甘肽是有谷氨酸(Glu)、半胱氨酸(Gly)组成的天然三肽,是一种含巯基(—SH)的化合物,广泛存在于动物组织、植物组织、微生物和酵母中。
谷胱甘肽能和5,5’-二硫代-双-(2-硝基苯甲酸)(5,5’-dithiobis-2-nitrobenoic acid,DTNB)反应产生2-硝基-5-巯基苯甲酸和谷胱甘肽二硫化物(GSSG)。
2-硝基-5-巯基苯甲酸为一黄色产物,在波长412nm处具有最大光吸收。
因此,利用分光光度计法可测定样品中谷胱甘肽的含量。
【器材与试剂】
1.实验仪器与用具
研钵、高速冷冻离心机、微量移液枪、离心管、试管、水浴锅、容量瓶(100ml、200ml、1000ml)、分光光度计
2.实验试剂
50g/L三氯乙酸(TCA)溶液(含5mmol/L Na2-EDTA):称取5g三氯乙酸,用蒸馏水溶解稀释至100ml。
再称取186mg Na2-EDTA·2H2O,加入到100ml 50g/L三氯乙酸溶液中溶解。
0.1mol/L磷酸钠溶液缓冲液(pH7.7):配制方法见附录。
0.1mol/L(pH6.8)磷酸钠缓冲液:配制方法见附录。
4mmol/L二硫代硝基苯甲酸(5,5’-dithiobis-2-nitrobenoic acid,DTNB)溶液:称取15.8mg DTNB,用0.1mol/L、pH6.8磷酸缓冲液溶解,定容至10ml,混匀,4℃保存。
现用现配。
100μmol/L还原型谷胱甘肽标准液:称取3.1mg 还原型谷胱甘肽,加入少量无水乙醇溶解,加蒸馏水定容至100ml。
3.实验材料
同抗坏血酸。
【实验步骤】
1.标准曲线制作
取6支试管,编号,按照表1加入各种试剂,混匀,25℃保温反应10min。
以0号管为参比调零,测定显色液在412nm处的吸光度。
以吸光度为纵坐标,还原型谷胱甘肽物质的量(μmol)为横坐标,绘制标准曲线。
项目试管号
0 1 2 3 4 5
100μmol/L还原型谷胱甘肽标准液/ml 0 0.2 0.4 0.6 0.8 1.0
蒸馏水/ml 1.0 0.8 0.6 0.4 0.2 0
0.1mol/L pH7.7磷酸缓冲液/ml 1.0 1.0 1.0 1.0 1.0 1.0
4mmol/L DTNB试剂/ml 0.5 0.5 0.5 0.5 0.5 0.5
相当于还原型谷胱甘肽物质的量/μmol 0 20 40 60 80 100
2.提取
取材后,称取2.5g样品置于研钵中,加入5ml经4℃预冷的50g/L三氯乙酸溶液(含5mmol/L Na2-EDTA),在冰浴条件下研磨成匀浆后,于4℃、12000g离心20min。
收集上清液来测定谷胱甘肽含量,测量提取液体积。
3.测定
取1支试管,依次加入1ml蒸馏水、1ml 0.1mol/L 磷酸缓冲液(pH7.7)和0.5ml 4mmol/L DTNB荣毅仁,混匀,即为绘制标准曲线的0号管液。
以此溶液作为参比,在波长412nm处对分光光度计进行调零。
另取2支试管,分别加入1ml上清液、1ml 0.1mol/L磷酸缓冲液(pH7.7)。
向一支试管加入0.5ml 4mmol/L DTNB溶液,另一支试管中加入0.5ml 0.1mol/L磷酸缓冲液(pH6.8),
将两支试管置于25℃保温10min 。
按照制作标准曲线的方法,迅速测定显色液在波长412nm 处的吸光度,分别记作OD s 和OD c 。
重复3次。
【计算结果】
显色反应后,分别记录样品管混合液的吸光度(OD s )和空白对照管反应混合液的吸光度(OD c )。
根据吸光度差值,从标准曲线上查出相应的还原型谷胱甘肽量,计算还原型谷胱甘肽含量(μmol/g )。
还原型谷胱甘肽含量(μmol/g )=
式中,n 为由标准曲线查的的溶液中还原型谷胱甘肽物质的量(μmol );V 为样品提取液总体积(ml );V s 为吸取样品液体积(ml );m 为样品质量(g )。
【注意事项】
1. 在提取样品时,需要沉淀出去蛋白质,以方志蛋白质中所含巯基及相关酶对测定结果的影响。
2.利用本方法还可以测定样品中总谷胱甘肽(GSSG+GSH )和氧化型谷胱甘肽(GSSG )的含量。
在谷胱甘肽还原酶(GR )作用下,将GSSG 还原成GSH 再进行测定和计算。
3. 建议在第一次测定时先做2或3个样品本底对照,如果样品中本底对照和空白对照非常接近,则说明样品液中不存在干扰物质,可以不再检测样品本底对照。
n ×V
V s ×m。
