2011年高考化学选择题训练1
2011届全国高考真题化学试题分类汇编---化学实验综合题(一)
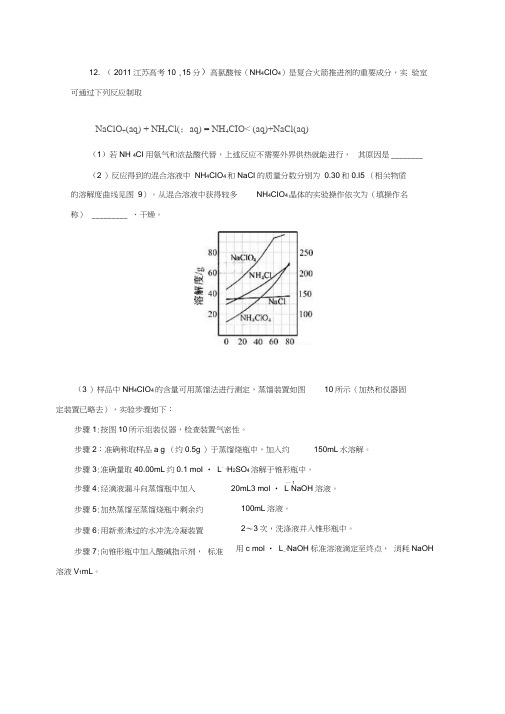
12. ( 2011江苏高考10 ,15分)高氯酸铵(NH 4CIO 4)是复合火箭推进剂的重要成分,实 验室可通过下列反应制取NaClO +(aq) + NH 4Cl(;aq) = NH 4CIO< (aq)+NaCl(aq)(1)若NH 4CI 用氨气和浓盐酸代替,上述反应不需要外界供热就能进行, 其原因是 ________ (2 )反应得到的混合溶液中 NH 4CIO 4和NaCI 的质量分数分别为 0.30和0.I5 (相关物质 的溶解度曲线见图 9)。
从混合溶液中获得较多 NH 4CIO 4晶体的实验操作依次为(填操作名称) _________ 、干燥。
(3 )样品中NH 4CIO 4的含量可用蒸馏法进行测定,蒸馏装置如图 10所示(加热和仪器固定装置已略去),实验步骤如下:步骤1:按图10所示组装仪器,检查装置气密性。
步骤2:准确称取样品a g (约0.5g )于蒸馏烧瓶中,加入约150mL 水溶解。
步骤3:准确量取40.00mL 约0.1 moI • L -1H 2SO 4溶解于锥形瓶中。
步骤4:经滴液漏斗向蒸馏瓶中加入 步骤5:加热蒸馏至蒸馏烧瓶中剩余约 步骤6:用新煮沸过的水冲洗冷凝装置 步骤7:向锥形瓶中加入酸碱指示剂, 标准溶液V 1mL 。
一 120mL3 mol • L NaOH 溶液。
100mL 溶液。
2〜3次,洗涤液并入锥形瓶中。
用c mol • L _1NaOH 标准溶液滴定至终点, 消耗NaOH步骤8•将实验步骤1〜7重复2次IWH細①步骤3中,准确量取40.00ml H2SO4溶液的玻璃仪器是________________________________ 。
②步骤1〜7中确保生成的氨被稀硫酸完全吸收的实验是__________________________________ (填写步骤号)。
③为获得样品中NH4CIO4的含量,还需补充的实验是 _______________________________________ 。
2011年高考理综化学8+4模拟卷(05)

2011年高考理综化学8+4模拟卷(05)第I卷选择题(共126分)一、选择题(本题包括13小题,每小题6分,共78分。
每小题只有一个选项符合题意)6.对相同状况下的12C18O和14N2两种气体,下列说法正确的是 ( )A.若质量相等,则质子数相等B.若原子数相等,则中子数相等C.若分子数相等,则体积相等D.若体积相等,则密度相等7.一定能在下列溶液中大量共存的离子组是()A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-B.c(H+)=1×10-13mol·L-1的溶液:Na+、Ca2+、SO42-、CO32-C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-D.含有大量NO3-的溶液:H+、I-、SO42-、Cl-8.下列叙述正确的是()A.物质的量浓度均为0.1mol·L-1的(NH4)2SO4、(NH4)2Fe(SO4)2两种溶液中,c(NH4+)相同B.25℃时,在CH3COOH溶液中加入CH3COONa固体,溶液的pH一定小于7C.在0.1mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)9.设N A代表阿佛加德罗常数,下列说法中正确的是①常温常压下,17g甲基(—14CH3)所含的中子数为9N A②常温常压22.4L NO气体的分子数小于N A③64g铜发生氧化还原反应,一定失去2N A个电子④常温常压下,100mL 0.5 mol·L-1的乙酸溶液中,乙酸的分子数目小于0.05N A⑤标况时,22.4L二氯甲烷所含有的原子数为4N A⑥常温常压下,1mol氦气含有的核外电子数为4N AA.①② B.③④ C.②④ D.⑤⑥10.某温度下,体积为1L的密闭容器中分别加入2molX、 2molY、1molW、1molZ进行如下可逆反应:X(g)+Y(g)Z(g)+W(s);ΔH>0一段时间后反应达到平衡状态,下列叙述正确的是A.加入少量W,逆反应速率增大,平衡向左移动B.达到同一平衡时,X 和Z 的浓度可能分别为2.5mol ·L —1和1.5mol ·L —1C.若上述反应在绝热系统中进行,反应达平衡,体系的温度一定降低D.若缩小容器的体积,达到新的平衡时,气体的平均分子量有可能增大11. A 、B 、C 、D 四种短周期主族元素,其原子序数依次递增,A 元素的原子既能形成简单阳离子、又能形成简单阴离子;B 、C 、D 核电荷数总和为25,且B 与C 两元素能形成BC 、BC 2两种常见的共价化合物。
高考化学-不定项选择专项训练第一部分试题与答案

高考化学-不定项选择题专项训练第一部分试题与答案第一部分60题(每题有一个或两个正确选项)1、某单质能与浓硝酸反应,若参加反应的单质与硝酸的物质的量之比为1:4,则该元素在反应中所显示的化合价可能是 A +1 B +2 C +3 D +4 E +52、把质量为m克的铜铜灼烧变黑,立即放入下列物质中,能使铜丝变红,且质量还是m 克的是A 稀硫酸B C2H5OHC 稀硝酸D CH3COOHE CO3、将一定量有机物充分燃烧后的产物通入足量石灰水中完全吸收,经过滤得到沉淀20克,滤液质量比原石灰水减少5.8克.该有机物可能是( ).(A)乙烯(B)乙二醇(C)乙醇(D)甲酸甲酯4、某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或二种.现将13.8克样品加入足量水,样品全部溶解.再加入过量的CaCl2溶液,得到9克沉淀.对样品所含杂质的正确判断是(A)肯定有KNO3 (B)肯定有KNO3,可能还含有Na2CO3(C)肯定没有Ba(NO3)2,可能有KNO3 (D)肯定没有Na2CO3和Ba(NO3)25、将可能混有下列物质的硫酸铵样品13.2克,在加热条件下与过量氢氧化钠溶液反应,可收集到气体4.3升(标准状况),则该样品内不可能含有的物质是A 碳酸氢铵和硝酸铵B 碳酸铵和硝酸铵C 氯化铵和碳酸氢铵D 氯化铵和碳酸铵6、在由Fe、FeO和Fe2O3组成的混合物中加入100毫升2摩/升的盐酸,恰好使混合物完全溶解,并放出448毫升气体(标准状况),此时溶液中无Fe3+离子。
则下列判断正确的是A 混合物里三种物质反应时消耗盐酸的物质的量之比为1:1:3B 反应后所得溶液中的Fe2+离子与Cl-离子的物质的量之比为1:2C 混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多D 混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多7、联合制碱法中关键的一步是把NH4Cl从几乎饱和的NaHCO3溶液中分离出来,为此根据NaCl 和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,可析出不夹带NaHCO3的NH4Cl.NaCl和NH4Cl共同存在时的溶解度曲线如图所示,以下操作正确的是8、第二主族元素R的单质及其相应氧化物的混合物12g,加足量水经完全反应后蒸干,得固体16g,试推测该元素可能为A MgB CaC SrD Ba9、由CO2、H2和CO组成的混合气在同温同压下与氮气的密度相同。
2011年高考化学(高考真题+模拟新题)分类解析汇编:B单元 化学物质及其变化

B 单元 化学物质及其变化B1 离子反应与离子方程式8.B1[2011·安徽卷] 室温下,下列各组离子在指定溶液中能大量共存的是( )A .饱和氯水中Cl -、NO -3、Na +、SO 2-3B .c (H +)=1.0×10-13mol·L -1溶液中C 6H 5O -、K +、SO 2-4、Br -C .Na 2S 溶液中 SO 2-4、K +、Cl -、Cu 2+D .pH =12的溶液中 NO -3、I -、Na +、Al 3+8.B1【解析】 B 饱和氯水中含有的Cl 2和HClO 都具有强氧化性,能够氧化SO 2-3离子,故A 错误;c (H +)=1.0×10-13 mol·L -1的溶液为强碱性溶液,OH -与C 6H 5O -、K +、SO 2-4、Br -都不发生反应,故B 正确;Na 2S 溶液中的S 2-能与Cu 2+反应生成CuS 沉淀,故C 错误;强碱性溶液中Al 3+能与OH -发生反应生成AlO -2,故D 错误。
27.B1B3J2[2011·安徽卷] (14分)MnO 2是一种重要的无机功能材料,粗MnO 2的提纯是工业生产的重要环节。
某研究性学习小组设计了将粗MnO 2(含有较多的MnO 和MnCO 3)样品转化为纯MnO 2的实验,其流程如下:(1)第①步加稀H 242(2)第②步反应的离子方程式是□________+□ClO -3+□ ________===□MnO 2↓+□Cl 2↑+□________。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、________、________、________,已知蒸发得到的固体中有NaClO 3和NaOH ,则一定还含有________(写化学式)。
(4)若粗MnO 2样品的质量为12.69 g ,第①步反应后,经过滤得到8.7 g MnO 2,并收集到0.224 L CO 2(标准状况下),则在第②步反应中至少需要________mol NaClO 3。
高考化学选择题训练(一)

(一)一、选择题(此题包括9小题,每题3分,共27分。
每题只有一个选项符合题意)1.将甲和乙气体同时通入过量丙溶液中,可能产生沉淀的组合是序号甲乙丙①CO2SO2Ca(OH)2②HCl CO2Ca(OH)2③CO2SO2Ba(NO3)2④NO2SO2CaCl2⑤CO2NH3CaCl2⑥O2NH3AlCl3A.全部B.①③④⑤⑥C.①②③④⑤D.①③⑤⑥2.合成氨工业中用铁触媒来催化N2和H2合成NH3 。
假设将a L NH3通过灼热的装有铁触媒的硬质玻璃管后,气体体积变为b L(气体体积均在同温同压下测定),则该b L气体中的NH3体积分数是A.a ab-B.b ab-C.a ba-2D.b ba-23.以下有关表达:①非金属单质M能从N的化合物中置换出非金属单质N;②M原子比N 原子容易得到电子;③单质M跟H2反响比N跟H2反响容易得多;④气态氢化物水溶液的酸性H m M>H n N;⑤氧化物水化物的酸性H m MO x>H n NO y;⑥熔点M>N。
能说明非金属元素M比N的非金属性强的是A.②⑤B.①②③C.①②③⑤D.全部4.欲配制100 ml 1.0 mol/L Na2SO4溶液,正确的方法是①将14.2 g Na2SO4 溶于100 ml水中;②将32.2 g Na2SO4·10H2O溶于少量水中,再用水稀释至100 ml;③将20 ml 5.0 mol/L Na2SO4溶液用水稀释至100 ml。
A.②③B.①②C.①③D.①②③5.HF的酸性比HCN的酸性强,现有物质的量浓度和体积均一样的NaF和NaCN两种溶液,前者溶液中的离子总数为n1,后者溶液中的离子总数为n2 ;另有物质的量浓度和体积均一样的Na2A ( pH=10 )和Na2B ( pH=9 ) 两种溶液,前者溶液中的离子总数为n3,后者溶液中的离子总数为n4;以下关系正确的选项A.n1<n2,n3>n4B.n1<n2,n3<n4C.n1>n2,n3<n4 D.n1>n2,n3>n46.以N A表示阿伏加德罗常数,以下说法正确的选项A.T ℃时,1 L pH=6纯水中,含10–6N A个-OHB.15.6 g Na2O2与过量CO2反响时,转移的电子数为N AC.1 mol SiO2中含有2 mol Si–O单键D.假如5.6 L N2含有n个氮分子,则阿伏加德罗常数一定约为4n7.以下说法正确的选项A.铜、石墨均导电,因此它们均是电解质B.NH3、CO2的水溶液均导电,因此NH3、CO2均是电解质C.液态HCl、固体NaCl均不导电,因此HCl、NaCl均是非电解质D.蔗糖、酒精在水溶液或熔融状态下均不导电,因此它们均是非电解质8.在以下反响类型中,能表达绿色化学中的“原子经济”原则的是(1)置换反响;(2)化合反响;(3)分解反响;(4)取代反响;(5)加成反响;(6)复分解反响;(7)酯化反响。
高考化学选择题强化训练(1)

选择题强化训练(1)一、单选题(每小题4分,8小题共32分)1、室内空气污染之一是人们现代生活中所使用的化工产品,如泡沫绝缘材料、化纤、油漆等会不同程度地放出某种气体,该气体可能是A 、SO 2B 、NO 2C 、CH 4D 、HCHO2、用石灰水保存鲜蛋是一种化学保鲜法。
其原理是①石灰水是电解质溶液,能使蛋白质凝聚;②石灰水能渗入蛋内中和酸性物质;③石灰水能与鲜蛋呼出的CO 2反应生成碳酸钙薄膜,起保护作用;④石灰水具有较强的碱性,杀菌能力强A 、①②B 、③④C 、①③D 、②④3、下列说法正确的是A 、一种元素可有多种离子,但只有一种原子;B 、由同种元素组成的物质属于单质C 、有新单质生成的化学反应不一定是氧化还原反应;D 、具有相同质子数的微粒都属同种元素4、A 、B 、C 为三种的气体,把amolA 和bmolB 充入一密闭容器中,发生反应,达到平衡时,若它们的物质的量满足n(A)+ n(B)= n(C),则A 的转化率为A 、 100%B 、 ×100%C 、 ×100% D 、 ×100% 5、下列混合物的物质的量一定时,组内各物质按任意比混合,完全燃烧时耗O 2的量不变的是A 、甲烷、甲醇、甲醛;B 、乙炔、苯、1,3-丁二烯C 、丙烯、2-丁烯、环已烷D 、乙醇、乙烯、丙烯酸(CH 2=CH-COOH )6、下列离子方程式中错误的是A 、稀氨水吸收足量SO 2: NH 3·H 2O + SO 2 = NH 4+ + HSO 3-B 、向Ca(ClO)2溶液中通入过量二氧化碳:ClO - + H 2O + CO 2 = HClO + HCO 3-C 、稀硝酸中加入铁粉:2Fe + 6H + = 2Fe 3+ + 3H 2↑D 、过氧化钠和冷水反应:2Na 2O 2 + 2H 2O = 4Na + + 4OH - + O 2↑7、在反应5H 2O + 3BrF 3 = Br 2 + O 2↑+ HBrO 3 + 9HF 中,当有45克水被氧化时,被子水还原的BrF 3的物质的量是A 、5/3 molB 、5/2 molC 、3/2 molD 、4/3 mol8、下列各项中指定的比值是2:1的是A 、C 2H 4在氧气中充分燃烧生成的CO 2、H 2O 的物质的量之比;B 、K 2S 溶液中[K +]与[S 2-]之比C 、Na 2O 2晶体中阳离子与阴离子的物质的量之比;D 、16O 原子的中子数和质量数之比二、选择题(每小题有1~2个正确答案,10小题共40分)9、下列分子中的所有原子不可能在同一平面上的是A 、苯乙烯B 、溴乙烯C 、丙烯D 、10、已知a A n+、b B (n+1)+、c C n-、d D (n+1) -具有相同的电子层结构,有关A 、B 、C 、D 四种元素的叙述中正确的是A 、原子序数:b > a > c >dB 、原子半径:A>B>C>DC 、金属性:B>A ,非金属性:D>CD 、离子半径:D>C>B>A11、常温下,某溶液中由水电离产生的OH -的物质的量浓度为1×10-12mol/L ,此溶液可能是A 、pH=12的KCN 溶液B 、pH=12的NaOH 溶液C 、0.01mol/LH 2SO 4D 、0.01mol/LHCl12、用N 0代表阿佛加德罗常数,下列说法正确的是A 、360gC 60晶体中的分子数为N 0B 、标况下,11.2LSO 3所含的分子数目为0.5 N 0C 、用浓盐酸还原氯酸钾制取Cl 2,生成0.5molCl 2时,电子转移数目为N 02(a+b) 5ba +b 5 2(a+b) 5 (a+b) 5aD、0.1molCH5+所含的电子数目为N0。
高考全国1卷化学选择题训练.doc
高三化学选择题训练 1一、选择题(共 7 小题,每小题 6 分,满分 42 分)7 . 食 品 添 加 剂 关 系 到 大 家 健 康 , 下 列 物 质 中 的 添 加 剂 作 用 不 正 确 的 是 ( )A . ①B .②C . ③D . ④8. 下列与处理方法对应的反应方程式不正确的是()A .工业上用水吸收 NO 生产硝酸: 3NO 2 + H O = 2HNO 3+ NO22B .用氨水除去工业原料氯化铵中的氯化铁杂质:3+-Fe + 3OH= Fe(OH) ↓3C .用熟石灰处理泄漏的液氯: 2Ca(OH) 2 +2Cl 2 = CaCl 2 + Ca(ClO) 2 +2H 2OD .用明矾除去水中的悬浮颗粒物: 3+ + 3H O Al(OH) +Al (胶体 ) + 3H239. 下列说法不正确的是()A .乙二醇用于汽车防冻液B .麦芽糖在水解前后均能发生银镜反应C . 1-氯丙烷和 2-氯丙烷发生消去反应的产物不同D .H 2N — CH 2 — COOH 的缩聚产物中含结构10.短周期四种元素离子 W 2+ 、X -、 Y 2- 、 Z +的电子层结构相同。
下列说法正确的是()A .原子序数: W>Z>X>Y2+一2+B .离子半径: r (W ) >r (X ) >r ( Y -) >r ( Z )C . Y 的气态氢化物比 X 的气态氢化物稳定D .氢氧化物碱性强弱:W ( OH ) 2>ZOH11.下图为 Pt 电极的氢氧燃料电池工作原理示意图,H 2SO 4 为电解质溶液。
有关说法不正确的是()A . a 极为负极,电子由 a 极流向 b 极B . a 极的电极反应式是: -+H 2 -2e = 2H C .电池工作一段时间后,装置中c(H 2 SO 4)增大D .若将 H 2 改为等物质的量 CH 4 , O 2 的用量增多12.用氯气制取并获得碘单质,不能实现实验目的的装置是()A .用甲制取少量氯气B .用乙氧化溶液中的碘离子C .用丙提取置换出来的碘D .用丁过滤 I 2 的 CCl 4 溶液得碘单质13. 下列溶液中,微粒浓度关系一定正确的是()A . pH=6 的纯水: c (OH ﹣ )< c ( H +)B . 0.1mol ?L ﹣1 的( NH 4)2 SO 4 溶液: c ( NH 4+)> c (SO 4 2﹣ )> c ( H +)C . 常温下, pH=7 的醋酸与醋酸钠的混合溶液:c ( CH 3COO ﹣)> c ( Na +) D .常温下, pH=2 的一元酸和 pH=12 的一元强碱等体积混合后所得溶液:c (OH ﹣ )=c ( H +)请将答案写在下列表格否则无效(每题6 分共 42 分)7 8 9 10 11 12 13高三化学选择题训练 2一、选择题(共7 小题,每小题 6 分,满分42 分)7.据《自然》杂志报道,在300~ 400℃的高温下,将砂糖(主要成分为蔗糖)等碳水化合物用加热的方法使其形成焦糖与碳之间的“半成品碳”状态,再放进硫酸溶液中高温加热,生成了一种叫“焦糖烯”的物质,其分子式为 C36H50O25。
2011届全国高考真题化学试题分类汇编---化学实验综合题(一)
12.( 2011江苏高考10,15分)高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取(1)若NH4Cl用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是。
(2)反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线见图9)。
从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)、干燥。
(3)样品中NH4ClO4的含量可用蒸馏法进行测定,蒸馏装置如图10所示(加热和仪器固定装置已略去),实验步骤如下:步骤1:按图10所示组装仪器,检查装置气密性。
步骤2:准确称取样品a g(约0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤3:准确量取40.00mL约0.1 mol·L-1H2SO4 溶解于锥形瓶中。
步骤4:经滴液漏斗向蒸馏瓶中加入20mL3 mol·L-1NaOH 溶液。
步骤5:加热蒸馏至蒸馏烧瓶中剩余约100mL溶液。
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤7:向锥形瓶中加入酸碱指示剂,用c mol·L-1NaOH标准溶液滴定至终点,消耗NaOH 标准溶液V1mL。
步骤8.将实验步骤1~7重复2次①步骤3中,准确量取40.00mlH2SO4 溶液的玻璃仪器是。
②步骤1~7中确保生成的氨被稀硫酸完全吸收的实验是(填写步骤号)。
③为获得样品中NH4ClO4 的含量,还需补充的实验是。
【分析】本题以复合火箭推进剂的重要成分制取和分析为背景的综合实验题,涉及理论分析、阅读理解、读图看图、沉淀制备、沉淀洗涤、含量测定等多方面内容,考查学生对综合实验处理能力。
【备考提示】实验的基本操作、实验仪器的选择、实验误差分析、物质的除杂和检验等内容依然是高三复习的重点,也是我们能力培养的重要目标之一。
答案:(1)氨气与浓盐酸反应放出热量(2)蒸发浓缩,冷却结晶,过滤,冰水洗涤(3)①酸式滴定管②1、5、6③用NaOH标准溶液标定H2SO4溶液的浓度(或不加高氯酸铵样品,保持其他条件相同,进行蒸馏和滴定实验)13.(2011江苏高考,12分)草酸是一种重要的化工产品。
2011年高考化学(高考真题+模拟新题)分类解析汇编
O单元化学与技术O1化学与工农业生产6.O1[2011·北京卷] 垃圾分类有利于资源回收利用。
下列垃圾归类不合理的是()6.O1【解析】B废易拉罐可回收利用,A项正确;废塑料瓶属于可回收垃圾,B项错误;灯管中的荧光粉对人体有害,C项正确;不可再生的废纸属于可燃垃圾,D项正确。
6.O1[2011·福建卷] 下列关于化学与生产、生活的认识不.正确..的是() A.CO2、CH4、N2等均是造成温室效应的气体B.使用清洁能源是防止酸雨发生的重要措施之一C.节能减排符合低碳经济的要求D.合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺6.O1【解析】A CO2、CH4是造成温室效应的主要气体,而N2是空气中的主要气体,不是温室气体,故A项错误;产生酸雨的主要原因是SO2气体,使用清洁能源可以有效防止酸雨发生,故B项正确;节能减排可以减少CO2的排放,符合低碳经济的要求,故C项正确;合理开发可燃冰可以减少煤、石油等紧缺能源的使用,故D项正确。
9.O1[2011·江苏化学卷] NaCl是一种化工原料,可以制备一系列物质(见图4)。
下列说法正确的是()A.25 ℃,NaHCO3在水中的溶解度比Na2CO3的大B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应D.图4图09.O1【解析】B NaHCO3的溶解度比Na2CO3小,A错;根据2Ca(OH)2+2Cl2===CaCl 得2e-2+Ca(C失2e-lO)2+2H2O,氯元素的化合价既升高,又降低,故Cl2既是氧化剂,又是还原剂,B对;铁在加热条件下可以与Cl2反应生成FeCl3,C错;NaCl与NH3、CO2和H2O反应生成NaHCO3和NH4Cl,不属于氧化还原反应,D错。
31.O1[2011·山东卷] 【化学-化学与技术】水处理技术在生产、生活中应用广泛。
1-2-2细胞器——系统内的分工与合作
是合成蛋白质的场所,故B错;高尔基体与分泌蛋白的加工
和分泌有关,而血红蛋白为红细胞内的结构蛋白,故C错; 人胰岛素基因存在于细胞核中的DNA上,其转录的场所是细 胞核,故D正确。 答案 D
题后反思
对一些常见细胞代谢产物的化学本质应熟记,进
而结合各种细胞器的功能找到具体化合物的产生场所。
双基自主落实
核心互动突破
活页限时训练
【识图析图】
1.结构模式图
双基自主落实
核心互动突破
实验专项突破
高考真题集训
活页限时训练
两图都是分泌蛋白这一考点中常出现的,A图是细胞的局部,
B图则是完整细胞。但考查的知识点基本相同。
考点 1:从图上首先识别出相应结构的名称,并熟悉在分泌 蛋白中的分工及相应作用。
考点2:B图中⑦代表分泌蛋白,常考的有消化酶、抗体、蛋
实验专项突破
高考真题集训
活页限时训练
【训练 2】► 下列模式图表示几种细胞器,有关说法不正确的是
(双选)( BC )。
A.细胞器A、C、E、F能产生水
B.细胞器A、B、F不含磷脂 C.绿色植物的细胞都含有A、C、D、E、F D.A与植物细胞细胞壁的形成有关
双基自主落实 核心互动突破 实验专项突破 高考真题集训 活页限时训练
工的“车间”;高尔基体能对来自内质网的蛋白质进行加工;
溶酶体含有多种水解酶,能分解自身细胞的衰老、损伤的细 胞器、入侵的病毒、病菌的各种组成成分;核糖体是蛋白质 的合成场所;可见,加工修饰的场所是内质网和高尔基体。 答案 A
双基自主落实
核心互动突破
实验专项突破
高考真题集训
活页限时训练
观察叶绿体和线粒体
类组成,体现膜系统的统一性;但每种成分所占的比例不同,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学选择题训练(1) 一、选择题(每小题只有一个正确答案,每小题4分,共32分)
1. 下列物质不能用作饮用水的消毒剂的是 A. Cl2 B. —OH C. O3 D. ClO2 2. FeCl3溶液、Fe(OH)3 胶体共同具备的性质是 A.加入饱和的MgSO4溶液都发生聚沉 B.分散质的粒子都不能通过半透膜 C.都比较稳定,密封保存一段时间也都不会产生沉淀
D.加入硫酸先产生沉淀,后沉淀溶解 3. 实验室用4mol SO2和2mol O2进行下列反应:2SO2 (g)+O2(g) 2SO3(g)
△H=–196.64kJ/mol,当放出314.62 kJ热量时,SO2的转化率为
A.40% B. 50% C.80% D. 90% 4. 在一定条件下有如下反应:R2On2-+aH++3Y2- =2R3++3Y+bH2O,则R2On2-中的n值为
A.4 B. 5 C.6 D. 7 5. 下列叙述正确的是 A. 两种元素构成的共价化合物分子中的化学键都是极性键
B. 两种非金属元素原子之间形成的化学键都是极性键
C. 含有极性键的化合物分子中一定不含非极性键
D. 只要是离子化合物,其熔点就比共价化合物的熔点高
6. 化学式与苯丙氨酸(C9H11NO2)相同,且同时符合下列两个条件: ①有带有两个取代基的苯环,②有一个硝基直接连在苯环上的异构体的数目是
A.3 B. 5 C.6 D. 10
7. 将溶质的质量分数为a%、物质的量浓度为C1 mol·L-1的H2SO4溶液蒸发掉一定量的水,使其溶质的质量分数变为2a%,此时物质的量浓度为C2 mol·L-1,则C1和C2的关系是
A. C2>2C1 B. C2=2C1 C. C2<2C1 D. C1=2C2 8. 在一密闭容器中盛有mLCl2和H2的混合气体,用电火花引燃后,恢复到原来状态,发现气体仍为mL。用足量的NaOH溶液吸收燃烧后的气体,结果无气体剩余。由以上条件,推知原混合气体中Cl2和H2物质的量之比一定是 A.Cl2︰H2=1 B. Cl2︰H2≥1 C.Cl2︰H2<1 D. Cl2︰H2≤1 二、选择题(每小题4分,10小题共40分,每小题有一个或两个正确选项。)
9. 关于非金属元素N、O、C、P的叙述中正确的是
A.N2、C和P在一定条件下分别与足量的O2反应△H都小于零
B.每种元素仅生成一种氧化物 C.气态氢化物的稳定性为PH3>CH4>NH3>H2O D.原子半径大小比较为P>C>N>O 10.下列各组中,两种气体的分子一定相等的 A.温度相同,体积相同的O2和N2 B.压强相同,体积相同的O2和N2
C.体积相等,密度相等的CO和C2H4
D.质量相等,密度不等的C2H4和N2 11. 下列离子方程式中正确的是 A. 氢氧化钠溶液吸收过量的二氧化碳 OH-+CO2 = HCO3- B. 亚硫酸氢铵溶液与足量氢氧化钠溶液反应 HSO3-+ OH-= SO32-+ H2O C. 氯气通入冷水中 Cl2 +H2O = Cl- +ClO- +2H+ D. 碳酸镁悬浊液中加醋酸 CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O 12. 某溶液中含三种离子,加入过量氨水有沉淀生成,过滤后滤液中加过量盐酸,又有沉淀生成,再过滤,滤液中加入过量Na2CO3溶液,仍有沉淀生成,原溶液中含有的离子可能是
A.Ag+、Fe2+、Ca2+ B.Ag+、Mg2+、Ba2+
C.Ca2+、Fe2+、Ba2+ D.Al3+、Mg2+、Ba2+ 13. 某温度下,反应H2(g)+I2(g) 2HI(g) △H<0,在带有活塞的密闭容器中达到平衡,下列说法中正确的是
A.体积不变,升温正反应速率减少 B.温度、压强均不变,充入HI气体,开始时正反应速率增大
C.温度不变,压缩气体的体积,平衡不移动,颜色加深
D.体积、温度不变,充入氦气后,正反应速率将增大
14. 25℃时,在某物质的溶液中,由水电离出的c(H+)=1×10-a mol·L-1,下列说法不正确的是 A.a<7时,水的电离受到抑制 B.a>7时,水的电离受到抑制 C.a<7时,溶液的pH一定为a D.a>7时,溶液的pH一定为14-a
15. 用铂作电极电解100g 4.55%NaOH溶液,一段时间后,溶液中的溶质的质量分数变为5.00%,则阳极产生的气体在标准状况下的体积为
A.28.0L B. 56.0L C. 112L D. 168L 16. 由短周期两种元素形成化合物A2B3,A3+比B2-少一个电子层,且A3+具有与Ne相同的核外电子层结构,则下列说法正确的是
A.A2B3是三氧化二铝 B. A3+和B2-最外电子层上的电子数相等 C. A是第二周期第ⅢA族的元素 D. B是第二周期ⅥA族的元素 17. 在常温下10mLpH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是
A.c(K+)=c(A-) B. c(H+)=c(OH-)<c(K+)<c(A-) C. 混合后溶液的体积≤20mL D. 混合后溶液的体积≥20mL 18. 在密闭容器中充入CO2和CO的混合气体,其密度是相同条件下氦气密度的8倍,这时测得容器内的压强为P1,若控制容器的体积不变,加入足量的Na2O2,充分振荡并不断用电火花燃至反应完全,恢复到开始时的温度,再次测得容器内的压强为P2,则P1
和P2之间的关系是
A. P1=P2 B. P1=2P2 C. P1=4P2 D. P1=8P2 . . . .
. . . 2007年北京理综高考化学试题2007-6-9 5.将用于2008年北京奥运会的国家游泳中心(水立方)的建筑采用了膜材料ETFE,该材料为四氟乙烯与乙烯的共聚物,四氟乙烯也可与六氟丙烯共聚成全氟乙丙烯。下列说法错误..的是
A.ETFE分子中可能存在“-CH2-CH2-CF2-CF2
-”的连接方式
B.合成ETFE及合成聚全氟乙丙烯的反应均为加聚反应
C.聚全氟乙丙烯分子的结构简式可能为 D.四氟乙烯中既含有极性键又含有非极性键 6.对相同状况下的12C18O和14N2两种气体,下列说法正确的是
A.若质量相等,则质子数相等 B.若原子数相等,则中子数相等
-CF2-CF2-CF2-CF-CF3- ] [
n C.若分子数相等,则体积相等 D.若体积相等,则密度相等
7.在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
① K+、Cl-、NO3-、S2- ② K+、Fe2+、I-、SO42- ③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
8.X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是
A.X的原子半径一定大于Y的原子半径 B.X与Y的简单离子不可能具有相同的电子层结构
C.两元素形成的化合物中,原子个数比不可能为1 :1
D.X2Y可能是离子化合物,也可能是共价化合物 9.如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的
水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶气体是
① CO、O2 ② Cl2、CH4 ③ NO2、O2 ④ N2、H2
A.①② B.②④ C.③④ D.②③ 10.一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:
2X(g)+Y(g)Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
A.以X浓度变化表示的反应速率为0.001mol/(L·S)
B.将容器体积变为20L,Z的平衡浓度变为原来的21
C.若增大压强,则物质Y的转化率减小 D.若升高温度,X的体积分数增大,则该反应的△H>0 11.用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误..的是
12.有 ① Na2CO3溶液 ② CH3COONa溶液 ③ NaOH溶液各25mL,物质的量浓度均为0.1mol·L-1,下列说法正确的是
A.3种溶液pH的大小顺序是 ③>②>① B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25mL0.1mol·L-1盐酸后,pH最大的
