物理化学相平衡作业 图片版
合集下载
清华大学物理化学B-相平衡-2

物理化学B
PhaseEquilibrium (II)
1
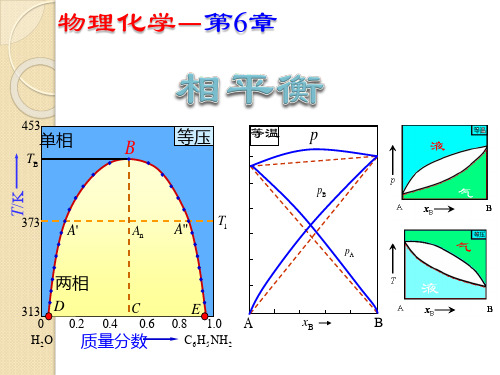
4.3 两组分系统的气液平衡相图
相律分析:
C=2
f=C-P+2=4-P f=0, Pmax=4
当P=1, fmax=3
三维立体坐标
通常固定压力p或固定温度T f*=3-P
若P=1, f*max=2
平面坐标
所以两组分系统的相图通常用
指定温度的p-x 或 指定压力的T-x表示。
8.5%
0
8.5%
20 ℃ 0<wB<8.5%
醇的水溶液
100 ℃ 0<wB<9.3% 120 ℃ 0<wB<14%
8.5%<wB<83.6%
83.6%<wB<100%
共轭溶液 conjugate solution 水的醇溶液
9.3%<wB<70.2%
70.2%<wB<100%
14%<wB<61.5%
12
在沸点-组成图中,具有最高(或最低)的温 度,称为最高(或最低)恒沸点。
恒沸物:具有恒沸点组成的溶液
特点:
(1) 恒沸物上方蒸汽的组成与液相组成相同, 即: xB=yB ---浓度限制条件
(2) 恒沸物不是化合物而是混合物。其组成均 随压力不同而改变,甚至可能消失。
(3) 对具有恒沸混合物的系统,不能用精馏的 方法得到两个纯组分。
b
yB B
根据杠杆定律,物系点变化影响液相和气相的相对量。
n ( l xo xB ) n g(yB xo)
从室温到T1原来物系点液态的X0的物质已被分 解为液态组成为a,气态组成为b的平衡的两相。 18
PhaseEquilibrium (II)
1
4.3 两组分系统的气液平衡相图
相律分析:
C=2
f=C-P+2=4-P f=0, Pmax=4
当P=1, fmax=3
三维立体坐标
通常固定压力p或固定温度T f*=3-P
若P=1, f*max=2
平面坐标
所以两组分系统的相图通常用
指定温度的p-x 或 指定压力的T-x表示。
8.5%
0
8.5%
20 ℃ 0<wB<8.5%
醇的水溶液
100 ℃ 0<wB<9.3% 120 ℃ 0<wB<14%
8.5%<wB<83.6%
83.6%<wB<100%
共轭溶液 conjugate solution 水的醇溶液
9.3%<wB<70.2%
70.2%<wB<100%
14%<wB<61.5%
12
在沸点-组成图中,具有最高(或最低)的温 度,称为最高(或最低)恒沸点。
恒沸物:具有恒沸点组成的溶液
特点:
(1) 恒沸物上方蒸汽的组成与液相组成相同, 即: xB=yB ---浓度限制条件
(2) 恒沸物不是化合物而是混合物。其组成均 随压力不同而改变,甚至可能消失。
(3) 对具有恒沸混合物的系统,不能用精馏的 方法得到两个纯组分。
b
yB B
根据杠杆定律,物系点变化影响液相和气相的相对量。
n ( l xo xB ) n g(yB xo)
从室温到T1原来物系点液态的X0的物质已被分 解为液态组成为a,气态组成为b的平衡的两相。 18
物理化学第六章-相平衡(72).ppt

OB线?
点:三相点,P=3,F=0
to 0.01C, po 0.610kPa
(3)相图的应用
① 当T、p 一定时,确定系统
相态。
② 当T、p 改变时,描述系统
相态变化。
a b cd e
系统从a到e过程系统的相态 改变如下:
H2Os H2Os H2Ol H2Ol H2Ol H2Og H2Og
度数,用 F 表示 例如:水与水蒸气两相平衡系统
变量数= 2(T、p)
自由度数= 1(T or p)
1.2 相律公式 (1)形式: F C P 2
(2)几点说明
★相律公式中的2 :特指 T、p,表示对平衡系统有影响的因素
有温度 T 和压力 p 两个,且系统整体的温度、压力皆相同。
★其它形式 :如有其它因素,F=C-P+n;
液态混合物的特点。
(2) 作图 以甲苯(A)-苯(B)系统为例。
理想液态混合物甲苯(A)-苯(B)系统相图
① p-xB图
p pA pB
由图可知,
p
B
pA p pB
即理想液态混合物的蒸气总
压始终介于两纯液体的饱和
pB pB xB
蒸气压之间。这也是理想液 态混合物的特点。
一样,在理想液态混合物中,
易挥发组分在平衡气相中的
相对含量总是大于它在液相
中的相对含量。
p
A
把表示溶液蒸气总压与
蒸气组成关系的线即p-y 线, 0
1
称之为气相线
A
B
理想液态混合物甲苯(A)-苯(B)系统相图
(3)读图
① 气相线、液相线
等温
② 各相区的相态及自由度 pa
点:三相点,P=3,F=0
to 0.01C, po 0.610kPa
(3)相图的应用
① 当T、p 一定时,确定系统
相态。
② 当T、p 改变时,描述系统
相态变化。
a b cd e
系统从a到e过程系统的相态 改变如下:
H2Os H2Os H2Ol H2Ol H2Ol H2Og H2Og
度数,用 F 表示 例如:水与水蒸气两相平衡系统
变量数= 2(T、p)
自由度数= 1(T or p)
1.2 相律公式 (1)形式: F C P 2
(2)几点说明
★相律公式中的2 :特指 T、p,表示对平衡系统有影响的因素
有温度 T 和压力 p 两个,且系统整体的温度、压力皆相同。
★其它形式 :如有其它因素,F=C-P+n;
液态混合物的特点。
(2) 作图 以甲苯(A)-苯(B)系统为例。
理想液态混合物甲苯(A)-苯(B)系统相图
① p-xB图
p pA pB
由图可知,
p
B
pA p pB
即理想液态混合物的蒸气总
压始终介于两纯液体的饱和
pB pB xB
蒸气压之间。这也是理想液 态混合物的特点。
一样,在理想液态混合物中,
易挥发组分在平衡气相中的
相对含量总是大于它在液相
中的相对含量。
p
A
把表示溶液蒸气总压与
蒸气组成关系的线即p-y 线, 0
1
称之为气相线
A
B
理想液态混合物甲苯(A)-苯(B)系统相图
(3)读图
① 气相线、液相线
等温
② 各相区的相态及自由度 pa
物理化学第6章相平衡

变的变量(可以是温度、压力和表示相组成的某些 物质的相对含量)叫自由度。
2018/12/10 祝大家学习愉快,天天进步! 18/94
§ 6.1 -1.基本概念
(5)自由度数 F:这种变量的数目叫自由度数。 或:能够维持系统原有相数、相态不变可以独立
变化的强度变量数。 例如:纯水在气液两相平衡时,
F=1
试求(1) 、(2)两种情况下,系统的组分数 C=? F=?
解: (1) C = S - R - R´= 3 - 1 - 1=1
F=C-P +2= 1-2+2=1
(2) C = S - R - R´= 3 - 1 - 0 =2 F= C - P + 2 = 2 - 2 + 2 = 2
2018/12/10 祝大家学习愉快,天天进步! 28/94
尽管我们不知这些函数的具体形式。 本章中反复用到相律来讨论各种相平衡关系
2018/12/10
祝大家学习愉快,天天进步!
27/94
例1
(1) 仅由 NH4Cl(s) 部分分解,建立如下反应平衡: NH4Cl (s) =NH3(g)+HCl(g) (2) 由任意量的 NH4Cl (s) 、NH3(g)、HCl(g) 建立如 下反应平衡: NH4Cl (s) =NH3(g)+HCl(g)
祝大家学习愉快,天天进步!
6/94
物理化学电子教案—第六章
相平衡研究的内容 -----相图和相律
用图解的方法研究由一种或数种物质所构成的相 平衡系统的性质(如沸点、熔点、蒸汽压、溶解度等) 与条件(如温度、压力及组成等) 的函数关系。我 们把表示这种关系的图叫做相平衡状态图,简称相图。
或用图形表示多相体系的状态如何随浓度、温度、 压力等变量的改变而发生的变化,此图形称为相图。 通过相图,可以得知在某一温度、压力下,系统 处于相平衡时存在哪几个相,每个相的组成如何, 各个相的量之间有什么关系,以及当条件改变时, 系统相变化的方向和限度。
2018/12/10 祝大家学习愉快,天天进步! 18/94
§ 6.1 -1.基本概念
(5)自由度数 F:这种变量的数目叫自由度数。 或:能够维持系统原有相数、相态不变可以独立
变化的强度变量数。 例如:纯水在气液两相平衡时,
F=1
试求(1) 、(2)两种情况下,系统的组分数 C=? F=?
解: (1) C = S - R - R´= 3 - 1 - 1=1
F=C-P +2= 1-2+2=1
(2) C = S - R - R´= 3 - 1 - 0 =2 F= C - P + 2 = 2 - 2 + 2 = 2
2018/12/10 祝大家学习愉快,天天进步! 28/94
尽管我们不知这些函数的具体形式。 本章中反复用到相律来讨论各种相平衡关系
2018/12/10
祝大家学习愉快,天天进步!
27/94
例1
(1) 仅由 NH4Cl(s) 部分分解,建立如下反应平衡: NH4Cl (s) =NH3(g)+HCl(g) (2) 由任意量的 NH4Cl (s) 、NH3(g)、HCl(g) 建立如 下反应平衡: NH4Cl (s) =NH3(g)+HCl(g)
祝大家学习愉快,天天进步!
6/94
物理化学电子教案—第六章
相平衡研究的内容 -----相图和相律
用图解的方法研究由一种或数种物质所构成的相 平衡系统的性质(如沸点、熔点、蒸汽压、溶解度等) 与条件(如温度、压力及组成等) 的函数关系。我 们把表示这种关系的图叫做相平衡状态图,简称相图。
或用图形表示多相体系的状态如何随浓度、温度、 压力等变量的改变而发生的变化,此图形称为相图。 通过相图,可以得知在某一温度、压力下,系统 处于相平衡时存在哪几个相,每个相的组成如何, 各个相的量之间有什么关系,以及当条件改变时, 系统相变化的方向和限度。
物理化学课件05章 相平衡

根据偏摩尔量加和公式
dG dGB dGB B dnB B dnB
因为 dnB dnB
dG B dnB B dnB (B B )dnB
平衡时 dG 0
B B
同理,可以推广到多相平衡系统
(4) 化学平衡条件
在达到化学平衡时,反应物的化学势等于生 成物的化学势,化学势的代数和可表示为
相图(phase diagram) 研究多相系统的状态如何随温度、压力和组成 等强度性质变化而变化,并用图形来表示,这种图 形称为相图。
§5.1 引 言
相律(phase rule)
研究多相平衡系统中,相数、独立组分数与描 述该平衡系统的变数之间的关系。它只能作定性的 描述,而不能给出具体的数目。
相(phase) 系统内部物理和化学性质完全均匀的部分称 为相。
f * C 1
若除温度、压力外,还要考虑其他因素(如磁 场、电场、重力场等)的影响,则相律可表示为
f C n
§5.4 单组分系统的相平衡
单组分系统的两相平衡——Clapeyron方程
外压与蒸气压的关系—— 不活泼气体对液体蒸气压的影响
水的相图 *硫的相图
超临界状态
在 界面上宏观性质的改变是飞跃式的。
§5.1 引 言
系统中相的总数称为相数,用 表示。
气体,不论有多少种气体混合,只有一个气相。
液体,按其互溶程度可以组成一相、两相或三 相共存。
固体,一般有一种固体便有一个相。两种固体粉 末无论混合得多么均匀,仍是两个相(固体溶液 除外,它是单相)。
设 相膨胀了 dV 相收缩了 dV
当系统达平衡时 dA dA dA 0
dA p dV p dV 0
dV dV
p p
dG dGB dGB B dnB B dnB
因为 dnB dnB
dG B dnB B dnB (B B )dnB
平衡时 dG 0
B B
同理,可以推广到多相平衡系统
(4) 化学平衡条件
在达到化学平衡时,反应物的化学势等于生 成物的化学势,化学势的代数和可表示为
相图(phase diagram) 研究多相系统的状态如何随温度、压力和组成 等强度性质变化而变化,并用图形来表示,这种图 形称为相图。
§5.1 引 言
相律(phase rule)
研究多相平衡系统中,相数、独立组分数与描 述该平衡系统的变数之间的关系。它只能作定性的 描述,而不能给出具体的数目。
相(phase) 系统内部物理和化学性质完全均匀的部分称 为相。
f * C 1
若除温度、压力外,还要考虑其他因素(如磁 场、电场、重力场等)的影响,则相律可表示为
f C n
§5.4 单组分系统的相平衡
单组分系统的两相平衡——Clapeyron方程
外压与蒸气压的关系—— 不活泼气体对液体蒸气压的影响
水的相图 *硫的相图
超临界状态
在 界面上宏观性质的改变是飞跃式的。
§5.1 引 言
系统中相的总数称为相数,用 表示。
气体,不论有多少种气体混合,只有一个气相。
液体,按其互溶程度可以组成一相、两相或三 相共存。
固体,一般有一种固体便有一个相。两种固体粉 末无论混合得多么均匀,仍是两个相(固体溶液 除外,它是单相)。
设 相膨胀了 dV 相收缩了 dV
当系统达平衡时 dA dA dA 0
dA p dV p dV 0
dV dV
p p
物理化学6相平衡资料
水的相图
p / Pa
C
水f
A
冰
P
610.62 D O
q
B
水蒸气
OC 是液-固两相平衡线
273.16
TC T / K
• OC线不能任意延长:当C点延长至压力大于2.07×108Pa时, 相图变得复杂,有不同结构的冰生成。
OA,OB,OC线 p / Pa 的斜率都可以用克-
E
超 临
C
水
界 水
F
A
f
克方程或克拉佩龙方
例如:对于没有气相存在的凝聚系统,可以忽略压力
f * f 1
多相系统平衡的一般条件――吉布斯相律
对具有 个相系统的热力学平衡,实际上包
含了如下四个平衡: (1) 热平衡
(2) 力学平衡 (3) 相平衡
(4) 化学平衡
某平衡系统中有 S 种不同的化学物种,有 个
相,需要多少独立强度变量(f)才能确定系统的状 态?
物种数(S):系统中存在的化学物种数。 组分数(K):构成平衡系统所需的最少物种数。
K=S- R- R′
R表示独立的化学反应数, R′表示独立的浓度限 制条件数。物质在不同相之间保持一定的数量关 系,不能算作浓度限制条件。
平衡系统 NH4Cl (s) =NH3 (g) + HCl (g)中, S = 3, R = 1, R′= 1,K=1
K=S- R- R′=5- 0- 1=4
若考虑可能析出固体,以K+、Na+、 SO42-、NO3-、H2O和K2SO4、Na2SO4、 KNO3、NaNO3为对象 S=9 R=4,4个独立的化学平衡 R′=1,溶液保持电中性
K=S- R- R′=9- 4- 1=4
常见化学平衡图像及分析PPT课件

常见化学平衡图像及分析
1
历年高考查情况
2
2017考试大纲
• 通过对自然界、生产和生活中的化学现象 的观察,以及实验现象、实物、模型的观 察,对图形、图表的阅读,获取有关的感 性知识和印象,并进行初步加工、吸收、 有序存储。
• 将分析和解决问题的过程及成果,能正确 地运用化学术语及文字、图表、模型、图 形等进行表达,并做出合理解释。
t1 t 2、画出改变条件后v-t图像,并分析平衡移动。
问题二:在t2时刻,其他条件不变,只增大压强,若m+n>p+q,:
1、条件改变的瞬时,正、逆反应速率如何变化?随后正、逆反应
速率如何变化?
2、画出改变条件后的v-t
图像,并分析平衡如何移动?
问题三:在t3时刻,其他条件不变,
①只升高温度,若该反应△H>0,画出改变条件后的v-t图像。
逆向思维:如何从v-t图中得知反应从哪个方 向进行建立平衡?
6
二、 v-t图像常见形式及分析
V
V正 V逆 0 t0
以反应 mA(g)+nB(g) pC(g)+qD(g)为例, 在一定条件下达到平衡状态,其图像为:
问题一:在t1时刻,其他条件不变,只增加反应物的 浓度,那么: 1、条件改变的瞬时,正、逆反应速 率如何变?随后正、逆反应速率如何变化?
300C 看图技巧: 200C 作辅助线, 100C “定一议二”
等温线
0
P P1 压强
请根据图像求:m+n > p+q, △H >0 15
练习1:
mA(g) +nB(g)
pC(g) + qD(g)
A
等温线
1
历年高考查情况
2
2017考试大纲
• 通过对自然界、生产和生活中的化学现象 的观察,以及实验现象、实物、模型的观 察,对图形、图表的阅读,获取有关的感 性知识和印象,并进行初步加工、吸收、 有序存储。
• 将分析和解决问题的过程及成果,能正确 地运用化学术语及文字、图表、模型、图 形等进行表达,并做出合理解释。
t1 t 2、画出改变条件后v-t图像,并分析平衡移动。
问题二:在t2时刻,其他条件不变,只增大压强,若m+n>p+q,:
1、条件改变的瞬时,正、逆反应速率如何变化?随后正、逆反应
速率如何变化?
2、画出改变条件后的v-t
图像,并分析平衡如何移动?
问题三:在t3时刻,其他条件不变,
①只升高温度,若该反应△H>0,画出改变条件后的v-t图像。
逆向思维:如何从v-t图中得知反应从哪个方 向进行建立平衡?
6
二、 v-t图像常见形式及分析
V
V正 V逆 0 t0
以反应 mA(g)+nB(g) pC(g)+qD(g)为例, 在一定条件下达到平衡状态,其图像为:
问题一:在t1时刻,其他条件不变,只增加反应物的 浓度,那么: 1、条件改变的瞬时,正、逆反应速 率如何变?随后正、逆反应速率如何变化?
300C 看图技巧: 200C 作辅助线, 100C “定一议二”
等温线
0
P P1 压强
请根据图像求:m+n > p+q, △H >0 15
练习1:
mA(g) +nB(g)
pC(g) + qD(g)
A
等温线
物理化学之相平衡
通过升华从冻结的样品中除去水份的方法。
E
f=2
B
冰
水
f=2 A
C
气
D
f=2
s+g, f=1,冷冻干燥
T
一、单组分系统的相图
f f=K- +2 水的相图
E
B
冰
水
p
610.6Pa
A:三相点
C
A
气
f=0
D
T
0.0098℃
一、单组分系统的相图
f=K-f+2 水的三相点:水的气、液、固三相平衡点。 f=0,T=273.16K ( 0.01℃),p=610.6Pa 水的凝固点(冰点):水的液、固二相平衡点。
↑
l+g, f=1
l+g, f=1 TB
l, f=2
T
A
xB →
B
T
二、杠杆规则
TA
↑
f f=K- +2 g, f=2
l+g, f=1 TB
l, f=2
A
xB →
B
T
二、杠杆规则
TA
↑
f f=K- +2 g, f=2
l+g, f=1 TB
l, f=2
A
xB →
B
T
二、杠杆规则
TA
↑
f=K-f+2 g, f=2
单位与相图一致
A
x1 x0
y1
B
二、杠杆规则
f=K-f+2 系统温度变化时,相如何变化?
n1L1= n2L2
TA
L1
L2
气
T0时,L1=0,得 n2=0
聊城大学材料物理化学-第五章 相平衡4
M2 B G•b%= G1•b1%+ G2•b2%(2)
将(1)式代入,得
(G1+G2)b%= G1•b1%+ G2•b2% G1(b-b1)=G2(b2-b)(3)
所以 G1(M1-M)=G2(M-M2)两个新相M1和M2在系统中的含量则为:
G1=(M-M2/M1+M2)%
G2=(M1-M/M1+M2)%
需要指出的是,转熔点P位于与P点液相平衡的两个晶相 AmBn和B的组成点的一侧,这与低共熔点E位于与E点相平 衡的两个晶相A和AmBn的组成点I和J的中间是不同的。
(2) 析晶 路线
T
a
L
L+A E A+C
1
K P
GD
L+C OJ
b
M L+B
F
C+B
L C
B
A
L B 析出晶 C
B
熔体1 L p=1 f=2
b2
b
b1
A
M1
M
若组成为M的原始混合物含B为 b%,总质量为G;新相M1含B为 b1%,质量为G1;新相M2含B 为b2%,质量为G2。因变化前、 后的总量不变,所以
G = G1+G2 (1) 原始混合物中B的质量为G•b%, 新相M1中B的质量为G1•b1%。 新相M2中B的质量为G2•b2%。 所以:
E1是A-AmBn分二元系统的低 共熔点,在这点上进行的过 程是LE1↔A+AmBn。 E2点是AmBn-B分二元系统 的低共熔点,在这点上进行 的过程是LE2↔AmBn+B。 M点:是化合物AmBn熔点。
M′
(2)结晶路线 a
L M
b
将(1)式代入,得
(G1+G2)b%= G1•b1%+ G2•b2% G1(b-b1)=G2(b2-b)(3)
所以 G1(M1-M)=G2(M-M2)两个新相M1和M2在系统中的含量则为:
G1=(M-M2/M1+M2)%
G2=(M1-M/M1+M2)%
需要指出的是,转熔点P位于与P点液相平衡的两个晶相 AmBn和B的组成点的一侧,这与低共熔点E位于与E点相平 衡的两个晶相A和AmBn的组成点I和J的中间是不同的。
(2) 析晶 路线
T
a
L
L+A E A+C
1
K P
GD
L+C OJ
b
M L+B
F
C+B
L C
B
A
L B 析出晶 C
B
熔体1 L p=1 f=2
b2
b
b1
A
M1
M
若组成为M的原始混合物含B为 b%,总质量为G;新相M1含B为 b1%,质量为G1;新相M2含B 为b2%,质量为G2。因变化前、 后的总量不变,所以
G = G1+G2 (1) 原始混合物中B的质量为G•b%, 新相M1中B的质量为G1•b1%。 新相M2中B的质量为G2•b2%。 所以:
E1是A-AmBn分二元系统的低 共熔点,在这点上进行的过 程是LE1↔A+AmBn。 E2点是AmBn-B分二元系统 的低共熔点,在这点上进行 的过程是LE2↔AmBn+B。 M点:是化合物AmBn熔点。
M′
(2)结晶路线 a
L M
b
物理化学Ⅰ14 相平衡.ppt
dp dT
H m TVm
但也有少数相变ΔH=0,ΔV=0 但ΔCp≠0, Δα ≠0 ,Δκ ≠0, 即
(
2 1
T 2
)
p
(
22
T 2
)
p
T
(
1
p
)T
p
T
( p
)T
p
(
2 1
p 2
)T
(
22
p 2
单组分系统的相平衡一般包括物质的气-液平衡, 气-固平衡,液-固平衡和固-固平衡
处于上述平衡的温度、压力是相互关联的
在指定温度T、压力下p,假设α、β两相成平衡
B
B
T+dT,p+dp 仍处平衡
B
d
B
B
d
B
d
B
d
B
dB* SmdT Vmdp
S
m
结论:
① 液体的蒸汽压随液体上方的外压增加而增大,
② 液体的蒸汽压随外压的变化很小,通常均可 忽略。
若 Vm=RT/p
ln
pg,2 p g ,1
Vm,l RT
( pl,2
pl ,1 )
4. High order phase equilibria
Classification of phase transition
I
ln p
T2 T1
H m RT 2
dT
1 (a lnT 1 b T 1 c T 2 I T A)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
相平衡
1。
指出下列平衡系统中的组分数C,相数Φ及自由度F。
①I2(s)与其蒸气成平衡;
②CaCO3(s)与其分解产物CaO(s)和CO2(g)成平衡;
③NH4HS(s)与其分解产物NH3(g)H2S(g)成平衡;
④任意量的NH3(g),H2S(g)与NH4HS成平衡;
⑤I2在两互不相容的溶液H2O和CCl4中达到分配平衡。
3.用相率分析硫的相图中,各点,线及相区的相平衡关系及自由度。
7.水异丁醇系统液相部分互溶,在101.325KPa下,系统的共沸点为89.7℃,气(G),液(l1),液(l2)三相平衡时的组成ω(异丁醇)依次为:70.0%,8.7%,85.0%,今有350g水和150g 异丁醇形成的系统在101.325KPa压力下,由室温加热,问:
①温度刚要达到其共沸点时,系统处于相平衡时存在哪些相?其质量各为多少?
②当温度由共沸点刚有上升趋势时,系统处相平衡时存在哪些相?其质量各为多少?
14.固态完全互溶,具有最高熔点的A-B二组分系统的相图如下,
指出各相点的相平衡关系,各条线的意义,a,b样品的冷却曲线。
18.二元凝聚系统Hg-Cd相图示意如附图,指出各个相区的稳定相和三相线上的相平衡关系。
16.某A-B二组分凝聚系统相图如下:
①指出个相区稳定存在时的相;
②指出图中的三相线,哪几个相成平衡,相平衡关系如何?
③绘出图中状态点为a,b,c三点样品的冷却曲线,并注明各阶段时的相变化。
20.A-B二元凝聚系统相图如下,标出图中各相区的稳定相,并
指出图中的三相线及三相平衡关系。
