我院药品不良反应上报情况分析与评价
我院药品不良反应报告信息利用分析

障药师正常工作 的前 提。 入库验 收应严格 审查 , 品上架应仔 细核 药
对 包 装 、 号 和 有 效 期 , 配 和 发 药 环 节 应 严 格 执 行 四查 十对 , 批 调 发 现 问 题 应 及 时 与 处 方 医师 联 系 确认 , 防在 某 个 环 节 用 药 失 误 。 严 此
3 积极 开展 用药 教 育 , 防 用 药 失 误 预 3 1 减 少 药 师 调 配 失 误 . 整 洁 有 序 的 工 作 环 境 , 范 严 谨 的 工 作 制 度 和 操 作 规 程 是 保 规
用药 的认识 和需求 1益迫 切。 了准确快捷地调配发放药品外 , 3 除 药 师更重要 的任务是为患者提供专业 的用药指导 。 近几年 , 院不断 我 引进各种形式 的“ 合理用药软件” 系统 , 购买 了大量专业书籍 , 尝试
3%左右 。 院通过加强宣传和严格考核制度后 , 0 医 报告 数 量 稳 中有 升 , 告 质量 也 逐 步 提 高 。 报 2 2 抗 菌 药物 药 品不 良反 应
院 内药 品不 良反应信 息分析小组 由药剂科 主任 、 临床药学 室 主任 、 药品不 良反应 报告联 络员组成 , 根据需要 邀请 医师 、 护理 人 员参加 。 主要任务是定期 、 不定期对 院内药 品不 良反应报告进行分 析 和评 价 , 将有 价值 的信 息形成 电子或者纸 质 的院 内药品不 良反 应信 息通报 , 告给临床各用药部门及院 内相关部 门, 报 特别重要的 信息如 导致患者 死亡 的药品不 良反应 、 体性药 品 良反应及 时 群
管理办法》 规定 , 医疗机构应该经常对本单位生产 、 经营 、 使用的药 品所发生 的药 品不 良反应进行分析 、 评价 , 并采取相应措施 减少 和
药品不良反应监测工作总结6篇

药品不良反应监测工作总结6篇第1篇示例:药品不良反应监测工作是保障人民群众用药安全的重要工作,通过及时发现和报告药品的不良反应,可以有效保护患者的健康和生命安全。
在过去的一年里,我们按照上级部门的要求,认真贯彻落实药品不良反应监测的相关政策和规定,开展了一系列监测工作。
现在,我将对过去一年的药品不良反应监测工作进行总结,以期更好地提高工作效率和质量。
我们注重加强队伍建设。
药品不良反应监测工作需要具备丰富的医学知识和严密的数据分析能力。
我们组建了专业化的监测团队,包括临床医生、药师、护士等各个专业的人员。
除了基本的专业技能外,我们还定期组织培训和学习交流,提高队伍的整体素质和专业水平。
我们加强了监测工作的宣传和培训。
药品不良反应监测是全社会的责任,需要医务人员、患者等各方共同参与。
我们定期开展相关政策法规的宣传和解读,向社会各界普及药品不良反应的相关知识和意识。
我们还不断加强医务人员的培训,提高他们对药品不良反应监测工作的认识和重视程度。
我们加强了监测数据的收集和分析。
监测工作的关键在于对药品不良反应数据的准确收集和及时分析。
我们建立了完善的数据采集和管理制度,确保每一起药品不良反应都能得到及时记录和汇总。
我们还不断优化数据分析的方法和技术,提高数据挖掘和分析的效率和准确性。
我们加强了监测结果的应用和反馈。
药品不良反应监测的最终目的是为了保障患者的用药安全,我们及时将监测结果反馈给相关部门和机构,为政府制定药品监管政策提供参考。
我们也将监测结果及时反馈给药品生产企业和医疗机构,帮助他们及时调整药品使用和管理的措施,保障患者的安全和利益。
通过一年的药品不良反应监测工作,我们取得了一定的成绩。
但也要看到存在的问题和不足,如数据不全、反馈不及时等。
我们将进一步加大力度,完善工作机制,提高工作效率和质量,为保障人民群众的用药安全作出更大的贡献。
希望在未来的工作中,我们能够不断提升自身的专业水平和服务能力,为药品不良反应的及时发现和有效管理做出更大的努力。
医疗安全不良事件分析报告

2016年度医疗安全不良事件分析报告XXXXXX人民医院质控科随着人们法律观念和维权意识日益增强,对医护人员的职业道德、技术水平及服务质量提出了更高的要求;为进一步加强医疗安全管理,促进医疗质量的持续改进,保障医疗安全,进一步明确以“病人安全”为导向,自从2014年我院制定了非处罚性的医疗安全不良事件报告制度及工作流程以来,各科室严格监控和管理,按规定及时、主动上报,2016年度各科室上报不良事件及药品不良反应312例,未发生重大安全事件;现将各科室报告医疗安全不良事件进行分析,以利于消除安全隐患,防范医疗事故及纠纷,不断提高医疗质量;一、2016年度不良事件数据汇总1.1-12月上报例数:图12. 医疗安全不良事件科室分布:图23. 不良事件分类:4.2016年与2015年不良事件对比,见图4图4 2016年与2015年各类不良事件对比4. 各类不良事件1-12月趋势,见图5图5—2016年1-12月趋势图5. 不良事件发生场所,见图6二、2016年各类不良事件汇总分析一医疗安全不良事件1.医疗不良事件分类:图7—-医疗不良事件分类柏拉图2. 医疗不良事件分级:3. 医疗安全不良事件小结:医疗安全不良事件中,由医生上报7例,护士上报19例;绝大多数属于Ⅳ级事件,占73%,主要是医嘱事件,Ⅲ级事件占27%,主要有医疗处置事件、用药错误等;医嘱事件16例,其中录错药物数量5例、录错药物剂量4例、漏录电脑4例、录错患者3例;医疗处置事件4例,包括胸腔闭式引流操作2例,导尿操作2例;用药错误2例,包括用法错误、提前用药各1例;跌倒事件2例,均为脑血管疾病患者夜间坠床;意外事件1例,为住院处录入身份信息错误;输液反应1例;二护理安全不良事件1.护理不良事件分类:2. 护理不良事件分级3. 2016年与2015年护理不良事件对比,见图11图11—2016年与2015年护理不良事件对比4. 护理不良事件小结:从图9、图11中看出:用药错误共发生27例,比2015年增加8例,增长率42 %;坠床/跌倒事件23例,比2015年增加11例,增长率91 %;管路事件13例,比2015年减少9例,降低40%;意外事件15例,包括:床档致皮肤挫裂伤、皮肤烫伤、手术物品不齐全、服药伤害、患者走失等;操作处置事件12例,包括静脉输液操作4例、导尿操作2例、输液泵操作不当2例、肾透析操作2例;标本采集事件9例,包括用错试管、血标本溶血、试管错误、血标本送检延误等;通过综合评定,117例医疗护理安全不良事件分级情况,见图10Ⅳ级事件:25例,分别为医嘱事件、意外事件、护理操作处置事件等,占21%Ⅲ级事件:87例,分别用药错误、管路事件、跌倒事件、标本采集事件、非预期压疮等,占75%,是2017年进行质量控制的重点;Ⅱ级事件:5例,为跌倒致口唇清创缝合、跌倒致眼部裂伤、跌倒致牙冠横折口唇缝合、跌倒致手掌挫裂伤、口服药自伤抢救各1例,占4%;其中1例病人自服过量抗抑郁症药,入急诊科洗胃、抢救6天,好转出院;三药品不良反应及不良事件本年度共上报药品反应149例,占全院不良事件的48%;包括54种药物,其中以抗生素居多,分别是氧氟沙星10例,表现为恶心呕吐、上腹部不适、注射部位瘙痒;美洛西林舒巴坦8例,头孢曲松8例,表现为全身皮肤瘙痒、散在丘疹、红肿、胸闷憋喘;阿奇霉素8例,主要表现为腹痛、恶心、呕吐、小儿哭闹;前列地尔7例,表现为输液部位发红、疼痛、恶心呕吐等;硝酸异山梨酯16例,表现为头疼、头胀不适;吡拉西坦7例,表现为注射部位疼痛、头晕、恶心、心慌、皮肤瘙痒等;红花注射液5例,表现为胸闷、气促、上腹部不适;盐酸溴己新4例,表现为皮肤瘙痒、皮疹、腹痛、小儿哭闹;其它药物有硫辛酸、血塞通、二丁环磷腺苷钙、脑蛋白水解物、脂溶性维生素、泮托拉唑、地塞米松等,口服药有硝苯地平、坎地沙坦、氟桂利嗪、通心络等,均为一般药物反应;新的药品不良反应有5例,包括:静脉注射还原型谷胱甘肽致鼻塞、流涕、胸闷等过敏症状1例;注射兰索拉唑致高热、憋喘1例;口服通心络胶囊致上腹部撑胀2例;口服坎地沙坦致面部肿胀、皮疹1例;严重药品不良反应2例,包括注射液甘露聚糖肽致呼吸急促、憋喘、恶心呕吐、呼吸衰竭、心脏骤停,过敏性休克1例;静脉注射17种氨基酸致心慌、胸闷、憋喘,过敏反应1例;另有药品不良事件3例,包括中药房、西药房各发错药1例,护士发现后及时改正;发生1例液体加入帕瑞西布药后,出现絮状物的事件,药剂科立即与医药公司取得联系,生产厂家派人来科室了解情况后反馈,分析原因由于药物性质不稳定引起,建议帕瑞西布溶于%氯化钠溶液使用,在使用前后充分冲洗静脉通路;四医疗器械设备不良事件本年度共上报20例,其中三类14例,包括一次性输液器调节夹关闭不紧、输液器漏液4例、静脉留置针针芯不能分离2例、输液泵在输液暂停时未报警2例、一体性鼻氧管漏气2例、避光输液器管道内有飞虫1例、一次性注射器内有头发1例;二类6例,包括动脉接入止血器过敏2例、一次性引流袋接头处漏液2例、无菌阴道扩张器关节处断裂1例、氧气湿化瓶连接不牢固1例;对医疗器械设备存在的质量问题,均已通知供货商,更换新产品,并从国家药品不良反应监测系统进行可疑医疗器械不良事件上报,及时送泰安医疗器械维修站检修;一例输液器管道内有飞虫事件,引起患者不满,已联系生产厂家,给予沟通、经济补偿;三、总结分析从本年度事件上报情况看:以药品不良反应、护理不良事件为主,反应出医疗、护理安全、用药管理方面任重而道远,需要严格执行医疗护理规章制度,不断改进工作流程和方法,严格控制用药安全;医生发现药品不良反应报告及时;护理人员上报的不良事件整体质量较高,书写工整,内容项目齐全,事件原因及事件处理情况分析准确,处理得当,事件等级定性准确;医务科、护理部、药剂科、医疗设备科接报后均能在第一时间了解事件情况,积极协助事件处理,最大程度上减少了医疗纠纷及安全隐患;结合图表分析如下:一图1、2所见,2016年度共上报不良事件312件,按核定床位580张计算,符合二级甲等医院评审A款要求;全院临床、医技科室36个,17个科室有医疗安全不良事件报告,比2014年的24个科室下降29%,与2015年报告科室相同,科室报告数量最多的45例,最少的3例,与科主任、护士长认真负责,科室人员安全意识较强密切相关;未上报不良事件的科室,考虑原因为:1部分科室医疗人员对医疗安全不良事件的认识存在理解偏差以及对不良事件的报告制度落实不严格;2对医疗安全不良事件报告主动性不够,错误地认为报告了会影响个人、科室形象,会受到处罚,担心会引起纠纷;3科室主任、护士长、质控人员监督检查不到位,科室发生的不良事件未能及时发现;4科室培训不到位,对不良事件报告流程的认知缺乏,新入人员对上报流程不熟悉;二图3、图4、图5所见,在312例不良事件中,药品反应及不良事件149例,占全院48%,比2015年减少7例,上半年上报40%,下半年上报60%,呈逐渐上升趋势;护理不良事件共上报117例,与2015年持平,占%,全年上报例数比较均衡;医疗不良事件上报26例,占%;医疗器械设备不良事件20例,占%,二者上报例数持续走低;三报告人员方面,在医疗安全不良事件中,医生报告7例,占27%,其余19例由护理人员报告,占73%;药品不良反应及不良事件中,医生上报143例,护理人员上报3例;护理不良事件、医疗器械设备不良事件由护理人员上报100%,无医技、后勤科室人员上报,不符合常理,希望引起各科室领导重视;四图6所见,不良事件发生场所以住院部病房为主,占90%,其次是急诊病区、卫生间、肾透析中心、手术室、门诊科室、电梯内、病房楼外;五本年度上报的医疗安全不良事件,科室和相关职能部门已完成原因分析、处理、不良事件评价及持续改进;药品反应及器械设备不良事件已按要求上报国家食品药品监督局,并及时送检维修;四、针对以上存在问题,制定整改措施:1.加强医疗安全不良事件上报的培训,充分认识不良事件上报的意义和重要性,人人掌握不良事件的相关知识,上报流程,提高全院医务人员的识别及早期处理医疗隐患的能力;根据二级甲等评审要求,鼓励科室积极上报,完成每百张床位≥20件的指标,特别是医技、后勤人员,争取实现“零突破”;2.树立良好的为患者服务思想,严守职业道德和职业操守,加强医患沟通,尊重患者的各项知情权,合理、及时告知,改善服务态度,提高责任心,提高患者满意度;3.加强法律法规和业务知识的学习,通过学习使医护人员更加明确医患双方的责任和权利,科室形成良好的学习氛围,提高医务人员的业务水平,以严谨的工作作风及优良的服务,有效的维护患者的生命健康和安全,使科室整体水平有一个质的飞跃;4.严格执行各项医疗核心制度,落实各级各类人员职责,各级岗位职责,做到每项医疗行为有制度有规程;5.科室加强对新上岗人员的培训,重点加强对本科疾病的常规培训,定期组织培训学习,不定时抽查对相关知识的掌握,科室对未掌握标准、规范及操作流程的医护人员不要急于排班,加强带教培训及安全监管,防止私自独立操作,引发不良事件;6.学习新药物的药理知识,严格掌握各种药物的适应症、禁忌症,掌握抗生素的使用原则,不滥用抗生素,用药过程中注意观察患者的药物反应,对于科室不常用的特殊药物应阅读说明书,对有疑问的医嘱不可盲目执行,必要时请示科室主任护士长;7.加强医疗设备使用的培训,减少错误操作导致的各种故障;在进行各项医疗护理技术操作时,要有爱伤观念,对可能出现的并发症有预见性,做好预防的准备;如跨专业使用医疗设备,立即请相关科室专科指导操作方法、注意事项及观察内容,组织全科人员学习;8.医护人员应密切观察病情变化,对老、幼、昏迷及术后患者按需要加防护栏,躁动病人应用安全约束带防止坠床,对精神异常和有自杀倾向患者应密切观察动态,防止因医护人员疏忽大意而发生意外;9.认真做好术前讨论,对手术适应症、术中及术后可能出现的问题进行充分讨论,术前与患方充分沟通,告知手术并发症及预防措施,尽可能减少非计划再手术发生机率;严格执行无菌操作技术和手术规程,不断提高手术操作技能,确保手术成功率;10.护士长加强安全管理,每月召开安全会议,提高护理人员对病人安全管理重要性的认识,将各项护理措施实施到位,健康教育达到预期效果,防止烫伤、跌倒/坠床事件发生,降低护理风险的发生;11.随着就医患者数量的增加,或某些疾病患病高峰时段的到来,在床位满载的情况下,为了满足患者的就医需求,保证正常的医疗护理工作秩序和质量,护理部特制定加床管理制度,增加房间或加床管理流程,科室监督执行,以避免因对加床患者的管理不善导致差错的发生;12.加强对各种医疗设施设备的监管,总务科、医疗设备科定期巡查,定期进行日常检查、维护保养,及时更换老化、过期仪器设备及零部件,保证医疗安全;医疗安全不良事件的发生,虽有一部分原因来自个人的疏忽或技术不良,但更大部分原因来自长期潜在于整个系统中的失误,是因为系统、流程、工作环境的疏失;苛责个人并不能使系统更安全,重要的是防止别人犯类似的错误;因此,营造开放式的质量安全文化,每一位员工积极参与科室质量管理与不良事件的搜集、报告,从不良事件中汲取经验并不断改进工作流程,建立不以惩罚为手段的不良事件报告系统是建立安全医疗体系的第一步;本年度上报的医疗安全不良事件,已按制度进行奖励,科室管理者及医护人员要充分认识到报告医疗不良事件的积极意义,即通过报告来掌握错误发生的信息,增加对错误的系统识别能力、风险防御能力,通过整改来提高医疗服务质量,更大程度地保障病人医疗安全;2016年2月16日。
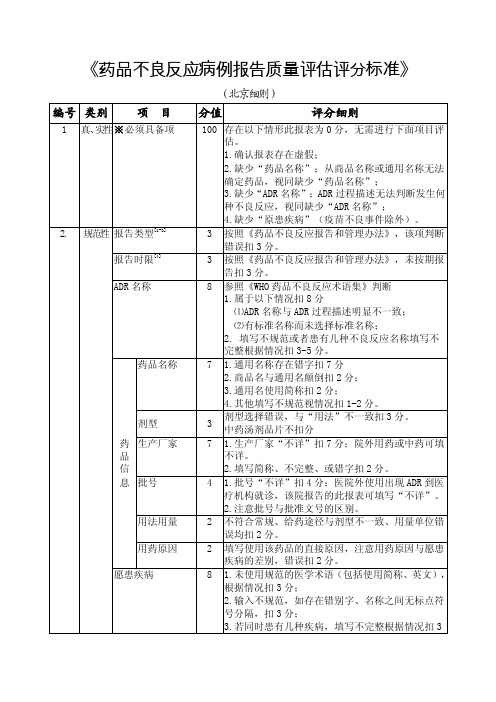
药品不良反应病例报告质量评估评分标准
病情动态变 5 严重病例报告无病情的动态变化记录视情况扣 3-5
化
分
治疗措施
3 1.无对症治疗措施或过于笼统扣 3 分。
2.停药在轻度病例中可视为治疗措施之一,但经停
药后反应并无好转,而又无记录其他治疗措施者视
为无对症治疗扣 3 分
治疗后效果 3 无治疗后结果扣 3 分
其他项目[9]
3 1. 除“家族药品不良反应”与“既往药品不良反应”
号分隔,扣 3 分;
3.若同时患有几种疾病,填写不完整根据情况扣 3
关联性评价 ADR 分析[7]
分。 4.扣分至此项 0 分为止。 2 评价标准[6]见备注,药品与 ADR 有关评价为“可能 无关”扣 2 分,而具体评为“可能”、“很可能” 还是“肯定”不扣分。
3 ADR 分析中 5 项中任何一项判断错误均扣 1 分,扣 分至此项 0 分为止。
《药品不良反应病例报告质量评估评分标准》
编号 类别 项 目
1 真、实性※必须具备项
2. 规范性 报告类型[1-3] 报告时限[4] ADR 名称
药品名称
剂型 药 生产厂家 品 信 息 批号
用法用量 用药原因 愿患疾病
(北京细则)
分值
评分细则
100 存在以下情形此报表为 0 分,无需进行下面项目评
估。
疗机构就诊,该院报告的此报表可填写“不详”。
2.注意批号与批准文号的区别。
2 不符合常规、给药途径与剂型不一致、用量单位错
误均扣 2 分。
2 填写使用该药品的直接原因,注意用药原因与愿患
疾病的差别,错误扣 2 分。
8 1.未使用规范的医学术语(包括使用简称、英文),
根据情况扣 3 分;
药品不良反应监测与报告

西立伐他汀
1997 年上市
降低血脂
横纹肌溶解 肾功能不全
2001 年
修改说明书
撤市
医院ADR监测工作的模式与意义
医疗机构如何开展ADR监测工作
1、建立健全组织机构,成立专业不良反 应监测管理机构。 2、完善制度,鼓励上报 3、加强内部培训,多渠道收集ADR报告 4、定期总结与反馈,发布药物警戒信息
药品不良反应表现相关的内容
不良反应转归、因果关系分析评价 其它需要补充说明的情况
药品信息常见错误:
?通用名、商品名混淆或填写混乱,剂型 不清; ?生产厂家缺项,填写药厂简称; ?把产品批号写成药品批准文号; ?用药原因错误; ?并用药品率低
不良反应名称不准确
? 皮肤反应 ? 迟发型过敏反应 ? 药疹 ? 中枢神经系统损害 ? 血管毒性 ? 青霉素 I型变态反应 ? 胃肠道反应 ? 肌肉紧张 ?致畸 妇科炎症
华法林致皮下出血
环丙沙星致光敏性皮炎
卡马西平致剥脱性皮炎
四环素类药物不仅可以影响婴幼儿时期发育的恒 牙牙色,而且孕妇若服用此类药物,还可以通过 胎盘影响胎儿期发育的乳牙牙色。许多儿童的龋
齿与骨骼发育障碍均与四环素有关。
尼美舒利颗粒
以上事件带给我们思考 是什么导致如此严重的事件的发生?
药品不良反应(ADR)
很可能 可能
可能无关 待评价
1
2
3
4
5
+
+
+
+
-
+
+
+
?
-
+
± ±? ? ±?
-
- ±? ? ±?
需要补充材料才能评价
无法评价
评价的必须资料无法获得
根据药品风险的普遍性或者严重程度,决定 是否需要采取相关措施,如在药品说明书中加入 警示信息,更新药品如何安全使用的信息等。
药品不良反应报告的评价与药物警戒中的信号问题

• 对发生率低的反应更难适用
虽然已证明苯丙醇胺与出血性中风有关 联,但在日常生活中很少见到使用含苯丙 醇胺的制剂导致出血性中风。
--然而当有病例符合时,则说明联 系有极强的因果性质。
流行病学因果判断的标准
5.联系的强度
(1) 量的强度
即联系的强度可以量化。 相互联系量大,往往说明其间有因果性。
量小的联系仍可能具因果性,量小有可能因研 究设计方面的问题所致。一般认为相对危险度在2 以下的为弱联系。吸烟与肺癌的相对危险度,多 方面研究的结果是10.0至30.0,是强联系。
流行病学因果判断的标准
3. 联系的时间程序
先因后果,原因在时间程序上必须是在结果之 前--先后关系
原因与结果的间隔时间往往有其特征
使用氰化物与死亡仅间隔几秒;青霉素引起的 过敏性休克及死亡发生在几分钟至几小时里;吩 噻嗪类引起的肝炎发生在几天至几个星期里;氯 霉素引起的再生障碍性贫血发生在用药后的1至4 个月。
度不同。
(二)ADR判断的若干 方法
评价ADR个例报告可出于不同的目的, 可应用不同的方法:
1. 总体评价法 2. 推理法
• Karch & Lasagnar法 • 美国FDA方法 • 我国卫生部药品不良反应监察中心方法 • WHO国际药物监测合作中心(UMC)推荐方法
3 记分推算法
• Naranjo方法 • Venulet方法 • 法国归因评定法
• 其他类型信息是指其他人体研究的数据,其他 有关问题研究的数据,如动物实验的数据以及 科学的病理生理学理论。如果某项发现能为已 有的资料和理论所解释,一般更令人信服。
如苯丙醇胺是一种合成的拟交感神经药, 化学结构与收缩血管的胺(如肾上腺素、 去氧肾上腺素、麻黄碱等)和兴奋中枢神 经的药物(如安非他明)相似。其药理实 验也已证明该药可收缩血管、升高血压。
药品不良反应216例报告分析

药品不良反应216例报告分析摘要目的:了解药品不良反应(adr)发生一般规律及特征,为adr监测和临床合理用药提供参考。
方法:收集216例adr报告,按年龄分布、给药途径、药品类型、adr状态、涉及器官或系统及临床表现等进行统计、分析。
结果:adr可发生于各年龄段,以静脉注射给药引发的居首;216例adr中涉及抗菌药物和中成药居前2位,其中头孢菌素类、喹诺酮类药物和中药注射剂发生频次较高;adr临床表现以皮肤及其附件损害最为常见。
结论:应加大临床adr 监测和报告力度,做好adr知识宣传,合理用药,减少或避免adr 的发生。
关键词药品不良反应报告分析合理用药药品具有双重属性,既能为患者解除痛苦、消除疾患,也可能给患者带来新的不适。
这种不适有时是轻微的、一过性的,有时候是严重的,对身体产生超过原患疾病的影响,甚至可能导致严重的药源性疾病。
药品不良反应(adr)监测是药品安全监管的重要手段,通过对adr信息的收集、报告和汇总,进行科学分析与评价,从中提取出有价值的警戒信号,达到有效预警和为临床安全合理用药提供参考。
为了解我院adr发生的特点与规律,探讨其原因和影响因素,保障患者用药安全、有效,对2009~2011年上报的216例adr报告进行统计分析,以促进adr监测工作的开展。
临床资料2009~2011年共收到各科室报告的adr 216例。
对报告采用回顾性调查方法,按患者的性别、年龄、给药途径、药品种类、adr 累及器官或系统及临床表现等进行统计分析。
结果adr与患者的性别年龄:男性患者114例(52.78%),女性患者102例(4722%);在年龄分布方面,各年龄段患者均有adr发生。
见表1。
adr状态:一般的不良反应为196例(9074%),严重的不良反应20例(926%);其中新的药品不良反应6例,严重1例,一般5例。
不良反应结果:216例adr报告中,治愈146例(6759%),好转70例(3241%),有后遗症0例,死亡0例。
药品不良反应报告和监测管理制度(5篇)

药品不良反应报告和监测管理制度为加强我院药品管理,规范药品不良反应报告和监测,及时、有效控制药品风险,保障患者用药安全,根据____年____月新颁布的《药品不良反应监测和管理办法》,修订本制度。
1、药品不良反应是指合格药品在正常用法用量下出现的与用药目的无关的有害反应。
2、药品不良反应监测领导小组具体负责药品不良反应报告和监测的____管理。
医院各科室设置药品不良反应监测员,负责本科室药品不良反应报告和监测工作。
药剂科临床药学室负责对收集到的药品不良反应报告和监测资料进行上报、分析和评价,建立并保存药品不良反应报告和监测档案。
3、对新药监测期内的国产药品,报告该药品的所有不良反应;其他国产药品,报告新的和严重的不良反应。
进口药品自首次获准进口之日起五年内,报告该进口药品的所有不良反应;满五年的,报告新的和严重的不良反应。
4、院内发生的新的、严重的药品不良反应____日内报告,其中死亡病例必须立即报告;其他药品不良反应____日内报告。
有随访信息的,应当及时报告。
5、发生医院药品不良反应逐级、定期报告。
发生新的、严重的不良反应必须立即报告;必要时可越级报告。
6、医务人员发现可疑药品不良反应时应及时停用可疑药品,对不良反应给予相应治疗并按规定详细记录,填写《药品不良反应/事件报告表》及时上报药剂科。
7、发生药品群体不良事件后,应当积极救治患者,迅速开展临床调查,分析事件发生的原因,必要时可采取暂停药品的使用等紧急措施;立即通过电话或传真等方式报所在地的药品监督管理部门、卫生行政部门和药品不良反应检测机构,必要时可以越级报告,同时填写《药品群体不良事件基本信息表》,对每一病例还应当及时填写《药品不良反应/事件报告表》,通过国家药品不良反应监测信息网络报告。
8、积极配合药品监督管理部门、卫生行政部门和药品不良反应监测机构对药品不良反应或者群体不良事件的调查,并提供调查所需的资料。
9、对药品不良反应报告和监测过程中获取的商业____、个人隐私、患者和报告者信息予以保密。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
我院药品不良反应上报情况分析与评价目的分析我院药品不良反应(ADR)发生的特点及规律,为临床合理用药提供参考。
方法对我院2015年上报的ADR报告进行分析、评价。
结果2015年我院共上报201例ADR。
其中,一般的ADR 108例(53.7%),新的一般的ADR 67例(33.3%),严重的ADR 20例(10.0%),新的严重的ADR 6例(3.0%);男性患者90例(44.8%),女性患者111例(55.2%);40~79岁患者构成比最高;给药途径中以静脉滴注的比例最高(84.6%);引起ADR发生率最高的药物为抗感染药(26.7%);主要累及的系统/ 器官为皮肤及附件(37.3%)。
结论我院应进一步加强ADR的监管与防范,规范临床用药,加强患者用药宣传,确保用药安全。
[Abstract] Objective To analyze the characteristics,regularity of adverse drug reaction (ADR)reports so as to provide reference for the rational use of drugs in clinic. Methods ADR reports collected in Affiliated Hospital of North Sichuan Medical College in 2015 were analyzed and evaluated. Results There were 201 ADR reports collected in our hospital in 2015.Among the ADR reports,there were 108 cases(53.7%)common ADR,67 cases (33.3%)of new and common ADR,20 cases (10.0%)were severe ADR and 6 cases (3.0%)were new and severe ADR;90 cases (44.8%)were male and 111 cases (55.2%)were female;Patients aged from 40 to 79 years accounted for the largest proportion;The main administration route causing ADR was intravenous infusion (84.6%);The most frequency in suspected drugs was anti-infective drugs (26.7%);Skin and appendages damage was the most frequent ADR (37.3%). Conclusion Our hospital should strengthen ADR monitoring and prevention,clinical medication should be further standardized and the related knowledge of drugs should be publicized to ensure the patients′ medication safety.[Key words] Adverse drug reaction;Analysis;Evaluation药品不良反应(adverse drug reaction,ADR)是指合格药品在正常用法用量下出现的与用药目的无关的有害反应[1],不仅加重患者的不适和痛苦,还会带给家庭、社会沉重的负担。
近年来,随着临床用药品种日益增多,人均用药率、群体用药频度和数量不断上升,ADR引发的问题更加突出和严峻[2]。
对ADR 进行监测和处理,分析评价报告是设置药物安全界限的有效保障,同时也是促进临床安全、合理用药的重要手段[3]。
现通过回顾性分析统计我院2015年上报的ADR,探讨ADR的发生规律及特点,以保障临床安全合理用药。
1 资料与方法1.1 资料来源检索2015年由我院上报国家药品不良反应监测系统中所有的ADR报告。
1.2 方法对ADR涉及的患者情况(性别、年龄)、上报人员、引起ADR的药品、给药途径、临床表现、转归等进行分类统计。
2 结果2.1 一般情况2015年我院共上报ADR报告201例。
报告类型中,一般的ADR 108例(53.7%),新的一般的ADR 67例(33.3%),严重的ADR 20例(10.0%);新的严重的ADR 6例(3.0%)。
上报人员中,医生上报109例(54.2%),护士上报57例(28.4%),药师上报35例(17.4%)。
2.2 ADR患者基本情况201例ADR中,男性患者90例(44.8%);女性患者111例(55.2%)。
患者年龄1~87岁,在发生ADR的患者中,60~69岁者所占比例最大(表1)。
表1 ADR患者基本情况(n)2.3 引发ADR的给药途径分布201例ADR报告中,怀疑由单一药品引起的191例,由联合用药引起的10例。
涉及静脉滴注、静脉注射、肌内注射、皮下注射、口服给药、局部外用6种途径(表2)。
表2 引发ADR的给药途径分布2.4 ADR涉及的药品种类分布根据《临床用药须知》(2010年版)分类方法,将201例ADR涉及的药物进行分类统计,引发ADR最多的为抗感染药,共57例,其次为心血管系统药和中药制剂,各26例(表3)。
表3 ADR涉及的药品种类分布2.5 ADR累及的系统/器官及临床表现在201例ADR报告中,发生在各系统的ADR共计241次(涉及到全身多个系统的ADR做了多次统计,共计有241例)。
其中皮肤及其附件损害最多,达到37.3%,其次为心血管系统和胃肠系统损害(表4)。
表4 ADR累及的系统/器官及临床表现2.6 转归201例ADR报告中,好转117例,痊愈84例,无未好转和死亡病例的报告。
3 讨论3.1 ADR上报情况从报告类型来看,一般的ADR最多,新的一般和严重的ADR所占比例也较高,达到43.3%,在ADR报告评价中,新的严重的报告发挥着重要作用[4]。
药品上市销售前,药物临床试验存在设计简单、样本数量少、病种单一、观察时间短、受试者入选条件局限等问题导致许多ADR未被发现,要求我们对新的和严重的ADR及时准确上报,避免药品对更多人群的伤害[5-6]。
上报人员中,医生上报ADR数最多,药师最少。
加强医生对ADR上报意识可极大提高ADR的上报量,此外有关部门还应积极采取有效措施,提高药师及护士的上报量。
3.2 性别、年龄对ADR的影响发生ADR的患者中,女性略高于男性,可能与女性体内药物分布特点及女性月经、妊娠生理周期对药物的敏感性比男性高有关[7-8]。
各年龄段均有ADR 发生,主要集中在40~79岁,可能与患者工作、生活压力大,身体处于亚健康,生病和用药频率较高有关[9]。
此外,中老年人的生理功能随着年龄增长而逐渐下降,体内药动/药效学参数发生改变,对药品耐受性变差;另外,随着年龄的增长易患多种疾病从而联合用药,这也增加了不良反应的发生[10-11]。
因此,对于中老年人用药更应小心、谨慎,对药物可能出现的ADR需要引起足够重视。
3.3 给药途径对ADR的影响报告中静脉滴注引起的ADR报告数最多,达到84.6%,说明静脉给药的风险明显高于非静脉给药,与文献[12-13]报道相符。
这可能由于药物无首过效应,直接入血,对机体的刺激较大,同时溶液的pH值、渗透压、内毒素、滴注速度以及联合用药等均是引发ADR的因素[14]。
故临床应严格把握静脉给药指征,遵循“可口服勿肌注,可肌注勿静注”的基本原则,并密切监护。
3.4 ADR涉及的药品品种抗感染药引起的ADR居首位,共57例(占26.7%),抗感染药临床应用非常广泛,而且存在无明显指征用药、剂量过大、疗程过长等问题,造成了ADR 的发生率升高。
滥用抗感染药不仅会引起不必要的ADR,还易导致细菌耐药。
因此临床医生应严格掌握用药指征,避免滥用,并密切观察患者的用药全过程[15]。
中药制剂和心血管系统药引起的ADR发生率位居第二。
目前,中药制剂在临床使用已相当广泛,由此导致的ADR也越来越多。
中药制剂所含成分相当复杂,其有效成分难分离,其药理及毒理作用机制、不良反应、疗效可靠性等还有待进一步探明,特别是中药注射剂的安全性和有效性更有待进一步验证[16-17]。
故临床用药时应详细询问患者有无过敏史,对应用中药注射剂的特殊人群及初次应用者均应更加慎重,并作重点监护。
3.5 ADR累及的系统/器官及临床表现本研究显示药物引起的ADR以皮肤及其附件损害比例最为常见,占37.3%,此类反应较直观、便察觉,易与其他疾病区别[18]。
累及其他器官/系统的临床表现较为隐匿,不易判断,对需要进行更加深入的临床监测和考察的ADR,如肝、肾损伤,心脑血管毒性等,均需临床医务人员高度重视,加强药物临床应用全过程的监测,尽量减少ADR的发生。
从整体上看,我院的ADR上报数量还远远不足,医院应进一步加强ADR 的监管与防范,提高医护人员主动上报ADR的意识和自觉性。
医院同时应加强对抗感染药和中药制剂的用药监管,要求临床医生严格掌握用药原则和指针,规范用药行为,确保用药安全;此外应加强用药宣传,使患者掌握正确的用药方法与剂量,及时向临床和患者提供相关的ADR信息,尽可能减少和避免ADR的发生。
[参考文献][1] 文继平.104例药品不良反应分析[J].中国现代药物应用,2015,9(24):175-176.[2] 朱光贵.某院2011-2013年药品不良反应的分析[J].中国医药指南,2014,12(36):143.[3] 李灵红.2014年南阳市第一人民医院203例药品不良反应报告分析与评价[J].中国医院用药评价与分析,2015,15(11):1497-1500.[4] 王杰松,刘刚,吴久鸿.药物临床试验的风险与管理[J].中国药房,2008,19(31):2 406.[5] 邹琛.试论我国开展药品安全主动监测的策略[J].药物流行病学杂志,2011,20(4):209 -211.[6] 李婵娟.药品不良反应信号检测方法理论及应用研究[D].西安:第四军医大学,2008.[7] 金小坡,卢美娇.我院465例药品不良反应报告分析[J].中国药房,2009,20(20):1582-1584.[8] 严丽娜,陆雯.药品不良反应分析应用[J].中医药管理杂志,2015,23(3):85-87.[9] 冉坤,李飞,李娜,等.468例药品不良反应报告分析[J].重庆医学,2015,44(36):5146 -5149.[10] 徐伟佳,高勇,梁少龙,等.2010-2014年我院935例药品不良反应报告分析[J].中国药物应用与监测,2015,12(6):364-367.[11] 吴杰,方欢,唐辉.355例药品不良反应分析[J].中国医院用药评价与分析,2014,14(1):75-77.[12] 欧阳红涛.2012-2014年某脑科医院药品不良反应分析及防治对策[J].湖南中医药大学学报,2016,36(2):68-71.[13] 徐茂星.药品不良反应报告175例分析[J].中国医药科学,2015,6(15):58-60.[14] 李韵梅.药物不良反应545例分析[J].当代医学,2013,19(6):54-55.[15] 骆芳茗.我院药品不良反应分析[J].中国实用医药,2011,6(23):151-152.[16] 韩联合,冯国清,王奎棚,等. 402例药品不良反应报告分析[J].中国医院药学杂志,2006,26(8):1046.[17] 吴昊,谭光羡,蒲荣.中药注射剂不良反应的常见原因分析[J].当代医学,2011,17(19):146-147.[18] 衣淑珍,付秋生,凌云.我院338例药物不良反应分析[J].中国药房,2003,14(3):170-171.。
