化工流程练习2
高三化学第一轮复习 化工流程专题练习
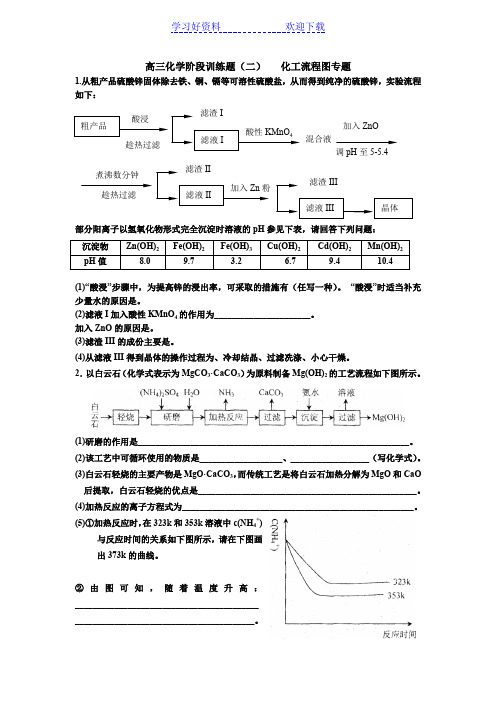
高三化学阶段训练题(二) 化工流程图专题1.从粗产品硫酸锌固体除去铁、铜、镉等可溶性硫酸盐,从而得到纯净的硫酸锌,实验流程如下:部分阳离子以氢氧化物形式完全沉淀时溶液的pH 参见下表,请回答下列问题:(1)“酸浸”步骤中,为提高锌的浸出率,可采取的措施有(任写一种)。
“酸浸”时适当补充少量水的原因是。
(2)滤液I 加入酸性KMnO 4的作用为______________________。
加入ZnO 的原因是。
(3)滤渣III 的成份主要是。
(4)从滤液III 得到晶体的操作过程为、冷却结晶、过滤冼涤、小心干燥。
2.以白云石(化学式表示为MgCO 3·CaCO 3)为原料制备Mg(OH)2的工艺流程如下图所示。
(1)研磨的作用是______________________________________________________________。
(2)该工艺中可循环使用的物质是___________________、__________________(写化学式)。
(3)白云石轻烧的主要产物是MgO·CaCO 3,而传统工艺是将白云石加热分解为MgO 和CaO 后提取,白云石轻烧的优点是__________________________________________________。
(4)加热反应的离子方程式为_____________________________________________________。
(5)①加热反应时,在323k 和353k 溶液中c(NH 4+)与反应时间的关系如下图所示,请在下图画出373k 的曲线。
②由图可知,随着温度升高:___________________________________________________________________________________。
趁热过滤 煮沸数分钟 调pH 至5-5.4 加入ZnO 混合液 趁热过滤3.硫酸铅广泛应用于制造蓄电池、白色颜料等。
选择题中的化工流程(精简有答案)

【来源】河北省邢台市2019届高三上学期第四次月考化学试题
【解析】
【分析】
由流程图可知,电解饱和食盐水用以制备NaClO3溶液,电解NaClO3溶液用以制备含有少量NaClO3的NaClO4溶液,除去NaClO3杂质后,向溶液中加入NH4Cl,反应生成NH4ClO4和NaCl,结晶得到NH4ClO4粗品和含有氯化钠的母液。
故选C。
【点睛】
本题考查化学工艺流程,对元素及其化合物的主要性质的理解,结合题目获取新信息是解答关键,C选项为易错点,注意滤渣的组成为氢氧化铁和氢氧化铝,氢氧化铁不溶于氢氧化钠溶液。
2.C
【来源】河南省南阳市2019届高三上学期期末考试理科综合化学试题
【解析】
【详解】
A.FeS中铁元素显+2价,硫元素显-2价,都具有较强的还原性,在强酸性溶液中通入O2时都将被O2氧化,其离子方程式为4FeS+3O2+12H+=4Fe3++4S↓+6H2O,A项正确;
B.气体M的成分是SO2,通入双氧水得到硫酸,可循环使用
C.若调节溶液Z的pH偏小,将导致聚铁中铁的质量分数偏大D.溶液X转化为溶液Y需要加过量铁粉,再过滤
3.某化工集团为减少环境污染,提高资源的利用率、将钛厂、氯碱厂、甲醇厂进行联合生产。其主要生产工艺如下:(FeTiO3中Ti为+4价)下列叙述正确的是
2.实验室可利用硫酸厂炉渣(主要成分为铁的氧化物,还含有少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),聚铁的化学式为[Fe2( OH)n(SO4)3-0.5n]m,制备过程如图所示。下列说法不正确的是
A.炉渣中FeS与硫酸、氧气反应的离子方程式为4FeS+3O2+12H+=4Fe3++4S↓+6H2O
高三化学化工流程专题练习.doc

化工流程专题练1.(1)硫酸铁和硫酸铜的混合溶液中加入适量CuO,将溶液的pH调节到约为4,结合平衡移动原理解释该操作的原因(己知:Fe3♦开始沉淀时pH为2.7,沉淀完全时pH为3.7;Cu ?+开始沉淀时pH为4.7,沉淀完全时pH 为6.7):_______________________________________________________________________________________________________________________________________________________________________________________________ O (2)配平反应器中发生的反应方程式:口【2 + I~~KC1O3 + I (H2Q = I~~ 11(103)2 + O<C1 + I~~ L t(3)精制卤水中的MgCk与适量石灰乳反应合成碱式氯化镁[Mg(OH)2_xClx・mH2O],反应的化学方程式为。
2.4.氯苯胺可用来合成橡胶、化学试剂、染料、色素等化工产品,制备4.氯苯胺的原理如下:Cl^^VNOa +H2催化剂-甲醇、吗琳在1L密闭容器中加入4-氯硝基苯100g.雷尼镣(催化剂\少量吗琳(脱氯抑制剂,)及甲醇250mL (溶剂), 密封;先充入氮气,然后充入氢气至密闭容器中产生一定压强。
在一定压力、温度等条件下发生加氢反应,充分反应后,冷却、过滤、洗涤、蒸僧,并收集64~65。
0®分。
(1)开始时先通入N2的目的是__________________________________________________________________ (2)上述实验中过滤的目的是,洗涤所用的试剂是(3)蒸憎时除用到导管、锥形瓶、温度计外,还用到的玻璃仪器有:64〜65V时僧出液的主要成分是o3.邻苯甲酸丁基月桂酯是一种淡黄色透明油状液体,密度约为0.97g/cm3 ,不溶于水,能溶于有机溶剂,常用作聚氯乙烯等树脂的增塑剂。
2020届高考化学——化学工业流程大题专题练习(二)
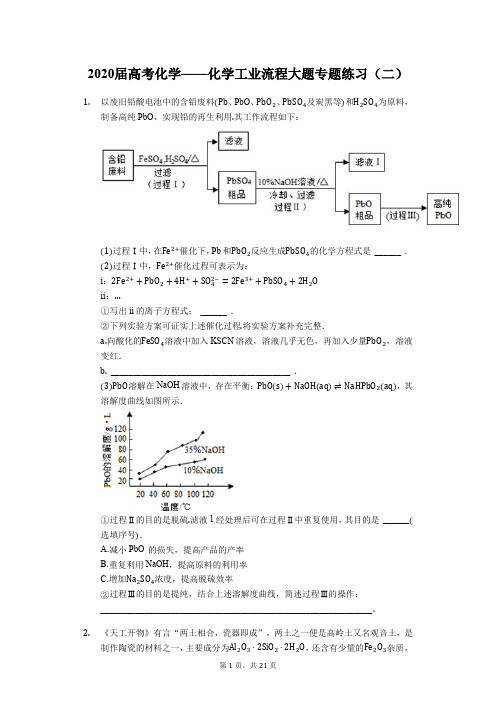
2020届高考化学——化学工业流程大题专题练习(二)1.以废旧铅酸电池中的含铅废料、PbO、、及炭黑等和为原料,制备高纯PbO,实现铅的再生利用其工作流程如下:过程Ⅰ中,在催化下,Pb和反应生成的化学方程式是______ .过程Ⅰ中,催化过程可表示为:i:ii:写出ii的离子方程式:______ .下列实验方案可证实上述催化过程将实验方案补充完整.向酸化的溶液中加入KSCN溶液,溶液几乎无色,再加入少量,溶液变红._________________________________________ .溶解在NaOH溶液中,存在平衡:,其溶解度曲线如图所示.过程Ⅱ的目的是脱硫滤液1经处理后可在过程Ⅱ中重复使用,其目的是______选填序号.A.减小PbO 的损失,提高产品的产率B.重复利用NaOH,提高原料的利用率C.增加浓度,提高脱硫效率过程Ⅲ的目的是提纯,结合上述溶解度曲线,简述过程Ⅲ的操作:______________________________________________________________。
2.《天工开物》有言“两土相合,瓷器即成”,两土之一便是高岭土又名观音土,是制作陶瓷的材料之一,主要成分为,还含有少量的杂质,下列为利用高岭土获取铝盐来沉淀卤水中的锂离子的上业流程,回答下列问题:已知: 高岭土的八面体结构的难溶于酸; 常温下,。
煅烧高岭上的目的是________。
酸浸后得到的滤渣A的主要成分是________。
除杂主要目的是除去Fe元素,除杂后溶液的,此时________。
填“是”或者“否”已经沉淀完全当溶液中的离子浓度小于则认为沉淀完全。
铝浸出液能沉淀锂离子的实质是铝盐与NaOH反应得到无定形的,将之放于卤水中可与LiCl形成难溶性锂铝沉淀物,这一个过程发生的化学方程式为________。
下图为NaOH用量对锂沉淀率的影响示意图从图中看出最佳的比为________,当大于时,锂离子的浸出率反而降低了,可能的原因是________用离子方程式表示。
【高考化学】2023届高考备考第一轮复习工业流程题提升练习2含解析

【高考化学】2023届高考备考第一轮复习工业流程题提升练习21.(2022·广西柳州·统考模拟预测)某炉渣主要成分有、、、MgO 、CaO 以及2TiO 2SiO 23Al O 少量的。
为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
23Fe O已知:“焙烧”中,、几乎不发生反应,、MgO 、CaO 、转化为相应的硫2TiO 2SiO 23Al O 23Fe O 酸盐。
在上述实验条件下,有关金属离子开始沉淀和沉淀完全的pH 见下表。
金属离子3Fe +3Al +2Mg +2Ca +开始沉淀的pH2.23.59.512.4沉淀完全()的pH51c 1.010mol L --=⨯⋅ 3.24.711.113.8回答下列问题:(1)产生的“尾气”是___________。
(2)在“分步沉淀”时先加氨水调节pH=5,此时过滤所得滤渣主要成分是___________;再向滤液中加入氨水调pH=11.4,此时“母液①”中的浓度为___________。
2Mg +1mol L -⋅(3)“水浸渣”的主要成分为、和___________;“酸溶”时,转化为进入溶液,2TiO 2SiO 2TiO 2TiO +则发生反应的化学方程式为___________。
2TiO(4)“酸溶”后,将溶液适当稀释并加热,“水解”生成沉淀,该反应的离子方程式是23H TiO ___________。
2.(2022秋·福建宁德·高三统考期末)从烟气脱硝催化剂(SCR)中回收金属元素可实现资源的循环利用。
一种从废弃SCR(主要含、、、、)中回收金属钒和钨的2TiO 25V O 3WO 2SiO 23Al O 流程如下:请回答下列问题:(1)为了加快“碱浸”的速率,可采取的措施有_______(任填一种)。
“碱浸”时,滤液中的阴子除、、外还有_______。
OH -24WO -3VO -(2)操作ⅰ的名称为_______;滤渣1的主要成分为_______(填化学式)。
高三化学化工流程题专题练习
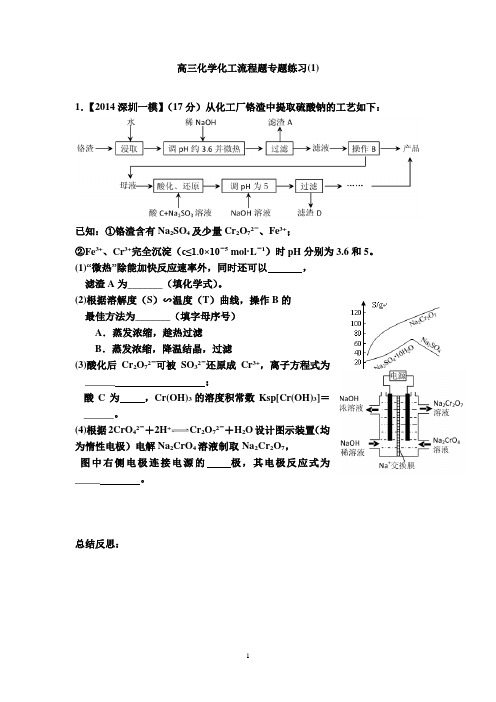
1 高三化学化工流程题专题练习(1) 1.【2014深圳一模】(17分)从化工厂铬渣中提取硫酸钠的工艺如下:
已知:①铬渣含有Na2SO4及少量Cr2O72-、Fe3+; ②Fe3+、Cr3+完全沉淀(c≤1.0×10-5 mol·L-1)时pH分别为3.6和5。 (1)“微热”除能加快反应速率外,同时还可以 , 滤渣A为_______(填化学式)。 (2)根据溶解度(S)∽温度(T)曲线,操作B的 最佳方法为_______(填字母序号) A.蒸发浓缩,趁热过滤 B.蒸发浓缩,降温结晶,过滤 (3)酸化后Cr2O72-可被SO32-还原成Cr3+,离子方程式为______ ; 酸C为 ,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=______。 (4)根据2CrO42-+2H+Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7, 图中右侧电极连接电源的 极,其电极反应式为_____ 。
总结反思: 2
2.【2014华附四校联考】(15分)钛有强度高和质地轻的优点,广泛应用于飞机制造业等。工业上利用钛铁矿,其主要成分为钛酸亚铁(FeTiO3)制备钛金属,工业流程如下: 已知:Ti与TiO2化学性质稳定,不溶于稀硫酸、稀盐酸等。
(1)请写出FeTiO3与稀盐酸反应的离子方程式: 。 (2)请写出“熔融氧化”的化学方程式: 。 (3)电解氯化镁的阴极反应式为: ,可循环利用的物质为: (填化学式)。 (4)热还原法中能否改用钠代替镁作还原剂: (填“能”或“不能”);原因为: 。 (5)用此方法制备得到的Ti金属常混有MgCl2和Mg,除杂试剂是 (填化学式)。
总结反思: 3
高三化学化工流程题专题练习(2) 3.【2014广州调研】(16分)锰是冶炼工业中常用的添加剂。以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
高考化工流程专项训练(带答案)
高考化工流程专项训练(带答案)1.海水资源丰富,海水中主要含有222433Na K Mg Cl SO Br CO HCO +++-----、、、、、、、等离子。
合理利用海水资源和保护环境是我国可持续发展的重要保证。
Ⅰ.火力发电燃煤排放的SO 2会造成一系列环境和生态问题。
利用海水脱硫是一种有效的方法,其工艺流程如下图所示:(1)天然海水的pH≈8,呈弱碱性。
用离子方程式解释原因___________________。
(2)天然海水吸收了含硫烟气后,要用O 2进行氧化处理,其反应的化学方程式是__________________________;氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是___________________________。
Ⅱ.重金属离子对河流及海洋造成严重污染。
某化工厂废水(pH=2.0,p≈1g·mL -1)中含有Ag +、Pb 2+等重金属离子,其浓度各约为0.01mol·L -1。
排放前拟用沉淀法A .NaOHB .Na 2SC .KID .Ca(OH)2 (4)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb 2+)=_________。
(5)如果用食盐处理其只含Ag +的废水,测得处理后的废水中NaCl 的质量分数为0.117%。
若环境要求排放标准为c(Ag +)低于1.0×l0-8mol·L-1,问该工厂处理后的废水中c(Ag +)=___,是否符合排放标准_____ (填“是”或“否”)。
已知Ksp(AgCl)=1.8×l0-10mol 2·L 2。
2.(16分)根据废水中所含有害物质的不同,工业上有多种废水的处理方法。
(1)①废水I 若采用CO 2处理,离子方程式是 。
②废水Ⅱ常用明矾处理。
实践中发现废水中的c (HCO 3-)越大,净水效果越好,这是因为 。
高考化工流程试题专项训练
化工流程试题专项训练【基础过关】增强你的自信心!【练1】工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:请回答下列问题:(1) 沉淀C 的化学式为 ___________ ,该物质除了 用于金属冶炼以外,还可用作 ________________ 。
(2) 操作I 、操作II 、操作III 都是____________________ (填操作名称),实验室要洗 涤AI (OH ) 3沉淀应该在 ______________________ 装置 中进行。
(3) 生产过程中,除 NaOH 、H 2O 可以循环使 用外,还可以循环使用的物质有 __________________ (填化学式)。
用此法制取铝的副产品是 _________________ (填化学式)。
(4) 写出 Na 2CO 3溶液与 CaO 反应离子方程式: ________________________________________________ 。
(5) 若铝土矿中还含有二氧化硅,此生产过程中得到的氧化铝将混有杂质:— _________________ (填化学式)【练2】亚氯酸钠(NaCIO 2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。
以下是过氧化氢法生产亚氯酸钠的工艺流程图:已知:①NaCIO 2的溶解度随温度升高而增大,适当条件下可结晶析出NaCIO 2?3H 2O 。
② 纯CIO 2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③ 160 g/L NaOH 溶液是指160 gNaOH 固体溶于水所得溶液的体积为1L 。
(1) 160 g/L NaOH 溶液的物质的量浓度为 _______________________ 。
若要计算该溶液的质量分数,还需要的一个条件是 _______________________________________________________ (用文字说明)。
无机化工流程专题练习
无机化工流程题专题练习考点一 操作流程式例1.过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。
工业上生产过氧化钙的主要流程如下:已知CaO 2·8H 2O 呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO 2·8H 2O 的化学方程式是________;(2)检验“水洗”是否合格的方法是________;(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是(写出两种):①____________;②____________。
(4)测定产品中CaO 2的含量的实验步骤:第一步:准确称取a g 产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI 晶体,再滴入少量2 mol ·L -1的H 2SO 4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol ·L -1的Na 2S 2O 3溶液至反应完全,消耗Na 2S 2O 3溶液V mL 。
【已知:I 2+2S 2O 2-3===2I -+S 4O 2-6】①CaO 2的质量分数为____________(用字母表示);②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO 2的质量分数可能________(填“不受影响”、“偏低”或“偏高”),原因是_________。
考点二 物质变化流程例2.碱式碳酸铜广泛用于制油漆颜料、烟火、杀虫剂、催化剂、其他铜盐和固体荧光粉激活剂等,也用于种子处理及作杀菌剂等。
某化学兴趣小组在实验室利用Na 2CO 3·10H 2O 跟CuSO 4·5H 2O 反应制备并检验碱式碳酸铜,实验步骤如下:⎦⎥⎤Na 2CO 3·10H 2O CuSO 4·5H 2O ――→研细――→混合研磨黏胶状――→沸水搅拌蓝绿色沉淀――→抽滤――→洗涤――→风干蓝绿色晶体(1)写出制备碱式碳酸铜的化学方程式___________________________________。
【高考复习】高考化学一轮复习化工流程专题练习(带答案)
【高考复习】高考化学一轮复习化工流程专题练习(带答案)学习知识重要的是为了应用在生活中,因此了解化工流程很有必要。
以下是化工流程专题练习,请考生注意做题质量。
(2022年广东省)32(16分)碳酸锂广泛应用于陶瓷和医药等领域。
已-锂辉石(主要成分为li2oal2o34sio2)为原材料制备li2co3的工艺流程如下:已知当Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH值分别为3.2、5.2、9.7和12.4;在303k下,Li2SO4、LiOH和Li2CO3的溶解度分别为34.2g、12.7g和1.3g。
(1)步骤ⅰ前,b-锂辉石要粉碎成细颗粒的目的是____________________________________(2)在第一步中,酸浸后得到的酸性溶液含有Li+、SO42-和其他杂质,如Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+,需要在搅拌下添加这些杂质(填充石灰石、氯化钙或稀硫酸),以将溶液的pH值调节到6.0~6.5,沉淀一些杂质离子,然后分离得到浸出液。
(3)步骤ⅱ中,将适量的h2o2溶液、石灰乳和na2co3溶液依次加入浸出液中,可除去的杂质金属离子有______________(4)在第三步中,生成沉淀的离子方程为________________________________________(5)从母液中可回收的主要物质是_____________(16分)(1)增加固液接触面积,加快浸出反应速度,提高浸出率(2)石灰石(3)fe2+、mg2+、ca2+(4)2li++co32-=li2co3(5)na2so4(广东)32(16分)由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用钢材镀铝。
工艺流程如下:(注:NaCl的熔点为801℃;AlCl3在181℃下升华)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为①和②(2)将cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 操作X 混 合 KCl→ H3PO4→ 萃
取 →
水相
有机相 一系列操作Y → KH2PO4(s)
反萃取 一系列操作Y 有机萃取剂 氨水 物质A ↓
副产品B
操 作 X
高三化学《化工流程》练习二 1.磷酸二氢钾(KH2PO4)在工业、农业、医药及食品等行业均有广泛的应用,有报道一种湿法磷酸萃取制备磷酸二氢钾的工艺流程如下图所示(部分流程步骤已省略):
已知萃取的主要反应原理:KCl+H3PO4KH2PO4+HCl; HCl+E(表示有机萃取剂) HCl•E;
请回答下列问题:
(1)在实验室实现流程图中操作X需要的主要玻璃仪器是 ;流程图中物质A是 ; (2)副产品B的化学式是 ;一系列操作Y,具体包括 、洗涤、干燥; (3)评价该工艺的优点 、 (任写两点); (4)若用1000kg质量分数为56%的磷酸溶液,产率为98%, 则可生产KH2PO4的质量为: kg; (5)萃取一步是该流程的核心操作,萃取率、杂质 脱除率受众多因素影响,请从右图中寻找出投料比
n(KCl) n(H3PO4) 对萃取率和杂质脱除率影响的主要规律或结
论(任写两条):① ; ② 。 2.对炼汞尾气(主要含Hg、SO2、N2,少量CO2、粉尘)中汞的净化回收工艺如下:
(1)在脱硫塔中发生的主要离子方程式是____________。为检验脱硫是否完全,可采取的措施是____________________________。 2
(2)用工业H2SO4、锰矿粉(主要为MnO2)和HgSO4配制成净化液。脱硫尾气中的Hg蒸气进入净化塔后主要通过途径Ⅰ、Ⅱ转化为HgSO4。途径Ⅰ包括以下①、②两个反应,完成②的反应方程式。①Hg+HgSO4 = Hg2SO4
② Hg2SO4+ H2SO4+ MnO2- HgSO4+ MnSO4+ (3)途径Ⅱ为:Hg蒸气被MnO2吸附:Hg(g)+MnO2(s)Hg2MnO2(s), Hg2MnO2进一步和硫酸反应生成HgSO4: Hg2MnO2+4H2SO4+MnO2=2HgSO4+2MnSO4+4H2O。请用化学平衡移动的原理来解释Hg蒸气如何通过途径Ⅱ转化为HgSO4 ________________________________________________________________________。 (4)若炼汞尾气没有经过脱硫塔直接经过净化塔,可能会出现什么问题? ____________________________________________________________________。 (5)净化塔中最后得到较多的HgSO4溶液,通常利用铁粉进行回收汞单质,反应的化学方程式是________________________________________________________。 (6)当净化液中Hg+浓度过高时,由于Hg2SO4溶解度低,它容易在塔内壁上析出,并分解成Hg和HgSO4。右图为净化塔排出气体中汞蒸气的浓度和净化液中Hg+浓度的关系图, 为了使排除气体含汞浓度不超过0.01 mg/km3,应该控制净化液中Hg+的物 质的量浓度________________________。
3.钛酸锂(Li4Ti5O12)作为新一代锂离子电池的负极材料。钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备钛酸锂和磷酸亚铁锂LiFePO4的工业流程如下图所示: 3
已知:①FeTiO3与盐酸反应的离子方程式为FeTiO3+4H++4Cl-===Fe2++TiOCl42-+2H2O ② T℃时,Ksp(FePO4)=1×10-22,Ksp[Mg3(PO4)2]=3×10-28 (1)A的成分是__________________,操作②是________________。 (2)滤液B中TiOCl42-与热水反应生成TiO2的离子方程式是 __________________________。 (3)反应③中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸 出率与反应温度的关系如右图所示。反应温度过高时,Ti元素浸出率下降的原因是 。 (4)反应④的化学方程是 。 (5)已知离子浓度小于10-5 mol·L-1时,认为该离子完全沉淀。T℃ 时,反应⑤中,若c(Mg2+)=0.1mol·L-1,当Fe3+完全沉淀时,Mg2+__________(填“能”、“不能”或“无法判断”) 生成Mg3(PO4)2沉淀。 4. 某化工厂利用氧化钴矿石制取CoC2O4(草酸钴)的工艺流程如下:
(注:黄钠铁矾不溶于水,可溶于酸) (1)步骤②中NaClO3将Fe2+氧化成Fe3+的离子方程式 。 (2)探究温度对步骤②中NaClO3将Fe2+氧化成Fe3+的影响,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(Fe2+)的变化,结果见下图,从图中分析最合适的温度下,在0s 至120s内的平均反应速率v(Fe2+)= mol·L-1·min-1。 4 HCl--H2O气氛下的MgCl2—MgO分布图 P(H2O)g 1.00 0.75 0.50 0.25 0 P(HCl)g 0 0.25 0.50 0.75 1.00
蒸气压 P(HCl)g + P(H2O)g = 1.00MPa
600 500 400 300 200 100
温度/℃ MgCl2 MgO
MgCl2·6H2O MgCl2·2H2O MgCl2·4H2O
MgCl2·H2O Mg(OH)Cl
(3)写出步骤③中除去镁离子的离子反应方程式 。 (4)若要检验黄钠铁矾[Na2Fe6(SO4)4(OH)12]中含有的金属元素,简述实验方案 。 (5)从绿色化学角度分析,母液中可循环利用的物质为 (填写名称)。
5. 广东省有着丰富的海洋资源。海水提取食盐和2Br以后的盐卤可以用来制备纯净的2MgCl或MgO。盐卤中含有2Mg、Cl,还含有少量Na、2Fe、3Fe、24SO和22CONH()等。制备流程如下图:
(1)滤渣的成分是 (写化学式);滤液Ⅱ中所含主要的杂质离子是 (写离子符号)。 (2)用NaClO除去尿素22CONH()时,生成物除盐 外,都是能参与大气循环的物质,则该反应的化学方程式为 ;加入NaClO的另一个作用是 。 (3)温度和压强gPHCl()对MgCl2·6H2O晶体热分解 产物的影响如图所示。请回答下列问题: ① 写出gPHCl()0.25MPa,温度从300℃升高 到550℃时反应的化学方程式 ;
② 实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是 ;
若要得到无水MgCl2须采取的措施是 。
MgCl2·6H2O 过滤 NaClO 盐 卤 △
CaCl2
滤渣
滤液Ⅰ 滤液Ⅱ
结晶 蒸发
过滤
MgCl2
MgO
少量NaOH 5
高三化学《化工流程》练习二 1.(1)分液漏斗;有机萃取剂; (2)NH4Cl;蒸发浓缩、冷却结晶、过滤; (3)操作简便、流程短、提高物质循环利用率、成本低、无三废污染、产品纯度高、副产物可利用等,合理即可,任写2条);
(4)761.6 (2分);
(5)①其他条件相同情况下,磷酸、盐酸萃取率均随 n(KCl) n(H3PO4) 的增大而降低,(比较而言盐酸萃取率的下降幅度相对缓慢);
②其他条件相同情况下,Fe3+、F¯脱除率均随 n(KCl) n(H3PO4) 的增大基本保持不变,(两者 比较F—的脱除率相对有极少量增加);
③在 n(KCl) n(H3PO4) =1.0~1.2时,盐酸萃取率下降幅度比前面大,应将 n(KCl) n(H3PO4) 确定为1.0~1.2为宜(近似表述亦可)。(其他合理表述均可,同种变化趋势拆成两条则只能算一...............
条.).
2.(1) SO2+OH-=HSO3- (2分,只写CO2和OH-反应不得分,多写CO2和OH-反应不扣分) 将少量经过脱硫塔的气体通入品红溶液中,若品红溶液不褪色,则证明脱硫完全;若品红溶液的红色褪去,则证明脱硫不完全。(2分,没写少量或没写两面只扣1分) (2) 1Hg2SO4+2H2SO4+1MnO2=2HgSO4+1MnSO4+2H2O(2分,配平错或漏补等号只扣1分) (3)溶液中存在平衡2Hg(g)+ MnO2(s)Hg2MnO2(s)(1分),通入尾气Hg后,Hg的浓度上升(1分),上述平衡向正反应方向移动(1分),生成的Hg2MnO2和MnO2发生氧化还原反应生成HgSO4(1分) (共4分) (4)具还原性的SO2和Hg2+、MnO2反应,降低净化效率(2分,1句话1分,Hg2+或MnO2答其中一种得1分,答“降低净化效率”得1分) (5) Fe+HgSO4= Hg+FeSO4 (6)不高于100.25 mol/L(2分,“不高于”写“小于等于”、“不大于”或符号也给分,没写单位扣1分,数据错不给分)
3.(1) SiO2 过滤 (2)TiOCl42-+H2O =====△ TiO2↓+2H++4Cl- (3)温度过高时,反应物氨水(或双氧水)会受热分解 (4)(NH4)2Ti5O15+2LiOH===Li2Ti5O15↓+2NH3·H2O (5)不能 4.(1) ClO3-+6Fe 2+ +6H+=6Fe 3++Cl-+3H2O (2) 0.25 (3)Mg2+ + 2F- = MgF2↓
(4)取黄钠铁矾用盐酸溶液溶解,分成两份,一份做火焰色反应,火焰为黄色证明有Na+存
在;另一份向其中滴加KSCN溶液,溶液变成血红色,证明有Fe 3+存在 (5)硫酸 5.(1)Fe(OH)3 、CaSO4 (2分); Na+(填有Ca2+扣1分) (2)3NaClO + CO(NH2)2=3NaCl + CO2↑+ N2↑+ 2H2O 将Fe2+ 氧化为Fe3+ ,并形成Fe(OH)3 被除去。 (3)① Mg(OH)ClMgO + HCl↑ ② P(HCl)小,加热时Mg2+ 会发生水解。 通入HCl ,增大P(HCl),抑制Mg2+ 水解。
