mannich缩合反应
药物合成反应 第五章 缩合反应

(CH3)2CHCH2 CH C COCH3 H
含α -活 泼氢的醛、 酮的交错缩合
H2O 30
(CH3)2CHCH2 CH
C COCH3 H
甲醛与含α -活泼氢 的醛、酮交错缩合
(CH3)2C CHO + H C H H
O
K2CO3 14 ~ 20
(CH3)2C
CHO (50%)
CH2OH
COOR
Na
+ X
NaX
第四节 其他缩合 达参反应
1.催化剂
2.α -卤代酸酯的结构 3.羰基化合物的结构
第四节 其他缩合 达参反应
i C4H9
CH3COCl/AlCl3 20 ,3~3.5h
CH3 i C4H9 C O
(95%)
CH3 i C4H9 C O C H COOCH(CH3)2 NaOH/H2O i C4H9
O
H + C2H5O
CH3 C
OC6H5+ H
H (2) HCl O (1)NaNH2 CH3 C C COOC2H5
(2)H
C
OC2H5 (1) EtONa, COOC2H5 回流10h 85 ~ 90 C O C6 H5CH C O H
OC2H5 C O
O C COOC2H5 + C6H5OH
C6H5
反应机 理
O H OO H H RCH2 C C COOC2H5 + C2H5O (1)C H ONa RCH2 C C COOC2H5 + C2H5OH 2 5 RCH2 C OC2H RCH2 C RC COOC2H5+C2H5OH R5 + H C COOC2H5
药物合成反应-缩合反应

●不饱和烃的-羟烷基化反应(Prins反应) p 133
◆在无机酸催化剂存在的条件下,甲醛和烯烃加成得到1,3-二
醇,进一步和甲醛反应生成环状缩醛的反应称为Prins甲醛-烯 加成反应。
RCH2
H CH2 + HCHO H2O R O HO CH HCHO CH2 O HO CH2
R
O HCH + H+
O TMSCl LDA
OTMS
O /TiCl4
O
OH
◆ 苯乙酮先与三甲基氯硅烷反应形成烯醇硅醚,再与丙酮
缩合得醛醇产物; ◆ 常用催化剂:四氯化钛,三氟化硼,四烃基铵氟化物;
◆亚胺法
R
CHO
R'NH2 R R
Li NR' LDA R NR'
R" R'"
O R" R'" N R' O Li
R" R'"
●有机金属化合物的-羟烷基化(Reformatsky反应)
◆醛或酮与 -卤代酸酯在金属锌粉存在下缩合而得到-羟基酸
酯或脱水得,-不饱和酸酯的反应称为Reformatsky反应。
C O + X C COOR5 2) H3O R2 R4 R3 OHR3 R1 H2O R1 C C COOR5 C C COOR5 R2 R2 R
授课人:孙斌 sunbb@
第四章 缩合反应
Condensation Reaction
Contents
α-羟烷基,卤烷基,氨烷基化反应 β-羟烷基, β-羰烷基化反应 亚甲基化反应
α, β-环氧烷基化反应
环加成反应
α-羟烷基化反应
曼尼希反应条件

曼尼希反应条件
曼尼希反应(Mannich reaction)是一种重要的有机合成反应,它涉及一个醛或酮(通常是非芳香性的),一种胺(如仲胺或特定的伯胺),以及一种含有活泼氢原子的化合物(如酮或醛)。
曼尼希反应的条件通常包括:
1.反应物:一种醛或酮、一种胺(通常是仲胺或特定
的伯胺)、以及一种含有活泼氢的化合物(如另一种
醛或酮)。
2.溶剂:常用的溶剂包括乙醇、甲醇、二甲基亚砜
(DMSO)和四氢呋喃(THF)。
3.温度:曼尼希反应可以在室温下进行,但有时需要
加热以促进反应。
4.酸性催化剂:许多曼尼希反应需要酸性条件来进
行。
常用的催化剂包括盐酸、硫酸、三氟乙酸和路
易斯酸如硼三氟化物。
5.时间:反应时间可以从几小时到几天不等,具体取
决于所使用的底物和条件。
曼尼希反应的机理涉及胺与醛或酮的形成亚胺中间体,然后与含活泼氢的化合物反应,形成β-氨基酮作为最终产物。
这种反应广泛应用于制药和有机合成中,用于构建多种含氮化合物。
mannich反应总结

mannich反应总结
Mannich反应是一种有机化学反应,主要涉及胺、酮和甲醛的反应,生成
β-氨基酮。
这个反应通常在酸性条件下进行,有时也会在弱酸性或中性条件下进行。
以下是Mannich反应的总结:
1. 反应机理:首先,甲醛与胺反应生成亚胺。
然后,酮与这个亚胺发生亲核加成,形成β-氨基酮。
2. 产物:主要产物是β-氨基酮,这是一种非常重要的有机合成中间体。
它
可用于合成多种药物、农药、染料和其他化合物。
3. 应用:Mannich反应在有机合成中具有广泛的应用。
例如,它可以用于
合成抗肿瘤药物、抗精神病药物、抗生素和抗炎药等。
4. 影响因素:反应的速率和选择性受多种因素影响,如反应物的浓度、温度、酸度、溶剂等。
选择合适的反应条件是实现高收率和高选择性的关键。
5. 改进与优化:尽管Mannich反应已经发展了很长时间,但研究者们仍在不断努力改进和优化这个反应,以提高产物的收率和选择性,并降低副产物的生成。
6. 局限性:尽管Mannich反应在合成上非常有用,但它也有一些局限性。
例如,反应通常需要甲醛作为起始原料,这可能会带来安全和环境问题。
此外,有时副反应的发生也会影响产物的纯度和收率。
总的来说,Mannich反应是一种重要的有机合成方法,有助于合成多种有用的化合物。
然而,由于其复杂性和局限性,需要深入理解并精心选择反应条件,以获得最佳的结果。
有机合成课件6章(缩合反应)
OH
2CH3COCH3 Ba(OH)2 CH3COCH2C(CH3)2 I2 CH3COCH=C(CH3)2
第六章 缩合反应
甲醛和苯甲醛不含α-H,可以和含活泼α-H的醛或酮缩合:
O
HC-O + CH3CHO
[HOCH2CH2CHO]
CH2=CH-CHO
Ph CH=O + CH3COCH3
HO Ph-C=C-C-CH3
NaOC2H5 NaOC2H5
PhCH CO2C2H5 CHO
PhCH(CO2C2H5)2 86%
如果把醛或酮滴加入不含活泼α-氢的酯溶液中,由于酯本身 不能自身缩合,而醛(酮)本身浓度很小,自身缩合的机会很 小,此时仍能得到较高收率的缩合产物。
第六章 缩合反应
如: PhCO2C2H5 + CH3COPh
O
PhCOCl H2N CH2CO2H
PhCONH CH2CO2H -H2O
O
N
PhCHO
Ph CH
O O
还原
H2 Ph C
O O
Ph
CH3CO2K
N Ph
Ph CH2 C CO2H NH
PhCH
O H2O Ph CH2 C CO2H
N
Ph
H2O C CO2H
H2O
NH2
PhCH2CH CO2H
NH COPh
CHO (CH3CO)2O KOCOCH3
CH=CH CO2H
这是制备肉桂酸的基本方法。能发生类似反应的还有其它醛。
(CH3CO)2O O CH O KOCOCH3
O CH=CH CO2H 65~70%
第六章 缩合反应
O2O2N 80%
第五章缩合反应

1. 含α–活泼氢的醛或酮的自身缩合
影响因素及反应条件
①反应物结构。
只含一个α -H醛进行自身缩合时,得到单一的β -羟基醛加成 产物。含二个以上α -H醛进行自身缩合时,得α ,β -不饱和醛
稀碱溶液和 较低温度下
酸催化或 高温度下
1. 含α–活泼氢的醛或酮的自身缩合
酮分子间的自身缩合,反应活性低,缩 合的速度慢,平衡偏向左边
第一节 醛酮化合物之间的缩合
一、自身缩合
1. 含α–活泼氢的醛或酮的自身缩合—羟醛缩合反应(Aldol Condensation) 含α–活泼氢的醛或酮在一定条件下发生反应生成β–羟基醛或酮, 或经脱水生成α,β–不饱和醛或酮的反应
1. 含α–活泼氢的醛或酮的自身缩合
反应机理
碱作催化剂
Perkin反应需在无水条件下进行。
三、雷福尔马茨基反应 (Reformatsky)
醛或酮与α -卤代酸酯和锌在惰性溶剂中反应,经水解后 得到β –羟基酸酯(或脱水得α ,β -不饱和酸酯)的反应 叫Reformatsky反应。其通式为:
影响因素及反应条件
1、反应物结构
①α–卤代酸酯的结构。α–溴代酸酯使用最多。
①亚甲基组分的结构 乙酰乙酸及其酯、丙二酸及其酯、丙二腈、 丙二酰胺、苄酮、脂肪族硝基化合物等。 ②羰基组分的结构 芳醛和脂肪醛均可顺利地进行反应,其中芳醛
的收率高一些。
酮类如 何反应?
1.影响因素及反应条件
反应条件
①催化剂 常用的催化剂有:醋酸铵、吡啶、丁胺、哌啶、甘氨酸、氨-乙醇、 氢氧化钠、碳酸钠等,并可使用微波加速反应 若用TiCl4-吡啶作催化剂,则用于位阻较大的酮类化合物,收率较 高。
有机合成课件6章(缩合反应)(最新版)
CH CH Ph
H3C O2N P2N O NO2
4. Knoevenagel反应: 这类反应的特点是一个亚甲基上连接两个吸电子基团, 使得其氢活性明显提高,反应较易进行。一般使用弱碱(有 机胺)作催化剂即可,甚至不使用催化剂。
第六章 缩合反应
如:
CH2(CN)2
O CH2-C-H
CH3CHO
OH CH3-CH-CH2-CH=O 不稳定,易脱水
CH3CH=CH-CHO
从反应过程来看,应该有两种可能缩合产物。表示如下:
第六章 缩合反应
O CH2-C-H (1) CH3-CH=O CH2=CH-O O H C-CH3 (2) CH3-CH-CH2-CH=O O CH3-CH-CH2-CHO (1) OH H =-16.62KJ/mol
和卤代酸酯的反应(Darzenes) 该反应也要在强作用下完成。如:
O + ClCH2CO2C2H5 t BuOK 83~95% O CO2C2H5
其反应过程为:
ClCH2CO2C2H5 Cl
t BuOK
ClCHCO2C2H5
O
CHCO2C2H5 O O
CO2C2H5
第六章 缩合反应
3,醛(酮)与其它化合物的缩合: 1)硝基化合物:
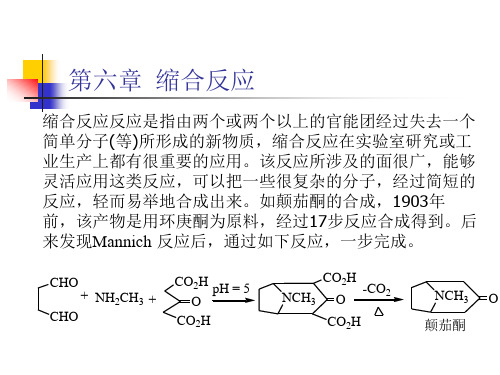
CHO CHO + NH2CH3 + CO2H O CO2H pH = 5 CO2H NCH3 O CO2H -CO2 NCH3 O
颠茄酮
第六章 缩合反应
一,碳负离子历程的缩合反应
这类反应很多,如羟醛(酮) 缩合,酯缩合等。其反应历程为:
C + C= O C O C 产物
1,醇醛缩合:
CH3CHO NaOH -H2O
缩合反应实例
RC R'
O C C OEt
CH2 C O
O
O H C OEt
C C
CH2 O
C O
EtO R
EtOH
R'
O
O
H O
C
C OEt
CH2 C OEt O
EtOH EtO
O C C C OEt
O CH2 C OH
从形式上看,该反应的特点是:醛(酮)的羰基碳与丁二酸 酯的一个酯基的α-C形成C=C,同时另一个酯基被水解成酸。
RCH2COOK
R ArCH C COO
+ RCH2COOH
反应历程:
O
RCH2 C OH
O
RCH 2
O C
O
O C
C
OO RCH C O C CH2R
O Ar C H
OHO O Ar C C C O C CH2R
HR
RCH 2COOH
OH H O O Ar C C C O C CH2R
(1) 碱 (2) H
R CC R'
O C OEt
CH2 C OH O
反应历程:
CH2 CH2
R C
R' O
O
C OEt
EtOH CH
EtO
O C OEt
R
O
R'
R C R'
C
C OEt O
R R'
O C OEt C CH2 C
CH2 C OEt
O O H C OEt
C
R
C
CH2
R'
OC
O OEt
2.官能团转化
O Ph C CH2CH2NR2
第九章-缩合反应
O +
O
Sc(TfO)3 THF, H2O
O
O 内向型,100%
§9.5 Diels-Alder反应 § 9.5.3 应用举例
Diels-Alder反应为可逆反应: (1) 逆Diels-Alder反应
理学院·应用化学系
Ni 500oC
+
Ni 500oC
2
(2) 反Diels-Alder反应
§9.5 Diels-Alder反应 § 9.5.3 应用举例
理学院·应用化学系
δδ+
§9.3 Mannich反应 § 9.3.2 反应机理
理学院·应用化学系
§9.3 Mannich反应 § 9.3.2 反应机理
理学院·应用化学系
只有一个活泼氢时,产品比较单纯; 若有两个或多个活泼氢时,这些氢可能会逐步被
胺甲基所取代。
§9.3 Mannich反应 § 9.3.3 应用
有机碱:醇钠、季铵碱、胺、氨基钠等;
无机碱:NaOH、KOH;
对于活性较高的反应物,常用较弱的碱;
对于活性较低的反应物,需用较强的碱。
OH CCC
H
+ CH2(COOC2H5)2
NH, EtOH
O H2
C
C
C H
CH(COOC2H5)2
§9.1 Michael加成 § 9.1.4 催化剂
Ph
Ph
Ph P Ph + R1R2CH X SN2 Ph P CHR1R2 B- Ph P CR1R2 + HB
Ph
Ph X -
Ph
R3As-CR1R2 砷叶立德
R2S-CR1R2 硫叶立德
缩合反应
6 缩合反应缩合反应一般指两个或多个有机化合物分子形成较大的分子的反应,此外缩合反应也可以发生在分子内。
缩合过程常伴有小分子消除。
通过缩合反应可以形成碳碳键、碳杂键,进而达到增碳、引入官能团以及成环等目的,在药物合成中占有重要地位。
本章内容主要为含活泼氢化合物(醛、酮和酯)之间的缩合反应。
6.1alpha-羟烷化、alpha-卤烷化和alpha-氨(胺)烷化反应指在底物分子的某位置引入alpha-羟烷基、alpha-卤烷基和alpha-氨烷基的反应。
alpha是指羟基(卤素和氨(胺)基)直接与引入的烷基的碳相连。
6.1.1alpha-羟烷化(1)羰基alpha碳的alpha-羟烷化(羟醛缩合)具活泼氢的醛(酮)在碱(或酸)的催化下,自身或交叉缩合,生成beta-羟基醛或酮的反应。
最初是因为烯醇负离子对一个醛(aldehyde)加成得到醇(alcohol)而得名(aldol)。
反应机理为烯醇(负离子)对羰基的亲核加成。
①具活泼氢的醛或酮的自身缩合反应可以是碱催化的。
根据反应条件的不同,生成的beta-羟基醛或酮可以发生消除而生成烯,如丁醛的羟醛缩合反应。
也可以用酸催化,比如硫酸、盐酸以及离子交换树脂等。
碱能催化的原因在于碱可以夺取底物的质子,使其形成烯醇负离子;酸能催化的原因在于酸既能质子化羰基,使之更容易被亲核试剂进攻,也能帮助烯醇式的形成,又能催化脱水。
对称酮缩合产物单一。
对于不对称酮,不论碱催化或酸催化,反应主要发生在含氢较多的alpha碳原子上,得到beta羟基酮或其脱水物。
②芳醛与具活泼氢的醛或酮的缩合芳醛与具活泼氢的醛或酮的缩合可生成b羟基芳丙醛(酮),并进一步消除生成更稳定的芳丙烯醛(酮),即Claisen-Schmidt反应。
消除产物以反式构型为主,如苯甲醛与苯乙酮的缩合。
这与过渡态的稳定性有关(反式共平面消除)。
芳醛与两个alpha位都含活泼氢的酮反应时,酸催化倾向于在含氢较少的位置缩合,碱催化与此相反。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
mannich缩合反应
Mannich缩合反应是一种重要的有机合成反应,由Carl
Mannich于1912年首次提出。该反应是将一些醛、酮或胺与
活性甲基化合物(如甲醛或其衍生物)进行缩合反应,生成含
有β-胺基酮或β-胺基醛的产物。Mannich缩合反应在药物合成、
天然产物的结构修饰以及有机合成中都具有广泛的应用。
Mannich缩合反应的机理较为复杂,但一般认为它是通过亲核
加成-质子转移来实现的。在反应过程中,亲核试剂首先进攻
醛、酮或胺的羰基碳,形成一个中间体。然后,由于中间体上
的碳正离子较为活泼,它可以发生质子转移,将氢原子转移到
中间体上的亲核试剂上,同时使中间体上的氮原子带正电荷。
最终,在去质子化步骤中,形成目标产物。
Mannich缩合反应的条件较为宽松,常用的试剂有:醛、酮等
羰基化合物、活性甲基化合物(如甲醛或其衍生物)以及质子
提供剂(如酸)。反应的选择性和产率受到很多因素的影响,
如反应物的结构、反应的溶剂、反应温度和反应时间等。通常,
在选择反应物时,要考虑它们的反应活性和亲核试剂的选择。
Mannich缩合反应可以生成多种不同结构的化合物。其中,最
常见的产物是含有β-胺基酮或β-胺基醛的化合物,它们具有
重要的药物活性,如具有抗癌、抗病毒和抗菌等活性。由于
Mannich缩合反应的多样性和高效性,它已广泛应用于药物合
成领域。例如,许多临床上使用的药物都是通过Mannich缩
合反应合成的,如麻黄碱、胺碘酮和对乙酰氨基酚等。
除了药物合成,Mannich缩合反应还可以用于合成具有天然产
物的结构修饰。天然产物是药物合成和天然产物合成的重要起
点,通过对其结构进行修饰和改造,可以合成一些具有新的生
物活性的分子。Mannich缩合反应在这方面发挥了重要的作用,
它可以用于扩展天然产物的化学空间,从而合成出一系列具有
新的生物活性的化合物。
综上所述,Mannich缩合反应是一种重要的有机合成反应,具
有广泛的应用价值。它可以合成具有药物活性的化合物,用于
药物合成和天然产物结构修饰。Mannich缩合反应的机理复杂,
但是可以通过亲核加成-质子转移来解释。此外,Mannich缩
合反应的条件较为宽松,反应的选择性和产率受到多种因素的
影响。因此,在实际应用中,需要综合考虑反应物的选择、反
应条件的优化以及产物的纯化和分离等因素,以取得较好的反
应结果。
