慢病毒包装、浓缩、纯化、滴度实验步骤
慢病毒包装和滴度检测方案流程

慢病毒包装、滴度测定方案流程一、背景:四质粒的包装体系1.含有目的基因的转染质粒2.VSV-G:pMD2.G(包膜质粒)3.Rev:pRSV-Rev4.Gag/Pol:pMDLg/pRRE二、包装细胞:293T293T细胞由293细胞通过基因技术派生出的细胞系,是经过腺病毒E1A基因的转染,能表达SV40大T抗原,含有SV40复制起始点与启动子区。
该细胞贴壁松散,操作时请尽量轻柔;换液时需预热培养基。
培养条件:DMEM +10% FBS+1% P/S三、主要试剂1.93T培养基:高糖DMEM(含丙酮酸钠、谷氨酰胺)+ 10% FBS + GlutaMAX2.病毒收获培养基:取50 ml 293T培养基,加入0.5 g BSA(Sigma A9418)和终浓度为10-15 mM的HEPES,0.22 µm过滤。
3.无内毒素质粒抽提试剂盒4.Polybrene (10 mg/ml):促转染试剂,提高转染效率。
四、包装步骤1.Day1:汇合度90%的10cm dishs HEK293T细胞(~ 6×107/dish)按1:1比例传代至15cm dishs,第二天细胞汇合度达到90%-95%(~1.5×108/dish),培养基为Gibico高糖DMEM培养基(含10%FBS)。
2.Day2:1)转染前2-3个小时更换培养基(含10%FBS);2)按照以下比例配制转染试剂:Mix 1体积μlMix 2量DMEM(无FBS)1000μlDMEM(无FBS)1000μl目的基因质粒25μgVGF190μl(1μg/μl)PMD2G7.5μgPSPAX215μgMix 1和Mix 2分别混合后,室温5-10min, 后将Mix 1和Mix 2混合,室温30min,加入至15cm dish中。
(细胞达到汇合度90%,细胞过少会影响转染效率)。
3.Day36h-24h内更换新鲜培养基(含10%FBS),观察转染效率并拍照。
病毒包装实验整体流程及原理(慢病毒、腺病毒)

广州英思特生物科技有限公司为您提供高效快速的病毒包装实验外包服务,病毒感染细胞实验整体流程及原理目的基因不能直接整合到大多数真核细胞,常用的手段是将目的基因包装成病毒来感染细胞,从而得到表达满足实验需求。
1、病毒的种类病毒有很多种,常见的有慢病毒和腺病毒1.1慢病毒1.1.1原理慢病毒(Lentivirus)是逆转录病毒的一种。
构建的siRNA/miRNA慢病毒载体,与化学合成的siRNA和基于瞬时表达载体构建的普通siRNA载体相比,一方面可以扩增替代瞬时表达载体使用,另一方面,Lentivirus-siRNA克隆经过慢病毒包装系统包装后,可用于感染依靠传统转染试剂难于转染的细胞系如原代细胞、悬浮细胞和处于非分裂状态的细胞,并且在感染后可以整合到受感染细胞的基因组,进行长时间的稳定表达。
1.1.2特点1)直接包装成为假病毒颗粒,对分裂和非分裂细胞均有感染作用,适合RNAi研究和体内实验中难于转染的细胞(比如神经元细胞、干细胞或其它原代细胞)。
?2)可以通过简单方式,在短时间内获得稳定表达特定基因的多种细胞株。
3)可用于基因敲除、基因治疗和转基因动物研究。
4)无需任何转染试剂,操作简便。
5)可以根据客户需要制备多种标记。
1.1.3慢病毒包装简要流程:1)含有目的基因的慢病毒RNAi干扰载体的构建和质粒纯化提取。
2)慢病毒载体,包装系统共转染病毒包装细胞293T等。
3)培养48hrs-72hrs左右,收集含有病毒的上清培养液。
4)病毒的纯化和浓缩。
5)分装、-80 ℃保存。
6)滴度测定目的基因检定,并出具检测报告。
1.2、腺病毒1.2.1原理腺病毒(Adenovirus,Ad)是一种无包膜的线状双链DNA病毒,其复制不依赖于宿主细胞的分裂。
有近50个血清型,大多数Ad载体都是基于血清型2和5,通过转基因的方式取代E1和E3基因,降低病毒的复制能力。
这些重组病毒仅在高水平表达E1和E3基因的细胞中复制,因此是一种适用于治疗的高效控制系统。
病毒包装实验整体流程及原理(慢病毒、腺病毒)

广州英思特生物科技有限公司为您提供高效快速的病毒包装实验外包服务,病毒感染细胞实验整体流程及原理目的基因不能直接整合到大多数真核细胞,常用的手段是将目的基因包装成病毒来感染细胞,从而得到表达满足实验需求。
1、病毒的种类病毒有很多种,常见的有慢病毒和腺病毒1.1慢病毒1.1.1原理慢病毒(Lentivirus)是逆转录病毒的一种。
构建的siRNA/miRNA慢病毒载体,与化学合成的siRNA和基于瞬时表达载体构建的普通siRNA载体相比,一方面可以扩增替代瞬时表达载体使用,另一方面,Lentivirus-siRNA克隆经过慢病毒包装系统包装后,可用于感染依靠传统转染试剂难于转染的细胞系如原代细胞、悬浮细胞和处于非分裂状态的细胞,并且在感染后可以整合到受感染细胞的基因组,进行长时间的稳定表达。
1.1.2特点1)直接包装成为假病毒颗粒,对分裂和非分裂细胞均有感染作用,适合RNAi研究和体内实验中难于转染的细胞(比如神经元细胞、干细胞或其它原代细胞)。
?2)可以通过简单方式,在短时间内获得稳定表达特定基因的多种细胞株。
3)可用于基因敲除、基因治疗和转基因动物研究。
4)无需任何转染试剂,操作简便。
5)可以根据客户需要制备多种标记。
1.1.3慢病毒包装简要流程:1)含有目的基因的慢病毒RNAi干扰载体的构建和质粒纯化提取。
2)慢病毒载体,包装系统共转染病毒包装细胞293T等。
3)培养48hrs-72hrs左右,收集含有病毒的上清培养液。
4)病毒的纯化和浓缩。
5)分装、-80 ℃保存。
6)滴度测定目的基因检定,并出具检测报告。
1.2、腺病毒1.2.1原理腺病毒(Adenovirus,Ad)是一种无包膜的线状双链DNA病毒,其复制不依赖于宿主细胞的分裂。
有近50个血清型,大多数Ad载体都是基于血清型2和5,通过转基因的方式取代E1和E3基因,降低病毒的复制能力。
这些重组病毒仅在高水平表达E1和E3基因的细胞中复制,因此是一种适用于治疗的高效控制系统。
慢病毒包装、纯化、滴度测定及感染

慢病毒包装、纯化、滴度测定及感染一、包装1.包装细胞Lenti-X™ Lentiviral Expression Systems User Manual.pdf(P11); Lenti-X™ shRNA Expression Systems User Manual.pdf(P16)2.病毒载体及包装质粒病毒载体:DNA组构建及中量提取;包装质粒:商品化产品(Lenti-X™ Lentiviral Expression Systems User Manual.pdf(P12); Lenti-X™ shRNA Expression Systems User Manual.pdf(P17))或DNA中量提取(目前唯一使用来源);3.细胞转染方法一:Lenti-X™ Lentiviral Expression Systems User Manual.pdf(P12);Lenti-X™ shRNA Expression Systems User Manual.pdf(P17);方法二:按照Lipofectamine™LTX & Plus Reagent (Cat.No.15338,invitrogen)进行,简要中文说明如下:a. 转染前24小时,把4–5 x 106个293T细胞传代至10cm培养皿中,加入完全培养基至终体积10ml,培养过夜,转染时,细胞密度为80–90%;b. 293T细胞转染前2小时换上9ml新鲜的完全培养基;c. 用之前充分混匀PLUS Reagent,在EP管中加入15ug的DNA混合物(pLVX-shRNA Plasmid DNA:pMDLg:pRes-Rev:pCMV-VSV-G 的摩尔比为1:1:1:1),15ul的PLUS Reagent,用Opti-MEM定容到500ul,标记为Tube 1,温和混匀,室温孵育5分钟;d. 充分混匀Mix Lipofectamine LTX,在EP管中加入45ul的Mix LipofectamineLTX和455ul的Opti-MEM,标记为Tube 2,温和混匀;e. 将Tube 1的溶液加到Tube 2中,温和混匀,室温孵育5分钟;Tube 1 (Plasmid DNA) Tube 2 (LTX)15ug DNA MIX(pLVX-shRNA Plasmid DNA:455 µl Opti-MEMpMDLg:pRes-Rev:pCMV-VSV-G=1:1:1:1)15 µl PLUS Reagent 45 µl Mix Lipofectamine LTX Up to 500µl Opti-MEM 500 µl Total V olume500 µl Total Volumef. 将1 ml 转染复合物逐滴加入前一天种好细胞的100mm皿中,边加边摇匀。
慢病毒包装实验技术方法

慢病毒包装实验技术方法1、实验试剂DMEM、超牛血清、G418、L-谷氨酰胺、非必需氨基酸、Lipofectamine TM 20002、实验仪器细胞培养板,37℃细胞培养箱,离心机,Amicon Ultra-15离心过滤器3、293FT细胞的培养用于包装病毒的293FT细胞必须处于生长旺盛期,细胞状态良好,细胞边缘清晰,传代次数较低。
293FT细胞培养:使用含10%超级新生牛血清的DMEM高糖培养基(并添加0.1mM的非必需氨基酸,2mM的L-谷氨酰胺,2mM的丙酮酸钠,500µg/ml的G418和1%的青霉素或链霉素),置于37℃、5% CO2 细胞培养箱中常规培养,保证细胞生长状态良好。
4、转染质粒细胞铺板:用含有10%FBS的无抗生素DMEM将生长旺盛的293FT细胞以一定密度铺到培养板中,使次日密融合度达到60%左右。
分别用脂质体作为转染试剂实现包装质粒和核心质粒的共转,PAX 2、pMD和核心穿梭质粒以3:1:4的比例用Lipofectamine TM 2000共转293 FT细胞。
转染6h后,移去细胞培养液,更换为新鲜的DMEM 培养基。
转染后24 h和48h分别于倒置荧光显微镜下观察转染效率并拍照,效率应达到85%以上。
5、收集病毒转染48小时后收集含慢病毒的上清液于无菌的离心管中,3000 rpm,4 ℃离心10 min,取离心后的上清分装到新的无菌的离心管中,-80℃冰箱保存。
将包装病毒的细胞培养板中加上新鲜的培养基,72h 后再次收获慢病毒上清液并离心处理后于-80℃保存。
6、慢病毒滴度测定慢病毒滴度测定:滴度测定前1天接种HeLa细胞,12孔板中细胞密度为2×105个细胞/孔,含10% FBS的DMEM为1ml/孔,第2天将500µl病毒液及含10% FBS的DMEM 500µl加入到1.5ml的离心管中混匀,并将其加入到预先种好的细胞中,37℃、5%CO2培养箱培养,48h后用流式细胞仪检测阳性率。
慢病毒载体包装构建过程
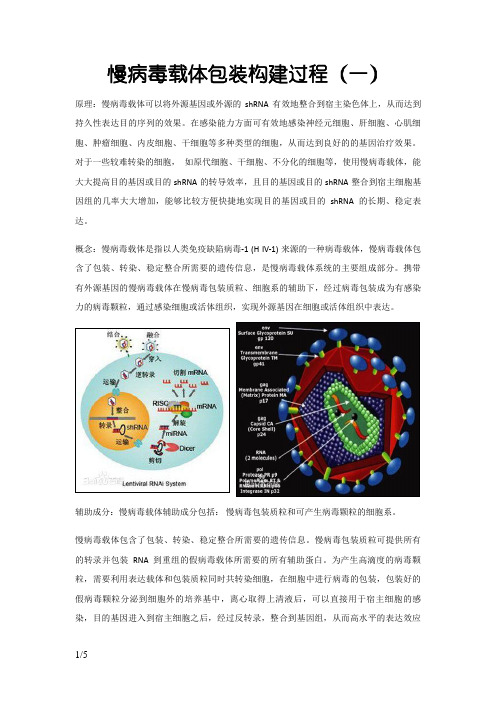
慢病毒载体包装构建过程(一)原理:慢病毒载体可以将外源基因或外源的shRNA有效地整合到宿主染色体上,从而达到持久性表达目的序列的效果。
在感染能力方面可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,从而达到良好的的基因治疗效果。
对于一些较难转染的细胞,如原代细胞、干细胞、不分化的细胞等,使用慢病毒载体,能大大提高目的基因或目的shRNA的转导效率,且目的基因或目的shRNA整合到宿主细胞基因组的几率大大增加,能够比较方便快捷地实现目的基因或目的shRNA的长期、稳定表达。
概念:慢病毒载体是指以人类免疫缺陷病毒-1 (H IV-1) 来源的一种病毒载体,慢病毒载体包含了包装、转染、稳定整合所需要的遗传信息,是慢病毒载体系统的主要组成部分。
携带有外源基因的慢病毒载体在慢病毒包装质粒、细胞系的辅助下,经过病毒包装成为有感染力的病毒颗粒,通过感染细胞或活体组织,实现外源基因在细胞或活体组织中表达。
辅助成分:慢病毒载体辅助成分包括:慢病毒包装质粒和可产生病毒颗粒的细胞系。
慢病毒载体包含了包装、转染、稳定整合所需要的遗传信息。
慢病毒包装质粒可提供所有的转录并包装RNA 到重组的假病毒载体所需要的所有辅助蛋白。
为产生高滴度的病毒颗粒,需要利用表达载体和包装质粒同时共转染细胞,在细胞中进行病毒的包装,包装好的假病毒颗粒分泌到细胞外的培养基中,离心取得上清液后,可以直接用于宿主细胞的感染,目的基因进入到宿主细胞之后,经过反转录,整合到基因组,从而高水平的表达效应分子。
基本原理:慢病毒载体系统由两部分组成,即包装成分和载体成分。
包装成分:由HIV-1基因组去除了包装、逆转录和整合所需的顺式作用序列而构建,能够反式提供产生病毒颗粒所必需的蛋白。
包装成分通常被分开构建到两个质粒上,一个质粒表达Gag和Pol蛋白,另一个质粒表达Env蛋白,其目的也是降低恢复成野生型病毒的可能。
将包装成分与载体成分的3个质粒共转染细胞(如人肾293T细胞),即可在细胞上清中收获只有一次性感染能力而无复制能力的、携带目的基因的HIV-1载体颗粒。
慢病毒包装实验流程、原理与步骤
慢病毒包装实验流程、原理与步骤慢病毒(Lentivirus)是逆转录病毒的一种,它需要相对较长的孵育时间,所以称之为“慢”病毒,Lenti在拉丁文中就是慢的意思。
它包括人免疫缺陷病毒(HIV)、猫免疫缺陷病毒(FIV)、猿免疫缺陷病毒(SIV)、牛免疫缺陷病毒等。
其中研究最多的是HIV-1慢病毒。
慢病毒载体(Lentivirus vector)是以慢病毒基因组为基础,由所需的目的基因取代部分基因构建而成。
目前使用的慢病毒载体多采用HIV-1基因组改造而来。
与一般的逆转录病毒载体相比,慢病毒载体对分裂细胞和非分裂细胞均具有感染能力而具有更广的宿主范围。
慢病毒载体还可以将外源基因有效地整合到宿主染色体上,从而实现持久表达。
在感染能力方面可以有效感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,又很少引发机体免疫反应,能达到良好的基因治疗效果,具有广阔的应用前景。
慢病毒包装实验流程如下:1.根据目的基因相关信息(序列,基因序列号等)获取目的基因;2.根据客户要求选择对应载体;3. 将目的基因构建到慢病毒载体获得含有目的基因的重组载体;4. 测序鉴定重组质粒,高纯化(不含内毒素)提取的重组质粒;5. 使用高纯提重组载体和慢病毒包装质粒共转染 293FT 细胞,进行病毒包装并收集上清液;6. 通过超滤和超速离心浓缩和纯化病毒;7. 使用病毒液感染 293T 细胞,药物筛选细胞,构建稳定表达细胞系。
慢病毒使用安全及注意事项1.慢病毒相关实验请在生物安全柜内操作。
如果使用超净台请不要打开风机。
2.慢病毒感染实验时,请穿实验服,佩戴口罩和手套,尽量不用将身体的任何部位裸露在安全柜内。
3.操作病毒时尽量避免气雾或者飞溅。
如果溅出,请立即用70%乙醇加1%的SDS溶液擦拭干净。
4.如果需要离心,应使用密封性好的离心管,或者用Parafilm膜封口后离心。
5.废弃的含有病毒的培养基或者病毒接触过的枪头、离心管、培养板及培养瓶请用84消毒液(1:20),浸泡一天后丢弃。
汉恒生物-慢病毒生产及使用操作手册第二版
2. 感染细胞最佳 MOI 的测定 MOI(Multiplicity of Infection,感染复数)是指每个细胞感染的病毒
数,通常 MOI 越高,病毒整合到染色体的数量以及目的蛋白的表达量越高。 对于分裂活跃的细胞,比如 Hela、293 细胞,MOI=1~3 时,80%以上的细胞均表 达目的基因。而对于非分裂细胞,比如原代细胞,感染效率较低。需要进行 MOI 梯度摸索实验,选择适合的 MOI 进行实验。
四、慢病毒包装和浓缩 (一)质粒扩增
构建好的慢病毒载体和辅助质粒需经过大量抽提,浓度大于 1ug/ul,A260/280 在 1.7-1.8 间方可用以包毒。推荐使用 Qiagen 大抽试剂盒进 行质粒的大量去内毒素抽提。 (二)传 293T 细胞
将培养 293T 细胞 T75 瓶中的培养基吸净,加入 2mL 4 度冰箱取出的 0.25% 胰酶,使其均匀覆盖瓶底,置于 37 度培养箱中 3-5min,取出,摇晃可发现细胞 于底部脱离,将其全部晃下,加入 3mL 37 度水浴中预热的 10% DMEM,移液枪 用 10mL 移液管进行吹打,较大力吹打 6-8 次即可,不留死角,瓶口处较难吹打 可将移液管对准培口,小力将培养基打出即可覆盖到接近瓶口的细胞。之后,将 所有细胞吸出,置于 15mL 离心管中,取 50ul 混匀后的细胞于 1.5mL eppendorf
当细胞传代次数过多,细胞状态变差时,或者细胞出现污染事故时,需要丢 弃并对最初冻存的细胞进行复苏。
1、设置温度为 37~42℃的水浴。 2、查看细胞库记录,根据记录从液氮罐中取出冻存的细胞(需戴上棉手套, 防止被冻伤),迅速丢入水浴锅中并快速晃动,尽量在 1~2min 内使细胞溶液完全 溶解。 3、将细胞溶液转移到 15ml 离心管中,并在其中加上 1ml 新鲜的完全培养 基,混匀后离心,1000rpm,5min。 4、去掉上清,加入 5ml 新鲜的完全培养基,混匀沉淀后,转入 6cm 培养皿。 5、将培养皿平稳放入 37℃、5%CO2 和 95%相对湿度的培养箱中培养。 6、第二天观察细胞存活率。给细胞换一下培养基。以后每天观察细胞生长 情况。
慢病毒纯化
慢病毒纯化
慢病毒纯化是指从慢病毒病毒培养物中分离和纯化出慢病毒颗粒的过程。
这个过程通常包括以下步骤:
1.细胞培养:首先,需要将慢病毒所感染的细胞系培养到适
当的细胞密度和病毒扩增时间,以确保足够的病毒产量。
2.细胞裂解:将培养的细胞收集并经过离心等方法分离,然
后使用裂解缓冲液裂解细胞,释放出细胞内的慢病毒。
3.离心和过滤:经过细胞裂解后,样品需要进行离心,以去
除细胞碎片和核酸残余物。
然后,可以使用过滤器对澄清
的上清液进行过滤以去除大颗粒物质。
4.病毒浓缩:慢病毒通常是低浓度的,因此需要进行浓缩。
可以使用超滤、离心和沉淀等方法,将病毒颗粒从大量液
体中浓缩到较小的容量中。
5.梯度离心:为了进一步纯化病毒,可以使用梯度离心技术,
如葡聚糖梯度离心或离心浓缩。
这个过程可将纯化的病毒
与细胞碎片、蛋白质和其他污染物分离开来。
6.病毒沉淀:经过梯度离心后,可以进行病毒的最终沉淀。
使用离心来将病毒沉淀到盘底或在离心管底端形成浓缩的
沉淀。
7.再悬浮:将病毒沉淀用缓冲液再悬浮,以便进行后续实验
应用。
在整个慢病毒纯化的过程中,必须遵守基本的生物安全措施,
并使用无菌操作、合适的缓冲液和处理设备。
每一步之间的温度、离心速度和离心时间等参数也需要根据具体的实验条件和病毒类型进行优化和调整。
慢病毒实验方法
慢病毒包装、浓缩纯化及滴度测定一、试剂、耗材及仪器1.1试剂1.1.1 商品化试剂及试剂盒名称厂家货号Lenti-X 293T Cell Line clontech632180 DMEM Gibco C11995500BTFetal Bovine Serum, Qualified, Australia Origin LifeTechnologies10099-141Lipofectamine™LTX & Plus Reagent invitrogen15338 QIAGEN Plasmid Midi Kit (25)QIAGEN121431.1.2 试剂配制a. 氨苄青霉素储液称取氨苄青霉素10g,加8ml 超纯水,溶解,定容至10 ml,过滤除菌,分装,-20℃保存。
b. LB液体培养基实用文档称取蛋白胨(tryptone)10g、酵母提取物(yeast extract)5g、NaCl 10 g,加800 ml 超纯水,用10M NaOH调节pH至7.0,定容至1, 000 ml,分装,高压灭菌(121℃/20min),4℃保存。
c. 完全培养基把DEME培养基与血清按照9:1(V/V)进行混合。
d. 50%PEG6000溶液称取125gPEG6000用超纯水溶解,定容到250ml,分装,高压灭菌(121℃/20min),4℃保存。
e. 4M NaCl溶液称取46.752gNaCl,加超纯水溶解,定容到200ml,分装,高压灭菌(121℃/20min),4℃保存。
f. PBS缓冲液称取8gNaCl,0.2gKCl,3.58gNa2HPO4.12H2O,0.27gKH2PO4,加800 ml 超纯水,调节pH至7.4,定容至1, 000 ml,分装,高压灭菌(121℃/20min),4℃保存。
实用文档1.2 耗材名称厂家货号25cm2 Growth Area Flasks corning430639 75cm2细胞培养瓶corning430641 TC表面细胞培养皿,规格:35mm corning430165 TC表面细胞培养皿,规格:60mm corning430196 TC表面细胞培养皿,规格:100mm corning430293 6孔细胞培养板corning3516外旋盖冻存管corning430659 15ml尖底离心管corning430790 50ml尖底离心管corning4558 3毫升吸管Biologix30-0138A1 1.3 仪器名称仪器厂家仪器型号二氧化碳培养箱Thermo371生物安全柜Thermo Forma Class II,B2倒置荧光显微镜OLYMPUS IX71实用文档台式高速冷冻离心机Thermo LEGND MACH 1.6R小型高速离心机Thermo LEGEND MICRO 17小型冷冻高速离心机Thermo LEGEND MICRO 17R超低温冰箱SANYO MDF-U73V冰箱Haier BCD-290W二、方法2.1.包装细胞准备2.1.1.细胞复苏a. 把完全培养基预热至37℃;用清洗洁净的500ml烧杯盛300ml超纯水,然后放入37℃水浴锅中,预热至37℃(至少需30min);准备好生物安全柜及所需培养耗材(灭菌处理);b. 快速从液氮罐中取出装有冻存细胞的冻存管并放置于装有液氮的保温杯中,用洁净镊子取出冻存管,并立即放入上述准备好的水浴中(放入之前快速检查盖子是否拧紧,盖子切勿没入水中),用镊子镊好冻存管,快速沿着烧杯内壁转圈,细胞未冻融时切勿取出观察,细胞冻融时间一般为1-2 min,如果超过2 min仍未冻融,应掉弃该管细胞,细胞冻融后把冻存管放入70%酒精中3s,然后立即放入生物安全柜中;实用文档c. 把冻融的细胞立即转移至装有1ml预热完全培养基的15ml离心管中,混匀,立即加入4ml预热完全培养基,混匀;d. 加入5ml预热完全培养基,混匀,离心(100 g,5 min),小心移除上清;e. 加入6 ml预热完全培养基,吹打重悬细胞,然后把细胞悬液转移至T25培养瓶中,并放入二氧化碳培养箱(5% CO2, 37℃)中培养;f. 24小时观察细胞的贴壁情况,并根据细胞的密度进行换液或细胞传代;2.1.2细胞培养a. 当细胞达到80%融合时,移培养液,用PBS洗涤两次,加入1ml胰酶消化液,把培养皿置于倒置显微镜下观察,如大部分细胞变圆,立即移除胰酶消化液(如大部分细胞飘起,可不移除胰酶消化液),加入6ml 预热DMEM完全完全培养基,用吸管取培养液吹打瓶壁细胞,使其脱离瓶壁形成单细胞悬液,离心(100 g,5 min),小心移除上清,加入10ml预热完全培养基,吹打重悬细胞用细胞计数板在显微镜下计算细胞数,取1*106细胞分装入新T75培养瓶,添加基至总体积为20ml,置于37 ℃、5 %CO2 培养箱中培养;每隔2~3天传代1次,实验用第2~3代细胞。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、包装细胞293T细胞的培养一、293T细胞的冻存1。
随着传代的次数增加,293T细胞会出现生长状态下降,出现突变等。
所以要在细胞购进时就进行冻存。
2. 在细胞对数生长期进行冻存,增加细胞复苏成活率。
3. 倒去细胞上清液,加入D-Hank’s液洗去残留的培养基.4。
加入0.25%的胰酶,消化10—20s后倒去。
5。
镜下观察细胞变圆,细胞间间隙加大时,加入新鲜培养基吹打混匀。
6。
细胞计数。
7。
将细胞离心,1000rpm,2min。
8. 根据计数结果加入细胞冻存液(70%完全培养基+20%FBS+10%DMSO)重悬细胞,密度为3×106个/ml。
10。
第二天将细胞放入液氮灌,并记录。
二、293T细胞的传代1。
当细胞生长至汇合率达到80~90%需要对细胞进行传代操作,以扩大细胞数量,维持细胞良好的生长状态.2. 消化细胞,方法同上。
3。
细胞离心结束后,加入完全培养基重悬。
密度为3×105个/ml。
4. 分到10cm培养皿中,10ml/皿。
三、293T细胞的复苏1. 当细胞传代次数过多(超过50代),细胞状态变差时或细胞出现污染事故时,需要丢弃并对开始冻存的细胞进行复苏。
2。
打开水浴锅,设置温度为40℃。
3。
查看细胞库记录,根据记录从液氮灌中取出冻存的细胞(需戴上棉手套,防止被冻伤),迅速丢入水浴锅中并快速晃动,在1~2 min内使细胞溶液完全溶解。
4。
将1ml细胞溶液加入9 ml完全培养基中并混匀后转入10cm培养皿。
5. 放回37℃、3%CO2和95%相对湿度的培养箱中培养。
6。
第二天观察细胞存活率。
倒掉旧的培养基,加入10ml新鲜培养基。
二、慢病毒的包装、浓缩和滴度测定1. 所用病毒检测引物为WPRE特异引物,序列如下5’—CCTTTCCGGGACTTTCGCTTT—3' (forward primer),5’-GCAGAATCCAGGTGGCAACA—3' (reverse primer) and5’-FAM—ACTCATCGCCGCCTGCCTTGCC—TAMRA-3’ (probe)2。
TaqMan Universal PCR Master Mix (Applied Biosystems,cat。
no. 4304437)3. TaqMan DNA Template Reagent Kit (Applied Biosystems,cat。
no。
401970)4。
TaqMan RNaseP control reagent (Applied Biosystems,cat. no. 4316844)用于包装的293T细胞的培养用于包装的293T细胞(ATCC No. CRL—11268)必需选择处于生长旺盛期,细胞状态较佳,存活率90%以上,细胞边缘清晰,传代次数较低。
任何时候细胞汇合率都不准达到100%.慢病毒的包装1. 预先准备3个T150瓶的293T细胞,培养基为DMEM + 10%FBS,1%Glutamax ,1%青霉素—链霉素。
2. 将细胞分到12分到12个T150瓶中,每瓶的细胞密度是8×106个。
3。
第二天,镜下检查细胞。
细胞融合度应大致为30—40%,分布均匀。
4。
转染前1小时,取出细胞板,去除原有细胞培养基,加入20ml的Opti—MEM培养基,将细胞送回培养箱。
5. 取两支无菌的50ml离心管,其中一支中加入252 μg pNL-EGFP/CMV/WPREDU3 载体质粒,168 μg pCD/NL-BH*DDD 包装质粒和84 μg pLTR-G质粒,用Opti—MEM培养基补齐到18ml.另一支中加入500 μl Trans-EZ溶液和17。
5 ml Opti-MEM培养基,用电动移液器轻轻混匀。
将Trans—EZ稀释液滴加到质粒管中,边加边轻轻晃匀。
关键步骤:推荐使用Qiagen质粒大抽试剂盒或相当的试剂盒所制备的质粒。
6. 室温孵育20分钟,使DNA和Trans-EZ充分结合形成转染复合体。
7。
取1支5ml的移液管,将得到的DNA—Trans—EZ复合体均匀滴加入到细胞培养板中,每板3ml.来回晃动培养板,混匀后放回到5%二氧化碳培养箱。
每一皿细胞培养盘不要超过6盘.8。
6小时后,移去细胞上清,更换为17ml的DMEM完全培养基.9. 转染后一天观察细胞,所有的细胞应当都是健康的并且密度接近60—80%。
如果所转染质粒带有GFP荧光,那么这时候可以看到大于95%的细胞都是带有荧光的。
10。
将细胞送回培养箱继续培养2天(36—48小时)。
在这个过程中,细胞会逐渐融合形成多核体,大多数的细胞依然贴壁。
11. 收集所有的上清,分装到50ml离心管中.12.4℃,500g离心10分钟,除去脱落的细胞和大的细胞碎片。
13. 总的上清约为204 ml,用250-ml 0.45 μm PVDF过滤装置过滤.如果发现滤膜被堵住,表现为过滤速度变慢,更换新的滤器.慢病毒的浓缩与纯化方法一超速离心沉淀法1。
取6个Ultra—clear SW28离心管,用70%乙醇消毒后,放在超净工作台中打开紫外灯继续消毒30分钟。
2. 每个Ultra-clear SW28离心管中加入约32ml的预先处理的病毒上清液。
3。
取一支10ml的移液管,吸取12 ml 20%的蔗糖溶液.将移液管一直插入到离心管的底部,缓慢将蔗糖溶液打出4 ml。
同样地,将剩下8 ml的蔗糖溶液分别加入到另两个离心管中。
另取一支干净的移液管,对剩下3管进行同样处理.4. 用PBS调整各管的重量,使对应的离心管之间的重量相差不超过0。
1g。
5。
按次序将所有6个离心管放入Beckman SW28 超速离心转头中。
7. 小心将管子从转头中取出。
倒掉上清,将离心管倒扣在纸巾上放置10分钟使剩余的上清流干。
吸掉剩余的液滴。
在管底应当有可见的沉淀.8。
每管中加入100ml 不含钙和镁的PBS洗下沉淀。
9. 将SW28超速离心管插入到50ml锥底离心管中,盖上盖子。
10.在4℃溶解2小时,每隔20分钟轻轻震荡.11。
4℃,500g离心1分钟,使溶液集中于管底.12. 用200μl 移液器轻柔吹打使沉淀重悬。
避免产生泡沫。
将所有管中的液体集中到一个SW28离心管中。
13. 集中后的病毒悬液分装成50μl 每份,保存在成品管中.用碎干冰速冻后储存在-80 ℃。
方法二PEG-8000浓缩法PEG(聚乙二醇)是高分子聚合物,具有高亲水性,在溶液中会吸收大量水分,减少病毒之间的距离,使病毒与病毒能够很容易的聚合在一起,病毒的相对浓度提高,达到沉淀浓缩的目的。
5X PEG8000+NaCl配制称取NaCl 8。
766 g; PEG8000 50g溶解在200ml Milli—Q纯水中;121摄氏度30min 湿热灭绝30min;保存在4℃。
1. 使用0。
45μm滤头过滤慢病毒上清液;3. 每20~30min混合一次,共进行3—5次;4. 4度放置过夜;5. 4度,4000 g,离心20min;6. 吸弃上清,静置管子1~2分钟,吸走残余液体;7. 加入适量的慢病毒溶解液溶解慢病毒沉淀;8. 集中后的病毒悬液分装成50 μl每份,保存在成品管中。
用碎干冰速冻后储存在-80 ℃病毒滴度的测定稀释计数法滴度单位:TU/ml,指每毫升中含有的具有生物活性的病毒颗粒数。
”TU”为"transducing units”的缩写,中文为“转导单位",表示可以感染并进入到靶细胞中的病毒基因组数。
第一天细胞准备将生长状态良好的293T细胞消化计数后稀释至1×105/ml,加入96孔板,100μl/孔,为每个病毒准备10个孔。
放入37℃,5%CO2培养箱中培养。
第二天加病毒在EP管中做10倍梯度稀释,连续10个稀释度。
稀释方法如下:每种病毒准备10个1.5ml EP管,每管加入90μl培养液,往第一个管中加入10μl病毒原液,混匀后,吸取10μl加入第二个管混匀。
依此类推,做十个稀释度(10~10-8).吸取96孔板中原有的培养基,加入含稀释好的病毒液.并做好标记.第三天追加培养液在每个孔再加入100μl完全培养液,利于细胞的生长。
第五天观察结果并计算滴度在荧光显微镜下观察结果,并数出最后两个有荧光的荧光细胞克隆数。
假设为X和Y,则滴度(TU/ml)=(X+Y*10)*1000/2/X孔的病毒液的含量(μl)。
定量PCR法病毒感染1天前,取6孔板接种HOS细胞。
每孔细胞为5×104个。
接种细胞24小时后,取两个孔的细胞用血球计数板计数,确定感染时细胞的实际数目,记为N。
弃去其他培养板中的培养基,更换为含有5μg/ml polybrene的新鲜培养基。
将浓缩病毒用培养基稀释200倍,也就是取1μl病毒加入到199μl的培养基中。
在3个培养孔中分别加入0。
5μl,5μl和50μl的稀释病毒。
感染开始后20小时,除去培养上清,换为500μl含DNaseI (Takara Mirus Bio,终浓度为10 U/ml)的新鲜培养基。
在37℃消化15分钟,这一步是要除去残余的质粒DNA。
然后换为2ml正常的培养基,继续培养48小时。
用0.5ml 0。
25%胰酶-EDTA溶液消化细胞,在37℃放置1分钟。
用培养基吹洗下,离心收集细胞.按照DNeasy试剂盒的说明抽提基因组DNA。
每个样品管中加入200μl洗脱液洗下DNA。
用DNA定量试剂盒定量(Bio-Rad)。
基因组DNA可以稳定保存在—20℃至少2个月。
准备PCR所需的试剂和样品。
为病毒序列检测引物配总管Ⅰ:n = number of reactions. 例如:总反应数为40,将1ml 2× TaqMan Universal PCR Master Mix,4μl forward primer,4μl reverse primer,4μl probe 和788μl H2O混和。
震荡后放在冰上。
为人基因组序列检测引物配总管Ⅱ:n = number of reactions. 例如:总反应数为40,将1ml 2× TaqMan Universal PCR Master Mix,100μl 10×RNaseP primer/probe mix和700μl H2O混和.震荡后放在冰上。
在预冷的96孔PCR板上完成PCR体系建立.从总管Ⅰ中各取45μl加入到A—D各行的孔中,从总管Ⅱ中各取45μl加入到E-G各行的孔中.分别取5μl质粒标准品和待测样品基因组DNA加入到A-D行中,每个样品重复1次.另留1个孔加入5μl的水做为无模板对照(no-template control)。
