有机化学实验报告1溴丁烷的制备
正溴丁烷的制备实验报告

实验名称:正溴丁烷的制备实验日期:2023年11月X日实验者:XXX一、实验目的1. 学习由醇和氢卤酸制备卤代烷的原理和方法。
2. 掌握回流操作及有害气体的吸收操作。
3. 掌握萃取、洗涤的原理及操作方法。
二、实验原理正溴丁烷是由正丁醇与氢溴酸反应制备的卤代烷。
在实验室中,伯卤代烷可由相应的醇与氢卤酸发生亲核取代反应来制备,溴代烷的制备一般需要硫酸作催化剂。
本实验中采用过量硫酸与溴化钠反应生成溴化氢,进而与正丁醇作用生成正溴丁烷。
反应方程式如下:C4H9OH + HBr → C4H9Br + H2O三、实验仪器与试剂1. 仪器:圆底烧瓶、回流装置、蒸馏装置、分液漏斗、冷凝管、沸石、烧杯、锥形瓶、量筒、滴定管、酒精灯、电热套等。
2. 试剂:正丁醇、溴化钠、浓硫酸、饱和碳酸氢钠溶液、无水氯化钙、水等。
四、实验步骤1. 投料:在圆底烧瓶中加入5ml水,再慢慢加入7ml浓硫酸,混合均匀并冷至室温后,再依次加入4.7ml正丁醇和6.5g溴化钠,充分振荡后加入几粒沸石。
2. 安装回流装置:将回流装置安装好,确保气体吸收部分连接正确。
3. 加热回流:以电热套为热源,加热回流,保持沸腾而又平稳回流,不时摇动烧瓶促使反应完成。
反应约30min。
4. 分离粗产物:待反应液冷却后,改回流装置为蒸馏装置,蒸出粗产物。
注意判断粗产物是否蒸完。
5. 洗涤粗产物:将馏出液移至分液漏斗中,加入10ml的水洗涤(产物在下层),静置分层后,将产物转入另一干燥的分液漏斗中,用5ml的浓硫酸洗涤(除去粗产物中的少量未反应的正丁醇及副产物正丁醚、1-丁烯、2-丁烯。
尽量分去硫酸层(下层)。
6. 萃取:有机相依次用10ml的水(除硫酸)、饱和碳酸氢钠溶液(中和未除尽的硫酸)和水(除残留的碱)洗涤后,转入干燥的锥形瓶中。
7. 干燥:向锥形瓶中加入适量的无水氯化钙,充分振荡,待晶体析出后,过滤、洗涤、干燥,得到正溴丁烷。
8. 蒸馏精制:将干燥后的正溴丁烷进行蒸馏,收集沸点范围内的馏分,即为精制的正溴丁烷。
实验1-81-溴丁烷的制备

实验1-8 1-溴丁烷的制备1、在正溴丁烷制备实验中,硫酸浓度太高或太低会带来什么结果?答:硫酸浓度太高,会有以下结构:(1) 会使NaBr氧化成Br2,而Br2不是亲核试剂。
2 NaBr +3 H2SO4(浓) → Br2 + SO2 + 2 H2O +2 NaHSO4(2) 加热回流时可能有大量HBr气体从冷凝管顶端逸出形成酸雾。
硫酸浓度太低:生成的HBr量不足,使反应难以进行。
2、在正溴丁烷的制备实验中,各步洗涤的目的是什么?答:用硫酸洗涤:除去未反应的正丁醇及副产物1-丁烯和正丁醚。
第一次水洗:除去部分硫酸及水溶性杂质。
碱洗(Na2CO3):中和残余的硫酸。
第二次水洗:除去残留的碱、硫酸盐及水溶性杂质。
3、什么时候用气体吸收装置?如何选择吸收剂?答:反应中生成的有毒和刺激性气体(如卤化氢、二氧化硫)或反应时通入反应体系而没有完全转化的有毒气体(如氯气),进入空气中会污染环境,此时要用气体吸收装置吸收有害气体。
选择吸收剂要根据被吸收气体的物理、化学性质来决定。
可以用物理吸收剂,如用水吸收卤化氢;也可以用化学吸收剂,如用氢氧化钠溶液吸收氯和其它酸性气体。
4、在正溴丁烷的合成实验中,蒸馏出的馏出液中正溴丁烷通常应在下层,但有时可能出现在上层,为什么?若遇此现象如何处理?答:若未反应的正丁醇较多,或因蒸镏过久而蒸出一些氢溴酸恒沸液,则液层的相对密度发生变化,正溴丁烷就可能悬浮或变为上层。
遇此现象可加清水稀释,使油层(正溴丁烷)下沉。
5、粗产品正溴丁烷经水洗后油层呈红棕色是什么原因?应如何处理?答:油层若呈红棕色,说明含有游离的溴。
可用少量亚硫酸氢钠水溶液洗涤以除去游离溴。
反应方程式为:Br 2 + NaHSO3 + H2O → 2HBr + NaHSO46、一溴丁烷制备实验为什么用回流反应装置?答:此反应较慢,需要在较高的温度下、长时间反应,而玻璃反应装置可达到的最高反应温度是回流温度,所以采用回流反应装置。
实验三 1-溴丁烷的制备

实验三 1-溴丁烷的制备一、实验目的1.掌握在实验室以溴化钠、浓硫酸和正丁醇制备1-溴丁烷的原理和方法2.练习带有有害气体吸收装置的回流操作3.熟练掌握回流、洗涤、干燥、蒸馏、操作二、实验原理本实验为亲核取代反应。
主反应:C 4H 9OH+HBr C 4H 9Br +H 2O NaBr +H 2SO 4+NaHSO 4HBr副反应: C 4H 9OH24C 4H 8+H 2O C 4H 9OH 2H 2SO 4C 4H 9OC 4H 9+H 2O三、实验药品正丁醇6.2mL (5g ,0.068mol ),溴化钠(无水)8.3g (0.08mol ),浓硫酸(d=1.84)10mL (0.18mol ),10%碳酸钠溶液,无水氯化钙。
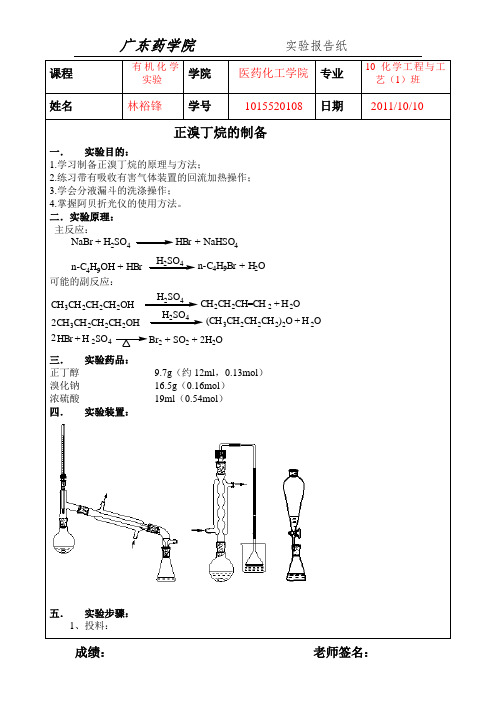
四、实验仪器:圆底烧瓶,蒸馏头,75º弯管,直形冷凝管,接引管,温度计,锥形瓶。
五、实验步骤在100ml 圆底烧瓶中放入8.3g 研细的溴化钠[1],6.2mL 正丁醇和1-2粒沸石。
烧瓶上装回流冷凝管。
在一个小锥形瓶中放入10mL 水,将瓶放在冷水浴中冷却,一边振荡,一边慢慢加入10mL 浓硫酸。
将稀释的硫酸分4次从冷凝管上端加入烧瓶,每加一次都要充分振荡烧瓶,是反应物混合均匀,在冷凝管上口,用弯玻璃管连接气体吸收装置[2]。
用小火加热到沸腾,保持回流30min [3]。
反应完成后,将反应物冷却5min 。
卸下回流冷凝管,再加入1-2粒沸石,用75º弯头连接冷凝管进行蒸馏。
仔细观察馏出液,直到无油滴蒸出为止[4]。
将馏出液倒入小分液漏斗中,将油层[5]从下面放入干燥的锥形瓶中。
然后用3mL 浓硫酸分两次加入瓶中,每加一次都要摇匀混合物。
如果锥形瓶发热,可用冷水浴冷却。
将混合物慢慢倒入分液漏斗中,静置分层,分出下层的浓硫酸[6]。
油层依次用10mL 水[7]、5mL10%碳酸氢钠溶液和10mL 水洗涤。
将下层的粗1-溴丁烷放入干燥的锥形瓶中,加1-2g 块状的无水氯化钙,间歇振荡锥形瓶,直到液体澄清为止。
正溴丁烷的制备实验报告
将干燥好的产物移至小蒸馏瓶中,蒸馏,收集99—103℃的馏分。
六.实验产率:
反应物:0.13mol
产物:12.03g/137.03g/mol
所以:产率=产物/反应物*100%=12.03/137.03/0.13*100%=67.53%
七.思考题:
1.加料时,是否可以先使溴化钠与浓硫酸混合,然后加正丁醇及水?为什么?
2、以电热套为热源,按实验原理图安装回流装置(。(注意防止碱液被倒吸)
3.加热回流:
在石棉网上加热至沸,调整加热速度,以保持沸腾而又平稳回流,并不时摇动烧瓶促使反应完成。回流约30min。
4.分离粗产物
待反应液冷却后,改回流装置为蒸馏装置(用直形冷凝管冷凝),蒸出粗
产物。
5、洗涤粗产物
将馏出液移至分液漏斗中,加入10ml的水洗涤(产物在下层),静置分层后,将产物转入另一干燥的分液漏斗中,用8ml的浓硫酸洗涤(除去粗产物中的少量未反应的正丁醇及副产物正丁醚、1—丁烯、2—丁烯。尽量分去硫酸层(下层)。有机相依次用10ml的水(除硫酸)、饱和碳酸氢钠溶液(中和未除尽的硫酸)和水(除残留的碱)洗涤后,转入干燥的锥形瓶中,加入1—2g的无水氯化钙干燥,间歇摇动锥形瓶,直到液体清亮为止。
3.用分液漏斗洗涤产物时,正溴丁烷时而在上层时而在下层,如不知道产物的密度的情况下可用什么方法来判别?
答:将一滴水滴入分液漏斗,若上层为水层,则水滴在上层消失;若有机层在上层,则水滴穿过上层,在下层消失。
4.分液漏斗洗涤产物时为什么要摇动后及时放气?应如何操作?
答:分液漏斗洗涤产物时,经摇动后会产生一定的蒸汽压或反应的气体。漏斗应倾斜向上,朝向无人处。可能副反应:三.实验药品:
正丁醇9.7g(约12ml,0.13mol)
正溴丁烷实验报告

正溴丁烷实验报告
实验目的:掌握正溴丁烷的制备方法,并进行实验观察和记录。
实验原理:正溴丁烷是一种有机化合物,化学式为C4H9Br。
它可以通过乙醇和氢溴酸的反应制备得到,反应方程式为:
C2H5OH + HBr → C2H5Br + H2O
实验步骤:
1. 准备实验所需材料和设备,包括乙醇、氢溴酸、冷水、烧杯、试管、滴管等。
2. 将乙醇倒入烧杯中,使用滴管将氢溴酸滴加到乙醇中,并持续搅拌。
3. 观察反应过程中的变化,观察是否有气泡产生或溶液颜色的变化。
4. 反应结束后,将反应液倒入冷水中,观察是否有沉淀产生。
5. 将沉淀过滤并干燥,得到正溴丁烷产物。
6. 对产物进行性质测试,包括溶解性测试、沸点测定等。
实验结果:
根据实验步骤进行操作,观察到反应过程中有气泡产生并且溶液颜色发生变化。
反应结束后,观察到有沉淀产生,并通过过滤和干燥得到了白色的正溴丁烷产物。
实验讨论:
通过对正溴丁烷实验的操作和观察,我们成功制备了该化合物。
在后续的性质测试中,我们可以进一步了解其溶解性、燃烧性
等特性,为进一步的应用和研究提供基础数据。
实验结论:
通过本实验,我们成功制备了正溴丁烷,并对其进行了性质测试和观察。
这有助于我们更好地了解该化合物的特性和用途。
正溴丁烷的合成实验报告

正溴丁烷的合成实验报告正溴丁烷的制备实验一1-溴丁烷的制备计划学时:5学时一、实验目的:1、学习以溴化钠、浓硫酸和正丁醇制备正溴丁烷的原理与方法;2、练习带有吸收有害气体装置的回流加热操作。
二、实验原理:本实验中正溴丁烷是由正丁醇与溴化钠、浓硫酸共热而制得: 【反应式】主反应:NaBr + H2SO4n-C4H9OH + HBr可能的副反应:HBr + NaHSO4n-C4H9Br + H2OCH3CH2CH2CH2OH2CH3CH2CH2CH2OH2HBr + H2SO4CH2CH2CH=CH2 + H2O(CH3CH2CH2CH2)2O + H2O 2+ SO2 + 2H2O三、主要原料、产品和副产物的物理常数【试剂】7.5ml(0.08mol)正丁醇,10g(0.10mol)溴化钠,浓硫酸,饱和碳酸氢钠溶液,无水氯化钙四、实验装置:图1五、实验步骤:1、投料在圆底烧瓶中加入10ml水,再慢慢加入12ml浓硫酸,混合均匀并冷至室温后,再依次加入7.5ml正丁醇和10g溴化钠,充分振荡后加入几粒沸石。
(硫酸在反应中与溴化钠作用生成氢溴酸,氢溴酸与正丁醇作用发生取代反应生成正溴丁烷。
硫酸用量和浓度过大,会加大副反应进行;若硫酸用量和浓度过小,不利于主反应的发生,即氢溴酸和正溴丁烷的生成)2、以电热套为热源,按图1安装回流装置(含气体吸收部分)。
(注意防止碱液被倒吸)3、加热回流在石棉网上加热至沸,调整加热速度,以保持沸腾而又平稳回流,并不时摇动烧瓶促使反应完成。
反应约30—40min。
4、分离粗产物待反应液冷却后,改回流装置为蒸馏装置(用直形冷凝管冷凝),蒸出粗产物。
(注意判断粗产物是否蒸完)。
见【注释】(2)5、洗涤粗产物将馏出液移至分液漏斗中,加入10ml的水洗涤(产物在下层),静置分层后,将产物转入另一干燥的分液漏斗中,用5ml的浓硫酸洗涤(除去粗产物中的少量未反应的正丁醇及副产物正丁醚、1—丁烯、2—丁烯。
1-溴丁烷的合成
因此反应完毕,除得到主产物1-溴丁烷外, 还有正丁烷、正丁醚等副产物。反应中产生的 无机物硫酸氢钠需用蒸馏的方法除去。
三. 反 应 装 置
气体吸收回 流反应装置
出水
进水
四.实 验 步骤
1. 按图塔好反应装置,将12.5g(0.12mol)溴化 钠,9.3ml(0.1mol)正丁醇,1~2粒沸石投入 100ml圆底烧瓶中,摇匀。 2. 在一个锥形瓶中加入15ml水,然后在冷水 浴中一边振荡一边加入15ml浓硫酸。 3. 将稀释的硫酸从球形冷凝管上口分批加入, 并充分振荡,加完料后,装上气体吸
五. 注 意 事 项
1. 回流反应装置必须密封,气体导管出口处 要接近但不能接触吸收液面。 2. 最后蒸馏产品时,所用的仪器必须先烘干, 否则易浑浊。
c旋转棱镜转动手轮使在目镜中能看到明暗分界线若有色散光带可调节消色散棱镜手轮使明暗清晰然后再旋转棱镜转动手轮使明暗分界线恰好通过目镜中字交叉点记录从镜筒中读取的折光率读至小数点后第四位
有机化学合成实验
1-溴丁烷的合成
一.实 验 目 的
1.掌握带气体吸收的回流冷凝装置 2.掌握卤代物的一般制备和分离提纯
二. 实 验 原 理
1-溴丁烷是由正丁醇与卤代试剂通过亲 核取代反应制得。 主反应如下:
NaBr + H2SO4 CH3CH2CH2CH2OH + HBr HBr + NaHSO4 CH3CH2CH2CH2Br + H2O
伴随主反应同时发生的是消除等副反应:
C4H9OH 2C4H9OH H2SO4 H2SO4 C4H8 + H2O C4H9OC4H9 +H2O
3. 安装好蒸馏装置,通过长颈漏斗加少量棉 花将液体滤入圆底烧瓶,加入沸石,进行 蒸馏,收集99~102℃的馏分。 4. 产品量取体积,并用折光仪测定折光率。
有机化学实验-4 1-溴丁烷的制备
4.2 分液漏斗使用注意事项
➢ 玻璃活塞使用前应涂抹凡士林防漏 ➢ 洗涤的原则:少量多次 ➢ 未拿到产品前,保留所有分出液 ➢ 有机溶剂溶解溶质后改变密度,注意判断产品层 ➢ 洗涤:用后即洗干净 ➢ 漏斗烘干:贴上标签,放入烘箱。把活塞和塞盖
取下,单独保存 ➢ 存放:活塞垫纸片
五、有机液体的干燥
上次实验需要注意的问题
➢ 报告:
✓ 提炼实验原理。对于制备实验,以反应方程式 表示。
✓ 试剂:制备实验列出主要反应原料和产物的性 质;提取实验只列出产物的性质。
✓ 提炼反应流程图,避免过简或抄书。
✓ 实验操作只记录“真实的操作”,必须按照要 求格式记录。
上次实验需要注意的问题
➢ 产品:被升华残余物污染,没有达到纯化 目的
醇时溶液应先经冷却。 6. 加完KBr固体,立即将烧瓶磨口清除干净,
安装仪器
七、实验应注意的问题
7. 第一次蒸馏残留液趁热回收 8. 浓硫酸洗涤,使用干燥的分液漏斗 9. 回收洗涤用硫酸 10.洗涤液体过程中,洗干净精馏用仪器,并
烘干待用:
✓ 蒸馏头、直型冷凝管、接液管、3个圆底烧瓶
11.精馏前,预先称量接收瓶
考虑吸水能力和干燥效能等干燥时间大于30分钟并加盖防止空气中的水气进入可逆干燥剂受热后会脱水故蒸馏之前要滤去干燥剂bm2waj型阿贝折射仪手轮进光棱镜遮光板反射镜目镜6162目镜内的视场13300刻度读数与温度相关同时记录温度2waj型未调好未调好正确七实验应注意的问题1
1-溴丁烷的制备
教师:安林坤
本次实验内容
合成部分
纯化部分
有气体吸收的回流反应装置
洗涤
蒸馏
三、反应装置
气体吸收装置
碱液
实验八 1-溴丁烷的制备
1、影响萃取法的萃取效率因素有哪些?怎样才能选择好溶剂?答:(1)用同一分量的溶剂,分多次用少量溶剂来萃取,其效率高于一次用全量溶剂来萃取。
(2)在萃取时,若在水溶液中先加入一定量的电解质(如NaCI)利用所谓“盐析效应”以降低有机化合物在水溶液中的溶解度,常可提高萃取效果。
萃取溶剂的选择要根据被萃取物质在此溶剂中的溶解度而定。
同时要易于和溶质分离开。
所以最好选用低沸点的溶剂。
一般水溶性较小的物质可用石油醚萃取;水溶性较大的物质可用本或乙醚萃取;水溶性极大的物质可用乙酸乙酯萃取。
2、使用分液漏斗的目的何在?使用分液漏斗时要注意哪些事项?答:分液漏斗主要应用于:(1)分离两种分层而不起作用的液体。
(2)从溶液中萃取某种成分。
(3)用水、酸或碱洗涤某种产品。
(4)用来滴加某种试剂(即代替滴液漏斗)。
3、本实验中硫酸的作用是什么?硫酸的用量和浓度过大和过小有什么不好?答:硫酸是反应物,也是催化剂。
用量过小起不到催化作用,甚至不能反应;用量过大容易产生生成烯、醚、溴的副反应等。
4、反应后的粗产物中含有哪些杂质?各步洗涤的目的何在?答:可能有的杂质有溴化氢、二氧化硫、正丁酸、正丁醇、正丁醚、溴、水等。
第一步水洗的目的是洗去溴化氢、二氧化硫、正丁酸,浓硫酸洗的目的是洗去正丁醇、正丁醚,第二次水洗的目的是洗去硫酸,饱和碳酸氢钠洗的目的是进一步洗去硫酸,第三次水洗的目的是洗去碳酸氢钠。
5、用分液漏斗洗涤产物时,正溴丁烷时而在上层,时而在下层,如不知道产物的密度时,可用什么简便的方法加以区别?答:可取一滴上层(或下层)液体加少许水进行溶解性试验,若能溶解说明是水层,若不溶说明是1-溴丁烷层。
6、为什么用饱和碳酸氢钠溶液洗涤前先要用水洗涤一次?答:若直接用碳酸氢钠溶液洗,由于液体中可能有较多的硫酸,会产生大量的二氧化碳气体,给洗涤操作带来不便,甚至产生危险。
7、用分液漏斗洗涤产物时,为什么摇动后要及时放气?应如何操作?答:由于摇动后溶液的挥发性增强,或发生反应产生气体使分液漏斗内压力增大会引起冲料现象,所以要及时放气。
1-溴丁烷的实验原理
1-溴丁烷的实验原理1溴丁烷是一种有机化合物,它的分子式为C4H9Br,属于卤代烷。
在实验中,通过一系列的化学反应和操作步骤,可以合成溴丁烷。
下面将详细介绍1溴丁烷的实验原理。
首先,制备1溴丁烷的主要原料是1丁醇(C4H10O)和盐酸(HCl)。
在实验中,可以通过下述反应来合成1溴丁烷:C4H10O + HCl →C4H9Cl + H2O上述反应是一种酸催化的亲核取代反应,其中氯离子(Cl-)作为一个亲核试剂攻击醇分子,产生1溴丁烷和水。
此反应需要在酸性条件下进行,一般用盐酸来提供氢离子(H+)。
在实验中,首先将适量的1丁醇加入到反应瓶中。
然后,逐滴加入盐酸催化剂,这样可以提高反应速率。
为了更好地混合反应物,反应瓶通常会加入反应搅拌器或将反应溶液轻轻摇动。
反应过程中需要控制温度和反应时间,一般将反应瓶置于水浴中,并加热至适当温度。
反应完成后,用水洗涤反应溶液以去除盐酸和其他杂质,然后用饱和氯化钠溶液或饱和碳酸钠溶液中和反应溶液的酸性。
最后,用无水硫酸钠将水分离,并通过过滤或蒸馏,得到纯净的1溴丁烷。
除了上述所述的直接合成1溴丁烷的方法,还可以使用其他方法来制备该化合物。
例如,还可以通过溴代丁基钠和卤代烷反应生成1溴丁烷:C4H9X + CH3CH2Br →C4H9Br + CH3CH2X其中X代表其他卤素(如氯、溴或碘)。
这种方法利用卤代烷与溴代丁基钠反应生成1溴丁烷的特性。
总结起来,制备1溴丁烷的实验原理主要是通过酸催化的亲核取代反应,将1丁醇与盐酸反应得到。
实验中需要注意控制温度和反应时间,以及去除杂质和水分的步骤。
此外,还可以使用溴代丁基钠和卤代烷反应生成1溴丁烷。
这些实验步骤和原理的掌握,有助于合成纯净的1溴丁烷,以便在化学实验和应用中的进一步研究和应用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机化学实验报告1溴丁烷的制备
1,溴丁烷的制备
一、实验目的
1.学习由醇制备溴代烃的原理及方法。
2.练习回流及有害气体吸收装置的安装与操作。
3.进一步练习液体产品的纯化方法、洗涤、干燥、蒸馏等操作。
二、实验原理
卤代烃是一类重要的有机合成中间体。由醇和氢卤酸反应制备卤代烷,是卤代
制备中的一个重要方法,正溴丁烷是通过正丁醇与氢溴酸制备而成的,HBr是一种
极易挥发的无机酸,无论是液体还是气体刺激性都很强。因此,在本实验中采用
NaBr与硫酸作用产生HBr的方法,并在反应装置中加入气体吸收装置,将外逸的
HBr气体吸收,以免造成对环境的污染。在反应中,过量的硫酸还可以起到移动平
衡的作用,通过产生更高浓度的HBr促使反应加速,还可以将反应中生成的水质子
化,阻止卤代烷通过水的亲核进攻返回到醇。
HBr + NaHSONaBr + HSO主反应424
HBr + HOCCHOH + HBr49249
HSO24CHCHCH+ HOHOHC252249副反应
HSO24+ HOHOHCHOCHC22494949
Br + SO + HOHBr + HSO22224
醇类、醚类可与浓硫酸作用生佯盐溶于浓硫酸中,故用浓硫酸洗涤的目的是除
录像机,又佯盐遇水分解,必须用干燥漏斗进行此步洗涤(1):
HSOCHOHCHOH +HSO44949224
CHOCHHSOHOCH + HSOC49494494924H
三、实验药品及物理常数
分子量 用量 熔点 沸点 比重 水溶解度 药品名称20(ml、g、mol) (?) (?)
(mol ) (d) (g/100ml) 4
正丁醇 74.12 11.2ml -89.5 117.7 0.8098 7.9 1,溴丁烷 不溶于水 137.03
101.6 1.276
溴化钠 微溶于水 102.89 15g 747 1390 0.9005
浓硫酸 易溶于水 98 18ml 1.84
其它药品 10%碳酸钠溶液、无水氯化钙
四、实验装置图
回流冷凝装置 蒸馏装置 五、实验步骤
(1)在100ml圆底烧瓶中加入15ml水,然后加入18ml浓硫酸(分3-4次加),
摇匀后,冷却至室温,再加入11.2ml正丁醇,混合后加入15g溴化钠(小心加入,
节不可在磨口处留有固体),充分振荡,加入几粒沸石,在烧瓶上装上球形冷凝管
回流(因为球型冷凝管冷凝面积大,各处截面积不同,冷凝物易回流下来),在冷凝
管的上口用软管连接一个漏斗,置于盛水的烧杯中。
(2)在石棉网上用小火加热回流半小时(在此过程中,要经常摇动)。冷却后,
改作蒸馏装置,在石棉网上加热蒸中所有的溴丁烷。
3)将馏出液小心地转入分液漏斗,用10ml水洗涤,小心地将粗品转入到另一
干燥的分(
液漏斗中,用5ml浓硫酸洗涤。尽量分去硫酸层,有机层依次分别用水、饱和
碳酸氢钠溶液和水各10ml洗涤。产物移入干燥的小三角烧瓶中,加入无水气温化
钙干燥,间歇摇动,直至液体透明 。将干燥后的产物小心地转入到蒸馏烧瓶中。
在石棉网上加热蒸馏,收集99-103度的馏分,产量约为6-7g(产率约为52%)。
六、实验纯化过程与现象
混合物(馏液)(呈淡白色浑浊状)
(丁醇、溴丁烷、丁醚、水、溴化氢、溴)
上层 下层
(理论:水、HBr、Br2) (理论:丁烷、溴丁烷、丁醚)
(实际:呈棕黄色,为有机层) (实际:呈淡白色,为无机层)
5ml浓硫酸
上层 下层
(理论:溴丁烷) (理论:丁醇、丁醚、浓硫酸)
(实际:呈淡黄色) (实际:呈深黄色)
10ml水
上层 下层
(硫酸、水,呈淡黄色) (溴丁烷)
10ml碳酸钠
上层 下层
(理论:硫酸、水) (理论:溴丁烷)
(实际:呈淡白色) (实际:呈纯白色浑浊)
无水氯化钙干燥
滤渣 滤液
(水合氯化钙 ) (溴丁烷、无色透明)
蒸馏
正溴丁烷 产品产量:4.2g 理论产量:0.12*137=16.44 产率4.2/16.44=25%
七、讨论
理论与实验现象不同的原因及解决措施
1、 馏出液分两层,通常下层为粗正溴丁烷,上层为水,若反应的正丁醇较
多,或因蒸馏过
久蒸出一些溴化氢恒沸物,则液层的相对密度发生变化,油层可能悬浮或变为
上层,遇
此现象,可加清水稀释使油层下沉(2).
3、 加料用浓硫酸洗涤粗产品时,一定要事先将油层与水层彻底分开,否则浓
硫酸被稀释而
降低洗涤的效果。如果粗蒸时蒸出的HBr洗涤前未分离除尽,加入浓硫酸后就
被氧化生
成Br,而使油层和酸层都变为橙黄色或橙红色。在随后水洗时,可加入少量
NaHSO,23
充分振摇而除去。
BrHO++NaHSO32NaBr+SONaHSO+222342
4、加料时,不要让溴化钠粘附在液面以上的烧瓶壁上,加完物料后要充分摇
匀,防止硫酸局部过浓,一加热就会产生氧化副反应,使产品颜色加深。
2NaBrHSO+3BrSO+++22HO24NaHSO2224 扩展
5、若不用浓硫酸洗涤粗产物,则在下一步蒸馏中,正丁醇与1-溴丁烷由于可
形成共沸物(b.p. 98.6 0C, 含正丁醇13%),难以除去,使产品中仍然含有正丁醇
杂质。
6、本实验最后蒸馏收集99,103?的馏分,但是,由于干燥时间较短,水一般除
不尽,因此,水和产品形成的共沸物会在99?以前就被蒸出来,这称为前馏分,不
能做为产品收集,要另用瓶接收,等到99?后,再用事先称重的干燥的锥形瓶接收
产品。 7、粗产品用浓硫酸洗涤后,不直接用饱和碳酸氢钠洗涤而要用水洗,然后
加饱和碳酸氢钠洗涤的原因:因为刚用浓硫酸洗过的产品还含有不少浓硫酸(包括漏
斗壁),若直接用饱和碳酸氢钠中和,则由于酸的量太多,酸碱中和产生大量的
热,同时有大量的二氧化碳产生,极易在洗涤时溅出甚至冲出液体,不易操作,也
造成产品的损失。为了使该中和反应不致于这么剧烈,故在加饱和碳酸氢钠之前,
用水洗涤产品及其漏斗壁上的大部分浓硫酸。
