国家食品药品监督管理局关于实施《外科植入物生产实施细则》有关
国家食品药品监督管理局关于合成树脂义眼片等产品分类界定的通知-国食药监械[2006]454号
![国家食品药品监督管理局关于合成树脂义眼片等产品分类界定的通知-国食药监械[2006]454号](https://img.taocdn.com/s3/m/b1da03096d175f0e7cd184254b35eefdc8d3153e.png)
国家食品药品监督管理局关于合成树脂义眼片等产品分类界定的通知正文:----------------------------------------------------------------------------------------------------------------------------------------------------国家食品药品监督管理局关于合成树脂义眼片等产品分类界定的通知(国食药监械[2006]454号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局):为适应医疗器械监督管理工作需要,现将合成树脂义眼片等产品的分类界定通知如下:一、合成树脂义眼片:主要成分为甲基丙烯酸甲酯、聚甲基丙烯酸甲酯、自凝聚甲基丙烯酸甲酯。
用于人体眼球摘除后放置于眼结膜内,起填充、支撑、美容作用。
作为Ⅱ类医疗器械管理。
二、急性中毒现场急救快速检验箱:以临床毒物分析化学为理论基础,采用化学显色反应和高效薄层层析法,对临床上常见含磷农药、安眠药、含氯农药、无机毒物、醇类化合物、有毒气体等提供完整的样品提取、分析鉴定方法,以及配套的实验器具和化学试剂。
作为Ⅲ类医疗器械管理。
三、抗菌纱布、抗菌敷料:材质为棉花或非织造敷布,含有0.2%聚六甲基撑基双胍盐酸盐(PHMB)抗菌成分。
适用于裂口、擦伤、烧伤、渗出伤口、一度和二度烧伤、外科伤口和伤口包扎,以及静脉输注口、气管切开导管切口、胸腔导管切口、插管管口和排液口。
阻止细菌在敷料内滋生,减少局部和全部伤口感染。
作为Ⅲ类医疗器械管理。
四、医用臭氧治疗仪,医用臭氧心血管病、肝病治疗仪:产生臭氧,将洁净无菌并含有一定浓度的臭氧气体充入输液瓶、输血袋内,或对自体回输的血液进行处理后再回输到人体内。
用于改善血液流变学指标、改善微循环、抗炎、促进组织修复。
治疗血栓、中风后康复、冠状动脉硬化、高血脂、慢性病毒性肝炎。
作为Ⅲ类医疗器械管理。
五、烧伤敷料:以动物(猪、牛)腹膜为原材料制成,主要是弹力纤维、胶原纤维。
国家食品药品监督管理总局通告2014年第8号 关于发布第一类医疗器械产品目录的通告

2
关于发布第一类医疗器械产品目录的通告
附件
第一类医疗器械产品目录
6801 基础外科手术器械
序号
1 2
产品类别 产品类别 (一级) (二级)
手术刀
手术刀片 基础外科用 刀
手术刀柄
备皮刀
组织剪
基础外科用 剪
辅料剪
产品描述
预期用途
品名举例
由手术刀片和刀柄组 用于外科手术时切
器械钳、持针钳、持 针器、微血管持针 钳、硬质合金镶片 持针钳、小切口持 针钳、皮管钳、置放 钳、夹持钳、夹持 器、结扎钳、施夹 钳、施夹器、帕巾 钳、海绵钳 拆钉钳、拆钉器、拆 针器、
由一对尾部叠合的叶 片组成。镊端有齿,有
用于夹持人体组 粗齿和细齿之分。通常 织。 采用不锈钢材料制成。 可重复使用。
通常有直形和枪形两 用于显微手术时精 种形式。可重复使用。 细修剪组织。
由头部、杆部和柄部组 用于显微手术时钳
成。可重复使用。
取组织或者器械。
由一对尾部叠合的叶 片组成。通常采用不锈 钢材料制成。可重复使 用。
用于显微手术时夹 持、分离组织或夹 持缝针等器械。
通常有直头和弯头两 用于显微手术中夹
种。可重复使用。
锐形、开窗形等多种形
外科牵开器、钳式 牵开器
式的钩状刀片。可重复
使用。
通常为细长设计,近端
刮匙
有手柄,远端为匙形, 用于外科手术时刮 刮匙、皮肤刮匙
可分单头或双头。可重 除坏死组织、皮屑。
复使用。
皮肤组织钻 通常是直杆状器械,近 用于皮肤和组织钻
端有手柄,远端为锥
皮肤组织钻孔器
孔器
医疗器械检查记录表
抽查情况
年度是否接受过质量抽验,监督抽验不合格的,是否实施了有效整改
查看质量监督检验报告,及整改记录。
注:情况复杂的,可另附材料说明。
检查组组长(签字): 检查组成员(签字): 检查时间:
查看生产现场,看是否配备完成该工艺的生产设备,核对企业工艺要求及设备维护保养记录。
2.生产现场是否管理有序
查看现场及企业是否按产品注册的要求进行生产,并查看是否制定了生产过程控制和管理文件。
3.生产场地环境、照明是否与其生产的产品及规模相适应
查看生产现场环境与照明情况,并查看环境监测记录,查看生产面积是否拥挤。注:一次性无菌医疗器械生产现场应符合《无菌医疗器具生产管理规范》(YY0033)的要求。
5.原材料、外协件和外购件等采购产品是否符合规定要求
检查企业供方的评审记录。原材料、外协件和外购件的采购检验记录,采购合同/技术协议是否符合该产品的质量要求,检查物资供应方的资质证明,尤其是原材料必须是有医疗器械注册证的(如义齿等),要注意检查相关资质证明。
6.生产过程的控制,在产品形成过程中,是否有清晰的状态标识和可追溯标识
查看企业生产产品所依据的产品,是否为有效版本,是否保存产品中引用的国标、行标等文件。
3.产品出厂是否具有合格证,签发合格证是否按规定要求进行。检验人员是否经过培训并持证上岗
查看企业成品库房,查看企业合格证的签发记录,与成品检验报告核对。人员的上岗证与相关的培训证明及培训记录。
4.是否按要求进行产品的型式检验,是否有完整的型式检验报告
检查质量手册和程序文件,看是否有YY/T0287或YY/T0288的专用要求。
2.企业质量体系的运行情况是否按体系规定进行了内审和管理评审并有相应记录
医疗器械检查记录表
2.企业质量体系的运行情况是否按体系规定进行了内审和管理评审并有相应记录
查看企业内审和管理评审记录。
3.纠正和预防措施的落实情况
查看企业纠正和预防措施的执行记录。
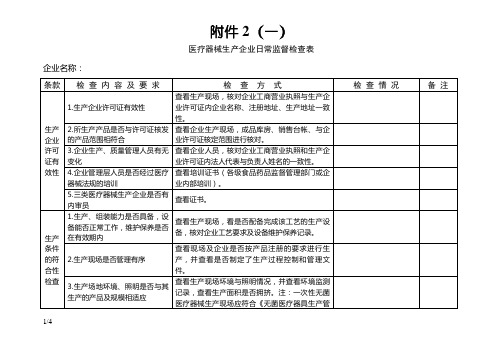
医疗器械生产企业日常监督检查表
条款
检 查 内 容 及 要 求
检 查 方 式
检 查 情 况
备 注
售后服务
1.售后服务的情况
查看售后服务的记录,检查销售Fra bibliotek录是否有可追溯性、保存期限是否符合产品的要求。
2.用户投诉的情况
查看用户投诉记录。
不合格品的控制
对不合格品是否进行标识、登记、隔离、是否按规定对不合格品进行评价、处置
查看现场,检查不合格品记录。
不良事件的报告
产品是否有不良事件发生;不良事件的处理情况;是否执行医疗器械不良事件的报告制度
附件2
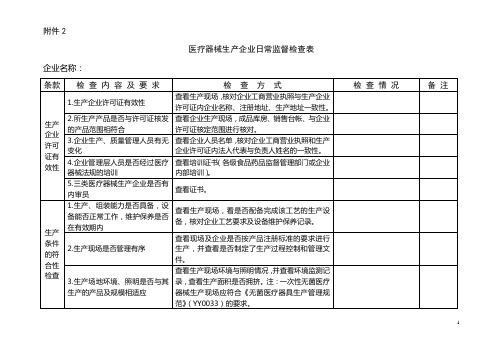
医疗器械生产企业日常监督检查表
企业名称:
条款
检 查 内 容 及 要 求
检 查 方 式
检 查 情 况
备 注
生产企业许可证有效性
1.生产企业许可证有效性
查看生产现场,核对企业工商营业执照与生产企业许可证内企业名称、注册地址、生产地址一致性。
2.所生产产品是否与许可证核发的产品范围相符合
查看企业生产现场,成品库房、销售台帐、与企业许可证核定范围进行核对。
5.原材料、外协件和外购件等采购产品是否符合规定要求
检查企业供方的评审记录。原材料、外协件和外购件的采购检验记录,采购合同/技术协议是否符合该产品的质量要求,检查物资供应方的资质证明,尤其是原材料必须是有医疗器械注册证的(如义齿等),要注意检查相关资质证明。
国家食品药品监督管理总局公告 9第号

国家食品药品监督管理总局公告2009年第83号关于实施YY0068.4-2009《医用内窥镜硬性内窥镜第4部分:基本要求》等80项医疗器械行业标准的公告YY0068.4-2009《医用内窥镜硬性内窥镜第4部分:基本要求》等80项医疗器械行业标准已经审定通过,自2011年6月1日起施行。
其标准编号、名称如下:一、强制性行业标准(20项)1.YY0068.4-2009《医用内窥镜硬性内窥镜第4部分:基本要求》(部分代替YY0068-92)2.YY0069-2009《硬性气管内窥镜专用要求》(代替YY0069-92)3.YY0304-2009《等离子喷涂羟基磷灰石涂层钛基牙种植体》(代替YY0304-1998)4.YY0322-2009《高频电灼治疗仪》(代替YY0322-2000)5.YY0341-2009《骨接合用无源外科金属植入物通用技术条件》(代替YY0341-2002)6.YY0585.4-2009《压力输液设备用一次性使用液路及附件第4部分:防回流阀》7.YY0601-2009《医用电气设备呼吸气体监护仪的基本安全和主要性能专用要求》(代替YY0601-2007)8.YY0761.1-2009《牙科旋转器械金刚砂车针第1部分:尺寸、要求、标记和包装》9.YY0762-2009《眼科光学囊袋张力环》10.YY0763-2009《医用内窥镜照明用光缆》11.YY0764-2009《眼科仪器视力表投影仪》12.YY0765.1-2009《一次性使用血液及血液成分病毒灭活器材第1部分:亚甲蓝病毒灭活器材》13.YY0766-2009《眼科晶状体超声摘除和玻璃体切除设备》14.YY0767-2009《超声彩色血流成像系统》15.YY0768-2009《牙科学义齿基托聚合物冲击强度试验》16.YY0769-2009《牙科用磷酸酸蚀剂》17.YY0770.1-2009《医用输、注器具用过滤材料第1部分:药液过滤材料》18.YY0770.2-2009《医用输、注器具用过滤材料第2部分:空气过滤材料》19.YY1026-2009《牙科学汞及银合金粉》(代替YY1026-1999)20.YY1080-2009《眼科仪器直接检眼镜》(代替YY91080-1999)二、推荐性行业标准(60项)1.YY/T0127.4-2009《口腔医疗器械生物学评价第2单元:试验方法骨埋植试验》(代替YY/T0127.4-1998)2.YY/T0127.9-2009《口腔医疗器械生物学评价第2单元:试验方法细胞毒性试验:琼脂扩散法及滤膜扩散法》(代替YY/T0127.9-2001)3.YY/T0127.15-2009《口腔医疗器械生物学评价第2单元:试验方法亚急性和亚慢性全身毒性试验:经口途径》4.YY/T0127.16-2009《口腔医疗器械生物学评价第2单元:试验方法哺乳动物细胞体外染色体畸变试验》5.YY/T0269-2009《牙科正畸托槽粘接材料》(代替YY0269-1995)6.YY/T0340-2009《外科植入物基本原则》(代替YY/T0340-2002)7.YY/T0495-2009《牙根管充填尖》(代替YY0495-2004)8.YY/T0507-2009《医用弹性绷带基本性能参数表征及试验方法》9.YY/T0508-2009《外固定支架专用要求》10.YY/T0509-2009《生物可吸收内固定板和螺钉的标准要求和测试方法》11.YY/T0510-2009《外科植入物用无定形聚丙交酯树脂和丙交酯-乙交酯共聚树脂》12.YY/T0511-2009《多孔生物陶瓷体内降解和成骨性能评价试验方法》13.YY/T0512-2009《外科植入物金属材料α+β钛合金棒材显微组织的分类》14.YY/T0513.1-2009《同种异体骨修复材料第1部分骨组织库基本要求》15.YY/T0513.2-2009《同种异体骨修复材料第2部分:深低温冷冻骨和冷冻干燥骨》16.YY/T0513.3-2009《同种异体骨修复材料第3部分:脱矿骨》17.YY/T0514-2009《牙科手机软管连接件》18.YY/T0515-2009《牙科学银汞合金的腐蚀试验》19.YY/T0516-2009《牙科EDTA根管润滑/清洗剂》20.YY/T0517-2009《牙科预成根管桩》21.YY/T0518-2009《牙科修复体用聚合物基粘接剂》22.YY/T0519-2009《牙科材料与牙齿结构粘接的测试》23.YY/T0520-2009《钛及钛合金材质牙种植体附件》24.YY/T0521-2009《牙科学骨内牙种植体动态疲劳试验》25.YY/T0522-2009《牙科学牙种植体系统临床前评价动物试验方法》26.YY/T0523-2009《牙科学牙种植体开发指南》27.YY/T0524-2009《牙科学牙种植体系统技术文件内容》28.YY/T0525-2009《牙科学口腔颌面外科用骨填充及骨增加植入性材料技术文件内容》29.YY/T0526-2009《牙科学口腔颌面外科用组织再生引导膜材料技术文件内容》30.YY/T0527-2009《牙科学复制材料》31.YY/T0528-2009《牙科金属材料腐蚀试验方法》32.YY/T0756-2009《光学和光学仪器激光和激光相关设备激光光束功率(能量)密度分布的试验方法》33.YY/T0771.1-2009《动物源医疗器械第1部分风险管理应用》34.YY/T0771.2-2009《动物源医疗器械第2部分:来源、收集与处置的控制》35.YY/T0771.3-2009《动物源医疗器械第3部分:病毒和传播性海绵状脑病(TSE)因子去除与灭活的确认》36.YY/T0772.3-2009《外科植入物超高分子量聚乙烯第3部分:加速老化方法》37.YY/T0772.4-2009《外科植入物超高分子量聚乙烯第4部分:氧化指数测试方法》38.YY/T0772.5-2009《外科植入物超高分子量聚乙烯第5部分:形态评价方法》39.YY/T1150-2009《血红蛋白干化学检测系统通用技术要求》40.YY/T1151-2009《体外诊断用蛋白质微阵列芯片》41.YY/T1152-2009《生物芯片用醛基基片》42.YY/T1153-2009《体外诊断用DNA微阵列芯片》43.YY/T1154-2009《激光共聚焦扫描仪》44.YY/T1155-2009《全自动发光免疫分析仪》45.YY/T1156-2009《凝血酶时间检测试剂(盒)》46.YY/T1157-2009《活化部分凝血活酶时间检测试剂(盒)》47.YY/T1158-2009《凝血酶原时间检测试剂(盒)》48.YY/T1159-2009《纤维蛋白原检测试剂(盒)》49.YY/T1160-2009《癌胚抗原(CEA)定量测定试剂(盒)(化学发光免疫分析法)》50.YY/T1161-2009《肿瘤相关抗原CA125定量测定试剂(盒)(化学发光免疫分析法)》51.YY/T1162-2009《甲胎蛋白(AFP)定量测定试剂(盒)(化学发光免疫分析法)》52.YY/T1163-2009《总前列腺特异性抗原(t-PSA)定量测定试剂(盒)(化学发光免疫分析法)》53.YY/T1164-2009《人绒毛膜促性腺激素(HCG)检测试纸(胶体金免疫层析法)》54.YY/T1165-2009《沙保弱琼脂培养基》55.YY/T1166-2009《淋球菌琼脂基础培养基》56.YY/T1167-2009《厌氧血琼脂基础培养基》57.YY/T1168-2009《巧克力琼脂基础培养基》58.YY/T1169-2009《麦康凯琼脂培养基》59.YY/T1170-2009《碱性蛋白胨水培养基》60.YY/T1171-2009《改良罗氏基础培养基》特此公告。
国家食品药品监督管理总局公告第

国家食品药品监督管理总局公告2009年第83号关于实施YY0068.4-2009医用内窥镜硬性内窥镜第4部分:基本要求等80项医疗器械行业标准的公告YY0068.4-2009医用内窥镜硬性内窥镜第4部分:基本要求等80项医疗器械行业标准已经审定通过;自2011年6月1日起施行..其标准编号、名称如下:一、强制性行业标准20项1.YY0068.4-2009医用内窥镜硬性内窥镜第4部分:基本要求部分代替YY0068-922.YY0069-2009硬性气管内窥镜专用要求代替YY0069-923.YY0304-2009等离子喷涂羟基磷灰石涂层钛基牙种植体代替YY0304-19984.YY0322-2009高频电灼治疗仪代替YY0322-20005.YY0341-2009骨接合用无源外科金属植入物通用技术条件代替YY0341-20026.YY0585.4-2009压力输液设备用一次性使用液路及附件第4部分:防回流阀7.YY0601-2009医用电气设备呼吸气体监护仪的基本安全和主要性能专用要求代替YY0601-20078.YY0761.1-2009牙科旋转器械金刚砂车针第1部分:尺寸、要求、标记和包装9.YY0762-2009眼科光学囊袋张力环10.YY0763-2009医用内窥镜照明用光缆11.YY0764-2009眼科仪器视力表投影仪12.YY0765.1-2009一次性使用血液及血液成分病毒灭活器材第1部分:亚甲蓝病毒灭活器材13.YY0766-2009眼科晶状体超声摘除和玻璃体切除设备14.YY0767-2009超声彩色血流成像系统15.YY0768-2009牙科学义齿基托聚合物冲击强度试验16.YY0769-2009牙科用磷酸酸蚀剂17.YY0770.1-2009医用输、注器具用过滤材料第1部分:药液过滤材料18.YY0770.2-2009医用输、注器具用过滤材料第2部分:空气过滤材料19.YY1026-2009牙科学汞及银合金粉代替YY1026-199920.YY1080-2009眼科仪器直接检眼镜代替YY91080-1999二、推荐性行业标准60项1.YY/T0127.4-2009口腔医疗器械生物学评价第2单元:试验方法骨埋植试验代替YY/T0127.4-19982.YY/T0127.9-2009口腔医疗器械生物学评价第2单元:试验方法细胞毒性试验:琼脂扩散法及滤膜扩散法代替YY/T 0127.9-20013.YY/T0127.15-2009口腔医疗器械生物学评价第2单元:试验方法亚急性和亚慢性全身毒性试验:经口途径4.YY/T0127.16-2009口腔医疗器械生物学评价第2单元:试验方法哺乳动物细胞体外染色体畸变试验5.YY/T0269-2009牙科正畸托槽粘接材料代替YY0269-19956.YY/T0340-2009外科植入物基本原则代替YY/T0340-20027.YY/T0495-2009牙根管充填尖代替YY0495-20048.YY/T0507-2009医用弹性绷带基本性能参数表征及试验方法9.YY/T0508-2009外固定支架专用要求10.YY/T0509-2009生物可吸收内固定板和螺钉的标准要求和测试方法11.YY/T0510-2009外科植入物用无定形聚丙交酯树脂和丙交酯-乙交酯共聚树脂12.YY/T0511-2009多孔生物陶瓷体内降解和成骨性能评价试验方法13.YY/T0512-2009外科植入物金属材料α+β钛合金棒材显微组织的分类14.YY/T0513.1-2009同种异体骨修复材料第1部分骨组织库基本要求15.YY/T0513.2-2009同种异体骨修复材料第2部分:深低温冷冻骨和冷冻干燥骨16.YY/T0513.3-2009同种异体骨修复材料第3部分:脱矿骨17.YY/T0514-2009牙科软管连接件18.YY/T0515-2009牙科学银汞合金的腐蚀试验19.YY/T0516-2009牙科EDTA根管润滑/清洗剂20.YY/T0517-2009牙科预成根管桩21.YY/T0518-2009牙科修复体用聚合物基粘接剂22.YY/T0519-2009牙科材料与牙齿结构粘接的测试23.YY/T0520-2009钛及钛合金材质牙种植体附件24.YY/T0521-2009牙科学骨内牙种植体动态疲劳试验25.YY/T0522-2009牙科学牙种植体系统临床前评价动物试验方法26.YY/T0523-2009牙科学牙种植体开发指南27.YY/T0524-2009牙科学牙种植体系统技术文件内容28.YY/T0525-2009牙科学口腔颌面外科用骨填充及骨增加植入性材料技术文件内容29.YY/T0526-2009牙科学口腔颌面外科用组织再生引导膜材料技术文件内容30.YY/T0527-2009牙科学复制材料31.YY/T0528-2009牙科金属材料腐蚀试验方法32.YY/T0756-2009光学和光学仪器激光和激光相关设备激光光束功率能量密度分布的试验方法33.YY/T0771.1-2009动物源医疗器械第1部分风险管理应用34.YY/T0771.2-2009动物源医疗器械第2部分:来源、收集与处置的控制35.YY/T0771.3-2009动物源医疗器械第3部分:病毒和传播性海绵状脑病TSE因子去除与灭活的确认36.YY/T0772.3-2009外科植入物超高分子量聚乙烯第3部分:加速老化方法37.YY/T0772.4-2009外科植入物超高分子量聚乙烯第4部分:氧化指数测试方法38.YY/T0772.5-2009外科植入物超高分子量聚乙烯第5部分:形态评价方法39.YY/T1150-2009血红蛋白干化学检测系统通用技术要求40.YY/T1151-2009体外诊断用蛋白质微阵列芯片41.YY/T1152-2009生物芯片用醛基基片42.YY/T1153-2009体外诊断用DNA微阵列芯片43.YY/T1154-2009激光共聚焦扫描仪44.YY/T1155-2009全自动发光免疫分析仪45.YY/T1156-2009凝血酶时间检测试剂盒46.YY/T1157-2009活化部分凝血活酶时间检测试剂盒47.YY/T1158-2009凝血酶原时间检测试剂盒48.YY/T1159-2009纤维蛋白原检测试剂盒49.YY/T1160-2009癌胚抗原CEA定量测定试剂盒化学发光免疫分析法50.YY/T1161-2009肿瘤相关抗原CA125定量测定试剂盒化学发光免疫分析法51.YY/T1162-2009甲胎蛋白AFP定量测定试剂盒化学发光免疫分析法52.YY/T1163-2009总前列腺特异性抗原t-PSA定量测定试剂盒化学发光免疫分析法53.YY/T1164-2009人绒毛膜促性腺激素HCG检测试纸胶体金免疫层析法54.YY/T1165-2009沙保弱琼脂培养基55.YY/T1166-2009淋球菌琼脂基础培养基56.YY/T1167-2009厌氧血琼脂基础培养基57.YY/T1168-2009巧克力琼脂基础培养基58.YY/T1169-2009麦康凯琼脂培养基59.YY/T1170-2009碱性蛋白胨水培养基60.YY/T1171-2009改良罗氏基础培养基特此公告..国家食品药品监督管理局二○○九年十二月三十日。
医疗器械经营企业质量负责人培训教材PPT(45张)
2016年5月
内容提要
第一讲 医疗器械法规体系 第二讲 《医疗器械监督管理条例》 第三讲 医疗器械的定义与分类 第四讲 《医疗器械经营企业许可证管理办法》(局令15号) 第五讲 江西省局有关《医疗器械经营企业许可证》 第六讲 《医疗器械生产监督管理办法》(局令12号) 第七讲 《医疗器械注册管理办法》(局令16号) 第八讲 《医疗器械临床管理办法》 第九讲 《医疗器械说明书、标签和包装标识管理规定》(局令10号) 第十讲 医疗器械分类目录 第十一讲 医疗器械标准 第十二讲 《医疗器械广告审查办法》 第十三讲 《医疗器械不良事件监测和再评价管理办法(试行)》
第二讲 《医疗器械监督管理条例》
一、管什么?(第一条、第二条) 1、管医疗器械的安全、有效。 2、管理医疗器械的研究、生产、经营、使用、监督管理 的单位或者个人。
二、谁来管?(每四条) 1、国家药品监督管理部门负责全国的医疗器械监督管理 工作。 2、县级以上的地方人民政府药品监督管理部门负责本行 政区域内的医疗器械监督管理工作。 3、国务院药品监督管理部门应当配合国务院经济综合部 门,贯彻实施国家医疗器械产业政策。
三、与医疗器械经营有关的
规章和规定:
1、YY/T0278-2003idtISO13485:2003(医疗器械 质量管 理体系 用于法规的要求);
2、《一次性使用无菌医疗器械监督管理办法》; 3、《医疗器械经营企业许可证管理办法》; 4、《江西省医疗器械经营企业许可证管理实施办法》; 5、《关于进一下步医疗器械批发经营企业监督管理的通知》(鄂 食药监文[2009]第25号); 6、《关于印发2010年湖北省医疗器械批发经营企业许可证换证 工作方案的通知》(鄂食药监文[2010]73号)——附件1:江西省 《医疗器械经营企业许可证(批发)检查验收标准》; 7、《关于印发体外诊断试剂经营企业(批发)验收标准和开办申 请程序的通知》(国食药监文[2007]2009号); 8、省局《关于进一步明确体外诊断试剂经营监管有关事项的通知》
医疗器械岗位招聘笔试题与参考答案(某大型国企)
招聘医疗器械岗位笔试题与参考答案(某大型国企)一、单项选择题(本大题有10小题,每小题2分,共20分)1、医疗器械注册证的有效期是多久?A. 3年B. 4年C. 5年D. 6年答案:C解析:根据《医疗器械注册管理办法》的规定,医疗器械注册证的有效期为5年。
有效期届满需要延续注册的,应当在有效期届满6个月前向原注册部门提出延续注册的申请。
2、以下哪项不属于医疗器械的分类?A. Ⅰ类医疗器械B. Ⅱ类医疗器械C. Ⅲ类医疗器械D. Ⅳ类医疗器械答案:D解析:医疗器械按照风险程度由低到高,管理类别依次分为第一类(Ⅰ类)、第二类(Ⅱ类)和第三类(Ⅲ类)。
因此,Ⅳ类医疗器械并不属于医疗器械的分类范畴。
3、医疗器械注册证书的有效期一般为多少年?A. 3年B. 5年C. 7年D. 10年答案:B解析:根据《医疗器械注册管理办法》的规定,医疗器械注册证书的有效期一般为5年。
在有效期内,医疗器械注册人应当在产品上市后开展再评价工作,对医疗器械的安全性、有效性和质量可控性进行监测和评估,形成再评价报告。
4、以下哪项不属于医疗器械分类的依据?A. 医疗器械的结构特征B. 医疗器械的预期目的C. 医疗器械的使用方式D. 医疗器械的原材料答案:D解析:医疗器械的分类主要依据其风险程度,具体分类规则由国务院食品药品监督管理部门制定、调整并公布。
这些分类依据通常包括医疗器械的结构特征、预期目的、是否接触人体等因素,而不直接基于其原材料。
因此,原材料不是医疗器械分类的直接依据。
5、在医疗器械注册过程中,负责受理境内第三类医疗器械注册申请的机构是:A. 国家药品监督管理局B. 省级药品监督管理部门C. 市级市场监督管理部门D. 区县级卫生行政部门【答案】A 【解析】根据中国医疗器械监管法规,国家药品监督管理局负责境内第三类医疗器械的注册审批工作,因此正确选项为A。
6、下列哪种材料因其良好的生物相容性而被广泛应用于制造植入式医疗器械?A. 不锈钢B. 钛合金C. 聚乙烯D. 铝合金【答案】B 【解析】钛合金以其优良的耐腐蚀性和生物相容性,在医疗领域尤其是植入物方面得到了广泛应用。
医疗器械检查记录表
检查企业供方的评审记录。原材料、外协件和外购件的采购检验记录,采购合同/技术协议是否符合该产品的质量要求,检查物资供应方的资质证明,尤其是原材料必须是有医疗器械注册证的(如义齿等),要注意检查相关资质证明.
6。生产过程的控制,在产品形成过程中,是否有清晰的状态标识和可追溯标识
查看企业生产产品所依据的产品标准,是否为有效版本,是否保存产品标准中引用的国标、行标等文件.
3.产品出厂是否具有合格证,签发合格证是否按规定要求进行。检验人员是否经过培训并持证上岗
查看企业成品库房,查看企业合格证的签发记录,与成品检验报告核对.人员的上岗证与相关的培训证明及培训记录。
4.是否按标准要求进行产品的型式检验,是否有完整的型式检验报告
检查企业生产工艺的验证报告(或记录).检查生产过程的记录,按生产批号能否追溯到产品原材料的批号、每批产品关键工序及特殊过程的控制情况、每批产品生产过程中有关设备、人员情况和质量记录。
出厂检验记录
1。检验设备的配置是否能够覆盖标准中所规定的出厂检验项目。检验人员是否经过培训持证上岗
查看检验现场,检验设备清单,查验出厂检验报告(与注册产品标准的要求核对)查看检验人员的上岗证及相关的证明培训记录。
检查质量手册和程序文件,看是否有YY/T0287或YY/T0288的专用要求。
2。企业质量体系的运行情况是否按体系规定进行了内审和管理评审并有相应记录
查看企业内审和管理评审记录。
3.纠正和预防措施的落实情况
查看企业纠正和预防措施的执行记录.
医疗器械生产企业日常监督检查表
条款
检查内容及要求
检查方式
检查情况
附件2
医疗器械生产企业日常监督检查表
国家食品药品监督管理总局通告2014年第18号--关于发布禁止委托生产医疗器械目录的通告
国家食品药品监督管理总局通告2014年第18号--关于发布禁止委托生产医疗器械目录的通告文章属性•【制定机关】国家食品药品监督管理总局(已撤销)•【公布日期】2014.09.26•【文号】国家食品药品监督管理总局通告2014年第18号•【施行日期】2014.09.26•【效力等级】部门规范性文件•【时效性】失效•【主题分类】医疗安全与血液正文国家食品药品监督管理总局通告(2014年第18号)关于发布禁止委托生产医疗器械目录的通告为加强医疗器械生产监管,保障上市医疗器械安全有效,根据《医疗器械监督管理条例》(国务院令第650号),按照生产工艺和生产过程控制较为复杂、用于支持维持生命、应用于人体重要部位、使用中发现较多可疑不良事件的筛选原则,国家食品药品监督管理总局选取部分植入性医疗器械,组织制定了《禁止委托生产医疗器械目录》,现予发布。
原国家食品药品监督管理局《关于发布第一批禁止委托生产的医疗器械目录的通知》(国食药监械〔2005〕166号)即行废止。
特此通告。
附件:禁止委托生产医疗器械目录国家食品药品监督管理总局2014年9月26日附件禁止委托生产医疗器械目录一、部分植入材料和人工器官类医疗器械1.血管支架、血管支架系统(外周血管支架除外);2. 心脏封堵器、心脏封堵器系统;3. 人工心脏瓣膜;4.整形植入物(剂)。
二、同种异体医疗器械三、部分动物源医疗器械1.心脏、神经、硬脑脊膜修补材料;2.人工皮肤;3.体内用止血、防粘连材料;4. 骨修复材料;5.其他直接取材于动物组织的植入性医疗器械。
四、其他1.心脏起搏器;2.植入式血泵;3.植入式胰岛素泵。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 / 1
国家食品药品监督管理局关于实施《外科植入物生产实施细
则》有关工作的通知
【法规类别】医务工作
【发文字号】国食药监械[2003]132号
【失效依据】
国家食品药品监督管理局关于废止和宣布失效的规范性文件目录(第二批)的
公告
【发布部门】国家食品药品监督管理局(原国家药品监督管理局)(已撤销)
【发布日期】2003.07.01
【实施日期】2003.07.01
【时效性】失效
【效力级别】部门规范性文件
国家食品药品监督管理局关于实施
《外科植入物生产实施细则》有关工作的通知
(国食药监械[2003]132号)
各省、自治区、直辖市药品监督管理局:
根据《医疗器械生产企业监督管理办法》、《医疗器械注册管理办法》和《医疗器械生
产企业质量体系考核办法》,国家药品监督管理局印发了《外科植入物生产实施细则》
(国药监械〔2002〕473号,以下简称《细则》),并于20
