SDS-PAGE蛋白电泳手册
SDS-PAGE电泳标准操作流程

SDS-PAG电泳标准操作规程(网上)3. 程序:端平齐。
放于制胶架上夹紧,下端紧贴密封条。
3.1.2分离胶的配置3.122 灌胶混匀后用移液枪将凝胶溶液沿玻棒小心注入到长、短玻璃板间的狭缝内(胶高度距样品模板梳齿下缘约1cm)。
3.1 . 2.3液封在凝胶表面沿短玻板边缘轻轻加一层水以隔绝空气,使胶面平整。
静置约30min观察胶面变化,当看到水与凝固的胶面有折射率不同的界限时,表明胶已完全凝固,倒掉上层水,并用滤纸吸干残留的水液。
3.1.3浓缩胶的配置混匀后用移液枪将凝胶溶液注入到长、短玻璃板间的狭缝内(分离胶上方),轻轻加入样品模板梳,小心避免气泡的出现。
约30分钟,聚合完全。
3.2.1安装电泳槽将制备好的凝胶板取下,小心拔下梳子。
两块10%勺凝胶板分别插到U形橡胶框的两边凹形槽中,可往上提起使凝胶板紧贴橡胶。
将装好玻璃板的胶模框平放在仰放的贮槽框上,其下缘与贮槽框下缘对齐,放入电泳槽内。
倒入1X tris-gly 电泳缓冲液。
3.2.2 样品处理对于蛋白样品直接取80 pl的样品,依次加上20Q 5x buffer (加了B-巯基乙醇),混匀。
对于菌体或组织等固体样品,取少量样品加100ul 2x buffer (加了B-巯基乙醇)煮沸10分钟。
3.2.3 加样用移液枪取处理过的样品溶液10 p l,小心地依次加入到各凝胶凹形样品槽内,marker加入到其中一个槽内,为区别两块板,marker可加在不同的孔槽中。
3.2.4电泳将电泳槽放置电泳仪上,接通电源,正负极对好。
电压调至约150v保持恒压。
待溴酚蓝标记移动到凝胶底部时,关电源,把电泳缓冲液倒回瓶中。
3.2.5剥离胶把电泳槽取出,两块板拿下来,用刮片从长短玻片中间翘起,再把浓缩胶刮掉,取下。
3.3. 染色放于加有R250染色液的染色皿中,染液漫过胶即可,置于摇床上,转速约为45r/min,时间约1小时,完成后染液倒掉并用水洗掉染液。
3.4. 脱色取出染色过的胶放于加有脱色液的染缸里,脱色液漫过胶即可,置于摇床上,转速约为45r/min,时间约1小时,本底色脱净,条带清晰可见即可,完成后倒掉脱色液。
SDS-PAGE蛋白凝胶电泳

SDS Triton Tween EDTA DTT -巯基
-X100 20,60,80
乙醇
BCA 5% 5% 5%
10mM 1mM 1mM
Bradf 0.1% 0.1% 0.06% ord
SDS-PAGE蛋白凝胶电泳
5mM 1M
✓
凝胶聚合好的标志是胶与水层之间形成清晰的界面。 SDS-PAGE蛋白凝胶电泳
❖制备浓缩胶(浓缩胶)
插入样品梳
加入浓缩胶溶 液 pH 6.8
样梳需一次平稳插入,梳 口处不得有气泡,梳底需 水平。
分离胶 pH 8.8
SDS-PAGE蛋白凝胶电泳
样品处理
Sample buffer
1. SDS
2. - mercaptoethSanaoml ple buffer
实验原理
• 分子筛效应
pH6.8ຫໍສະໝຸດ 5%pH8.810%
Gly- Gly-
Gly-Gly-
Gly-Gly-
CGl-y- CGl-y-CGl-y- CGl-y-CGl-y-CGll-y- CGl-lyC-Gl-lCyl-G- ly-
主要离子
氯离子 甘氨酸离子(pI5.97) 蛋白质离子
甘氨酸解离增加 无快慢离子 Pr-根据分子量运动 分子筛效应
实验原理
• 浓缩效应
pH6.8
Pr-
Gly- Gly-
Cl- Cl- Cl-
Pr-
Gly- Gly-
Cl- Cl- Cl-
Pr-
Gly- Gly-
Cl- Cl-Cl-
主要离子
氯离子 甘氨酸离子(pI5.97) 蛋白质离子
pH8.8
快慢离子的产生 高的电压梯度 Pr-运动加速
(完整版)SDS-PAGE蛋白电泳方法

SDS-PAGE一. 实验原理SDS 是一种阴离子表面活性剂,在蛋白质溶液里加入 SDS 和巯基乙醇后,巯基乙醇能使蛋白质分子中的二硫键还原, SDS 能使蛋白质的氢键、疏水键打开并结合到蛋白质分子上,形成蛋白质-SDS 复合物。
在一定条件下,SDS 与大多数蛋白质的结合比例为 1.4:1。
由于十二烷基磺酸根带负电,使各种蛋白质的SDS-复合物都带上相同密度的负电荷,它的量大大超过了蛋白质原有的电荷量,因而掩盖了不同种类蛋白质间原有的电荷差别。
SDS与蛋白质结合后,还引起了蛋白质构象的改变。
蛋白质-SDS复合物的流体力学和光学性质表明,它们在水溶液中的形状,近似于雪茄烟形的长椭圆棒,不同蛋白质的 SDS 复合物的短轴长度都一样,约为 1.8nm ,而长轴则随蛋白质的 Mr 成正比的变化。
基于上述原因,蛋白质-SDS 复合物在凝胶电泳中的迁移率,不再受蛋白质原有电荷和形状的影响,而只与椭圆棒的长度有关,也就是蛋白质 Mr 的函数。
二. 试剂器材30%凝胶贮液(100mL):称取试剂Acr 29.2g和Bis 0.8g置于100mL烧杯中,向烧杯中加入约60mL双蒸水,充分搅拌溶解后加双蒸水定容至100mL,置于棕色瓶内4℃贮存,每过1-2个月应重新配制;注意:丙稀酰胺具有很强的神经毒性,并可通过皮肤吸收,其作用有积累性,配制时应戴手套和口罩等。
分离胶缓冲液(1.5 mol/L Tris-HCl,pH 8.8,100mL):称取Tris 18.2g 溶于约80mL 双蒸水,用6mol/L的HCl 调整pH值至8.8,加双蒸水定容到100mL,4℃ 贮存;堆积胶缓冲液(0.5 M Tris-HCl,pH 6.8,100mL):称取Tris 6.0g溶于约80mL双蒸水,用1mol/L的HCl 调整pH值至6.8,加双蒸水定容到100mL,4℃ 贮存;电泳缓冲液(1L):称取试剂Tris 3.03g和甘氨酸 14.4g置于500mL烧杯中,向烧杯中加入约400mL双蒸水充分溶解,再加入10%SDS溶液1.0mL,以双蒸水定容至1L (自然pH值为8.3,无需再调),4℃ 贮存,可重复使用5-6次;2×加样缓冲液(10mL):取下列试剂置于10mL塑料离心管中0.5mol/L Tris-HCl缓冲液(pH6.8) 2.0mL10%SDS溶液 4.0mL甘油 2.0mL巯基乙醇 2.0mL溴酚蓝 0.02g,混匀后1mL分装,-70℃可贮存6个月;10%AP:称取(NH4)2S2O3 1.0 g,溶于10.0mL双蒸水中,分装成每份1mL,-20℃贮存;TEMED:分装成每份1mL,4℃避光贮存;水饱和正丁醇(100mL):在玻璃瓶中加入50mL双蒸水和50mL正丁醇,振摇。
SDS-聚丙烯酰胺凝胶电泳(PAGE)测定蛋白质分子量

(4)聚丙烯胺凝胶的生成:
四、实验步骤:
1、贮液的配制:
2、凝胶的制备: 2.1 胶板的制备: 2.2 分离胶的制备: 2.3 浓缩胶的制备:
3、蛋白样品的制备:
4、装槽、点样: 5、电泳: 6、剥胶、染色、脱色:
2.1 胶板的制备:
3、植物组织蛋白质提取:
称取大豆叶片1g放在研钵中用液氮研磨,加
第二、不连续系统中的三种物理效应:
①电荷效应:
②分子筛效应: ③浓缩效应:
三、实验材料、仪器和试剂:
1、实验材料:黄瓜叶片(芽黄叶和正常叶)
2、仪器、器皿:
(1)垂直板电泳装置
(电泳槽,玻璃板,胶条,电泳梳子,制胶架等); (2)稳流稳压电泳仪; (4)电子天平; (6)瓷盘、微量进样器; (3)高速冷冻离心机; (5)电冰箱;
②光聚合:
催化剂是核黄素(VB2 ),在痕量氧存在下,核黄素光
解形成无色基,无色基再被氧氧化成自由基,激活单体发 生聚合。光聚合形成的凝胶孔径较大,且不稳定,适于制 备大孔径的浓缩胶。
5)聚丙烯酰胺凝胶结构上的特点:
① 聚丙烯酰胺的基本结构为丙烯酰胺单体构成的长 链,链与链之间通过甲叉桥联结在一起;
⑧支持物筛孔大小:
孔径小,电泳速度慢,反之则快。
2、SDS-聚丙烯酰胺凝胶电泳(SDSPAGE)
SDS-聚丙烯酰胺凝胶电泳PAGE测定蛋白质分子量

02 实验材料
所需的试剂和溶液
丙烯酰胺(AA):用于制备凝胶,是聚合反应 的单体。
甲叉双丙烯酰胺(MBA):交联剂,增加凝胶 的交联度。
N,N,N',N'-四甲基乙二胺(TEMED):催化剂, 加速交联聚合反应。
所需的试剂和溶液
过硫酸铵(APS)
引发剂,产生自由基,引发聚合反应。
SDS
十二烷基硫酸钠,用于变性蛋白质并促使其 带负电荷。
发展新型分离技术
随着生物技术的不断发展,可以发展新型的蛋白质分离技术, 如二维电泳、毛细管电泳等,以提高蛋白质分离的分辨率和准
确性。
应用多维度分析
在后续实验中,可以将SDS-PAGE与其他蛋白质分析技术相结 合,如质谱技术、免疫学检测等,进行多维度分析,更全面地
了解蛋白质的性质和功能。
THANKS FOR WATCHING
白质带负电荷,从而在电场中向正极移动。
聚丙烯酰胺凝胶作为支持介质,能够根据蛋白质分子量的不同
03
对其进行分离。
蛋白质的分子量测定
通过比较标准蛋白的迁移率和已知分 子量的标准蛋白,可以大致测定出待 测蛋白质的分子量。
蛋白质的迁移率与其分子量的对数成 反比,因此可以通过计算待测蛋白与 标准蛋白的相对迁移率来推算其分子 量。
甘氨酸
作为分子量标准品。
Tris-HCl缓冲液
维持电泳过程中的pH值稳定。
所需的仪器和设备
电源
为电泳提供电力。
凝胶板
放置凝胶的框架。
垂直电泳槽
提供电泳所需的基 本结构。
移液器
精确添加试剂和溶 液。
紫外透射仪
检测蛋白质条带。
实验前的准备事项
清洗电泳槽和相关器具,确保无残留物。 准备好所需的试剂和溶液,并确保其在有效期内。
SDS-PAGE电泳的标准操作规程
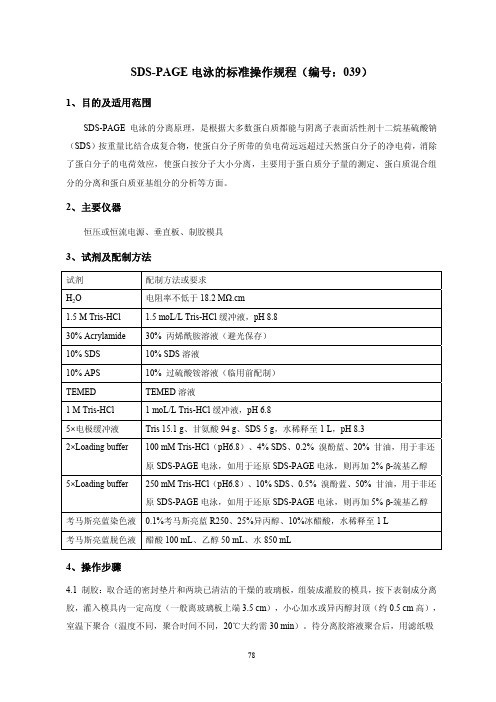
SDS-PAGE电泳的标准操作规程(编号:039)1、目的及适用范围SDS-PAGE电泳的分离原理,是根据大多数蛋白质都能与阴离子表面活性剂十二烷基硫酸钠(SDS)按重量比结合成复合物,使蛋白分子所带的负电荷远远超过天然蛋白分子的净电荷,消除了蛋白分子的电荷效应,使蛋白按分子大小分离,主要用于蛋白质分子量的测定、蛋白质混合组分的分离和蛋白质亚基组分的分析等方面。
2、主要仪器恒压或恒流电源、垂直板、制胶模具3、试剂及配制方法试剂配制方法或要求H2O 电阻率不低于18.2 MΩ.cm1.5 M Tris-HCl 1.5 moL/L Tris-HCl缓冲液,pH 8.830% Acrylamide 30% 丙烯酰胺溶液(避光保存)10% SDS 10% SDS溶液10% APS 10% 过硫酸铵溶液(临用前配制)TEMED TEMED溶液1 M Tris-HCl 1 moL/L Tris-HCl缓冲液,pH 6.815.1g、甘氨酸94 g、SDS 5 g,水稀释至1 L,pH 8.35×电极缓冲液 Tris2×Loading buffer 100 mM Tris-HCl(pH6.8)、4% SDS、0.2% 溴酚蓝、20% 甘油,用于非还原SDS-PAGE电泳,如用于还原SDS-PAGE电泳,则再加2% β-巯基乙醇5×Loading buffer 250 mM Tris-HCl(pH6.8)、10% SDS、0.5% 溴酚蓝、50% 甘油,用于非还原SDS-PAGE电泳,如用于还原SDS-PAGE电泳,则再加5% β-巯基乙醇考马斯亮蓝染色液 0.1%考马斯亮蓝R250、25%异丙醇、10%冰醋酸,水稀释至1 L考马斯亮蓝脱色液醋酸100 mL、乙醇50 mL、水850 mL4、操作步骤4.1 制胶:取合适的密封垫片和两块已清洁的干燥的玻璃板,组装成灌胶的模具,按下表制成分离胶,灌入模具内一定高度(一般离玻璃板上端3.5 cm),小心加水或异丙醇封顶(约0.5 cm高),室温下聚合(温度不同,聚合时间不同,20℃大约需30 min)。
实验二 聚丙烯酰胺凝胶电泳(SDS-PAGE)鉴定免疫球蛋白
将制备好的凝胶放入电泳槽,加入电泳缓冲液, 拨除梳子。用微量移液器点样。 5、电泳
样品在浓缩胶时,低电压(60~80V,起始电流不超过10~15mA), 进入分离胶后,提高电压(100~200V,电流不超过30mA),当 指示剂溴酚蓝前沿距离胶1~2mm,终止电泳。最好在低温下进行。
21
6、染色与脱色
7、加入一抗,室温平缓摇动2h;
8、废弃液体用TBST洗膜3次,每次5min;
9、加入二抗,室温下孵育1h;
10、废弃液体用TBST洗膜3次,每次5min;
11、显色 在DAB中显色约10-30min,待蛋白质带的颜色
深度达到要求后,用水漂洗,拍照或扫描。
42
实验报告要求与思考题
1、就实验中出现的各种问题进行分析 讨论。
以膜上的蛋白或多肽为抗原与相应的第一以膜上的蛋白或多肽为抗原与相应的第一抗体起免疫反应再和酶标记的第二抗体反抗体起免疫反应再和酶标记的第二抗体反应用适当的溶液漂洗去未结合抗体后置应用适当的溶液漂洗去未结合抗体后置含底物的溶液中温育即可检测出样品中的含底物的溶液中温育即可检测出样品中的特异蛋白质组分
实验二 SDS-PAGE分离鉴定 免疫球蛋白
凝胶浓度/% 2~5
100~500 40~100 10~40
<10
5~10 10~15 15~20 20~30
14
1、配制10ML12%分离胶
15
2、装配好电泳用双层垂直玻璃板,保证底部不漏水。将混合均匀的 分离胶凝胶溶液灌入双层玻璃板之间,控制溶液高度距离矮玻璃 板上缘2~3cm,立即在凝胶顶部加入2~3cm水层,室温静止 30~60min,待凝胶凝固后吸去顶部水层,灌浓缩胶至 双层玻璃板灌满为止,立即插入梳子,静止30~60min, 待凝胶凝固。
BIORAD电泳仪及SDS-PAGE凝胶电泳操作规范
使用BIO-RAD电泳仪进行SDS-PAGE凝胶电泳的操作规范实验原理根据蛋白分子量亚基的不同而分离蛋白,在样品介质和丙烯酰胺凝胶中加入离子去污剂和强还原剂后,蛋白质亚基的电泳迁移速率主要取决于亚基分子量的大小。
实验所用仪器FR-200A全自动紫外与可见分析装置上海复日科技有限公司电泳仪 BIO-RAD公司TS-1型脱色摇床江苏海门市其林贝尔仪器制造有限公司实验用试剂低分子量蛋白Maker TAKARA4*上样缓冲 TAKARAPagn Blue protein staining solution Fermentas试剂的配制1.贮液的配制(1)凝胶储液取30g丙烯酰胺+0.8g甲叉双丙烯酰胺0.8g ,先用35ml双蒸水溶解,搅拌,直到溶液变成透明,再用双蒸水稀释至100ml,过滤。
棕色瓶4℃保存一个月。
(2)1 mol/l Tris-HCL (PH 8.8)12.1g Tris(三羟甲基氨基甲烷)溶解在80ml双蒸水中,用4mol/l盐酸调PH至8.8。
再用双蒸水稀释至100ml,保存在4℃冰箱。
(3)1.0 mol/l Tris-HCL (PH 6.8)6.06g Tris溶解在40ml双蒸水中,用用4mol/l盐酸调PH至6.8。
再用双蒸水稀释至50ml,保存在4℃冰箱。
(4)10%过硫酸铵(APS)0.1g过硫酸铵+1ml双蒸水。
使用前新鲜配制(5)Tris–甘氨酸电泳缓冲液的配制(25mmol/L Tris;250mmol/L甘氨酸(pH8.3))30.3gTris+ 144.2g甘氨酸+ 10gSDS,双蒸水定容至1L。
每次使用时10倍稀释。
(6)样品缓冲液使用4*SDS-PAGE loading buffer(Takara公司),上样缓冲与样品比例1:3混匀,之后煮沸5min。
2.凝胶的配制注:上表所标体积为配制两块胶的用量。
若配制一块或多块,可按比例减半或加倍。
具体步骤如下:1、样品制备:40 µL蛋白+5*上样缓冲液10 µL,煮沸5 min,冷却后放冰箱下层保存,备用2、制胶1)用专用的医用棉口罩将胶板擦拭干净,电泳槽清洗干净,组装模具。
蛋白质的SDSPAGE电泳
分离胶内的电 泳
按分子量大小进行 分离
检测
☺考马斯亮蓝染色 ☺银染色
考马斯亮蓝
R—250 红蓝色,每个分子含有两个SO3H,偏酸性,结合在蛋白质的碱性 基团上
染色结果
银染色
机制: 将蛋白带上的硝酸银〔银离子〕还 原成金属银,使银颗粒沉积在蛋白带 上
应用
蛋白质分子量的测定 蛋白质纯度分析 蛋白质浓度测定 蛋白质水解的分析 免疫沉淀蛋白的鉴定 免疫印记第一步 蛋白质修饰的鉴定 分离和浓缩用于产生抗体的抗原 分离放射性标记的蛋白
电泳过程中的不正常现象
1 "微笑"现象 指示剂前言呈现两边向上的曲线形,说明 凝胶的不均匀冷却,中间部分冷却不好
2 皱眉现象 由于垂直电泳槽的装置不合适引起的,特别是当明胶和 玻璃板组成的"##治底部有气泡"或靠近隔片的凝胶聚 合不完全
3 "拖尾"现象 样品溶解不佳引起
解决办法:
➢加样前离心 ➢选择合适的样品缓冲液和凝胶缓冲液 ➢加增溶试剂 ➢降低凝胶浓度
X 100%
孔 徑 平 均 大 小
Å
% acrylamide
分离胶 浓缩胶 电泳液
三大特色: ☺PH不连续 ☺凝胶浓度不连续 ☺缓冲液成分不连续
ATTENTION:
☺不同的PH,氯离子,甘氨酸将会在
电泳过程中发挥重要作用
工作原理
➢蛋白质进入分离胶之前,先堆积成一条细线,使每个分子起 跑点相同,提高解析度
根据样品的处理方式不同: ➢还原SDS电泳 ➢非还原SDS电泳 ➢带有烷基化作用的还原SDS电泳
根据电泳形式: ➢圆盘电泳 ➢垂直电泳 ➢水平电泳 ➢平板电泳
目前实验室常用不连续的还原SDS垂直电 泳
sds-page(聚丙烯酰胺)蛋白电泳原理
sds-page(聚丙烯酰胺)蛋白电泳原理下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!SDSPAGE(聚丙烯酰胺)蛋白电泳原理蛋白质电泳是生物化学实验中常用的一种技术,可用于分离和分析蛋白质。
