手性有机化合物与不对称合成

第15卷 第4期 大学化学2000年8月今日化学
手性有机化合物与不对称合成
王 剑 波
(北京大学化学与分子工程学院 北京100871)
摘要 不对称合成是当今有机合成化学中最为引人注目的研究领域。本篇综述简要地回顾了手性化合物研究的历史;手性有机化合物在医药、材料等领域的重要性以及手性化合物的合成方法。
1 历史回顾
首先回顾一下手性化合物研究的历史。1808年,法国物理学家Malus通过方解石晶体的研究发现了偏振光现象,接着在1815年法国物理学家Biot发现一些天然有机物的溶液可以使偏振光旋转,并且发现这是溶于其中的有机物的固有特性。以后化学家们为发现具有这种所谓光学活性的新物质进行了研究,结果发现完全由人工合成的化合物全部是非光学活性的,而从动植物得到的化合物中有相当一部分是具有光学活性的。酒石酸是当时研究的比较多的一种具有光学活性的天然有机化合物,这和法国悠久的葡萄酒酿造历史是分不开的。在研究葡萄酒酿造过程中的副产物时,人们得到两种具有相同分子式的酸,其中一种可以使偏振光旋转,称为酒石酸;而另一种酸不能使偏振光旋转,称为葡萄酸。对于两者之间的关系并没有作深入的研究。
图1 互为镜像异构体的L 酒石酸和D 酒石酸
Pasteur1848年从巴黎大学毕业后,对酒石酸及其盐的重结晶进行了仔细的研究。发现在一定的条件下,酒石酸盐的结晶只向一个方向生长,对于19种不同的酒石酸盐进行研究的结果均得到了向一个方向生长的结晶。为了比较,Pasteur又对前面所提到的不能使偏振光旋转的葡萄酸的盐进行重结晶研究,发现葡萄酸的钠铵盐的晶体也会向一个方向生长。所不同的
王剑波:北京大学化学学院教授,有机化学研究所所长。
是,晶体有时是向左生长,有时则向右生长,而酒石酸盐的结晶则总是向一个方向生长。他将葡萄酸盐向左和向右生长的晶体仔细地分开,然后将其溶解后分别测其旋光,发现两种溶液均可以使偏振光旋转,前者使偏振光向左,而后者使偏振光向右。如果将两种晶体等量混合,则其溶液与结晶前的葡萄酸盐一样不能使偏振光旋转。将两种葡萄酸盐用酸处理得到游离的酸,发现其中之一和天然右旋性的酒石酸相同,称为D 酒石酸。而另一个则是一个未知物,除旋光的大小相同但方向恰好相反外,其他通常的物理化学性质完全相同。
Pasteur的这个实验第一次将光学活性的部分从没有光学活性的物质中分离出来。Pas teur选择酒石酸盐进行重结晶研究可以说是非常幸运的,因为绝大多数左旋和右旋的等量混合物是不能用简单的重结晶的方法分离的。事实上,在Pasteur的实验以后,人们经过一个世纪的研究也只发现9例可以用和Pasteur一样的重结晶方法进行光学活性物质分离的化合物。 人们试图从结构上对这种现象进行解释。Pasteur和其他的化学家已认识到如果分子的结构完全相同,但旋光性却不同,这种现象只能从原子在空间的不同排列才能解释。1874年,荷兰的van t Hoff和法国的Le Bel分别独立地提出立体构型的理论,对于前人有关旋光性的问题给予了完整的解释,这便是我们所熟悉的碳的四面体结构。
2 手性有机化合物问题为什么如此重要
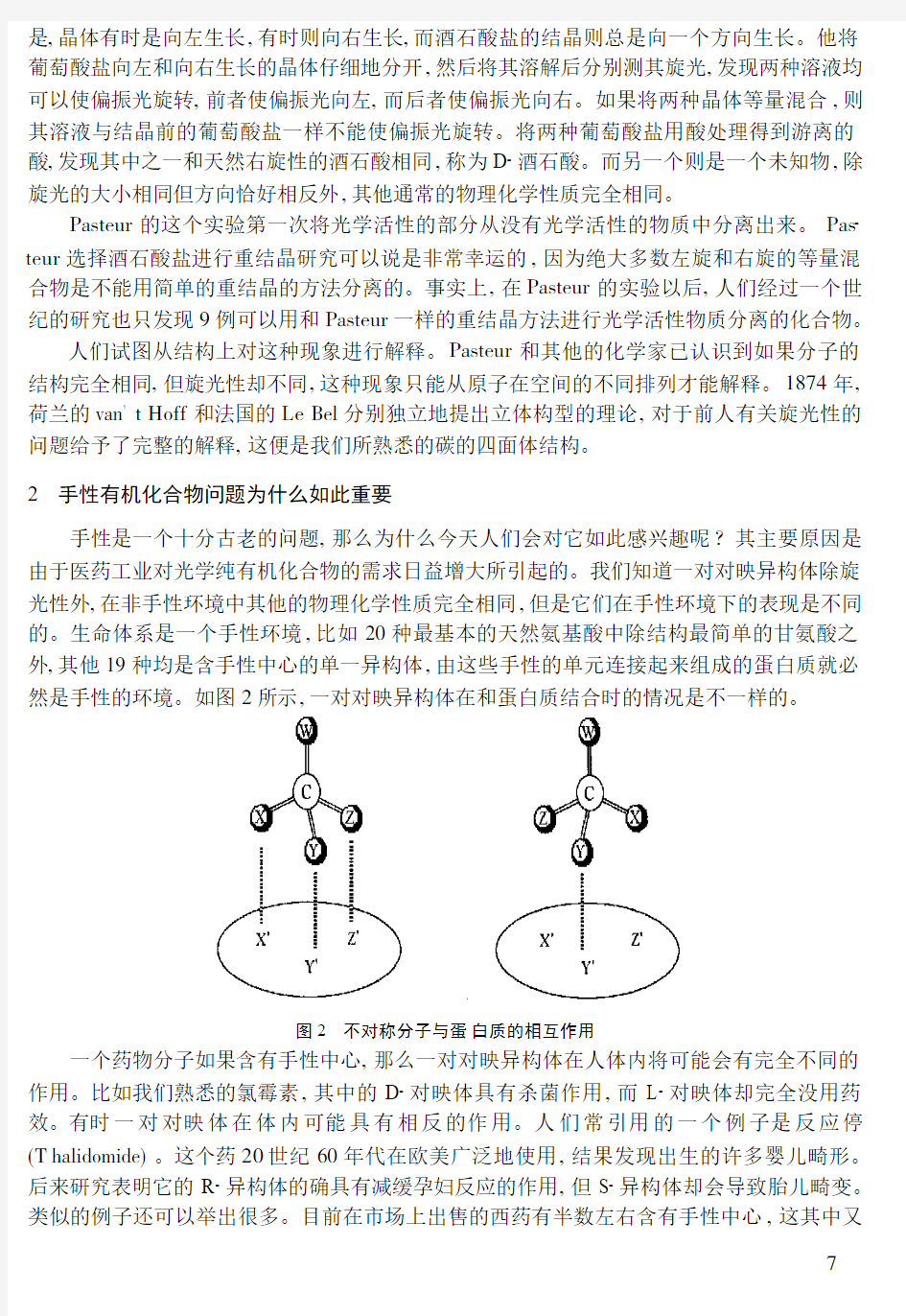
手性是一个十分古老的问题,那么为什么今天人们会对它如此感兴趣呢?其主要原因是由于医药工业对光学纯有机化合物的需求日益增大所引起的。我们知道一对对映异构体除旋光性外,在非手性环境中其他的物理化学性质完全相同,但是它们在手性环境下的表现是不同的。生命体系是一个手性环境,比如20种最基本的天然氨基酸中除结构最简单的甘氨酸之外,其他19种均是含手性中心的单一异构体,由这些手性的单元连接起来组成的蛋白质就必然是手性的环境。如图2所示,一对对映异构体在和蛋白质结合时的情况是不一样的。
图2 不对称分子与蛋白质的相互作用
一个药物分子如果含有手性中心,那么一对对映异构体在人体内将可能会有完全不同的作用。比如我们熟悉的氯霉素,其中的D 对映体具有杀菌作用,而L 对映体却完全没用药效。有时一对对映体在体内可能具有相反的作用。人们常引用的一个例子是反应停(T halidomide)。这个药20世纪60年代在欧美广泛地使用,结果发现出生的许多婴儿畸形。后来研究表明它的R 异构体的确具有减缓孕妇反应的作用,但S 异构体却会导致胎儿畸变。类似的例子还可以举出很多。目前在市场上出售的西药有半数左右含有手性中心,这其中又
有大约一半是以对映体混合物的形式出售的。人们到20世纪80年代以后才逐步认识到手性在药物中的重要性。这一方面是由于类似于反应停和氯霉素这样的例子不断增加,另一方面则是由于进入20世纪80年代后在手性化合物的合成以及分析分离方面有了一些突破性的进展,使得人们对这些问题的探讨有了可能。在20世纪80年代末90年代初的时候,欧美日等国在药物开发方面对有关手性的问题有了一些具体的立法,这对于医药工业形成了巨大的冲击,近几年单一对映体药每年均以10%以上的速度增长[1]。
T halidomide(反应停) Chloramphenicol(氯霉素)
图3 药物分子反应停和氯霉素
除医药工业之外,在材料方面手性化合物也有重要的用途。例如一种称为铁电液晶的新型液晶材料,它是在通常的液晶分子上再加上一个手性中心的部分,由于不对称因素的存在,使得分子在处于液晶状态时会更为有效地按某种方式有序地排列。在外加电场的作用下,这种排列会迅速发生改变,形成另外一种状态。这两种状态对应不同的光学性质,因而可以作为快速光开关。几年前铁电液晶(Ferroelectric Liquid Crystals)曾被认为极有可能取代正在使用的其他显示模式的液晶材料。虽然由于技术上的原因,铁电液晶目前尚未得到广泛的应用,但其广泛应用的可能性是仍然存在的[2]。
图4 铁电液晶分子的结构通式
C*为手性中心;A,B为极性基团;X,Y为不同取代基
由此可见手性化合物具有十分重要的应用价值。此外,手性化合物的合成具有很大的难度,从学术上来说是具有很强挑战性的。因此,目前有机合成化学的重点主要是在不对称合成方面。在过去的近20年中,有机合成化学家们在这一领域展开了大量的研究工作,新的不对称合成反应和合成路线不断涌现,其中一些反应已在工业上得到应用。
3 手性有机化合物的合成方法
合成光学活性有机化合物的方法大致可以分为以下4种: 旋光拆分; 用光学活性化合物作为合成起始物; 使用手性辅助剂; 使用手性催化剂。在实际应用中,这4种方法中的任何一种都有可能成为某一特定合成的最佳选择,它们各有其优缺点。我们在这里看一看这几种方法的例子。
旋光拆分是传统的方法,一般来说它是用一个手性的化合物和需要拆分的化合物形成某种化学结合,即形成一对非对映异构体,然后用柱色谱或重结晶等方法进行分离。最常见的是用一种光学纯的碱去拆分一个酸,或者用一种光学纯的酸去拆分一个碱,酸碱可以形成盐进行
重结晶。这种方法尽管古老,但目前在工业上还是用得很多的。除这种传统方法之外,近年来又发展起来了一种称为动力学拆分的方法。它是用一个手性环境下的化学反应,比如在手性催化剂作用下的反应,使得起始物中的某一个对映体以比较快的速度反应转化为另一种化合物从而达到分离的目的。比如史一安等报道的应用手性diox irane选择性环氧化起始物烯烃中的R对映体从而达到对映拆分的目的[3]。
图5 应用环氧化反应进行动力学拆分
应用手性助剂是合成光学纯化合物的另一个有效的方法。它是在分子内引入一个手性的辅助部分,用这个部分来控制反应中心的立体化学,生成的产物是非对映异构体,通常可以用柱色谱分离,最后去掉这个手性的辅助部分。在众多的手性助剂中比较成功的是美国哈佛大学Evans开发的Ox azolidinone和瑞士日内瓦大学Oppolzer的樟脑磺内酰胺(Camphorsul tam)。
图6 手性助剂Oxazolidinone和Camphorsultam
近年来不对称合成已逐步渗透到有机化学的各种反应类型。比如有机自由基反应以前被认为没有选择性,现在研究发现这类反应的立体化学是可以控制的。例如Naito等最近报道了一个合成 氨基酸的新方法,关键的步骤就是用了自由基反应,并用手性助剂樟脑磺内酰胺(Camphorsultam)控制反应的立体化学[4]。
Evans报道的另一个 氨基酸的合成方法是用Oxazolidinone作为手性助剂,通过立体选择性烷基化引入新的手性中心,再经过水解、Curtius重排和脱保护得到光学纯的 氨基酸[5]。 在不对称合成中最具有挑战性的是不对称催化反应[6],它是用催化剂的不对称中心来诱导产生产物的手性。这类反应中最著名的是20世纪80年代初Sharpless发展的不对称环氧化[7]。在该反应中D 酒石酸二乙酯作为手性源控制环氧化只从双键平面的一边进行。如果在反应中用L 酒石酸二乙酯,那么环氧化将从双键平面的另一边进行。只需要催化剂量的光学纯酒石酸二乙酯就可以实现高度对映选择性的环氧化。这个反应已在工业上得到了应用。 Sharpless的不对称环氧化适用于双键 位上含羟基的底物 烯丙醇类化合物。20世
图7 应用Camphorsultam为手性助剂的不对称合成
图8 应用Oxazlidinone为手性助剂的不对称合成
图9 Sharpless不对称环氧化反应
纪90年代初,Jacobsen开发了一类含C2对称轴的手性配体,这些配体与Mn( )形成的络合物可以高度对映选择性地催化非烯丙醇类烯烃双键的环氧化[8]。该反应迅速得到了广泛应用。
NM O:N 氧化 N 甲基吗啉(N M ethyl morpholi ne N Oxide) m CPBA:间氯过苯甲酸(m Chlorobenzoic Acid)
图10 Jacobsen不对称环氧化反应
除不对称环氧化之外,运用含手性配体的金属催化剂进行不对称氢化反应也是很活跃的
研究领域。早在20世纪60年代末,美国M onsanto公司的Know les就开始含手性磷配体的铑络合物的制备并将其应用于不对称氢化。这类手性催化剂经不断改进于20世纪70年代在M onsanto公司用于工业化生产L 多巴(L 二羟基苯丙氨酸,用于控制帕金森病)[9]。
图11 不对称催化氢化制备L 多巴
在以后的20多年间人们在不对称氢化方面开展了大量的研究工作,其中日本京都大学Noyori等最先开发的含手性联萘磷配体(BINAP)的金属催化剂获得了巨大的成功。Noyori 最初研究的是含手性联萘磷配体的金属铑催化剂,用于碳碳双键的不对称氢化,得到很高的对映选择性[10]。以后这类手性配体又被应用于其他的金属催化剂。
图12 不对称催化氢化合成手性 氨基酸
手性合成属于传统的方法,它是用手性的化合物作为起始物,应用常规的化学合成,经数步反应得到最终的光学纯产物。用光学活性化合物作为合成起始物方法的最大局限性在于获得手性起始物,即是否容易得到光学纯度高的起始物。此法的优点在于如果使用光学纯度高的起始物,则只要仔细地设计合成路线以防止发生消旋即可得到光学纯度很高的最终产物,并
且产物的绝对构型可以从起始物来推测。 氨基酸,碳水化合物, 羟基酸和萜类化合物是4类可以从中大量得到光学纯物质的天然产物,因而也常被用作为手性合成的起始物。例如L 天冬氨酸经手性中间体合成天然生物碱Solenopsin A[11]和Indolizidine209D[12]。Solenopsin A 是从美国南部蚂蚁的毒素中分离出来的天然产物,具有很强的生物活性。生物碱Indolizidine 209D是从分布在南美的一种蛙的皮中分离出来的含量极少的天然产物,其结构是从质谱分析推测出来的,为了进一部研究这类生物碱,需要做化学合成以制备得到较大量的物质。目标产物Indolizidine209D和Solenopsin A分子中均含有两个手性中心,其中打星号的不对称碳原子是从起始物L 天冬氨酸来的,而另一个手性中心是在合成过程中引入的。
图13 应用天然L 天冬氨酸合成手性生物碱
4 结束语
尽管近20年来化学家们在不对称合成方面进行了大量的研究工作,但是不对称合成依然是一个十分年轻且充满活力的领域,人们仍在继续开发高度选择性的有机反应。同时,光学纯有机化合物具有很高的附加值,因此手性化合物的工业化生产也是人们关注的问题。值得注意的是近年来有许多专门制备手性有机化合物的高科技公司在欧美等发达国家相继成立,显然是为了瓜分这一巨大市场。我国是人口大国,医疗保健是很大的市场,相应的手性药物中间体的需求也将是极大的。因此,我们很有必要在不对称合成的基础研究和产业化方面积极开展工作,在21世纪该领域的全球竞争中占有一席之地。
参 考 文 献
1 Caldw ell J.Chem&I ndustry,1995,176.
2 Goodby J W.Science,1986,231:350
3 Frohn M,Zhou X,Zhang J R,et al.J A m Che m S oc.1999,121:7718
4 M i yabe H,Fujii K,Naito https://www.360docs.net/doc/d215722681.html, L ett.1999,1:569
5 Evans D A,W u L D,Wiener J J M,et al.J Org Chem.1999,64:6411
6 Ojima I.Catalytic Asymmetric Synthesis.New York:VCH,1993
7 Katsuki T,Sharpless K B.J A m Chem Soc.1980,102:5974
8 Palucki M,Pospisil P J,Zhang W,et al.J A m Che m S oc.1994,116:9333
9 Knowles W S.J Chem Ed.1986,63:222
10 M iyash i ta A,Yasuda A,T akaya H,e t al.J Am Chem Soc.1980,102:7932
11 J efford C W,Wang J B.Tetrahe d ron L ett.1993,34:3119
12 J efford C W,Wang J B.Tetrahe d ron L ett.1993,34:2911
手性药物的合成与拆分的研究进展
手性药物的合成与拆分的研究进展 手性是自然界的一种普遍现象,构成生物体的基本物质如氨基酸、糖类等都是手性分子。手性化合物具有两个异构体,它们如同实物和镜像的关系,通常叫做对映异构体。对映异构体很像人的左右手,它们看起来非常相似,但是不完全相同。 目前市场上销售的化学药物中,具有光学活性的手性药物约占全部化学药40% } 50%,药物的手性不同会表现出截然不同的生物、药理、毒理作用,服用对映体纯的手性药物不仅可以排除由于无效(不良)对映体所引起的毒副作用,还能减少药剂量和人体对无效对映体的代谢负担,对药物动力学及剂量有更好的控制,提高药物的专一性,因而具有十分广阔的市场前景和巨大的经济价值[Dl 1由天然产物中提取 天然产物的提取及半合成就是从天然存在的光活性化合物中获得,或以价廉易得的天然手性化合物氨基酸、菇烯、糖类、生物碱等为原料,经构型保留、构型转化或手性转换等反应,方便地合成新的手性化合物。如用乳酸可合成(R)一苯氧基丙酸类除草剂[}z}。天然存在的手性化合物通常只含一种对映体用它们作起始原料,经化学改造制备其它手性化合物,无需经过繁复的对映体拆分,利用其原有的手性中心,在分子的适当部位引进新的活性功能团,可以制成许多有用的手性化合物。 2手性合成 手性合成也叫不对称合成。一般是指在反应中生成的对映体或非对映体的量是不相等的。手J险合成是在催化剂和酶的作用下合成得到过量的单一对映体的方法。如利用氧化还原酶、合成酶、裂解酶等直接从前体化合物不对称合成各种结构复杂的手性醇、酮、醛、胺、酸、酉旨、酞胺等衍生物,以及各种含硫、磷、氮及金属的手性化合物和药物,其优点在于反应条件温和、选择性强、不良反应少、产率高、产品光学纯度高、无污染。 手性合成是获得手性药物最直接的方法。手J险合成包括从手性分子出发来合成目标手性产物或在手性底物的作用下将潜在手性化合物转变为含一个或多个手性中心的化合物,手性底物可以作为试剂、催化剂及助剂在不对称合成中使用。如Yamad等和Snamprogetti 等在微生物中发现了能催化产生N-氨甲酞基一D-氨基酸的海因酶( Hy-dantoinase)。海因酶用于工业生产D一苯甘氨酸和D一对轻基苯甘氨酸。D一苯甘氨酸和D一对轻基苯甘氨酸是生产重要的临床用药半合成内酞胺抗生素(氨节青霉素、轻氨节青霉素、氨节头炮霉素、轻氨节头炮霉素)的重要侧链,目前国际上每年的总产量接近SOOOto 3外消旋化合物的拆分 外消旋拆分法是在手性助剂的作用下,将外消旋体拆分为纯对映体。外消旋体拆分法是一种经典的分离方法,在工业生产中己有100多年的历史,目前仍是获得手性物质的有效方法之一。拆分是用物理化学或生物方法等将外消旋体分离成单一异构体,外消旋体拆分法又可分为结晶拆分法;化学拆分法;生物拆分法;色谱拆分法;膜拆分和泳技术。 3. 1结晶拆分法 3.1.1直接结晶法 结晶法是利用化合物的旋光异构体在一定的温度下,较外消旋体的溶解度小,易拆分的性质,在外消旋体的溶液中加入异构体中的一种(或两种)旋光异构体作为晶种,诱导与晶种相同的异构体优先(分别)析出,从而达到分离的目的。在。一甲基一L一多巴的工业生产中就是使两种对映体同时在溶液中结晶,而母液仍是外消旋的,把外消旋混合物的过饱和溶液通过含有各个对应晶种的两个结晶槽而达到拆分的目的[3]。结晶法的拆分效果一般都不太理想,但优点是不需要外加手性拆分试剂。若严格控制反应条件也能获得较纯的单一对应体。 3. 1. 2非对映体结晶法
手性化合物合成方法
在有机合成中产生手性化合物的方法有4种: 1.使用手性的底物 2.使用手性助剂 3.采用手性试剂 4.使用不对称催化剂 常常需要使用天然产物,如:氨基酸、生物碱、羟基酸、萜、碳水化合物、蛋白质等。 1.使用手性的底物 这种方法局限于比较有限的天然底物 如图,该化合物的硼氢化反应中,由于羟基的作用产生另外新的立体中心(反应从分子的背后发生) 以下两个反应,第一个是由于羧基的控制得到相应的手性产物..另一个则是由于反应中间体烯醇阴离子的构象决定了构型 2.使用手性助剂 如图,在第一步使用LDA去质子化时,为了使得上边的醇锂和下边的烯醇锂相距最远,Z-异构体占优势,在下一步与EtI的反应中得以产生了立体中心。 类似地,用烯醇锆替代烯醇锂(使用LDA,ZrCp2Cl2)确保烯醇的构型,再和醛反应产生不对称中心。 这些反应多数通过手性助剂的金属原子和底物中已有手性的O、N等原子络合,之后再加入其他试剂实现不对称中心的形成。这其中手性唑啉环是一个非常不错的手性助剂,它水解后可以生成一个羧基(潜在官能团) 另外一个试剂是手性的3-烷基哌嗪-2,5-二酮(一个环状二肽,可由两个氨基酸环合生成),如图 在羰基的α位进行不对称烷基化使用的是以下两种试剂A和B(B称为SAMP),如图,对环己酮的反应中采用A得到S异构体而采用B得到R异构体.
在氨基的α位进行不对称烷基化使用的试剂如下二图,用胺和它们作用后再用LDA、MeI甲基化,最后用N2H4脱去助剂得到产物. 还有一些有趣的反应如脯氨酸的α烷基化,涉及到一个立体化学的"存储"问题,经历了一个消失和再产生的过程:: 手性亚砜的作用:分离得到手性亚砜试剂和卤代烷作用后在下一步反应中诱导手性基团的产生,Al/Hg可以方便地除去亚砜基团。 3.采用手性试剂 通过铝锂氢化物与手性二胺或氨基醇作用可以得到一个用于不对称还原的试剂。如图。 利用α-蒎烯和9-BBN作用得到的试剂是一个很好的不对称还原试剂.如图 不对称硼氢化反应也是一个很好的构造立体化学中心的反应。这里需要利用α-蒎烯(图中的反应是针对三取代烯烃的,对于双取代烯烃应采用条件温和的双取代硼烷)
手性药物不对称合成90 (3)_附件
手性药物及其不对称合成 [摘要]近年来不对称合成法应用在手性药物及药物中间体的制备中,使手性药物得到了快速的发展,不少手性药物及其中间体已经实现了工业化生产。本文介绍了手性药物及获取手性药物的方法,对不对称合成法尤其是不对称催化法在手性药物工业制备中的应用进行了综述。 [关键词]手性药物;制备;不对称合成;不对称催化 Chiral Drugs and Asymmetric Synthesis Abstract: In recent years ,since the asymmetric synthesis has been used in preparation of the chiral drugs and pharmaceutical intermediates ,there has been fast development in preparation of chiral drugs ,some of which has been already synthesed in industry scale .What is chiral drugs and the ways to abtain the chiral drugs are introduced .The methods of asymmetric synthesis,especially asymmetric catalytic reaction used in synthesis chiral drugs are reviewed . Key words :chiral drugs ,preparation , asymmetric synthesis;asymmetric catalytic synthesis 1 引言 2001 年10 月10 日,瑞典皇家科学院决定将2001年度诺贝尔化学奖授予在催化不对称反应领域做出突出贡献的3 位科学家:威廉·诺尔斯,野依良治与巴里·夏普赖斯。他们利用手性催化剂大大提升了单一对映异构体的产率,为手性药物的制备以及其他行业的发展都做出了突出的贡献。【1】 2手性药物 : 手性药物(chiral drug)是指其分子立体结构和它的镜像彼此不能够重合的
手性药物
我报告的题目是手性技术与手性药物。 首先让我和大家一起来回忆一下药物给人类带来空前灾难的反应停事件。1953年,联邦德国Chemie制药公司研究了一种名为“沙利度胺”的新药,该药对孕妇的妊娠呕吐疗效极佳,Chemie公司在1957年将该药以商品名“反应停”正式推向市场。两年以后,欧洲的医生开始发现,本地区畸形婴儿的出生率明显上升,此后又陆续发现12000多名因母亲服用反应停而导致的海豹婴儿!这一事件成为医学史上的一大悲剧。 后来研究发现,反应停是一种手性药物,是由分子组成完全相同仅立体结构不同的左旋体和右旋体混合组成的,其中右旋体是很好的镇静剂,而左旋体则有强烈的致畸作用。 到底什么是手性药物?用什么技术或方法能够分别获得左旋体和右旋体来进行研究和安全有效地使用呢? 这就是今天我要报告的主题——手性技术和手性药物。 要阐明这一主题,首先我们要认识什么是手性药物。手性药物分子有一个共同的特点就是存在着互为实物和镜像关系两个立体异构体,一个叫左旋体,另一个叫右旋体。就好比人的左手和右手,相似而不相同,不能叠合。 目前临床上常用的1850多种药物中有1045多种是手性药物,高达62%。像大家所熟知的紫杉醇、青蒿素、沙丁胺醇和萘普生都是手性药物。 手性是宇宙的普遍特征。早在一百多年前,著名的微生物学家和化学家巴斯德就英明地预见“宇宙是非对称的……,所有生物体在其结构和外部形态上,究其本源都是宇宙非对称性的产物”。 因此,科学家推断,由于长期宇宙作用力的不对称性,使生物体中蕴藏着大量手性分子,如氨基酸、糖、DNA和蛋白质等。绝大多数的昆虫信息素都是手性分子,人们利用它来诱杀害虫。很多农药也是手性分子,比如除草剂Metolachlor,其左旋体具有非常高的除草性能,而右旋体不仅没有除草作用,而且具有致突变作用,每年有2000多万吨投放市场,其中1000多万吨是环境污染物。Metolachlor自1997年起以单旋体上市,10年间少向环境投放约1亿吨化学废物。研究还发现,单旋体手性材料可以作为隐形材料用于军事领域。 左旋体和右旋体在生物体内的作用为什么有这么大的差别呢?由于生物体内的酶和受体都是手性的,它们对药物具有精确的手性识别能力,只有匹配时才能发挥药效,误配就不能产生预期药效。正如“一把钥匙开一把锁!”因此,1992年美国FDA规定,新的手性药物上市之前必须分别对左旋体和右旋体进行药效和毒性试验,否则不允许上市。2006年1月,我国SFDA也出台了相应的政策法规。 怎样才能将非手性原料转变成手性单旋体呢?从化学角度而言,有手性拆分和手性合成两种方法。经典化学反应只能得到等量左旋体和右旋体的混合物,手性拆分是用手性拆分试剂将混旋体拆分成左旋体和右旋体,其中只有一半是目标产物,另一半是副产物,而且需要消耗大量昂贵的手性拆分试剂。化学家一直在探索,是否有更经济的方法,将非手性原料直接转化为手性单旋体呢? 上世纪60年代初,科学家们开始研究在极少量的手性催化剂作用下获得大量的单旋体,这就是手性合成
浅谈手性化合物与现代医学
浅谈手性化合物与现代医学 一、手性化合物简介 手性化合物(chiral compounds)是指分子量、分子结构相同,但左右排列相反,如实物与其镜中的映体。人的左右手、结构相同,大姆至小指的次序也相同,但顺序不同,左手是由左向右,右手则是由右向左,所以叫做“手性”。也就是指一对分子。由于它们像人的两只手一样彼此不能重合,又称为手性化合物。判断分子有无手性的可靠方法是看有没有对称面和对称中心。 手性问题与我们的日常生活密切相关。天然存在的手性化合物品种很多,并且通常只含有一种对映体,手性问题还牵涉到农业化学、食品添加剂、饮料、药物、材料、催化剂等诸多领域。它的研究已经成为科学研究和很多高科技新产品开发的热点。在过去20年里,手性研究具有戏剧性的发展,已从过去的少数几个专家的学术研究发展到大面积科学研究的需要,在一些领域并已带来了巨大的经济效益。物质的手性已经变成越来越需要考虑的问题,其对我们的日常生活正在起到越来越重要的作用。 手性化合物主要从天然来源、不对称合成和外消旋体拆分3个方面得到。由天然来源获得手性化合物,原料丰富,价廉易得,生产过程简单,产品的纯度一般都较高,因此很多量大的产品都是从天然物中获得。在药物工业中由于对手性药物的要求不断增加,其大大激发了不对称有机合成的发展,使一些生物技术、生物催化剂也迅速扩展到该领域产生纯的的手性中间体和手性产品。 二、手性药物 由于自然界的生命体存在有手性,因而也就产生了手性药物。手性药物指分子结构中存在手性因素的药物。通常是指由具有药理活性的手性化合物组成的药物,或者是只含有效对映体或是以有效对映体为主的药物。按药效方面的简单划分,手性药物可能存在以下几种不同的情况:①只有一种对映体具有所要求的药理活性,而另一种对映体没有药理作用或活性很小。②一对对映体中的两个化合物具有等同或近乎等同的同一药理活性。③一对对映体具有完全不同的药理活性。 ④一对对映体之间一个有药理活性,另一个不但没有活性,甚至表现出一定的毒副作用。⑤一对对映体之间药理活性相近,但存在个体差异。⑥一对对映体中,一个有活性,另一个却发生拮抗作用。 三、手性药物未来展望 手性制药是医药行业的前沿领域,2001年诺贝尔化学奖就授予在分子不对称催化反应中做出杰出贡献的三位科学家。目前,世界单一对映体手性药物的销售额持续增长。1998年销售额已达到964亿美元。2000年的销售额为1330亿美元,并估计2008年达到2000亿美元。手性药物以其疗效高、毒副作用小、用药量少的优点满足了市场的需求,因而成为未来新药研发的方向。
不对称合成的发展与应用
不 对 称 合 成 的 发 展 与 应 用 专业:化学 姓名:史茹月 学号:2013296043
不对称合成的发展与应用 摘要:本文介绍了手性药物的重要性与类型;结合实例对不对称催化法合成手性药物作简要概述,尤其就是化学不对称催化技术,包括不对称催化氢化、羰基的不对称催化还原、不对称催化氧化、不对称环丙烷化、不对称催化羰基化及不对称催化加成反应等;展望了不对称催化反应在手性药物合成中的发展方向。 1、概述 手性就是自然界与生命休戚相关的基本属性之一。近年来,人们对单一手性化合物及手性功能材料的需求推动了手性科学的蓬勃发展,手性物质的合成与医药、农药、精细化工与材料科学的密切关系也显示出重要的应用前景。 近年来,研究者设计合成了一系列高选择性的手性配体与催化剂,其中螺环型手性配体已成为优势手性配体之一;她们发展了多个高选择性的不对称催化反应,并发展了手性催化剂负载化、分离回收新方法。 生命体系的大部分基本单元都就是手性分子,其所涉及的生命过程及相互作用也大多以手性方式进行。因此,具有生物活性的物质,如手性药物的对映体都以不同方式参与生命过程并对生物体产生不同的作用效果。 2、“完美合成化学”的重要途径 低成本、高药效的手性药物开发为不对称催化合成的发展提供了
巨大的吸引力,其广阔的市场需求更就是不对称催化发展的强劲动力。 人工合成就是获得手性物质的主要途径。外消旋体拆分、底物诱导的手性合成与手性催化合成就是获得手性物质的三种方法,其中,手性催化合成方法被公认为学术与经济上最为可取的手性技术,因而得到广泛的关注与深入的研究。因为一个高效的手性催化剂分子可以诱导产生成千上万乃至上百万个手性产物分子,达到甚至超过了酶催化的水平。 因此,如何设计合成高效、新型的手性催化剂,探讨配体与催化剂设计的规律,解决手性催化剂的选择性与稳定性,以及研究手性催化剂的设计、筛选、负载与回收的新方法,发展一系列重要的不对称反应就是该研究领域面临的新挑战。 3、科学基金布局手性合成研究 手性催化剂的研究目前还缺少系统的理性指导以及规律性可循,手性催化剂及高效催化反应的开发大都凭借经验、运气与坚持不懈的努力。因此,要实现手性催化反应的高选择性、高效率,需要从基础研究入手,通过理论、概念与方法的创新,解决这一挑战性问题。 上世纪80年代,我国科学家就开始注意到手性合成这一重要研究方向,并陆续有出色的成果出现。国家自然科学基金委员会适时组织了我国化学与生物学两个学科的研究人员,集中力量在手性药物的化学与生物学领域开展基础研究。 国家自然科学基金“九五”计划期间,由中国医学科学院药物研
手性分子的合成方法及研究进展
手性分子的合成方法及研究进展 学号: 班级: 姓名:
摘要:本文主要将手性药物的合成方法分为了两大类,并分别列举了一些方法,其中详细介绍了手性源合成以及酶法获得手性化合物两种方法,并通过对方法的介绍简述了手性化合物的研究进展。 关键词:手性化合物、合成、研究进展 手性是自然界最重要的属性之一,分子手性识别在生命活动中起着极为重要的作用。同一化合物的两个对映体之间不仅具有不同的光学性质和物理化学性质,而且它们具有不同的生物活性,比如在药理上,药物作用包括酶的抑制、膜的传递、受体结合等,均和药物的立体化学有关;手性药物的对映体的生物学活性、毒性、代谢和药物素质完全不同。获得手性化合物的方法,不外乎非生物法和生物法两种。 一、非生物法 非生物催化主要是指采用化学控制等手段来获得手性化合物,它主要包括不对称合成法、手性源合成、选择吸附拆分法、结晶法拆分、化学拆分法、动力学拆分、色谱分离等。下面主要介绍手性源合成: 手性源合成或者手性底物的诱导,该方法被称为第一代手性合成方法,亦称为底物控制法。它是通过底物中原有手性的诱导,在产物中形成新的手性中心。可简略表述为:原料为手性化合物A*,经不对称反应,得到另一手性化合物B*,即手性原料转化为反映产物。 美国Scripps 研究所Wong等曾报道了利用阿拉伯糖来合成L-N-乙酰神经氨酸的方法,该方法便是极其巧妙的利用了手性源合成。 阿拉伯糖是一个醛糖,它开环后的醛基与氨基化合物得到Schiff 碱中间体,硼酸衍生物上的乙烯基以富电子碳原子于Schiff碱上的碳原子发生亲核进攻,得到烯烃衍生物中间体,氨基用酸酐保护,总产率55%, de%为99%。烯烃衍生物中间体与硝酮衍生物进行1,3偶极环加成,得到氮氧五元环化合物,加成过程立体选择性较好,90%的产物是立体控制的。氮氧物五元环化合物经过脱质子化得到西佛碱中间体,水解后即得到L-N-乙酰神经氨酸(如图)。
手性药物的合成综述
手性合成的综述 姓名: 学号: 专业: 院系: 目录 手性合成的概念与简介 (2) 手性药物的合成的发展历程 (3) 手性合成的方法 (5) 几种手性药物合成方法的比较 (7) 化学—酶合成法合成手性药物的实例 (7) 手性药物的研究现状和展望 (10) 参考资料 (13) 手性药物的概念与简介 手性(英文名为chirality, 源自希腊文cheir)是用来表达化合物分子结构不对称性的术语。人的手是不对称的,左手和右手相互不能叠合,彼此是实物和镜像的关系,这种关系在化学中称为“对映关系”,具有对映关系的两个物体互为“对映体”。 化合物的手性与其空间结构有关,因为化合物分子中的原子的排列是三维的。例如,图1中表示乳酸分子的结构式1 a和1 b,虽然连接在中心碳原子上的4个基团,即H, COOH, OH和CH3都一样,但它们却是不同的化合物。它们之间的关系如同右手和左手之间的关系一样,互为对映体。 手性是人类赖以生存的自然界的本质属性之一。生命现象中的化学过程都是在高度不对称的环境中进行的。构成机体的物质大多具有一定空间构型,如组成蛋白质和酶的氨基酸为L-构型,糖为D-构型,DNA的螺旋结构为右旋。在机体
的代谢和调控过程中所涉及的物质(如酶和细胞表面的受体)一般也都具有手性,在生命过程中发生的各种生物-化学反应过程均与手性的识别和变化有关。 由自然界的手性属性联系到化合物的手性,也就产生了药物的手性问题。手性药物是指药物的分子结构中存在手性因素,而且由具有药理活性的手性化合物组成的药物,其中只含有效对映体或者以有效的对映体为主。这些对映异构体的理化性质基本相似,仅仅是旋光性有所差别,分别被命名为R-型(右旋)或S-型(左旋)、外消旋。药物的药理作用是通过与体内的大分子之间严格的手性识别和匹配而实现的。 手性制药是医药行业的前沿领域,2001年诺贝尔化学奖就授予分子手性催化的主要贡献者。自然界里有很多手性化合物,这些手性化合物具有两个对映异构体。对映异构体很像人的左右手,它们看起来非常相似,但是不完全相同。当一个手性化合物进入生命体时,它的两个对映异构体通常会表现出不同的生物活性。对于手性药物,一个异构体可能是有效的,而另一个异构体可能是无效甚至是有害的。手性制药就是利用化合物的这种原理,开发出药效高、副作用小的药物。在临床治疗方面,服用对映体纯的手性药物不仅可以排除由于无效(不良)对映体所引起的毒副作用,还能减少药剂量和人体对无效对映体的代谢负担,对药物动力学及剂量有更好的控制,提高药物的专一性。因而具有十分广阔的市场前景和巨大的经济价值。目前世界上使用的药物总数约为1900种手性药物占50%以上,在临床常用的200种药物中,手性药物多达114种。全球2001年以单一光学异构体形式出售的市场额达到1 472亿美元,相比于2000年的1 330亿美元增长了10%以上。预计手性药物到2010年销售额将达到2 000亿美元。 在许多情况下,化合物的一对对映异构体在生物体内的药理活性、代谢过程、代谢速率及毒性等存在显著的差异。另外在吸收、分布和排泄等方面也存在差异,还有对映体的相互转化等一系列复杂的问题。但按药效方面的简单划分,可能存在三种不同的情况:1、只有一种对映体具有所要求的药理活性,而另一种对映体没有药理作用,如治疗帕金森病的L-多巴(图2中a),其对映异构体对帕金森病无治疗效果,而且不能被体内酶代谢,右旋体聚积在体内可能对人体健康造成影响;2、一对对映异构体中的两个化合物都有等同的或近乎等同的药理活性,如盖替沙星(图2中b),其左旋体和右旋体的活性差别不大;3、两种对映体具有完全不同的药理活性,如镇静药沙利度胺(又名反应停,图2中c),(R)-对映体具有缓解妊娠反应作用, (S)-对映体是一种强力致畸剂[1,2]。因此,1992年3月FDA发布了手性药物的指导原则,明确要求一个含手性因素的化学药物,必须说明其两个对映体在体内的不同生理活性,药理作用,代谢过程和药物动力学情况以考虑单一对映体供药的问题。目前,手性药物受到世界各国的关注和重视,手性药物的合成也成为目前各国研究的一项迫切的任务。 手性药物的合成的发展历程
手性化合物
手性化合物的合成和分离方法研究进展 摘要:手性问题与我们的生活密切相关,它涉及到生命、动植物、药物、食品、香料、农药等诸多领域,本文介绍了手性化合物的一些用途,合成和分离方法及发展方向。手性化合物的制备已成为当前国内外较热门的研究课题之一。本文从非生物法和生物法两个方面较全面地综述了手性化合物的制备方法, 希望为相关研究者提供参考。 关键词:手性化合物;手性药物;制备;生物合成 1.1用途 手性化合物(chiral compounds)是指分子量、分子结构相同,但左右排列相反,如实物与其镜中的映体。人的左右手、结构相同,大姆至小指的次序也相同,但顺序不同,左手是由左向右,右手则是由右向左,所以叫做“手性”。也就是指一对分子。由于它们像人的两只手一样彼此不能重合,又称为手性化合物。判断分子有无手性的可靠方法是看有没有对称面和对称中心[1]。 手性问题与我们的日常生活密切相关。天然存在的手性化合物品种很多,并且通常只含有一种对映体,手性问题还牵涉到农业化学、食品添加剂、饮料、药物、材料、催化剂等诸多领域。它的研究已经成为科学研究和很多高科技新产品开发的热点。在过去20年里,手性研究具有戏剧性的发展,已从过去的少数几个专家的学术研究发展到大面积科学研究的需要,在一些领域并已带来了巨大的经济效益。物质的手性已经变成越来越需要考虑的问题,其对我们的日常生活正在起到越来越重要的作用。 手性化合物主要从天然来源、不对称合成和外消旋体拆分3个方面得到。由天然来源获得手性化合物,原料丰富,价廉易得,生产过程简单,产品的纯度一般都较高,因此很多量大的产品都是从天然物中获得。在药物工业中由于对手性药物的要求不断增加,其大大激发了不对称有机合成的发展,使一些生物技术、生物催化剂也迅速扩展到该领域产生纯的的手性中间体和手性产品[2]。 1.生物制药 在合成中引入生物转化在制药工业中已成为关键技术。如Merck公司开发的酰胺酶抑制剂西司他丁的生产就是一个实例。西司他丁是一种N-取代的(S)-2,2-二甲环丙烷羰酰胺衍生物,它可以从易得原料合成消旋2,2-二甲基环丙羰腈开始,通过不同途径合成。 2.生物农药 拟除虫菊酯类杀虫剂是70年代中期开始大量使用的新型农药,是天然除虫菊酯的模拟物,生物降解性好,对环境影响小。拟除虫菊酯具高效安全杀虫谱广等优点。在世界农药市场占有一定的地位。手性化合物在生物农药方面也有广扩的前景,此杀虫剂占全球杀虫剂市场的20%。 3.香料、添加剂和酶技术 香精香料和其他行业占手性市场总值的4.7%;如人工合成一些甜味剂癸内酯具有强烈的果香香气。 酶技术的一个新方向是美国Altus Biologics的交联酶结晶(cross - linked enzyme
手性化合物
手性化合物 手性化合物是指分子量、分子结构相同,但左右排列相反,如实物与其镜中的映体。人的左右手、结构相同,大姆至小指的次序也相同,但顺序不同,左手是由左向右,右手则是由右向左,所以叫做“手性”。也就是指一对分子。由于它们像人的两只手一样彼此不能重合,又称为手性化合物 什么是手性? 当我们伸出双手,双手手心向上时,可以看出左右手是对称的,但是将双只手叠合,无论如何也不能全部重叠,总有一部分是不能重合在一起的;如果我们将左手置于一面平面镜前,手心对着镜子,可以看到镜子里的左手的像和右手手心对着自己一样,即左手的像和右手可以完全重叠。象这样左手和右手看来如同物与像,但又不能叠合在一起,互相成为“镜像”关系,就称之为“手性”。 有机化合物是含碳的化合物,一个碳原子的最外层上有四个电子,若以单键成键时,可以形成四个共价单键,共价键指向四面体的顶点,当碳原子连接的四个基团各不相同时,与这个碳原子相连接的四个基团有两种空间连接方式,这两种方式如同左右手,互为“镜像”,也是不能完全叠合在一起的,因此,这样的分子叫做“手性分子”。这种构成手性关系的分子之间,把一方叫做另一方的“对映异构体”。许多有机化合物分子都有“对映异构体”,即是具有“手性”。构成生物体的许多有机化合物都有“手性”。如α-氨基酸,在碳连接有一个羧基、一个氨基、一个烃基和一个氢原子(或一个不同于前边的烃基)*,这时你想将其中三个相同颜色的球重叠,但是余下的那个颜色的球总不能重叠。由这些手性氨基酸组成的蛋白质也就与“手性”有密切的关系,因此,生命生理活动中的许多现象与“手性”密不可分。 如何检验物质具有手性? 手性物质具有一特殊性质——旋光性,将纯净的手性物质的晶体,或是将纯净的手性物质配成一定浓度的溶液,用平面偏振光1照射,通过手性物质的偏振光平面会发生一定角度的旋转,这称为旋光性。这种偏振光的平面旋转可左可右,以顺时针方向旋转的对映体,称为右旋分子,用“+”或“d”表示;以逆时针方向旋转的对映体,称为左旋分子,用“-”或“l”;如果将互为对映体的手性物质等物质的量混合后,以偏振光照射,而偏振光不发生旋转,称为外消旋体或外消旋混合物,外消旋体是由于左旋分子和右旋分子发生的偏振光旋转
手性合成手性识别手性拆分及在医药学中应用_张来新
收稿日期:2016-02-29 基金项目:陕西省重点实验室科学研究计划基金资助项目(2010JS067); 陕西省教育厅自然科学基金资助课题(04JK147);宝鸡文理学院自然科学基金资助课题(zk12014) 作者简介:张来新(1955-),男,汉族,陕西周至人,教授,硕士研究生 导师,主要从事大环化学研究及天然产物分离提取。 DOI :10.16247/https://www.360docs.net/doc/d215722681.html,ki.23-1171/tq.20160753 Sum 250No.07 化学工程师 Chemical Engineer 2016年第07 期 手性是人类赖以生存的自然界的属性之一,也是生命体系中最重要的属性之一。作为生命体三大 物质基础的蛋白质、核酸及糖类均是由具有手性的结构单元组成的。如组成蛋白质的氨基酸除少数例外,大多是手性的L-氨基酸; 组成多糖和核酸的天然单糖大都是手性的D-构型。因此,生物体内所有的生化反应、生理反应无一不表现出高度的手性立体特异性,而外源性物质进入体内所发生的生理生化反应过程也具有高度的立体选择性。医药学所有的手性药物是指分子结构中含有手性中心或不对称中心的药物,它包括单一的立体异构体、两个或两个以上立体异构体的混合物。手性化合物除了通常所说的含手性中心的化合物外,还包括含手性轴、手性平面、螺旋手性等因素的化合物。由于药物作用的靶点(如受体、酶或通道)结构上的高度立体 特异性,手性药物的不同立体异构与靶点的相互作 用有所不同,从而产生不同的药理活性,故表现出立体专一性和立体选择性。同样,药物进入体内后与机体内具有高度立体特异性的代谢酶及血浆蛋白或转运蛋白等相互作用,手性药物的不同异构体在体内也将表现出不同的药代动力学特征,并具有 立体专一性和立体选择性。但值得注意的是,有些手性化合物在体内甚至可能发生构型变化而改变 其药效或产生毒副作用。 由于手性药物是医药行业的主体和前沿阵地,故2001年诺贝尔化学奖就授予了分子手性催化剂的主要贡献者。自然界中有众多手性化合物,这些不同构型的化合物具有一对对映异构体。当一个手性化合物进入生命时,它的两个对眏异构体通常会表现出不同的生物生理活性。对于手性药物,一个异构体可能是有效的,而另一个异构体可能是无效的甚至是有害的(如青霉素),这就需要对对眏体进行拆分。手性制药就是利用化合物的拆分原理,开发出药效高、副作用小的药物。在临床治疗方面,服用一对对眏体中的一种单一构型的纯手性药物可以排除由无效或不良对眏体的另一种而引起的毒副作用,不仅如此,还可以减少药剂用量和人体对 手性合成手性识别手性拆分 及在医药学中应用 * 张来新*,陈 琦 (宝鸡文理学院化学化工学院,陕西宝鸡721013) 摘要:简要介绍了手性物质的合成、手性识别、手性拆分及在医药学上的应用。详细综述了:(1)手性合成手性识别手性拆分及在医药学中的应用;(2)新型金属手性超分子配合物的合成及应用;(3)手性杯芳冠醚的合成分子识别及应用。并对手性化学的发展进行了展望。 关键词:手性合成;手性识别;手性拆分;应用中图分类号:O658 文献标识码:A Chiral synthesis,chiral recognition,chiral separation and their applications to medeicine * ZHANG Lai-xin ,CHEN Qi (Chemistry &Chemical Engineering Department,Baoji University of Arts and Sciences,Baoji 721013,China ) Abstract :This paper introduces synthesis of chiral materials,chiral recognition,chiral separation,and their applications to medicine.Emphases are put on three parts :(1)chiral synthesis,chiral recognition,chiral separa -tion,and their applications to medicine ;(2)synthesis and applications of new metal chiral supramolecular com -plexes ;(3)synthesis,molecular recognition,and applications of chiral calix crown ethers.Future developments of charal chemestry are prospected in the end. Key words :chiral synthesis ;chiral recognition ;chiral separation ;application
手性药物的合成与生物转化
手性药物的合成与生物转化 摘要:药物分子的立体化学决定了其生物活性,手性已成为药物研究的一个关键因素,生物技术在手性药物合成中具有重要意义,利用酶催化的相关性质,通过酶拆分外消旋体酶法不对称合成等方法合成手性药物,采用定向进化技术酶分子修饰辅酶再生等方法对手性药物合成方法进行改进。 关键词:手性药物生物转化生物合成 手性(Chirality) 是自然界的本质属性之一。构成生命有机体的分子都是不对称的手性分子,生命界中普遍存在的糖为D型,,氨基酸为L型,蛋白质和DNA的螺旋构象又都是右旋的。手性药物( Chiral drug) 是指有药理活性作用的对映纯化合物。 手性药物的制备方法包括化学制备法和生物制备法,生物转化具有一些化学方法无可比拟的优点:反应条件比较温和;产物比较单一,具有很高的立体选择性(Enantioselectivity)、区域选择性(Regioselectivity)和化学选择性(Chemoselectivity);并且能完成一些化学合成难以进行的反应。目前,生物转化已涉及羟基化、环氧化、脱氢、氢化等氧化还原反应;水解、水合、酯化、酯转移、脱水、脱羧、酰化、胺化、异构化和芳构化等各类化学反应。 生物合成手性药物法主要包括酶拆分外消旋体法、酶法不对称合成和微生物发酵法。 1 酶法拆分外消旋体合成手性药物 近年来随着酶技术的发展,利用酶的高度立体选择性进行外消旋体的拆分从而获得光活性纯的化合物是得到手性药物的重要途径。酶是由L-氨基酸组成,其活性中心构成了一个部队称环境,有利于对消旋体的识别,属于高度手性的催化剂,催化效率高,有很强的专一性,
反应产物的对映体过量百分率(ee)可达100%。因此,在售性药物合成过程中,用酶拆分消旋体是理想的选择。D-苯甘氨酸金额D-对羟基苯甘氨酸是生产半合成青霉素和头孢菌类抗生素的重要侧链。DSM公司(Geleen,荷兰)利用恶臭假单胞菌(Pseydomonas putida)和L-氨肽酶拆分DL-氨基酸酰胺获得了D-苯甘氨酸和D-对羟基苯甘氨酸。拆分过程中生成的不要的对映体可通过与苯甲醛形成的酰胺的Schiff碱性成加合物,在升高pH值时发生外消旋化,外消旋后的氨基酸酰胺可重复利用。 如果想成功地提供药物中间体和药物活性组分,就必须有供选用的大量合成平台,生物催化仅是其中的一个办法。虽然产生一种现代的药物活性组分中通常只有一步是采用生物催化的,但这常常是把手性引入到化合物中的关键一步,并且由于药物结构中,分子手性部分变得越来越重要,随着分子中手性中心的增多,生物转化方法的良好专一性和选择,就必然要比其他手性合成方法发展得更快。 2 酶法不对称合成手性药物 将具有氧化或还原作用的酶及相关微生物作的手性合成催化剂,催化前手性底物,从而构建药物的手性中心的反应,利用氧化还原酶、合成酶、裂解酶等直接从前体化合物不对称合成各种结构复杂的手性醇、酮、醛、胺、酸、酯、酰胺等衍生物以及各种含硫、磷、氮及金属的手性化合物和药物。Pfizer等采用脱氧核糖-5-磷酸醛缩酶来催化连续的醇醛缩合反应,利用1mol氨基醛和2mol乙醛反应形成氨基内酯,随后通过常规氧化、保护和酯化形成他汀侧链,这一生物催化
不对称反应及应用—手性合成前沿研究
- 14 - 第2期2019年4月No.2 April,2019 1 什么是手性化合物 手性是三维物体的基本属性。如果一个物体不能与其镜像重合,该物体就称为手性物体。1848年,法国化学家巴斯德(L.Pasteur ,1822~1895)发现酒石酸两种不同的存在形式:左旋酒石酸、右旋酒石酸;发现手性分离方法—镊子。世界上大多数的有机物都是有手性的,即有光学活性。大多数氨基酸是D 型,大多数的单糖是L 型。手性化合物在我们身边无处不在。 2 手性合成的农业应用 农药残留引起的食品安全问题一直是社会关注的热点问题。在中国,目前生产的农药中,40%以上是手性农药,这一比例还在不断上升。手性化合物由一对或多对对映体组成。然而,无论是制备技术还是经济原因,大多数农药都是以消旋体的形式生产的。据报道,目前科学家们已提出了一种新的多残留分析方法,用于黄瓜、番茄、卷心菜、葡萄桑、苹果和梨中22种手性农药的对映体选择性分析。以石墨烯为吸附剂,采用磁性固相萃取技术对农药进行高效提取,采用响应面法进行多变量优化。例如,我们采用反相液相色谱—串联质谱联用技术,在Chiralpak IG 柱上47 min 内实现了对映体的完美手性拆分,拆分大量手性化合物具有显著的改善作用。该方法在选择性、线性、灵敏度、真实感、精密度等方面进行了验证,均满足农药残留分析的要求。该方法成功地应用于监测不同果蔬中农药的发生和对映体组成。有机农药广泛应用于农业中,以控制霉菌、害虫、杂草,从而保证世界各地蔬菜、水果和农作物的高品质和高产。由于农药的大量消耗,农药在农产品中经常被检测到,这可能对人体健康造成潜在的威胁。采用手性液相色谱法在美国马萨诸塞州米尔福市Waters Corp 的AcquityTM UPLC 系统上进行分析,该系统包括一个AcquityTM UPLC 双泵溶剂管理系统、一个AcquityTM UPLC 自动取样器和一个恒温柱室。采用Chiralpak IG 柱对22种农药进行手性分离,柱长250 mm ×4.6 mm ,I.D.5 m ,Daicel ,日本,柱长10 mm ×4 mm ,I.D.5 um ,Daicel ,日本。该手 性固定相的选择是基于其良好的对映体识别和分离能力。 Chiralpak IG 柱可用于正相、反相或极性有机相,但由于移动相组成与质谱仪具有较好的相容性,因此采用反相模式分离农药对映体。对映体拆分的最佳色谱条件在混炼上测定了化学成分。有效地对消旋体进行手性拆分,对于人类生活具有重大的意义。 3 手性合成在医药化学中的应用 医药工业对光学纯有机化合物的需求日益增大。生命体系是一个手性环境,比如20种最基本的天然氨基酸中除结构最简单的甘氨酸之外,其他19种均是含手性中心的单一异构体,由这些手性的单元连接起来组成的蛋白质就必然是手性的环境(见表1)。 表1 1994~1996年世界新药(NCE )上市情况分析药物199419951996手性药物262329混旋体药物756非手性药物141116合计 47 39 51 从1 850种常用药物看,大多数天然药物和半合成药物是手性化合物,以单一立体异构体存在并注册为药物,成为手性药物。由于手性药物具有副作用少、使用剂量低和疗效高等特点,颇受市场欢迎,销量迅速增长,近年来催化不对称全合成具有复杂结构的生物活性天然产物的研究进展飞速。催化不对称合成天然产物,用于开发新型抗感染和抗癌药物的天然产物是生物活性化合物的丰富来源,经常被开发成药物。 此外合成有机化学在天然产物结构的基础上,拓宽了可获得的化学实体的渠道,为药物和天然产物化学架起了桥梁。比如,Caprazamycin B 被发现是一种抗结核抗生素,并被开发为CPZEN-45,对广泛耐药株(XDR-TB )亮氨酸抑素A 具有活性,在相应基质细胞存在的情况下对肿瘤细胞具有 作者简介:孙阿强(1995— ),男,汉族,安徽阜阳人,本科生;研究方向:有机化学不对称合成。 不对称反应及应用—手性合成前沿研究 孙阿强 (河南师范大学 化学化工学院,河南 新乡 453007) 摘 要:通过研究近年以来的手性合成—不对称合成及应用发现,手性合成前沿研究的领域不再局限于传统的从自然界 直接分离提取手性药物,而是与生物、药物、计算机等多学科交叉应用,达到手性合成的高效合成和分离应用。不对称合成应用在药物开发、医学等领域是当今手性合成前沿研究的热点。对手性合成—不对称合成研究领域进行探讨,介绍了手性药物的发展历程、研究价值、应用方向,并对手性药物的手性合成未来趋向做出了展望。关键词:不对称反应;手性合成;应用现代盐化工 Modern Salt and Chemical Industry
不对称合成综述
手性药物及其不对称催化合成的研究进展 【摘要】本文介绍了手性药物的重要性和类型;结合实例对不对称催化法合成 手性药物作简要概述,尤其是化学不对称催化技术,包括不对称催化氢化、羰基的不对称催化还原、不对称催化氧化、不对称环丙烷化、不对称催化羰基化及不对称催化加成反应等;展望了不对称催化反应在手性药物合成中的发展方向。 【关键词】手性药物;不对称催化反应;合成 手性是自然界的普遍特征。作为生命活动重要基础的生物大分子,如蛋白质、多糖、核酸和酶等几乎全是手性的。当今世界常用的化学药物中手性药物占据了超过60%的比例,它们的药理作用是通过与体内大分子之间严格手性匹配与分子识别实现的。近年来,世界手性药物的销售总额也在不断增加,据资料统计,1995年为425亿美元,1997年为900亿美元,2000年已超过1200亿美元[1],2010年可望超过2500亿美元。由于市场巨大,已经引起了学术界和工业界的极大重视,并在国际上兴起手性技术的热潮。 1 手性药物及其药理活性 在生命的产生和演变过程中,自然界往往对一种手性有所偏爱,如自然界存在的糖为D-构型,氨基酸为L-构型,蛋白质和DNA的螺旋构象又都是右旋的。所以,当手性药物、农药等化合物作用于这个不对称的生物界时,由于它们的分子的立体结构在生物体内引起不同的分子识别造成“手性识别”现象,两个异构体在人体内的药理活性、代谢过程及毒性往往存在显著的差异,具体可能存在以下几种情况[2]: 1. 1 一个对映体具有显著的活性,另一对映体活性很低或无此活性例如普萘洛尔(propranolol)的(-阻滞作用中,S-普萘洛尔的活性是其R-普萘洛尔的100倍以上。 1. 2 对映体之间有相同或相近的某一活性例如噻吗洛尔(timolol)两个对映体都具有降低眼压治疗青光眼的作用,其中S-噻吗洛尔为(-阻滞剂,用它制备滴眼液治疗青光眼时,曾引起支气管收缩,使有支气管哮喘史的患者致死,所以仅R-噻吗洛尔治疗青光眼是安全的。因此从全面平衡仍宜选用单一对映体。 1. 3 对映体活性相同,但程度有差异例如S-氯胺酮(ketamine)的麻醉镇痛作用是R-氯胺酮的1/3,但致幻作用较R型强。 1. 4 对映体具有不同性质的药理活性例如(2S,3R)-丙氧芬(右丙氧芬)是止痛药,(2R,3S)-丙氧芬(左丙氧芬)是镇咳药。 1. 5 一个对映体具有疗效,另一对映体产生副作用或毒性-个典型的例子是20世纪50年代末期发生在欧洲的“反应停”事件,孕妇因服用沙利度胺(俗称“反应停”)而导致海豹畸形儿的惨剧。后来研究发现,沙利度胺包含两种不同构型的光学异构体,(R)-对映体具有镇静作用,而(S)-对映体具有强致畸作用。 以前由于对此缺少认识,人类曾经有过惨痛的教训。因此,如何合成手性分子的单一光学异构体就成了化学研究领域的热门话题,同时也是化学家面临的巨大挑战。近年来各大制药公司正在研发的和已上市的药物中,以单一对映异构体上市或研究的药物分别占到相当大比例。由于手性药物市场前景看好,巴斯夫、陶氏化学、罗地亚等国际知名企业均成立了各自的手性中间体开发机构。但是我国手性药物工业与世界发展水平尚有较大差距。
