配位平衡和分裂能的测定
工业分析技术专业《配位解离平衡及影响因素教案》

工业分析技术专业《配位解离平衡及影响因素教案》教案章节:一、课程介绍1.1 课程背景1.2 课程目标1.3 课程内容1.4 教学方法二、配位解离平衡基本概念2.1 配位化合物2.2 配位解离平衡的定义2.3 配位离子和配位体2.4 配位键的形成与断裂三、配位解离平衡的原理3.1 配位解离平衡常数3.2 配位化合物的稳定性3.3 配位化合物的平衡转化3.4 影响配位解离平衡的因素四、影响配位解离平衡的因素4.1 配位原子和配位数的改变4.2 配位体和金属离子的电荷变化4.3 温度的影响4.4 配位化合物的浓度变化五、配位解离平衡在工业分析中的应用5.1 配位滴定法5.2 配位化合物在工业分析中的应用5.3 配位化合物的分析测定5.4 实际案例分析六、配位解离平衡的数学表达6.1 配位解离平衡常数表达式6.2 配位化合物稳定常数表达式6.3 配位滴定的反应方程式6.4 配位解离平衡的计算方法七、配位滴定法的基本原理7.1 配位滴定的定义7.2 配位滴定的基本步骤7.3 配位滴定的类型及特点7.4 配位滴定的应用范围八、配位滴定的操作技术8.1 滴定仪器的选用及操作8.2 标准溶液的制备及标定8.3 滴定终点判断及误差分析8.4 配位滴定的数据处理及结果表示九、影响配位滴定的因素9.1 滴定剂的选择及浓度9.2 指示剂的选择及滴定终点判断9.3 温度对配位滴定结果的影响9.4 反应时间对配位滴定结果的影响十、配位滴定在工业分析中的应用实例10.1 金属元素的测定10.2 络合物中金属离子含量的测定10.3 工业废水中有害金属离子的检测10.4 配位滴定在工业生产中的应用案例分析十一、配位化合物在工业分析中的应用11.1 概述配位化合物在工业分析中的重要性11.2 配位化合物在金属离子分析中的应用11.3 配位化合物在环境监测中的应用11.4 配位化合物在其他工业分析领域的应用十二、现代分析技术在配位解离平衡中的应用12.1 原子吸收光谱法在配位解离平衡中的应用12.2 原子发射光谱法在配位解离平衡中的应用12.3 质谱法在配位解离平衡中的应用12.4 X射线荧光光谱法在配位解离平衡中的应用十三、配位解离平衡实验操作指导13.1 实验目的与要求13.2 实验原理与步骤13.3 实验注意事项13.4 实验数据处理与分析十四、配位解离平衡实验案例分析14.1 实验案例一:配位化合物稳定性常数的测定14.2 实验案例二:配位滴定法测定金属离子含量14.3 实验案例三:络合滴定的应用14.4 实验案例四:配位化合物在环境监测中的应用十五、课程总结与展望15.1 课程主要内容回顾15.2 配位解离平衡在工业分析技术中的应用前景15.3 配位解离平衡领域的研究动态与发展趋势15.4 课程学习效果评估与反馈重点和难点解析本文教案主要涵盖了配位解离平衡及影响因素的内容,重点包括配位化合物的定义、配位解离平衡的原理、影响配位解离平衡的因素、配位滴定法的基本原理及操作技术、配位化合物在工业分析中的应用等。
第八 配位平衡

K
d
[Ag ][NH3]2 [Ag(NH3)2 ]
将上述平衡换过来, 即为该配离子的生成反应:
Ag+ + 2NH3
[Ag(NH3)2]+
K
f
[Ag(NH3)2 ] [Ag ][NH3]2
32
K
f
[Ag(NH3)2 ] [Ag ][NH3]2
Kf值越大,表示形成配离子的倾向越大,此 配合物越稳定。所以配离子的生成常数又称为
稳定常数。
K
f
[Ag(NH3)2 ] [Ag ][NH3]2
K
d
[Ag ][NH3]2 [Ag(NH3)2 ]
1 Kd
Kf
33
(3) 逐级稳定常数
对于平衡
Cu2+ + 4NH3 [Cu(NH3 )4 ]2+
实际上在[Cu(NH3)4]2+配离子中, 配离子并不是一下子就形 成的,而是逐步形成的,即有下列一系列平衡:
常数,用
表Kd示 。
29
配离子的不稳定常数是配离子的特征常数,因 此可以利用不稳定常数比较配离子在水溶液中的 稳定性。
例1: K不 稳[ Ag (CN )2 ] 1022 K不 稳[ Ag ( NH3 )2 ] 108
稳定性: [ Ag (CN )2 ] > [ Ag(NH3 )2 ]
30
含有配离子或配位分子的化合物统称为配合物。
3
二、配位化合物的组成
配合物在组成上一般包括内界和外界两部分。
中心体(离子原子)
内界 配合物
外界
配体(单齿或多齿配体)
4
二、配位化合物的组成
[Cu(NH3)4]SO4
无机化学教学资料——配合物及配位平衡

第 4 章配合物[ 教学要求]1 .掌握配位化合物的基本概念,组成,命名,分类。
2 .掌握配位化合物价键理论和晶体场理论的基本内容。
[ 教学重点]1 .配合物的异构问题2 .配合物的价键理论[ 教学难点]配合物的几何异构和对映异构[ 教学时数] 4 学时[ 主要内容]1 .配位化合物的基本概念:什么叫配合物,组成,命名。
2 .配合物的价键理论:配合物的立体结构和几何异构,配合物类型简介(简单配离子、螯合物、多核配合物)。
3 .晶体场理论要点:简介d 轨道的能级分裂和晶体场效应:八面体场的分裂、四面体场的分裂、平面四边形场的分裂;分裂能和影响分裂能的因素,稳定化能;晶体场理论对配合物性质的解释(颜色、磁性)。
[ 教学内容]4-1 配合物的基本概念“科学的发生和发展一开始就是由生产所决定的”。
配合物这门科学的诞生和发展,也是人类通长期过生产活动,逐渐地了解到某些自然现象和规律,加以总结发展的结果。
历史上有记载的最早发现的第一个配合物就是我们很熟悉的亚铁氰化铁Fe4[Fe(CN)6]3 ( 普鲁士蓝) 。
它是在1704 年普鲁士人狄斯巴赫在染料作坊中为寻找蓝色染料,而将兽皮、兽血同碳酸纳在铁锅中强烈地煮沸而得到的。
后经研究确定其化学式为Fe4[Fe(CN)6]3。
近代的配合物化学所以能迅速地发展也正是生产实际需要的推动结果。
如原子能、半导体、火箭等尖端工业生产中金属的分离楼术、新材料的制取和分析;50 年代开展的配位催比,以及60 年代蓬勃发展的生物无机化学等都对配位化学的发展起了促进作用。
目前配合物化学已成为无机化学中很活跃的一个领域。
今后配合物发展的特点是更加定向综合,它将广泛地渗透到有机化学、生物化学、分析化学以及物理化学、量子化学等领域中去。
如生物固氮的研究就是突出的一例。
4-1-1 配合物的定义当将过量的氨水加入硫酸铜溶液中,溶液逐渐变为深蓝色,用酒精处理后,还可以得到深蓝色的晶体,经分析证明为[Cu(NH3)4]SO4。
配合物和配位平衡

第4&12章配位平衡教学要求1、掌握配合物的基本概念和配位键的本质;2、掌握配合物价键理论的主要论点,并能用它解释一些实例;3、掌握配位平衡的稳定常数和不稳定常数的概念;4、了解逐级形成常数的概念,了解影响配合物在水溶液中稳定性的因素;5、掌握配位平衡的有关计算。
教学重点配合物的命名;配合物的空间构型、相对稳定性的价键理论解释;配合物稳定常数的相关计算。
教学难点高自旋和低自旋配合物,电中性原理(反馈配键);配合物稳定常数的相关计算。
教学时数6学时教学内容1、配合物的基本概念2、配合物的价键理论3、配合物的稳定常数4、影响配合物在溶液中的稳定性的因素5、配合物的性质教学方法与媒体讲解,ppt展示。
引言历史上有记载的最早发现的第一个配合物就是我们很熟悉的亚铁氰化铁Fe4[Fe(CN)6]3( 普鲁士蓝) 。
它是在1704 年普鲁士人狄斯巴赫在染料作坊中为寻找蓝色染料,而将兽皮、兽血同碳酸纳在铁锅中强烈地煮沸而得到的。
后经研究确定其化学式为Fe4[Fe(CN)6]3。
近代的配合物化学所以能迅速地发展也正是生产实际需要的推动结果。
如原子能、半导体、火箭等尖端工业生产中金属的分离楼术、新材料的制取和分析;50 年代开展的配位催比,以及60 年代蓬勃发展的生物无机化学等都对配位化学的发展起了促进作用。
目前配合物化学已成为无机化学中很活跃的一个领域。
今后配合物发展的特点是更加定向综合,它将广泛地渗透到有机化学、生物化学、分析化学以及物理化学、量子化学等领域中去。
如生物固氮的研究就是突出的一例。
配合物的应用范围广泛, 配位化学研究成果显著.冶金、分离分析、有机催化、染料、医药、生物化学、酶化学等一、配合物的基本概念1、配合物的定义⑴配合物的形成:实验演示CuSO4溶液+ BaCl2溶液→↓(白),示有SO42-。
CuSO4溶液+过量氨水+ BaCl2溶液→↓(白),示有SO42-。
CuSO4溶液+ NaOH溶液→↓(蓝),示有Cu2+。
无机化学 第十章 配位化学与配位平衡

四、价键理论的局限性
(1)不能解释d9电子构型的Cu2+为什么会有平面四边形的配合 物如[CuCl4]2-,如果采取dsp2杂化, Cu2+必须有一个未成对 电子从3d轨道激发到外层轨道上,这个电子能量升高,应使 配合物不稳定,这与事实相悖。
(2)不能解释过渡金属配合物的颜色问题。 (3)无法解释配离子的稳定性与中心离子电子构型之间的关系。
我们只讨论配位数是6的八面体场的晶体场。
10-4-1 中心原子d轨道在配位场中的分裂 ∙ 分裂能△ ∙ 光谱化学系列
在八面体型的配合 物中,6个配位体分别占 据八面体的6个顶点,由 此产生的静电场叫做八 面体场。八面体场中d 轨道与配体间的相互关 系如图所示:
配位场中,原来简并的5个d轨道发生分裂。dz2和dx2-y2 轨 道的电子云正好与配体相碰,受到配体带负电的孤对电子的排
o = 408 kJ·mol-1
[Ir(NH3)6] 3+
o = 490 kJ·mol-1
配体对 的影响(光谱化学序列)
对于相同的中心离子而言,分裂能因配位场的强弱不同而 异。对八面体场来说,不同配位体的场强顺序为:
I- < Br- < S2- < SCN- < Cl- < NO3- < F- < OH-< C2O42< H2O < NCS- < NH3 < en < bipy < NO2-< CN - < CO
↑↑↑↑↑
Fe3+
3d
4s
4p
4d
↑↑↑↑↑
[Fe(H2O)6]3+ sp3d2杂化,外轨型。
3. 利用磁矩判断配合物是内轨或外轨型
无机化学:Chapter 8配位平衡与配位
(2)组成
1.中心离子(centralion)或原子(亦称“形成体”)
配合物内界中,位于其结构的几 何中心的离子或原子。
构成 类型
①阳离子:Ag+、Pt2+、Fe2+、Al3+、Si4+
②阴离子:I-→[I(I2)]-,S2-→[S(S8)]2③中性原子:Fe、Ni
2.配位体(Ligand)
配合物内界之中,位于中心原子或离子
②设0.1molAgI完全溶于1LKCN溶液中,则有 竞争平衡:AgI + 2CN- [Ag(CN)2]- + I-
平衡时 c(CN-)= c-0.1× 2
0.1
0.1
同样可计算c(CN-)=2.58×10-4 mol·L-1,起始 KCN浓度为:c=0.1 ×2+ 2.58×10-4=0.2 mol·L-1, 即为完全溶解的最低起始浓度。
解:①设0.1molAgI完全溶于1L氨水,则有竞 争平衡:AgI + 2NH3 [Ag(NH3)2]+ + I-
平衡时 c-0.1× 2
0.1
0.1
K
j
c([ Ag (NH3 )2 ] ) c(I ) c2 (NH3 )
K sp,AgI
K
f
c-0.2=6.25 ×103(mol·L-1),c≈ 6.25 ×103(mol·L-1), 氨水不能达到如此浓度,故不能溶解。
反应后:
0.3-0. 1 ×2=0.1 0.1
2 ×0.1
平衡时: x 0.1+2x ≈0.1 0.1-x≈0.1 0.2-2x≈0.2
Kj
c(
Ag
)
c
2
第7章 配位化合物与配位平衡
(4) 杂化方式与空间构型有关
7.2.2 配合物的形成和空间构型
由于中心离子的杂化轨道具有一定的方向性, 所以配合物具有一定的空间构型:
(1)一般规律
①形成体在中间,配位体围绕中心离子排布 ②配位体倾向于尽可能远离,使配合物稳定(能量低)
例1. 二配位的配合物
第7章 配位化合物与配位平衡
7.1 配位化合物与螯合物 7.2 配位化合物的价键理论 7.3 配位平衡及其影响因素
7.4 配位滴定法
1
7.1 配位化合物与螯合物
7.1.1 配合物的组成
7.1.2 配合物的命名
7.1.3 螯合物
7.1.4 配合物的应用
7.1.1 配合物的组成
如:
[Ag(NH3)2]+ 配体数 内 界
d.若配位原子相同:则以较少原子数的配体排在前;
e.若配位原子及配体原子数相同:则按与配位原子相连的元 素符号的英文字母顺序排列;
如:[PtNH2NO2(NH3)2]氨基· 硝基· 二氨合铂(Ⅱ)
例:
CoCl(NH 3 )(en ) 2 SO 4
[CoCl(NH3)(en)2] 2+(配离子电荷数:+2) SO42-
例外:[PtCl6]2-是 内轨型
一般:在NH3 以前的配体容易形成内轨型配合物,在NH3 以后 的配体容易形成外轨型配合物,NH3 要看中心离子的情况而言。
一般规律 中心离子: 高价态或得电子能力强时:易形成内轨型配合物 (如Co3+、Ni3+), 低价态或得电子能力弱时:易形成外轨型配合物 (如Co2+、Ni2+ )。 配位体: 电负性大时:易形成外轨型配合物(如F、O); 电负性小时:易形成内轨型配合物(如C、P); 电负性中等时:取决于中心离子的结合电子的能力( 如N、S、Cl)。
014配合物及配位平衡
4、轨道能量的计算
(1)八面体场
eg轨道 的能量为E eg , t2g轨道的能量为E t2g
E eg - E t2g = 10 Dq = o
2E eg + 3E t2g = 0
(1)
(2)
解得:
E eg = 6 Dq
E t2g = - 4 Dq (记住)
30
( 2 ) 四面体场 实验测得: t = 4/9 o
t = 4.45 Dq E t2 - E e = t
2E e + 3E t2 = 0 解得: E t2 = 1.78 Dq
(1) (2)
E e = - 2.67 Dq (记住) ( 3 ) 正方形场: s = 17.42 Dq
CH 2 NH2 CH 2 CH 2 NH2
OH (NH 3 ) Co 4 OH
CH 2 NH2 CH NH2
2 2
Co (NH 3) Cl
2
] 2+
CH
2
CoCH 2
NH ) Cl
Co(NH 2
CH 2
CH ( NH2)
CH 3 ) Cl
2
2
7
2. 立体异构 (1)空间几何异构 表10-4 表10-5 (2)旋光异构(自学内容)
NH3 NH3 NH NH 3 NHNH NH NH3 NH3 NH NH 3 3 NH 3 3 3 3 3
3
sp3d 2杂化轨道
6个 键 6个 键
外轨型配合物,高自旋 µ = 3.87B.M. 八面体构型
18
Ni(NH3)62+: Ni2+: 3d8
4d 4p 4s 3d 8
sp 3d 2杂化 3d
无机化学:配位平衡
第三节 配合物的稳定性
[Cu(NH3)4]2+ = Cu2+ + 4NH3
反应平衡常数为
K
[Cu 2 ][NH3 ]4 [Cu(NH 3 )42 ]
K称为[Cu(NH3)4]2+的不稳定常数,用K不稳表示。
K不稳越大, [Cu(NH3)4]2+越容易离解,配离子越
不稳定。
K稳
1 K 不稳
第三节 配合物的稳定性
(二) 影响配合物稳定性的因素 (一)鳌合效应
(二)软硬酸碱理论 (自学) 1. 中心离子的影响 2. 配体的影响
第三节 配合物的稳定性
什么是螯合物? 中心离子与多齿配体 形成的配合物
一、螯合物的结构特点: 具有多元环状结构
二、螯合物的稳定性: 稳定常数比较
返回
第三节 配合物的稳定性 一、配体的分类
2.091013
x 4.81017 mol L1
[Cu 2 ] x 4.81017 mol L1
计算结果说明什么?
结论:配合物十分稳定,游离态的中心离子浓度很小。
返回
第三节 配合物的稳定性
K稳值越大,生成配离子的倾向越大,解 离的倾向越小。
稳定常数的大小直接反映了配离子稳定 性的大小。对于同一类型配合物,K稳值越 大,配合物越稳定。
1035
[Fe2
]
[Fe(CN )64 ] 1035[CN ]6
E
(Fe(CN
)63
/
Fe(CN
)64
)
E
(Fe3
/
Fe 2
)
0.059
log
[Fe3 [ Fe 2
] ]
0.77
中山大学无机化学第8章配位化合物与配位平衡习题及答案
第8章 配位化合物与配位平衡一、选择题8-1 下列配合物的命名不正确的是: ( ) (A) (B)(C)(D)答案: B8-2 下列离子都可以作为配合物的中心原子,但生成的配合物稳定性最差的是: ( ) (A) (B) (C) (D) 答案: D 8-3 的名称是: ( )(A) 三氯化一水二吡合铬(III ) (B) 一水合三氯化二吡合铬(III ) (C) 三氯一水二吡合铬(III ) (D) 一水二吡三氯合铬(III ) 答案: C8-4 下列哪种物质是顺磁性的: ( )(A)(B) (C)(D) 答案: B 8-5用溶液处理再结晶,可以取代化合物中的,但的含量不变,用过量处理该化合物,有氯含量的氯以沉淀析出,这种化合[]()3233K Co(NO )Cl III 三氯三硝基合钴酸钾[]()3233K Co(NO )Cl III 三硝基三氯合钴酸钾()()()2323Co OH NH Cl Cl III ⎡⎤⎣⎦氯化二氯一水三氨合铬[]()26H PtCl IV 六氯合铂酸3+Sc 3+Cr 3+Fe 3+La ()()232Cr py H O Cl ⎡⎤⎣⎦()234Zn NH +⎡⎤⎣⎦()336Co NH +⎡⎤⎣⎦[]4TiF ()336Cr NH +⎡⎤⎣⎦33CoCl 4NH ⋅24H SO 2-4SO -Cl 3NH 3AgNO 1/3AgCl物应该是: ( )(A)(B) (C)(D)答案: A 8-6 羰基合物的磁矩为零,它的空间构型为: ( )(A) 三角双锥形 (B) 四方形(C) 三角锥形 (D) 四方锥形 答案: A8-7 配离子的磁矩为: ( ) (A) 3.88(B) 2.83 (C) 5.0 (D) 0 答案: D8-8 配离子的稳定性与其配位键类型有关,根据价键理论,可以判断下列配合物稳定性的大小,指出正确的是: ( )(A)(B)(C) (D) 答案: B 8-9 化合物的磁矩为,而的磁矩为,对于这种差别可以用下列哪一项所叙述的理由来解释: ( )(A) 铁在这两种化合物中有不同的氧化数 (B) 氰离子比氟离子引起更多的轨道分裂 (C) 氟比碳、氮具有更大的电负性 (D) 氰离子是弱的电子授体 答案: B8-10 某金属中心离子形成配离子时,由于配体的不同,其电子分布可以有1个未成对电()324Co NH Cl Cl ⎡⎤⎣⎦()334Co NH Cl ⎡⎤⎣⎦()324Co NH Cl Cl ⎡⎤⎣⎦()334Co NH Cl ⎡⎤⎣⎦()5Fe CO ⎡⎤⎣⎦()32Cu NH +⎡⎤⎣⎦()B.M.()()33266Fe CN Fe H O -+⎡⎤⎡⎤<⎣⎦⎣⎦()()32266Fe CN Fe H O -+⎡⎤⎡⎤>⎣⎦⎣⎦()()322Ag CN Ag NH -+⎡⎤⎡⎤=⎣⎦⎣⎦()()322Ag CN Ag NH -+⎡⎤⎡⎤<⎣⎦⎣⎦[]36K FeF 5.9B.M.()36K Fe CN ⎡⎤⎣⎦2.4B.M.d d子,也可以有5个未成对电子,此中心离子是: ( ) (A) (B) (C) (D)答案: C8-11 根据晶体场理论,高自旋配合物的理论判据是: ( ) (A) 分裂能 > 成对能 (B) 电离能 > 成对能 (C) 分裂能 > 成键能 (D) 分裂能 < 成对能 答案: D8-12 某金属离子在八面体弱场中的磁矩为 4.9 B.M.,而它在八面体强场中的磁矩为零,该中心金属离子可能是: ( ) (A) (B) (C)(D) 答案: D二、计算题和问答题8-13 用晶体场理论判断配离子,,,(,Co(III) 的电子成对能)是高自旋还是低自旋,并计算配合物的磁矩以及晶体场稳定化能(CFSE )。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
配位平衡和分裂能的测定
实验目的:
1、学习配合物的生成和平衡的移动
2、测定分裂能,讨论光谱化学系列
实验原理
实验内容:
一、配合物的生成
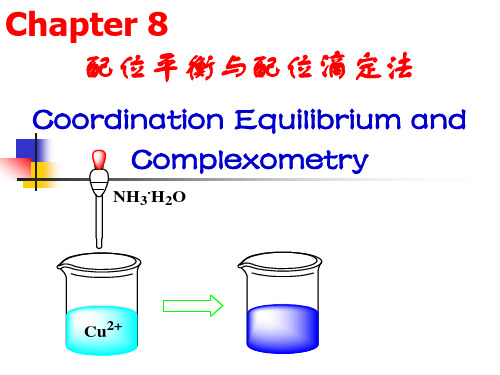
取一支试管,加入0.1mol∙dm-3CuSO4溶液1cm3,逐滴加入6mol∙dm-3NH3∙H2O,边加边振荡,开始时先生成浅蓝色Cu2(OH)2SO4沉淀,继续加入氨水,试管中的沉淀又溶解而生成深蓝色的Cu(NH3)42+溶液。
写出反应方程式。
在试管中再多加一些氨水[2],将此溶液分成三份,一份加入0.1mol∙dm-3BaCl2,一份加入0.1mol∙dm-3NaOH溶液,观察沉淀情况,另一份加少许无水乙醇,可看到蓝色硫酸四氨合铜的晶体。
取三支试管,加入少量0.1mol∙dm-3CuSO4溶液,一份加入0.1mol∙dm-3BaCl2,一份加入0.1mol∙dm-3NaOH溶液,观察沉淀情况,另一份加少许无水乙醇,观察现象,写出反应式。
根据上面实验结果,说明此配合物[Cu(NH3)4]SO4的内界和外界的组成。
二、配合平衡的移动
在一支25cm3试管中加入3滴0.1mol∙dm-3FeCl3溶液,然后加入3滴0.1mol∙dm-3KSCN溶液,加水10cm3冲稀后,将溶液分成三份:第一份加入0.1mol∙dm-3FeCl3溶液5滴,第二份加入0.1mol∙dm-3KSCN溶液5滴。
第三份留作比较,观察现象,比较实验结果,并解释之。
三、分裂能的测定:
1、铬(III)配合物溶液的配制和测定分裂能
(1)K3[Cr(C2O4)3]溶液的配制
在电子天平上称取0.02 gK3[Cr(C2O4)3]·3H2O晶体,溶于10 mL去离子水中。
(2)K[Cr(H2O)6](SO4)2溶液的配制
称取0.08 g硫酸铬钾,溶于10 mL去离子水中。
(3)[Cr(EDTA)]-溶液的配制
称取0.01 g EDTA溶于10 mL去离子水中,加热使其溶解,然后加入0.01 g 三氯化铬,稍加热,得到紫色的[Cr(EDTA)]-溶液。
2、测定配合物溶液的最大吸收波长
用720型分光光度计测定最大吸收曲线,确定最大吸收波长,计算分裂能。
实验条件:
360~720 nm波长范围内,以去离子水为参比液,测定上述配合物溶液的吸光度(A)
预习:配合物的组成、分光光度计的使用(参考邻二氮菲测定铁含量)。
