第4章 电位分析
仪器分析复习及自测

仪器分析复习及⾃测仪器分析复习资料各仪器分析⽅法的仪器组成、原理、定量分析⽅法、应⽤。
第⼀章引⾔⼀、仪器分析和化学分析⒈化学分析定义⒉仪器分析定义⒊两者的区别在于:①检测能⼒(灵敏度)②样品的需求量③分析效率(速度)④使⽤的⼴泛性(代价、分析种类)⑤精确度(误差)⼆、仪器分析⽅法的分类根据测量原理和信号特点,仪器分析⽅法⼤致分为四⼤类⒈光学分析法以电磁辐射为测量信号的分析⽅法,包括光谱法和⾮光谱法⒉电化学分析法依据物质在溶液中的电化学性质⽽建⽴的分析⽅法⒊⾊谱法以物质在两相间(流动相和固定相)中分配⽐的差异⽽进⾏分离和分析。
⒋其它仪器分析⽅法包括质谱法、热分析法、放射分析等。
三、仪器分析的发展概述⒈计算机技术在仪器分析中的⼴泛应⽤,实现了仪器操作和数据处理⾃动化。
⒉不同⽅法联⽤提⾼仪器分析的功能。
⒊各学科的互相渗透第⼆章⽓相⾊谱分析§2-1 ⽓相⾊谱法概述1、⾊谱法的产⽣和发展2、⾊谱法的优点和缺点(1)⾊谱法的优点分离效率⾼。
分析速度快。
检测灵敏度⾼。
样品⽤量少。
选择性好。
多组分同时分析。
易于⾃动化。
(2)⾊谱法的缺点定性能⼒较差。
3、⾊谱法的定义与分类4、⽓相⾊谱仪器⽓相⾊谱仪流程图:钢瓶、减压阀、稳压阀、(稳流阀)、进样器、⾊谱柱、检测器、记录仪。
5、基本参数基线:保留值:(1)死时间t M(2)保留时间t R(3)调整保留时间t?R= t R- t M(4)死体积V M=t M F0(5)保留体积V R=t R F0(6)调整保留体积V R?=t R‘F0 = V R - V M(7)相对保留值r21= t?R(2)/ t?R(1)(也可⽤α表⽰)区域宽度:(1)标准偏差(σ)0.607h,1/2W(2)半峰宽度(Y1/2)=2.35σ(3)峰底宽度(Y)=4σ§2-2 ⽓相⾊谱分析理论基础⽓-固⾊谱分析和⽓-液⾊谱分析的基本原理固定相:涂渍在惰性多孔固体基质(载体或担体)上的液体物质,常称固定液。
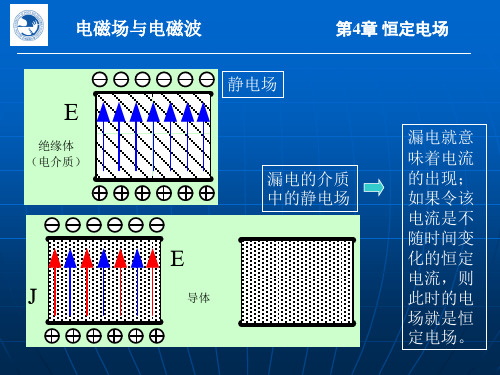
第4章 恒定电场
tg1 1 tg 2 2
tg1 1 tg1 1 tg 2 2 tg 2 2
例 习题 4.5 两层媒质的平板电 容器,要求各层的损耗相等,求 厚度的关系。
电磁场与电磁波
恒定电场与静电场的比拟
第4章 恒定电场
由于导电媒质内恒定电场的 基本方程与无电荷区域内电介质的静电场的基本方程在形 式上一样,边界条件也一致,故两种情况可以比拟。即可 以此一种情况的解导出另一种情况的解。
J ( E E' )
J Idl l ( E E ')dl l E 'dl l dl l S
Idl l E 'dl l S
任意时刻闭合回路中的总电动势与回路中各段电阻上的 总压降是相等的,即基尔霍夫电压定律。
电磁场与电磁波
恒定电场中的能量损耗
第4章 恒定电场
恒定电场中自由电子做定向运动形 成传导电流时,其运动过程中不断地与导体中的原子和离子 碰撞,把能量传递给原子和离子,使它们的热运动加剧,导 体温度升高,这种不可逆的能量转换被称为电流的热效应。 热效应给自由电子所带来的能量损失需要通过电源来补 偿,即电源通过恒定电场,由电场力对带电粒子做功来实现 这种能量的补偿。 dP dq E dl dI E dl J dS E dl dW F dl dq E dl dt
令漏电电流已知 I
J
p J E
P pdV
V
电磁场与电磁波
恒定电场的边界条件
第4章 恒定电场
1
1
J1
l E dl 0 J dS 0
仪器分析计算例题

第二章气相色谱分析例1:在一根90米长的毛细管色谱柱上测得各组分保留时间:正十四烷15.6min ;正十五烷21.95min ;正十六烷31.9min 。
计算色谱柱的死时间及载气平均速度。
解:方法一:同系物保留值之间存在以下关系:,11,r rn n n n=-+ ''''()(1)(1)()//R n R n R n R n t t t t -+=以()R M t t -代替'Rt 可推导出: 2(1)(1)()(1)()()(1)()()R n R n R n M R n R n R n R n t t t t t t t t -++--=---将正十四烷、正十五烷、正十六烷的保留时间代入公式:231.915.621.95min (31.921.95)(21.9515.6)M t ⨯-=--- 得4.40minM t = 载气的平均流速/Mu L t -=, 即90100/(4.4060)/34.09/u cm s cm s -=⨯⨯=方法二:直接用甲烷测定死时间。
即以甲烷的保留时间作为死时间。
例2:在一根2m 长的色谱柱上,A 、B 、C 、三组分的保留时间分别为2.42min 、3.21min 、5.54min ;峰宽分别为0.12min 、0.21min 、0.48min 。
另测得甲烷的保留时间为1.02min 。
求:(1)A 、B 、C 组分的调整保留时间;(2)A 与B 、B 与C 组分的相对保留时间; (3)A 、B 、C 组分的容量因子;(4)A 、B 、C 组分的有效塔板数和塔板高度; (5)A 与B 、B 与C 组分的分离度;解:(1)'(1)(1)R R M tt t =-'()()(2.42 1.02)min 1.40min R A R A M t t t =-=-= '()()(3.21 1.02)min 2.19min R B R B M tt t =-=-= '()()(5.54 1.02)min 4.52min R C R C M tt t =-=-=(2) ''2,1(2)(1)/R R r t t =, 2.19/1.40 1.56B A r ==, 4.52/2.19 2.06C B r ==(3) '1(1)/R M k t t ='()/ 1.40/1.02 1.37A R A M k t t === '()/ 2.19/1.02 2.15B R B M k t t === '()/ 4.52/1.02 4.43CR C M k t t ===(4)'216(),/R eff t n H L nw=='()22()1.416()16()2178,0.12R A eff A A tn w ===()/2100/21780.092A A eff A H L n cm ==⨯= '()22()2.1916()16()17400.21R B eff B B t n w ===()/2100/17400.115B B eff B H L n cm cm ==⨯= '()22()4.5216()16()14190.48R C eff C C t n w ===()/2100/14190.141C C eff C H L n cm ==⨯=(5)(2)(1)212()R R t t Rw w -=+()(),2()2(3.21 2.42)4.790.210.12R B R A A BB At t R w w -⨯-===++()(),2()2(5.54 3.21) 6.750.480.21R C R B B CC Bt t R w w -⨯-===++第三章 高效液相色谱分析例1:高效液相色谱法分离两个组分,色谱柱长30cm 。
仪器分析思考题2016分析

复习思考题第1章 绪论 了解一些基本概念第2章 色谱分析1、在气相色谱法中,用于定性的参数是什么?保留时间2、简要说明气相色谱分析的基本原理3、衡量色谱柱柱效能的指标是什么?用有效塔板数n 和有效塔板高度H 作为衡量柱效能的指标。
4. 在液相色谱中,范第姆特方程式中的哪一项对柱效的影响可以忽略不计?在液相色谱中,流动相为液体,组分的纵向扩散系数B 很小,流速 u 较高,故纵向扩散相B/u 可忽略不计。
Van Deemter 方程在HPLC 的表现形式: H=A+Cu5.为什么可用分离度R 作为色谱柱的总分离效能指标?分离度同时体现了选择性与柱效能,即热力学因素和动力学因素,将实现分离的可能性和现实性结合起来。
6、气相色谱分析中,理论塔板高度与载气线速u 间的关系? 随u 的增加而出现一个最小值。
7、气相色谱法使用的热导池检测器,产生信号的原理,是利用组分与流动相之间的什么性质?热导系数不同。
8、用角鲨烷分离甲烷、乙烷、丙烷时,它们从色谱柱中流出的顺序。
甲烷、乙烷、丙烷。
9、分配比表示物质在两相中的什么之比。
有机相中被萃取物的总浓度与水相中被萃取物的总浓度之比10、范第姆特方程式可以说明的哪些方面。
它可以说明填充均匀程度、担体粒度、载气种类、载气流速、柱温、固定相液膜厚度等对柱效、峰扩张的影响。
11、如果试样比较复杂,相邻两峰间距离太近或操作条件不易控制稳定,要准确测量保留值有一定困难的,可以采取什么方法。
用加入已知物以增加峰高的办法进行定性。
12、在色谱柱中,若某组分分配到固定相中的量为m s (单位:g),浓度为c s (g ⋅mL -1),分配到流动相中的量为m L (单位:g)浓度为c L (单位:g ⋅mol -1),则该组分的分配比k 是多少。
c s /c L13.理论塔板数n 的计算式为_________ 22211654.5⎪⎪⎭⎫ ⎝⎛=⎪⎪⎪⎭⎫⎝⎛=b R RW t b t n ____________________。
电位分析法的基本原理

电位分析仪的基本原理电位分析法是电化学分析法的一种。
电化学分析法是仪器分析法的一个重要组成部分.它是根据溶液中物质的电化学性质及其变化规律,通过在电位、电导、电流和电量竿电学量与被测物质的某些量之间建止计量关系,对被测组分进行定性和定量的仪器分析方法。
1.电化学分析法的分类电化学分析法—般可以分为以F二类。
第一炎是根据试液的浓度在特定实验条件下与化学电池中的某一心参数之间的义系求得分析结果的方法。
这是电化学分析法的主要类型。
电导分析法、库仑分析法、电位分析法、伏文法和极诺分析法等均属于这种类型。
第二类是利用电参数的突变来指示容量分析终点的方法。
这类力法仍以容量分析为基础,根据所用标准溶液的浓度和消耗的体积求出分析结果。
这类方法根据所测定的电参数的不同.分为电才滴定法、电位滴定法和电流摘定法。
第二类是电重量法,或称电解分析法。
这类方法通过在试液中通人直流电流,位被测组分在电极JI:还原沉积祈比,与共存组分分离,然后再对电极上的析出物进行重量分析以求出被测组分的含量。
2.电化学分析法的特点电化学分析法的灵敏度和准确度都很高,适用面也很广泛。
由于征测定过程中得到的是IU学信号,因而易于实现自动化和连续分析。
电化学分析法齐化学研究中也具有十分重要的作用,现已广泛应用于电化学基础理论、有机化学、药物化学、生物化学、临床化学等许多领域的研究中。
总之,屯化学分析法对成分分析(定性教定量分析)、生产过程控制和科学研究等许多方面部且花很重要的意义。
3.电位分析法的特点电伦分析法是电化学分析法的一个重要分支,它的实质是通过在罕电流条件下测定两电极间的电伦差(即所构成原电他的电动势)进行分析测定。
电位分析法包括直接电位法和电位滴定法,本章将对这两种方法进行详细介绍。
电位分析法具有如下特点(1)设备简单、操作方便tr即可,操作起来也非常方便至三二旦坚29鱼LJl—(2)方法多、应用范围广直接电位法中可采用标准曲线法、一次标准加入法和格氏作图法等进行测定;电位滴定法也可根据灾际情况灵活选择滴定方式和滴定剂。
材料腐蚀与防护-第四章-电化学腐蚀动力学

• 分类:表观极化曲线和理想极化曲线。 • *理想极化曲线----以单电极反应的平衡电位作为起始 电位的极化曲线。 • *表观极化曲线或实测极化曲线---- 由实验测得的腐蚀 电位与外加电流之间关系曲线。 • • 注意:表观极化曲线的起始电位只能是腐蚀电位而不 是平衡电极电位。
在金属腐蚀与防护研究中,测定金属电极表观极化曲线是 常用的一种研究方法。
第一节 第二节 第三节 第四节
本章主要内容 极化现象 极化 去极化 腐蚀极化图
第一节 极化
• 问题:因为具有很大腐蚀倾向的金属不一定必然对应着高 的腐蚀速度。 如:Al的平衡电极电位很负,从热力学上看它的腐蚀倾向很 大,但在某些介质中铝却比一些腐蚀倾向小的金属更耐蚀 。 • 因此,认识电化学腐蚀动力学规律及其影响,在工程上具 有更现实的意义。
2.2 去极化的方法: • 在溶液中增加去极剂(H+、O2-等)的浓度、升温、搅拌 以及其他降低活化过电压的措施,都将增强阴极去极化作 用; • 在溶液中加入络合物或者沉淀剂,它们会与金属离子形成 难溶的络合物或沉淀物,不仅可以使金属表面附近溶液中 的金属离子浓度降低,并能一定程度地减弱阳极极化作用 。 • 在溶液中升温、搅拌等均会加快金属离子进入溶液的速度 ,从而减弱阳极极化作用。 • 如果在溶液中加入某些活性阴离子,就有可能使已经钝化 的金属重新处于活化状态。
2)确定金属的腐蚀速度 • 利用极化曲线外延法求自腐蚀电流Icorr ,一种电化学技术 确定金属腐蚀速度的方法之一。
3.3 腐蚀速度计算及耐蚀评价
• 1)腐蚀速度计算 • 用腐蚀电池的腐蚀电流表征 • 电化学腐蚀过程严格遵守电当量关系。即一个一价的金属 离子在阳极区进入溶液,必定有一个一价的阴离子在阴极 获得一个电子;一个二价的金属的金属离子在阳极区进入 溶液,也必然有一个二价或两个一价的阴离子或中性分子 在阴极取走两个电子,如此类推。 • 金属溶解的数量与电量的关系遵循法拉第定律,即电极上 溶解(或析出)1mol的物质所需的电量为96500c,因此, 已知腐蚀电流或电流密度就能计算出所溶解(或析出)物 质的数量。
电位分析法
EK
2.303RT nF
lg ai
二、直接电位法测定离子活度(浓度)
的原理和方法
• 25C 时,上式简化为:
•
E=K±0.059lgai
• 式中ai ----为待测离子的活度
•
K-----为与测量条件和测量装置
有关的常数。
• 离子选择性电极作正极时,对阳离子响 应的电极,取正号;对阴离子响应的电 极,取负号。
• 对于pH值已知的标准缓冲溶液S
ES
KS'
2.303RT F
pHS
• 对pH值待测的试液X
EX
KX'
2.303RT F
pHX
(二)溶液pH值的测定方法—pH标度法
• 因为测定条件完全一致,
•则
Ks′=K x′, 两式相减得:
pHX
pHS
EX ES 2.303RT /
F
(2-8)
• 25℃ 时, 式(2-8)可简化为:
加入适当的pH缓冲剂和消除干扰 的掩蔽剂。 • 这种混合溶液称为总离子强度调 节缓冲液(简称TISAB)。
(二)总离子强度调节缓冲液
• 例如,如测 F- 离子所使用的TISAB典型 组成为:
• 1mol/L的NaCl,使溶液保持ol/L的NaAc, 使溶液pH在5左右;
斜率调节钮; • 11-功能选择键; 12-温度补偿钮;13-数字显示窗;14-电极接线座
(四)测量仪器及使用方法
• 图中,参比电极和指示电极的引线端通 过仪器背面电极接线座上相应的接线柱 与仪器连接。
• 接线座上还有调零电位器,用于仪器置 零,方法是:在仪器接通电源后、电极 插入前,若仪器显示不为零,则可通过 此调节钮,使仪器显示为零,调零后应 锁紧此电位器。
电位分析法
被测物质的最低量可以达到 10 mol/L 数量级。
第一章 电位分析法第 一节 基本原理1、电化学分析概述根据物质在溶液中的电化学性质及其变化来进行分析的方法。
它是 以电导、电位、电流和电量等电参量与被测物之间的关系做为计量的基 础。
依据物质电化学性质来测定物质组成及含量的分析方法称为电化学 分析或电分析化学。
它通常是使待分析的试样溶液构成一化学电池(原电池或电解池), 然后根据所组成电池的某些电物理量(如两电极间的电位差,通过电解 池的电流或电量,电解质溶液的电阻等)与其化学量之间的内在联系来 进行测定。
电化学分析法的特点:(1)灵敏度、准确度高,选择性好-12(2)电化学仪器装置较为简单,操作方便直接得到电信号,易传递,尤其适合于化工生产中的自动控制和在线分析。
(3)应用广泛传统电化学分析:无机离子的分析; 测定有机化合物也日益广泛; 有机电化学分析;药物分析;电化学分析在药物分析中也有较多应用。
活体分析。
根据所量的电参量的不同,电分析化学方法可分为三类:第一类:在某些特定条件下,通过待试液的浓度与化学电池中某些电参量的关系进行定量分析,如电导、电位、库仑极谱及伏 安分析第二类:通过某一电参量的变化来指示终点的电容量分析好电位滴定第三类:通过电极反应把被测物质,转变为金属或其它形式的搓化物,用重量法测定基会量。
2、电化学电池2.1原电池能自发的将本身的化学能变成电能,这种化学电池称为原电池。
以铜锌原电池为例锌电极、负极(阳极):Z n→Z n2++2e氧化反应铜电极、正极(阴极):C u2++2e→C u还原反应2.2电解池实现某种电化学反应的能量由外电源供给则这种化学电池称为电解池仍以铜电极和锌电极为例。
锌电极、负极(阴极):Z n2++2e→Z n还原反应铜电极、正极(阳极):C u→C u2++2e氧化反应应注意:阳极、阴极是对实际发生的反应而言,阳极发生氧化反应,阴极发生还原反应;正极、负极是对电荷的流向而言,电子流出为负极,电子流入为正极。
仪器分析-电化学分析法
银-氯化银电极:
银丝镀上一层AgCl沉淀,浸在一定浓度 的KCl溶液中即构成了银-氯化银电极。 电极反应:AgCl + e- = Ag + Cl半电池符号:Ag,AgCl(固)︱KCl 电极电位(25℃):
O EAgCl/Ag EAgCl/Ag 0.059lg aCl
表 银-氯化银电极的电极电位(25℃)
流动载体电极(electrodes with a mobile carrier)
敏化电极(sensitized electrodes) 气敏电极(gas sensing electrodes)
酶电极(enzyme electrodes)
4 离子选择性电极的结构与原理
组成:敏感膜,内参比电极、内参比溶液 (敏感膜:单晶、混晶、液膜、功能膜及生物膜等) 特点:仅对溶液中特定离子有选择性响应。 测定依据: 膜电位:膜内外被测离子活度的不同而产生电位差 使用方法及原理 将膜电极和参比电极一起插到被测溶液中,组成电池:
3 离子选择性电极的种类
Type , principle and structure of ion selective electrode (ISE) 离子选择性电极(又称膜电极)。
1976年IUPAC基于膜的特征,推荐将其分为以下几类: 原电极(primary electrodes) 晶体膜电极(crystalline membrane electrodes) 均相膜电极(homogeneous membrane electrodes) 非均相膜电极(heterogeneous membrane electrodes) 非晶体膜电极(crystalline membrane electrodes) 刚性基质电极(rigid matrix electrodes)
仪器分析重点
- 1 -仪器分析复习讲义第二章仪器分析:灵敏度高,但准确度低。
化学分析:准确度高,但灵敏度低。
1906年俄国植物学家茨维特首先提出。
主要按流动相状态不同分气相色谱和液相色谱气相色谱仪一般由五部分构成:载气系统、进样系统、分离系统、检测系统、记录系统。
温度控制(气化室、色谱柱、检测器) r 21代表固定相选择性。
只与组分、柱温和固定相有关。
r 21越大,分离越好。
r 21 =1,不能分离。
气固色谱分离原理:根据试样中各组分在固体吸附剂上被吸附能力的不同而进行分离。
当试样随载气进入色谱柱后,试样中各组分经历一系列的“吸附——脱附——再吸附——再脱附”被吸附能力大的组分,不易脱附,移动慢,在色谱柱中滞留时间长,峰靠后;不易被吸附的组分,易脱附,移动快,在色谱柱中滞留时间短,峰靠前;经过一段时间先后流出色谱柱彼此得以分离。
气液色谱分离原理:根据试样中各组分在固定液中溶解能力的不同而进行分离。
当试样随载气进入色谱柱后,试样中各组分经历一系列的“溶解——挥发——再溶解——再挥发”的过程。
溶解度大的难挥发,移动慢,在色谱柱中滞留时间长,峰靠后;溶解度小的组分,易挥发,移动快,在色谱柱中滞留时间短,峰靠前;经过一段时间先后流出色谱柱彼此得以分离。
配系数K :在一定温度下,组分在两相间分配达到平衡时的浓度(单位:g/mL )比,称为分配系数,用K 表示,即: 分配系数是色谱分离的依据K 值大小受组分和两相性质影响,还与温度、压力有关,还与相比有关。
分配比k (容量因子):在一定温度、压力下,组分在两相间分配达到平衡时的质量比。
β—相比V M 为柱内流动相体积(死体积),V S 为固定相体积 分配比与保留时间的关系 两种色谱理论:塔板理论和速率理论。
真正衡量柱效能的指标:有效塔板数n 有效或有效塔板高度H 有效。
速率方程(也称范第姆特方程式): H = A + B/u + C •u 使用粒度细和颗粒均匀的担体,并尽量填充均匀,是减少涡流扩散,提高柱效的有效途径。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
膜 = K - 0.059lgaF- = K+0.059pF
具有较高的选择性,需要在pH5~7之间使用, pH高时,溶液中的OH-与氟化镧晶体膜中的F-交换, pH较低时,溶液中的F -生成HF或HF2 - 。
硫化银膜电极
离子接触型
全固态型
硫化银膜具有离子传导及电子传导的能力,晶体中 可移动的离子是Ag+, 故膜电位对Ag+敏感。 测量体系中存在这如下平衡:
玻璃 = AgCl / Ag + 膜
3. 不对称电势:如果内参比溶液与试样溶液中的H+ 活度相同,即1= 2,则理论上膜=0,但实际上膜 ≠0(由于玻璃膜内、外表面含钠量、表面张力以及 机械和化学损伤的细微差异所引起的)。将此时仍存 在的电势称之为不对称电势。
当玻璃膜电极经过长时间浸泡后(24h),不 对称电势可以达到最小且恒定(1~30mV),可以 将其合并到公式中的K´项中;
2 Ag S
2
Ag2 S
一定条件下,可用硫化银电极测定氰离子,此时需 加入少量银氰络离子使其浓度在10-5~10-6mol/l ,溶液中 有如下平衡:
Ag(CN ) Ag 2CN K稳
2
Ag (CN )
2
2 Ag * CN
K稳很大 ,故:
Ag
用水浸泡玻璃膜时,玻璃表面的Na+与水中的H+交换, 在表面形成一层水合硅胶层 。当组成一定时 ,玻璃电极功能 的好坏主要取决于它的表面性质。 玻璃电极使用前,必须在水溶液中浸泡,使之生成一个三 层结构,即中间的干玻璃层和两边的水化硅胶层。 浸泡后的玻璃膜示意图:
水化硅胶层的化学性质和电性质不同于干玻璃层和溶液, 具有界面,构成单独的一相,厚度一般为0.01~10μm。
温度校正,对于SCE,t ℃时的电极电势为:
t= 0.2438- 7.6×10(t-25) (V)
银-氯化银电极:
银丝镀上一层AgCl沉淀,浸在一定 浓度的KCl溶液中即构成了银-氯化银电极。 电极反应:AgCl + e- == Ag + Cl半电池符号:Ag,AgCl(固)KCl 电极电势(25℃): AgCl/Ag = AgCl/Ag - 0.059lgCl表4-3
7. 缺点: 电极内阻很高,电阻随温度变化。
※
“碱差”或“钠差” pH>12产生误差,主要是Na+参 与相界面上的交换所致; 改变玻璃膜的组成,可制成对其它阳离子响应的玻 璃膜电极)
晶体膜电极
结构:(氟电极) 敏感膜:(氟化镧单晶) 掺有EuF2的LaF3单晶切片 内参比电极: 管内的Ag-AgCl电极。 内参比溶液: 0.1mol/L的NaCl和0.1~0.01mol/L的NaF混合溶液 (F-用来控制膜内表面的电势,Cl-用以固定内参比电 极的电势)。
内 = k1 + 0.059 lg (a2/a'2) 外 = k2 + 0.059 lg (a1/a'1)
说明:
1. 玻璃膜电极之所以能够测量溶液的pH是因为玻璃膜 电势与试样溶液中的pH成线性关系。式中K´是由玻璃 膜电极本身性质决定的常数; 2. 电极电势应是内参比电极电势和玻璃膜电势和:
电位分析法
利用电极电位与化学电池电解质溶液中某种组分 浓度的对应关系而实现定量测量的电化学分析法
电位分析法特点
(1)准确度高,重现性和稳定性好 (2)灵敏度高,10-4~10-8mol· -1 L 10-10 ~10-12 mol· -1(极谱,伏安) L (3)选择性好(排除干扰) (4)应用广泛(常量、微量和痕量分析) (5)仪器设备简单,易于实现自动化
第4章 电位分析
4-1 概述
电分析化学法
应用电化学的基本原理和实验技术,依据物质 的电化学性质来测定物质组成及含量的分析方法称之 为电化学分析或电分析化学。
电分析化学的特点
灵敏度、准确度高,选择性好,应用广泛。被测 物质的最低量可以达到10-12mol﹒L-1数量级。 电化学仪器装臵较为简单,操作方便,尤其适合于 化工生产中的自动控制和在线分析。 电分析化学分为电位分析法、库伦分析法、极谱 分析法、电导分析法及电解分析法
基准:电势值为零(任何温度) 电极反应: H2 + 2e- = 2H+
甘汞电极
电极反应: Hg2Cl2 + 2e- = 2Hg + 2 Cl半电池符号:Hg,Hg2Cl2(固)KCl
★ 电极内溶 液的Cl-活度一 定,甘汞电极电 势固定。
电极电势:(25℃)
表4-2甘汞电极的电极电势( 25℃)
0.1mol/L 甘汞电极 KCl 浓度 电极电位(V) 0.1 mol / L +0.3365 标准甘汞电极(NCE) 1.0 mol / L +0.2828 饱和甘汞电极(SCE) 饱和溶液 +0.2438
敏化电极
敏化电极是指气敏电极、酶电极、细菌电极及生 物电极等。这类电极的结构特点是在原电极上覆盖一 层膜或物质,使得电极的选择性提高。
4、气敏电极
气敏电极是基于界面化学反
应的敏化电极,实际上是一种化学 电池,由一对电极(指示电极和参 比电极)组成,具有代表性的是氨 敏电极,结构如右图。
原理:
LaF3的晶格中有空穴,在晶格上的F-可以移入晶格邻近的 空穴而导电,对于一定的晶体膜,离子的大小、形状和电荷决 定其是否能够进入晶体膜内,故膜电极一般都具有较高的离子 选性。 当氟电极插入到含有F- 的溶液中时,F-在晶体膜表面进行 交换,如果溶液中的F- 活度较高,则溶液中的F- 进入晶体。反 之,晶体表面的F- 进入溶液。由此产生的膜电势与溶液中的F活度的关系,在一定范围内可以用能斯特方程来表示。 25℃时:
a1、a2---分别表示外部试液和电极内参比溶液的H+活度 a'1、a'2---分别表示玻璃膜外、内水合硅胶层表面的H+活度 k1、k2 ---是由玻璃膜外、内表面性质决定的常数 由于玻璃膜内、外表面的性质基本相同 则: k1 = k2 , a'1 = a'2 膜 = 外 - 内 = 0.059lg(a1 /a2) 由于内参比溶液中的H+活度(a2)是固定的,则: 膜 = K´+0.059lga1 = K´- 0.059pH试液
在水化层,玻璃上的Li+ 或Na+ 与H+ 发生离子交换 而产生相界电势。
水化层表面可视作阳离子交换剂。溶液中H+ 经水 化层扩散至干玻璃层,干玻璃层的阳离子向外扩散以 补偿溶出的离子,离子的相对移动产生扩散电势。
两者之和构成膜电势,可以用能斯特方程式来描述。 将浸泡后的玻璃膜电极放入待测溶液,则由于水 合硅胶层表面与溶液中的H+活度不同,形成活度差, H+由活度大的一方向活度小的一方迁移, 达到平衡: H+溶液== H+硅胶
例如: Ag-AgCl
★二个相界面,常用作参比电极
第三类电极──汞电极 金属汞(或汞齐丝)浸入含有少量Hg2+ - EDTA配 合物及被测金属离子的溶液中所组成。根据溶液中同 时存在的Hg2+和Mn+与EDTA间的两个配位平衡,可以 导出以下关系式: (Hg22+/Hg ) = (Hg22+/Hg ) - 0.059lgaM n+
(敏感膜)
内外参比电极的电势值固定,
且内充溶液中离子的活度也一定,
则电池电动势为:
玻璃膜电极(非晶体膜电极) H+响应的玻璃膜电极: 敏感膜是在SiO2基质中加入 Na2O、Li2O和CaO烧结而成的特 殊玻璃膜。厚度约为0.05mm,内 装pH一定的缓冲溶液(内参比溶 液),内插Ag-AgCl电极作为内参 比电极。 SiO2 呈四面体聚合的“大分子”即石英晶体结构 。当加入Na2O时,某些硅氧键断裂,出现离子键: O3SiO· · · + · ·Na
Ag (CN )
K *
2
2 CN
常数 *
1
2 CN
可用硫化银电极测CN-变化时Ag+活度的变化。 与此类似的有用于测定卤素的卤化银-硫化银电极。
流动载体膜电极(液膜电极) 钙电极:内参比电极为Ag-AgCl电极,内参比溶液为
0.1mol/L CaCl水溶液。内外管之间装的是0.1mol/L二癸基磷 酸钙的苯基磷酸二辛酯溶液。二癸基磷酸钙为液体离子交换剂, 其极易扩散进入微孔膜,但不溶于水,故不能进入试液溶液, 但二癸基磷酸根可以在液膜 试液两相界面间来回迁 移,传递钙离子,直至 达到平衡。由于Ca2+ 在水相(试液和内参比 溶液)中的活度与有机 相中的活度差异,在两 相之间产生相界电势。 钙电极适宜的pH范围是 5~11,可测出10-5 mol/L的Ca2+
KCl 浓度 电极电位(V)
银-氯化银电极的电极3;0.2223 饱和 Ag-AgCl 电极 饱和溶液 +0.2000
) 0.1mol/LAg-AgCl 电极
0.1 mol / L +0.2880
温度校正,(标准Ag-AgCl电极),t ℃时的电极 电势为:t= 0.2223- 6×10-4(t-25) (V)
惰性金属电极 一般由惰性材料如铂、金或石墨,即如含有均 相合可逆的同一元素的两种不同氧化钛的离子溶液 中组成。
这类电极不参与反应,但其晶格间的自由电子 可与溶液进行交换.故惰性金属电极可作为溶液中氧 化态和还原态获得电子或释放电子的场所。
膜电极-离子选择电极 通过电极上的薄膜对各种离子有选择性的电位 响应作为指示电极的。 离子选择电极的分类:
4. 高选择性: 膜电位的产生不是电子的得失。其它离子不能 进入晶格产生交换。当溶液中Na+浓度比H+浓度高 1015倍时,两者才产生相同的电势
