钠钙硅玻璃的组成
钠钙硅酸盐玻璃中钠离子的扩散活化能

钠钙硅酸盐玻璃是一种常见的玻璃材料,其性能受到钠离子扩散的影响。
钠离子的扩散活化能是指在玻璃内部,钠离子从一个位置迁移到另一个位置所需的能量。
了解钠离子的扩散活化能对于理解玻璃的性能和特性非常重要。
1. 钠钙硅酸盐玻璃中钠离子扩散活化能的基本概念钠钙硅酸盐玻璃是一种无机非晶固体材料,具有优良的化学稳定性和机械性能。
在这种玻璃中,钠离子的扩散活化能是指钠离子在固体网络结构中移动时需要克服的能垒。
这个能垒来自于玻璃结构中钠离子周围的其他离子和原子对其运动的阻碍,是影响钠离子扩散速率的重要因素。
2. 钠离子扩散活化能的影响因素钠离子扩散活化能的大小受到多种因素的影响。
玻璃的化学成分会直接影响钠离子扩散的活化能,比如玻璃中氧离子和硅离子的排列方式会对钠离子的扩散产生影响。
温度是一个重要的因素,一般情况下,随着温度的升高,钠离子的活化能会减小,从而提高钠离子的扩散速率。
外加电场、压力等外部条件也会对钠离子扩散活化能产生一定影响。
3. 钠离子扩散活化能的测定方法研究人员通过多种方法来测定钠离子在玻璃中的扩散活化能。
常用的方法包括电动势法、放射性示踪法、中子散射法等。
这些方法可以通过测定钠离子在玻璃中的扩散速率和与温度的关系来间接获得钠离子扩散活化能的数据。
4. 个人观点和理解钠离子的扩散活化能对于玻璃的性能影响非常大,它不仅决定了玻璃的结晶速率和稳定性,也直接关系到玻璃制品的质量和使用寿命。
在实际应用中,通过控制玻璃的化学成分和制备工艺来调控钠离子的扩散活化能,是提高玻璃品质和开发新型玻璃材料的重要途径。
总结:钠钙硅酸盐玻璃中钠离子的扩散活化能是一个重要的材料性能参数。
了解其影响因素和测定方法,有助于我们深入理解玻璃材料的特性和应用。
在今后的研究和生产中,应该加强对钠离子扩散活化能的研究,为开发高性能玻璃材料提供科学依据。
通过以上内容,我尝试从简单介绍到深入探讨钠离子扩散活化能的影响因素和测定方法,并在个人观点中提及了主题文字。
玻璃的主要化学成分

玻璃的主要化学成分玻璃是人类使用的最古老的合成材料之一,那它有什么化学成分呢?以下是本人要与大家分享的:玻璃的主要化学成分,供大家参考!玻璃的主要化学成分一玻璃的主要化学成分是二氧化硅及氧化铝、氧化钙、氧化镁、氧化钠、氧化钾,其作用如下:1、二氧化硅为形成玻璃的主要组分,并使玻璃具有一系列优良性能,如透明度、机械强度、化学稳定性和热稳定性等。
缺点是其熔点高、熔液粘度大,造成熔化困难、热耗大,故生产玻璃时还需加入其他成分以改善这方面的状态。
2、玻璃原料中加入少量氧化铝,能够降低玻璃的析晶倾向,提高化学稳定性和机械强度,改善热稳定性,但当其含量过多时(Al2O3>5%),就会增高玻璃液的黏度,使熔化和澄清发生困难,反而增加析晶倾向,并易使玻璃原板上出现波筋等缺陷。
3、加入适量氧化钙,能降低玻璃液的高温黏度,促进玻璃液的熔化和澄清。
温度降低时,能增加玻璃液黏度,有利于提高引上速度。
缺点是含量增高时,会增加玻璃的析晶倾向,减少玻璃的热稳定性,提高退火温度。
4、氧化镁其作用与氧化钙类似,但没有氧化钙增加玻璃析晶倾向的缺点,因此可用适量氧化镁代替氧化钙。
但过量则会出现透辉石结晶,提高退火温度,降低玻璃对水的稳定性。
5、氧化钠、氧化钾为良好的助溶剂,降低玻璃液的年度,促进玻璃液的熔化和澄清,还能大大降低玻璃的析晶倾向,缺点则是会降低玻璃的化学稳定性和机械强度。
由于二氧化硅、氧化铝、氧化钙、氧化镁、氧化钠、氧化钾具有以上一些特点,故在中国玻璃工业中一般大致控制在下列含量范围:SiO2 70%~%,Al2O3 1%~2.5%,CaO 8%~10%,MgO 1.5%~4.5%,(Na2O+K2O)13%~15%。
此外,玻璃原料中常含有少量三氧化二铁、氧化铁、三氧化二铬等有害成分,其作用如下:a、三氧化二铁能使玻璃着色,降低玻璃的透明度、透紫外线性能、透热性和机械强度,造成熔化澄清困难,并给玻璃的熔制品带来不良影响。
玻璃的成分及使用的原料

1.玻璃的成分成分SiO2 Al2O3 CaO MgO Na2O K2O Fe2O3 含量72%1~3%8%4%14%少量0.1~0.3%作用构成网络,形成玻璃改善玻璃化学性能,提高其化学稳定性2.原料玻璃原料通常分为主要原料和辅助原料主要原料:(1)引入SiO2的原料SiO2 Al2O3 Fe2O3 CaO MgO R2O 硅砂90~98%1~5%0.1~0.2%0.1~1%0~0.2%1~3%砂岩95~99%0.3~0.5%0.1~0.3%0.05~0.1%0.1~0.15%0.2~1.5%(2)引入Al2O3的原料SiO2 Al2O3 Fe2O3 CaO MgO R2O 长石55~65%18~21%0.15~0.4%0.15~0.8%—13~16%高岭土40~60%30~40%0.15~0.45%0.15~0.8%0.05~0.5%0.1~1.35%(3)引入Na2O的原料纯碱(Na2CO3)质量要求:Na2CO3>98%;NaCl<0.1%;Fe2O3<0.1%生硝(Na2SO4)质量要求:Na2SO4>85%;CaSO4<4%;Fe2O3<0.3%;H2O<5%(4)引入CaO的原料:主要有石灰石、方解石质量要求:CaO ≥50%;Fe2O3<0.15%(5)引入MgO的原料:主要有白云石、CaCO3 、MgCO3辅助原料:1.澄清剂:在玻璃熔制过程中能分解产生气体,或能降低玻璃粘度促使玻璃液中气泡排除的原料的统称。
分为三类:(1)As2O3和Sb2O3:单独使用时仅起鼓泡作用,但与硝酸盐组合作用时在低温吸氧,在高温放氧而起澄清作用,但As2O3极毒,故少用。
(2)硫酸盐原料:主要有Na2SO4,在高温时分解逸出气体而起澄清作用。
(3)氟化物类原料:主要有萤石(CaF2)及氟硅酸钠(Na2SiF6)。
(4)NaCl:高温时挥发出NaCl蒸气。
建筑门窗及幕墙用玻璃术语JGT354 2012

建筑门窗及幕墙用玻璃术语JG/T 354-20121 范围本标准规定了建筑门窗及幕墙用玻璃品种、形状和结构、外观质量、性能、工艺方法、配套材料的术语和定义。
本标准适用于建筑门窗及幕墙用玻璃。
2 品种2.1 玻璃glass 由无机熔体冷却形成的非晶态固体。
2.2 钠钙硅玻璃soda-lime glass ;soda lime silicate glass 以二氧化硅、氧化钙和氧化钠为主要成分的玻璃。
2.3 硼硅酸盐玻璃borosilicate glass 以二氧化硅外加相当含量的氧化硼为主要成分的玻璃。
2.4 平板玻璃flat glass 采用浮法(6 .1)、压延法(6 .2)及平拉法(6 .3)等工艺生产的板状无机玻璃制品的总称。
注:改写GB/T 15754-2008 ,定义2.1。
2.5 浮法玻璃float glass 采用浮法(6.1)工艺生产的平板玻璃。
[GB/T 15764-2008 ,定义2.3]2.6 普通平板玻璃sheet glass 采用压延法(6 .2)或平拉法(6 .3)工艺生产的平板玻璃。
注:改写GB/T 15764-2008 ,定义2.2。
2.7超白浮法玻璃ultra-clear float glass ;low-iron float glass采用浮法(6 .1)工艺生产,成分中三氧化二铁含量不大于0.015%,具有高可见光透射比的平板玻璃。
[GB/T 15764-2008 ,定义2.5]2.8压花玻璃patterned glass ;figured glass采用压延法(6 .2)工艺生产,表面带有花纹图案的平板玻璃。
注:改写GB/T15764-2008 ,定义2.6。
2.9夹丝玻璃wired glass采用压延法(6 .2)工艺生产,内部夹有金属丝或网的平板玻璃。
[GB/T 15764-2008 ,定义2.7]2.10建筑玻璃architectural glass 用作建筑物的门、窗、屋面、墙体及室内外装饰、采光、遮像、隔声、隔热玻璃的统称。
玻璃的结构和组成

论据:①玻璃的X射线 衍射图一般有宽广的 (或弥散的 )衍射峰, 与相应晶体的强烈尖 锐的衍射峰有明显的 不同,但二者峰值所 处的位置基本是相同 的。
② 把晶体磨成细粉,颗粒度小于0.1μm时,其X射线 衍射图也产生一种宽广的(或弥散的 )衍射峰,与 玻璃类似,而且颗粒度越小,衍射图的峰值宽度越 大。
三度空间网络发生解聚,出现与一个硅原子键合的 非桥氧,碱金属离子处于非桥氧附近的网穴中,中 和过剩电荷。
原因:碱金属氧化物的加入使氧硅比值相对增大。 结果: [SiO4]网络失去原有的完整性,结构减弱疏
松,导致一系列性能变坏。
1.3.3 钠钙硅玻璃结构 CaO的加入使钠硅玻璃结构加强,一系列性能变好,
一、晶子学说
提出:1921年列别捷夫研究光学玻璃退火时,发现 折射率随温度变化曲线上520℃附近有突变,认为 这是玻璃中石英“微晶”晶型转变所致。
内容:认为玻璃是由无数“晶子”所组成。晶子是 尺寸极其微小、晶格变形的有序排列区域,分散在 无定形介质中,从晶子到无定形部分是逐步过渡的, 没有明显的界限。
三角形结构。B-O键是极性共价键,共价性成分约 占56%,键强略大于Si-O键,约为119cal/mol。整 个[BO3]正负电荷重心重合,不带极性。
根据X射线衍射和核磁共振的研究,证明B2O3玻璃 是由[BO3]组成的,但连接方式尚未彻底弄清。
由于B2O3玻璃密度与六角形结晶态的B2O3差别较 大,故不能把结晶态的结构推广到玻璃中。
玻璃结构的无序性主要是由于Si-Si距离(即Si-OSi键角)的可变性造成的。
[SiO4]之间的旋转角度也是无序分布的。所以[SiO4] 之间不能以边或面相连,而只能以顶角相连。
石英玻璃是[SiO4]之间以顶角相连,形成一种向三 度空间发展的架状结构,内部存在许多空隙。
玻璃的结构和组成

更高温度,每一对三角体均共用三个氧形成双锥体,两 个硼原子则处于三个氧原子平面之外的平衡位置,双锥 体通过氧原子的两个未偶合的电子和硼接受体互相作用 结合成短链。
第30页/共52页
1.4.2 碱硼酸盐玻璃结构 碱金属或碱土金属氧化物加入B2O3玻璃中,将产生硼氧四
第22页/共52页
玻璃结构的无序性主要是由于Si-Si距离(即Si-OSi键角)的可变性造成的。
[SiO4]之间的旋转角度也是无序分布的。所以[SiO4] 之间不能以边或面相连,而只能以顶角相连。
石英玻璃是[SiO4]之间以顶角相连,形成一种向三 度空间发展的架状结构,内部存在许多空隙。
第23页/共52页
第47页/共52页
1.12.2 热历史对性能的影响 密度
急冷:质点之间距离较大,结构疏松,密度较小; 慢冷:质点之间距离较小,结构致密,密度较大。
黏度
急冷:黏度小 慢冷:黏度大
热膨胀
急冷:热膨胀系数大 慢冷:热膨胀系数小
第48页/共52页
1.13 玻璃成分、结构、性能之间的关系
结构:原子或离子彼此以一定的方式组织起来。 性能:玻璃对外来因素(热、电、光、机械力、化
第14页/共52页
石英玻璃:与石英晶体类似存在最小结构单元— 硅氧四面体,但排列是无序的,缺乏对称性和周 期性。
钠钙硅玻璃:由硅氧四面体为结构单元的三度空 间网络所组成,碱金属和碱土金属离子均匀而无 序的分布于四面体之间的空隙中,以维持网络中 局部的电中性。
第15页/共52页
石英玻璃结构模型
第16页/共52页
第20页/共52页
如何鉴别玻璃瓶是否含铅 玻璃容器的化学成分是什么

玻璃材料品种多样,性能优越质量佳,不但能够作为装饰,而且耐用功能广。
玻璃隔断、汽车车窗,都要玻璃做主场。
光滑平整、纯净明亮,各行各业都要它。
玻璃是现在较为流行的装饰材料,建筑室内装潢与室外玻璃幕墙都会用到它。
如何鉴别玻璃瓶是否含铅,玻璃容器的化学成分是什么,一起来看看吧。
一、如何鉴别玻璃瓶是否含铅1、看标识:无铅玻璃杯一般含钾,多为高档工艺品并在外包装上有标识;而含铅玻璃杯则含铅,即在一些超市和地摊上常见的水晶玻璃器皿,其氧化铅的含量可达24%。
2、看色泽:无铅玻璃杯比传统含铅水晶玻璃杯有更好的折光性,更完美的展现了金属玻璃的折光性能;如一些各种造型的摆件、水晶酒杯、水晶灯等等就是由含铅玻璃制成的。
3、看耐热性:玻璃杯一般都可以耐很高的温度,但是一般耐极冷热性能差。
无铅水晶玻璃属于高膨胀系数的玻璃,耐极冷热性能更差一点,如果在特别冷的无铅玻璃杯中用开水泡茶容易发生碎裂。
4、掂轻重:含铅水晶玻璃制品与无铅水晶玻璃制品相比,要略显得厚重。
5、听声音:超越含铅水晶玻璃杯所发出的金属声,无铅玻璃杯的声响更悦耳动听,富有“音乐”杯之美誉。
6、看韧性:无铅玻璃杯比含铅水晶玻璃杯更有韧性即耐撞击性能。
二、玻璃容器的化学成分是什么瓶罐玻璃配合料一般由7~12种原料组成。
主要有石英砂、纯碱、石灰石、白云石、长石、硼砂、铅和钡的化合物等。
此外,还有澄清剂、着色剂、脱色剂、乳浊剂等辅助材料(见玻璃制造)。
粗颗粒石英难于熔融完全;颗粒过细在熔制过程中又容易产生浮渣和粉尘,影响熔化,易堵塞熔窑蓄热室。
适宜粒度为0.25~0.5mm。
为利用废旧玻璃,一般还加入碎玻璃,其用量通常为20~60%,可达90%。
玻璃瓶罐玻璃的化学成分,按其使用要求、成型方法、成型速度、工艺特点和原料品种等而有差异。
绝大多数瓶罐采用钠钙硅酸盐玻璃。
钠钙硅酸盐玻璃的主要成分为SiO2、Na2O和CaO。
引入适量Al2O3和MgO,可以降低玻璃的析晶倾向,增强玻璃的化学稳定性和机械强度,改善玻璃的成型性能。
玻璃形成热计算
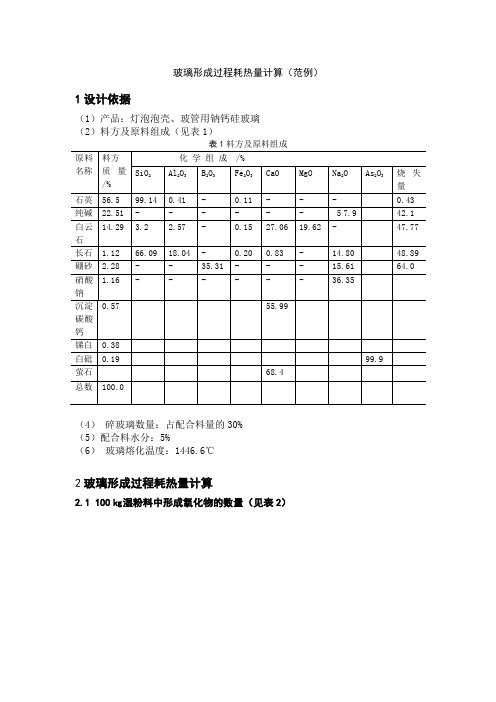
玻璃形成过程耗热量计算(范例)1设计依据(1)产品:灯泡泡壳、玻管用钠钙硅玻璃(2)料方及原料组成(见表1)(4)碎玻璃数量:占配合料量的30%(5)配合料水分:5%(6)玻璃熔化温度:1446.6℃2玻璃形成过程耗热量计算2.1 100㎏湿粉料中形成氧化物的数量(见表2)表2 100㎏湿粉料中形成氧化物的数量2.2生成硅酸盐耗热(以1㎏粉料计,单位是KJ/㎏)q=q粉G粉(2—1)q粉=∑q硅G氧(2—2)q硅是各种氧化物生成硅酸盐的反应热,各种硅酸盐的生成热查参考书①表1—3。
G氧是各种原料中的氧化物量。
由CaCO3生成CaSiO3的反应耗热量q1q1=1536.6GCaO= 1536.6×0.003032= 4.6590由白云石中CaMg(CO3)2生成CaMg(SiO3)2的反应耗热量q2q2 =2757.4GCaMgO2= 2757.4×(0.036735+0.026635)= 174.7364由纯碱中Na2CO3生成Na2SiO3的反应耗热量q3q3=951.7GNa2O= 951.7×0.123816= 117.8357由硝酸钠中NaNO3生成Na2SiO3的反应耗热量q4q4 =4144.9 GNa2O= 4144.9×0.004006= 16.6044由CaF2生成CaSiO3的反应耗热量q5q5= 1536.6 GCaO= 1536.6×0.006498= 9.9848由硼砂生成Na2SiO3的反应耗热量q6q6=1364.9 GB2O3=1364.9×0.007648= 10.43871㎏粉料生成硅酸盐耗热qⅠq′Ⅰ =q1+ q2+ q3+ q4+ q5+ q6= 334.25902.3 100㎏粉料逸出气体的组成:(见表3)表3 100㎏粉料逸出气体的组成① 2NaNO3 → Na2O+2 NO2+1/2 O2, 2NaNO3~ Na2O2NO2/Na2O = (2×46)/62 = 1.48390.5 O2/Na2O = 16/62 = 0.2581② 2CaF2+3SiO2→ 2CaSiO3+SiF4CaF2~CaOSiF4/2 CaO= 104.16/(2×56) = 0.932.4 配合料用量计算在粉料中挥发分占21.722% ,在1㎏粉料中加上碎玻璃0.3㎏,则得到:1-0.01×21.722 +0.3= 1.083㎏玻璃液因此,熔成1㎏玻璃液需要粉料量为 G 粉=1/1.0828=0.923㎏需要碎玻璃量为: G 碎=0.3/1.0828 = 0.277㎏熔成1㎏玻璃液需要配合料量:G 配= G 粉+ G 碎= 1.2㎏2.5 玻璃液形成过程的热量平衡(以1㎏玻璃液计,单位是kJ/㎏,从0℃算起) (1) 支出热量a.生成硅酸盐耗热q 1q 1= q′ⅠG 粉= 334.2590×0.923= 385.167 b.形成玻璃耗热q Ⅱq Ⅱ=347 G 粉(1-0.01G 气)= 347×0.923×(1-0.01×21.722)= 250.709式中:347—每千克硅酸盐熔融成玻璃液需347kJ 热量c.加热玻璃液到 1446.6 ℃耗热q Ⅲq Ⅲ=c 玻t 玻式中:c 玻—玻璃液的高温比热,kJ/(㎏·℃) c 玻=0.672+4.6×10-4t 熔 t 熔—玻璃熔化温度c 玻=0.672+4.6×10-4t 熔=0.672+4.6×10-4×1446.6 = 1.337 ∴ q Ⅲ=c 玻t 玻= 1.337×1446.6 = 1934.10d.加热逸出气体到 1446.6 ℃耗热q Ⅳ 1446.6 ℃时逸出气体的平均比热c 去气=0.01[c CO2·(CO 2%+SO 2%+ NO 2%)+c H2O ·H 2O%]= 0.01[2.325×(53.9+1.99)+1.827×42.72= 2.0799q Ⅳ=0.01V 去气 G 粉c 去气t 熔 (3—5) 式中: V 去气—100㎏粉料中逸出气体量,标准m 3q Ⅳ=0.01V 去气 G 粉c 去气t 熔= 0.01×14.5642×0.923×2.0799×1446.6 = 404.463e.蒸发水分耗热q Ⅴq Ⅴ=2491G 粉·G 水 (3—6) 式中:2491—1㎏水分汽化需2491 kJ 热量G 水— 1㎏ 湿粉料中的含水量,㎏q Ⅴ=2491G 粉·G 水=2491×0.923×0.05=114.960(2) 收入热量q Ⅵq Ⅵ= G 粉c 粉t 粉+G 碎c 碎t 碎 (3—7) 式中:c 粉—粉料比热,一般取0.963kJ/(㎏·℃) c 碎—碎玻璃的比热,kJ/(㎏·℃) c 碎=0.7511+2.65×10-4 t 碎t 粉 、t 碎—分别为粉料和碎玻璃入窑时的温度,℃设配合料入窑时为25℃25℃时的c 碎=0.7511+2.65×10-4×25= 0.75773 由粉料和碎玻璃带入的热量q Ⅵ= G 粉c 粉t 粉+G 碎c 碎t 碎= 0.923×0.963×25+0.277×0.75773×25= 27.466(3)熔化1㎏玻璃液在玻璃形成过程中的耗热量q 玻q 玻 = q 1+ q Ⅱ+ q Ⅲ+ q Ⅳ+ q Ⅴ-q Ⅵ= 3061.933。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
钠钙硅玻璃的组成
钠钙硅玻璃是一种常见的无机非金属材料,由钠氧化物(Na2O)、钙氧化物(CaO)和硅氧化物(SiO2)组成。
这种玻璃具有多种优良的物理和化学性质,广泛应用于建筑、家具、电子、光学等领域。
钠钙硅玻璃的组成主要是由这三种氧化物按一定比例混合而成。
其中,钠氧化物作为玻璃的主要成分之一,具有使玻璃具有一定的透明度和抗压强度的作用。
钙氧化物的加入可以提高玻璃的耐热性和化学稳定性。
而硅氧化物则是钠钙硅玻璃的主要成分,它是玻璃的主要结构形成元素。
硅氧化物具有良好的熔化性和成型性,能够使玻璃具有较高的抗压强度和耐腐蚀性。
钠钙硅玻璃的组成比例会根据具体的用途和要求而有所不同。
一般来说,钠氧化物的含量在10%~25%之间,钙氧化物的含量在5%~15%之间,而硅氧化物的含量则占据了大部分,通常在60%~75%之间。
这种组成比例可以使钠钙硅玻璃既具有良好的透明度,又具备较高的强度和耐腐蚀性。
钠钙硅玻璃的组成使其具有许多优异的性质。
首先,它具有较高的透明度,能够有效传递光线,因此在光学器件和光纤领域得到广泛应用。
其次,钠钙硅玻璃具有良好的机械性能,强度较高,能够承受一定的压力和冲击。
此外,它还具有较高的耐热性和化学稳定性,能够在高温和腐蚀环境下保持稳定性。
这些特性使得钠钙硅玻璃在
化学工业、建筑装饰和电子器件等领域有着广泛的应用。
在建筑领域,钠钙硅玻璃常用于制作窗户、门和墙壁等透明结构。
由于其较高的透明度和耐候性,可以有效地提供采光和美化建筑的效果。
同时,钠钙硅玻璃还具有较好的隔音性能,能够有效隔绝噪音,提供舒适的室内环境。
在电子领域,钠钙硅玻璃常用于制作电子器件的基板和封装材料。
由于其良好的耐热性和化学稳定性,能够保护电子元件不受外界环境的影响,提高电子设备的可靠性。
钠钙硅玻璃的组成主要由钠氧化物、钙氧化物和硅氧化物组成。
它具有良好的透明度、强度和耐腐蚀性,广泛应用于建筑、电子、光学等领域。
通过合理的组成比例和制备工艺,可以满足不同领域对玻璃性能的需求,为人们的生活和工作提供了便利。
