苏教版 必修一 市级公开课初高中衔接 酸碱盐
(完整word版)高中化学必修一专题一教案苏教版
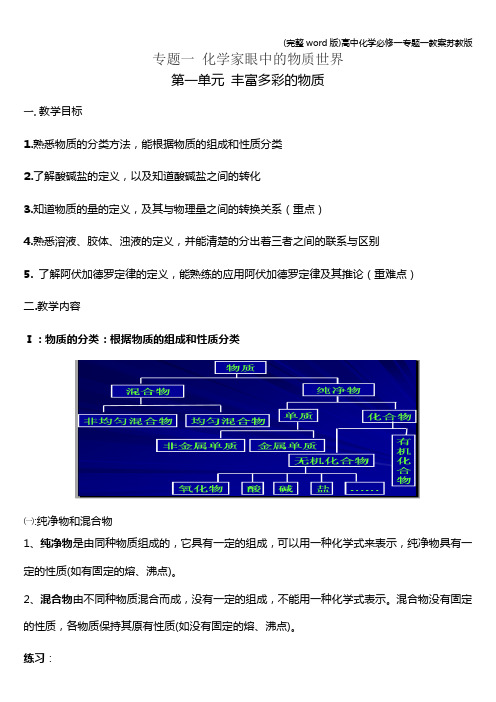
专题一化学家眼中的物质世界第一单元丰富多彩的物质一. 教学目标1.熟悉物质的分类方法,能根据物质的组成和性质分类2.了解酸碱盐的定义,以及知道酸碱盐之间的转化3.知道物质的量的定义,及其与物理量之间的转换关系(重点)4.熟悉溶液、胶体、浊液的定义,并能清楚的分出着三者之间的联系与区别5.了解阿伏加德罗定律的定义,能熟练的应用阿伏加德罗定律及其推论(重难点)二.教学内容Ⅰ:物质的分类:根据物质的组成和性质分类㈠:纯净物和混合物1、纯净物是由同种物质组成的,它具有一定的组成,可以用一种化学式来表示,纯净物具有一定的性质(如有固定的熔、沸点)。
2、混合物由不同种物质混合而成,没有一定的组成,不能用一种化学式表示。
混合物没有固定的性质,各物质保持其原有性质(如没有固定的熔、沸点)。
练习:1、下列物质属于纯净物的是(B)A.洁净的食盐水B.冰水混合物C.净化后的空气D.高锰酸钾完全分解后的剩余物2、某物质经分析知,其中仅含一种元素,此物质(A)A.可能是纯净物也可能是混合物B.可能是单质也可能是化合物C.一定是纯净物D.一定是一种单质㈡:单质和化合物单质:是由一种元素组成的纯净物化合物:是由两种或两种以上的元素组成的纯净物㈢:无机化合物1.氧化物的构成中只含两种元素,其中一种一定为氧元素且显现负价,另一种若为金属元素,则为金属氧化物;若为非金属,则为非金属氧化物。
A.氧化物按照是否与水生成盐,以及生成的盐的类型可分为:酸性氧化物、碱性氧化物、两性氧化物、不成盐氧化物、过氧化物B. 跟碱反应生成盐和水的氧化物,称为酸性氧化物C.跟酸起反应,生成盐和水的氧化物,叫做碱性氧化物练习:1、下列物质按照单质、混合物、氧化物的顺序排列的是(A)A.水银、硬水、水B.石墨、熟石灰、生石灰C .氨气、空气、消石灰D .黄铜、醋酸、干冰2、关于氧化物的下列说法中正确的是( B )A .金属氧化物一定是碱性氧化物B .碱性氧化物一定是金属氧化物C .非金属氧化物一定是酸性氧化物D .酸性氧化物一定是非金属氧化物2. 酸→指电离时产生的阳离子全部都是氢离子的化合物3.碱→指电离时产生的阴离子全部都是氢氧根离子的化合物4. 盐→指电离时生成金属阳离子(或NH 4+)和酸根离子的化合物练习:1、下列各组物质中,按酸、碱、盐、碱性氧化物、酸性氧化物的顺序排列正确的是( B )A 、盐酸、纯碱、氯酸钾、氧化镁、二氧化硅B 、硝酸、烧碱、次氯酸钠、氧化钙、二氧化硫C 、次氯酸、消石灰、硫酸铵、过氧化钠、二氧化碳D 、醋酸、过氧化钠、碱式碳酸铜、氧化铁、一氧化碳2.下列物质分类的正确组合是( D )3.纯净物根据其组碱 酸 盐 酸性氧化物 A纯碱 硝酸 烧碱 二氧化硫 B烧碱 硫酸 食盐 一氧化碳 C苛性钠 醋酸 石灰石 水 D 苛性钾 碳酸 苏打 三氧化硫成和性质可进行如下分类:(1)如图所示的分类方法属于(填序号) BA.交叉分类法B.树状分类法(2)以H、O、S、N、Na五种元素中任意两种或三种元素组成合适的常见物质,分别将其中一种常见物质的化学式填写于下表相应类别中:物质类别酸碱盐氧化物化学式HNO3NaOH Na2SO4SO2(3)从上表酸及碱中各选出一种能相互反应的物质,并写出其反应的化学方程式:HNO3 + NaOH ===NaNO3 + H2OⅡ:化学反应的分类方法酸、碱、盐在溶液中发生得复分解反应,通常有沉淀、气体或水等物质生成。
苏教版高中化学必修一课件专题1-第1单元-第1课时

2.用物质分类思想发现“新物质”。 如用Na、Cl、Mg、O、Cu、S、H、Ca、C九种元素 组成尽可能多的物质。如果这几种元素之间漫无规律地组 合,可能只能组成我们已知的十几种物质,倘若正确地运 用物质分类的思想,一类一类地“对号入座”,将会发现 仅这9种元素所能组成的物质,就远远超出我们的想像。
高中化学课件
灿若寒星整理制作
第一单元 丰富多彩的化学物质 第1课时 物质的分类与转化
教师用书独具演示
●课标要求 能根据物质的组成和性质对物质进行分类,认识分类 对化学研究的作用。
●课标解读 1. 了解从不同的角度(如组成、性质)对物质分类。 2.了解常见物质(酸、碱、盐、氧化物、单质等)之间 的转化和反应类型。 ●教学地位
(2)腌制松花蛋的配料用水调制时,主要发生的化学反 应的方程式有(不考虑黏土中的物质可能参与的反应) ________,________。
(3)松花蛋外的糊状物经水溶解、过滤后,滤液中肯定 大量含有的溶质为________和________,可能含有的物质 为Ca(OH)2或Na2CO3(不考虑黏土中的物质)。
1.单质、氧化物、酸、碱、盐之间的转化关系
对表中转化进行整理,可得出十种生成盐的方法: (1)非金属单质(氧气除外)+金属单质→无氧酸盐 (2)酸性氧化物+碱性氧化物→含氧酸盐 (3)酸性氧化物+碱→盐+水 (4)碱性氧化物+酸→盐+水 (5)酸+碱→盐+水 (6)酸+盐→新酸+新盐 (7)碱+盐→新碱+新盐 (8)盐+盐→新盐+另一新盐 (9)金属单质+盐→新金属+新盐 (10)金属单质+酸→盐+氢气
组 别 被选出的物质 依 据 第(1)组 第(2)组 第(3)组
【解析】 第(1)组物质可根据物质在通常状况下的聚
初高中化学衔接课题

初高中化学衔接课题初高中化学的衔接,是初高中教师们的重要研究课题之一。
下面是由店铺带来的初高中化学衔接课题,希望对你有所帮助。
初高中化学衔接课题:《初高中化学教学衔接探究》课题实施方案一、问题的提出由于初中高中化学知识的深度难度、学习方法都不同。
高中化学教学自始至终都要加强学生的能力培养,既针对高考命题的要求,又要适应社会工作对国民素质的需要。
而初中化学教学主要侧重于基础知识和基本技能的掌握,如果教学仅仅着眼于双基的掌握上,学生进入高中后就需要较长时间来适应高中教学的要求。
部分升入高中的学生因为不适应高中化学的学习,从而放弃理科学习。
二、需解决的主要问题1、教师要熟悉初高中教材,首先在知识设计上搭好台阶,搞好链接,低台阶高密度、放小步子使学生适应高中化学知识。
2、注意学法指导,提高学生自学、反馈、解决问题的能力。
学生学习方法的转变是一项艰苦的劳动,要有一个逐步适应的过程,决不能操之过急。
在高一对学生铺设的问题台阶不要一下子就很高,要使他们能上得去,以防发生两极分化。
要通过耐心细致的引导,教会学生从比较中学习,发现相似,寻求规律,逐步培养思维的敏捷性和严密性。
在做和练中,不断找出好的学习方法。
三、课题研究依据衔接”既“事物相连接”后一事物与前一事物相连接。
所谓初高中衔接期是指学生进入高一后逐步适应高中教学的过渡期。
对于不同的学生,衔接期的长度不一,一般认为是从进入高一开始至高一下学期期中前后。
初高中化学衔接期教学的课例研究以高一化学衔接期的课堂教学为实践基础,运用新课程理论,对在高一衔接期的课堂教学案例进行分析研究,并提出相应的教学对策和建议。
四、课题研究目标利用本校特点在初三下学年开设高一课程,我既有初中教学经历又有高中教学激励的优势,以现在的学生为研究对象。
以初中知识为基础,设计好学案,在知识、学习方法上做好指导做好知道,通过近一年时间为学生进一步学好高中化学打下良好的基础,力争不使每个学生因不适应而掉队。
高一化学人教版必修一初高中衔接练习酸、碱、盐在水溶液中的电离课时练习

第一课时酸、碱、盐在水溶液中的电离课时练习一、选择题( 每小题 4 分,共48 分)1.下列叙述中不正确的是( )A. 在熔融状态下和溶解于水时均不导电的化合物,叫做非电解质B. 电解质、非电解质都对化合物而言,单质不在此范畴C. 在水中的电解质一定都导电性很强D. 水是极弱的电解质解析:在水中的电解质也有强弱之分。
部分难溶于水的强电解质也不导电。
答案:C2. 下列叙述中正确的是( )①溶液都是纯净物②含氧的化合物都是氧化物③能电离出』的化合物都是酸④ 能电离出0H的化合物都是碱⑤能电离出金属离子和酸根离子的化合物都是盐⑥酸和碱的中和反应都是复分解反应A. 全部B.⑤⑥C.③④D.①②解析:可采用反例法分析。
①溶液都是混合物;②有很多含氧的化合物是酸(H2SO)、碱(NaOH)、盐(NazCQ)等;③NaHSO NaHCO等均可电离出』,但它们是盐类;④ Cib(OH)2CO 能够电离出OH,但属于盐类。
答案:B3. 下列各组均为两种化合物溶于水时电离出的离子,其中由酸电离产生的是( )A. Na+、OH 、SO24-B. H+、SO42-、Cl-C. Na+、K+、OH-D. K+、Na+、Cl-解析:电离出的阳离子全部是』的化合物才是酸。
B正确。
答案:BA. 硝酸钾溶液能导电,所以硝酸钾溶液是电解质B. 固态氯化钾不导电,但氯化钾是电解质C. 氯化氢溶液能导电,所以氯化氢是电解质D. SO溶于水能导电,所以SQ是电解质E. 铁能导电,所以铁是电解质F. Hz不导电,所以Hz是非电解质解析:A项不正确,因为硝酸钾溶液是混合物,所以不是电解质,但硝酸钾是电解质;B项正确,固态氯化钾不导电是因为K*和C「不能自由移动,当氯化钾在水溶液中或熔融状态时能导电,所以是电解质;C项正确,氯化氢是化合物,在水溶液中能电离出自由移动的离子,能导电,所以氯化氢是电解质;D项不正确,SQ的水溶液能导电,是因为SO与水反应生成了HSQ, HSQ能导电,是电解质,SQ是非电解质;E、F两项均不正确,因为Fe、H不论是否能导电,均为单质,既不是电解质,也不是非电解质。
苏教版高中化学必修一1.1《物质的分类与转化》参考教案

第一单元丰富多彩的化学物质第1课时物质的分类与转化学习目标:1。
能根据物质的组成和性质对常见物质进行分类,并了解比较和分类对化学研究的作用.2。
掌握单质、氧化物、酸、碱、盐之间的转化关系,能从化合价升降的角度初步认识氧化还原反应,并了解通过化学反应实现物质转化的重要意义.学习重、难点:学会从不同角度、不同的标准对物质及物质间的转化进行分类。
教学过程:一、导入新课教师讲解]阅读P2图片,思考化学与人类社会发展的关系。
强调]人类生活离不开各种各样的化学物质.化学物质种类繁多,且新分子和新材料还在飞速增长。
展示]新分子和新材料的飞速增长过渡]世界上的物质如此繁多,为了简明有序地掌握其性质及变化规律,常采用的方法之一是进行分类研究。
那么,我们是如何来对不同物质进行分类的呢?板书] 物质的分类与转化二、推进新课教学环节一:物质的分类板书]一、物质的分类交流与讨论]在我们日常生活中,常会接触到下列物质:空气、乙醇、水、硫酸铵、铜、碘酒、碘、氧气、石墨、食盐水请你将上述物质进行分类,并说明分类的依据。
将你的分类结果与同学交流讨论。
归纳]分类标准:(1)混合物和纯净物;(2)单质和化合物;(3)导体和非导体;(4)气体、液体和固体;(5)易溶物、微溶物和难溶物.板书]1。
研究物质常采用的方法之一是分类研究.2. 对于若干种同样的物质,若分类的依据不同,则得到的分类结果不同。
对物质进行分类的常见依据有组成、状态、性能等。
化学上,根据组成对物质进行分类是最常用的方法。
思考]下图是根据物质的组成对物质进行分类的一种结果,试填写其中空格:提问]请说出上述概念“混合物、纯净物、单质、化合物"的含义。
问题解决]实验室中有下列物质,请根据物质的组成对它们进行分类.①钠(Na);②氯气(Cl2);③氯化铁(FeCl3)溶液;④硫酸(H2SO4);⑤碳酸钙(CaCO3);⑥氧化钙(CaO);⑦氢氧化钠(NaOH);⑧葡萄糖(C6H12O6)。
江苏专用高中化学专题3第三单元盐类的水解微专题12酸碱中和反应过程中的图像分析课件苏教版选择性必修1

, > . ,
故B错误。
例2 25 ℃ 时,用浓度为 0.100 0 mol ⋅ L−1 的 NaOH 溶液滴
定体积均是 20 mL 、浓度均为 0.100 0 mol ⋅ L−1 的三种酸
HX 、 HY 、 HZ ,滴定曲线如图所示。下列说法正确的是
( C )
A.酸性强弱顺序是 HX > HY > HZ
2−
+
−4.3
A. HC2 O−
4 ⇌ H + C2 O4 的平衡常数 = 1 × 10
B.将等物质的量的 NaHC2 O4 、 Na2 C2 O4 溶于水中,
√
所得溶液 pH 恰好为4.3
C.常温下 HF 的电离常数 a = 1 × 10−3.45 ,将少量
H2 C2 O4 溶液加入到足量 NaF 溶液中,发生的反应为
−. , − 的水解平衡常数为
出 −
的电离平衡常数为
=
−
−
⋅
−
−
= −. < −. ,故 −
的水解程度小于 的电离程度,
−
等物质的量的 、 溶于水中, −
于1,则 和 都是一元弱酸,同浓度的三种酸的酸性强弱关系为 < < ,
A项错误; 为弱酸,存在电离平衡: ⇌ + + − ,根据图像数据,
. ⋅ − 的 溶液 = ,即该酸溶液中 + = − ⋅ − ,其电
错误。
例3 [2023湖北] H2 L 为某邻苯二酚类配体,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3HCl + Al(OH)3 == AlCl3 + 3H2O
化学性质-H2SO4
• 使紫色石蕊试液变红色,无色酚酞试液不 变色 • 与Fe、Zn等金属反应(用于制氢气)
Fe + H2SO4 — FeSO4 + H2↑
• 与金属氧化物反应(酸洗)
Fe2O3 + 3H2SO4 — Fe2(SO4)3 + 3H2O Cu(OH)2 + H2SO4 — CuSO4 + 2H2O
写出下列化合物的溶解性
用途
硫酸 盐酸 氢氧化 氢氧化 氯化钠 碳酸钠 钠 钙
酸洗
酸洗
造纸
轻工 纺织 石化
干燥剂
制氢气
中和土 壤酸性 建筑 漂白粉 农药
食用
玻璃
防腐
肥皂
其他
化工原 纸张 料
复分解反应发生的条件: ①生成沉淀 ②生成气体 ③或生成水
复分解反应是酸、碱、盐、氧化物之间互相 交换成分的反应。它们的化合价均不改变。 其中碱与盐的反应必须都要是可溶的。
• 与酸反应
NaOH + HCl — NaCl+ H2O
• 与硫酸铜、氯化铁反应
2NaOH+ CuSO4 — Cu(OH)2 ↓+ Na2SO4
3NaOH+ FeCl3 — Fe(OH)3 ↓+ 3NaCl
• 使紫色石蕊试液变蓝色,无色酚酞试液变红色
化学性质-Ca(OH)2
• 与非金属氧化物反应
CO2 + Ca(OH)2 — CaCO3↓ + H2O(检验CO2) SO2 + Ca(OH)2 — CaSO3 + H2O
(治理大气污染)
• 与酸反应
Ca(OH)2 + H2SO4 — CaSO4+ 2H2O
• 与碳酸钠反应
Ca(OH)2+ Na2CO3 — CaCO3 ↓+ 2NaOH
(用于区别氢氧化钠与氢氧化钙)
二、氢氧化钠、氢氧化钙溶液的化学性质 1、碱 + 指示剂 2、碱 + 非金属氧化物 → 盐 + 水 3、碱 + 酸→ 盐 + 水 4、碱 + 盐 → 新盐 + 新碱
沼涛中学 化学组
学生活动一:写出下列物质的化学式,并按单质、氧 化物、酸、碱、盐进行分类。
①铁钉、②氢氧化钠、③盐酸、④氧化铜、⑤碳酸钙 ⑥硫酸、⑦纯碱、⑧硝酸银⑨干冰、⑩氧化铁、⑾硫 酸铜、 ⑿熟石灰、 。(填序号) 单质: ;氧化物: 碱: ;盐 ;酸: 。 ;
紫色石蕊
稀盐酸
NaOH 溶液
无色酚酞
助记口诀
钾钠铵硝都要溶 盐酸盐中要除银 硫酸铅钡它不溶 硫酸钙银是微溶 溶碱氨钡钾钠钙 常见的酸都要溶 运用酸、碱、盐的溶解性去判断复分解反应能否发生 特别注意两种反应:盐+碱、盐+盐 首先要求反应物全溶,然后再考滤生成物中是否 有沉淀。
各种盐的溶解性:
钾钠铵硝均可溶, 氯中只有银不溶, 硫酸钡外都会溶, 碳酸磷酸不溶多, 碱溶铵钠钾钡钙。
下列哪几组物质在水溶液里 能发生复分解反应: (1)KNO3+NaCl (2) Na2CO3+KNO3 (3) BaCl2+Na2SO4 (4) FeCl3+NaOH (5) Zn+H2SO4(稀) (6)CaCO3+HCl
判断下列反应能否发生?为 什么? A.①NaOH+H2SO4=== ② CaCO3+HCl = ==
• 与氢氧化铁反应
Fe(OH)3 + 3HCl — FeCl3+ 3H2O
• 与硝酸银反应
AgNO3+ HCl — AgCl ↓+ HNO3
一、酸的化学性质: 1、酸 + 指示剂 2、酸 + 活泼金属 → 盐 + 氢气 3、酸 + 金属氧化物 → 盐 + 水 4、酸 + 5、酸 + 碱 → 盐 + 水(中和反应) 盐 → 新盐 + 新酸
NaOH 溶液 稀盐酸
小明看见爸爸常常用稀盐 酸给铁制器皿除锈,他自己想 亲自试一试。于是,他找出一 颗生锈铁钉出来,放入足量稀 盐酸中,然后,美滋滋地去睡 觉了……
生锈铁钉消失原因
Fe2O3+6HCl == 2FeCl3+ 3H2O Fe + 2HCl ==FeCl2 + H2↑
成份:氢氧化铝、 碘甲基蛋氨酸等
• 与氢氧化铜反应
• 与氯化钡反应
BaCl2 + H2SO4 — BaSO4 ↓+ 2HCl
化学性质-HCl
• 使紫色石蕊试液变红色,无色酚酞试液不变色
• 与Fe、Zn等金属反应
Zn + 2HCl — ZnCl2 + H2↑
• 与金属氧化物反应(酸洗)
CuO + HCl — CuCl2 + H2O
二、氢氧化钠、氢氧化钙溶液的化学性质:
1、碱 + 指示剂
二、氢氧化钠、氢氧化钙溶液的化学性质:
Ca(OH)2Biblioteka + CO2 === CaCO3↓ + H2O 2、碱 + 非金属氧化物 → 盐 + 水
二、氢氧化钠、氢氧化钙溶液的化学 性质:
物理性质-碱
• NaOH(俗称“烧碱、苛性钠”)
1、白色固体
Ca(OH)2+ Na2CO3 — CaCO3 ↓+ 2NaOH
物理性质-盐
• NaCl(俗称“食盐”)
1、无色透明的晶体 2、粗盐因含MgCl2、CaCl2等杂质,易潮解
• Na2CO3(俗称“纯碱、苏打”)
1、白色粉末
2、易溶于水,
(3、其水溶液呈碱性能使酚酞溶液变红色)
(4、与盐酸反应有二氧化碳生成
2、易溶于水,溶解时放出大量的热
3、易潮解 4、水溶液有滑腻感,有腐蚀性
• Ca(OH)2(俗称“熟石灰、消石灰、石灰 浆”)
白色粉末、微溶于水
化学性质-NaOH
• 使紫色石蕊试液变蓝色,无色酚酞试液变红色
• 与非金属氧化物反应
CO2 + 2NaOH — Na2CO3 + H2O(易变质) SO2 + 2NaOH — Na2SO3 + H2O (治理大气污染) SiO2 + 2NaOH — Na2SiO3 + H2O (不能用玻璃瓶塞)
二、各类物质的性质及其相互关系
请说出盐有哪些化学性质?
金属
新盐+新金属
盐
酸
碱
新盐+新酸
新盐+新碱
盐
新盐+新盐
请对每一条规律举一个典型的化学反应。
盐类的化学性质
• 与酸反应 例:CaCO3 + 2HCl — CaCl2 + H2O + CO2↑ • 与可溶性碱反应 例: 2NaOH+ CuSO4 — Cu(OH)2 ↓+ Na2SO4 • 与金属反应 例:Fe + CuSO4 — Cu + FeSO4 • 与另一种可溶性盐反应生成两种新盐 例:NaCl + AgNO3 — AgCl↓+ NaNO3 CuSO4 + BaCl2 — BaSO4↓ + CuCl2
