【二轮特供】高考化学二轮冲刺习题:第2讲化学常用计量 (Word版含答案)
2020浙江高考化学二轮课后达标:专题二化学常用计量Word版含解析
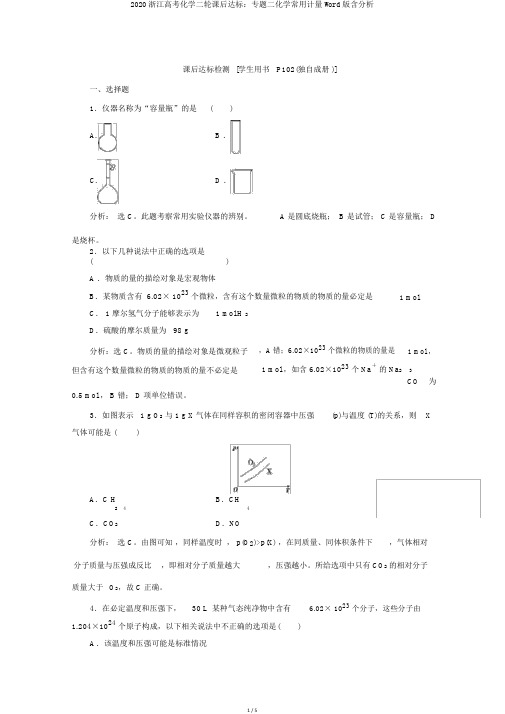
课后达标检测[学生用书P102(独自成册 )]一、选择题1.仪器名称为“容量瓶”的是()A. B .C. D .分析:选 C。
此题考察常用实验仪器的辨别。
A 是圆底烧瓶; B 是试管; C 是容量瓶; D是烧杯。
2.以下几种说法中正确的选项是( )A .物质的量的描绘对象是宏观物体B.某物质含有 6.02× 1023个微粒,含有这个数量微粒的物质的物质的量必定是 1 mol C. 1 摩尔氢气分子能够表示为 1 mol H 2D.硫酸的摩尔质量为 98 g分析:选 C。
物质的量的描绘对象是微观粒子,A 错;6.02×1023个微粒的物质的量是 1 mol ,但含有这个数量微粒的物质的物质的量不必定是 1 mol ,如含 6.02×1023个 Na+的 Na2 3为CO0.5 mol , B 错; D 项单位错误。
3.如图表示 1 g O2与 1 g X 气体在同样容积的密闭容器中压强(p)与温度 (T)的关系,则X 气体可能是 ()A.C H4 B.CH42C.CO2 D.NO分析:选 C。
由图可知,同样温度时, p(O2)>p(X) ,在同质量、同体积条件下,气体相对分子质量与压强成反比,即相对分子质量越大,压强越小。
所给选项中只有CO2 的相对分子质量大于O2,故 C 正确。
4.在必定温度和压强下,30 L 某种气态纯净物中含有 6.02× 1023个分子,这些分子由1.204×1024个原子构成,以下相关说法中不正确的选项是()A.该温度和压强可能是标准情况B.标准情况下该纯净物若为气态,其体积约是22.4 LC.该气体中每个分子含有 2 个原子D.若 O2在该条件下为气态,则 1 mol O 2在该条件下的体积也为 30 L分析:选 A 。
由分子数和原子数的关系可知该分子为双原子分子,且其物质的量为 1 mol ,若在标准情况下该物质为气态,则其体积为 22.4 L ,故该温度和压强不行能是标准情况,在此情况下, V m= 30 L mol·-1。
专题二化学常用计量 高考化学(课标)二轮复习

专题二化学常用计量一、选择题1.设N A为阿伏加德罗常数的值,下列说法正确的是( )A.转移0.2N A个电子使Na完全转化为Na2O2,需要氧气的体积为2.24 LB.生成6N A个N—H键同时消耗3N A个H—H键,即标志着反应N2+3H22NH3达到平衡状态C.常温常压下,1.42 g Na2SO4中含有的Na+数为0.02N AD.1 mol苯理论上可以与3 mol H2发生加成反应,所以1 mol苯分子中含有3N A个碳碳双键答案 C A项,Na完全转化为Na2O2,氧元素化合价的变化为0→-1,转移0.2N A个电子,需要标准状况下氧气的体积为2.24 L,但题中未指明气体所处状况,无法确定体积,错误;B项,生成6N A个N—H键(即2 mol NH3)的同时消耗3N A个H—H键(即3 mol H2),体现的都是正反应速率,与反应是否达到平衡状态无关,错误;C项,Na2SO4为离子晶体,常温常压下为固体,1.42g(即0.01 mol)Na2SO4中含有的Na+数为0.02N A,正确;D项,苯分子中不存在碳碳双键,错误。
2.(2019湖北黄冈中学模拟)含硫酸钾、硫酸铝和硫酸的混合溶液,其中c(H+)=0.1mol·L-1, c(Al3+)=0.4 mol·L-1,c(S O42-)=0.8 mol·L-1,则c(K+)为( )A.0.15 mol·L-1B.0.2 mol·L-1C.0.3 mol·L-1D.0.4 mol·L-1答案 C 因溶液呈电中性,故存在:3c(Al3+)+c(K+)+c(H+)=2c(S O42-)+c(OH-),而溶液中c(OH-)很小,可以忽略不计,则有3c(Al3+)+c(K+)+c(H+)=2c(S O42-),所以c(K+)=2c(S O42-)-3c(Al3+)- c(H+)=2×0.8 mol·L-1-3×0.4 mol·L-1-0.1 mol·L-1=0.3 mol·L-1。
高考化学二轮专题 02 化学中的常用计量

高考化学二轮专题 02 化学中的常用计量姓名:________ 班级:________ 成绩:________一、单选题 (共12题;共24分)1. (2分) (2016高三上·伊宁开学考) 用NA表示阿伏加德罗常数的值,下列说法正确的是()A . 在标准状况下22.4L H2O中含有氢原子的个数为2NAB . 2.7g 铝与足量的盐酸反应时失去的电子数为0.3NAC . 1mol/L NaCl溶液中含有钠离子的个数为NAD . 常温常压下,11.2 L氧气含有的原子数目为NA2. (2分) (2016高三上·赣州开学考) 设NA代表阿伏加德罗常数的数值,则下列说法正确的是()A . 1.8 g D2O含有NA个中子B . 用5 mL 3 mol/L FeCl3溶液制成的氢氧化铁胶体中所含胶粒数为0.015 NAC . 在Na2O2与CO2的反应中,每转移NA个电子时,消耗22.4 L的CO2D . 25℃时,7 g C2H4和C3H6的混合气体中,含有NA个C﹣H键3. (2分) (2016高三上·大连开学考) NA代表阿伏加德罗常数的值.下列叙述正确的是()A . 标准状况下,2.24L戊烷中存在的共价键总数为1.6NAB . 23gNO2与N2O4的混合气体中含有的氮原子数为0.5NAC . 过氧化钠与二氧化碳反应时,生成0.1mol氧气转移的电子数为0.4NAD . 1L0.1mol•L﹣1的NaH2PO4溶液中H2PO4﹣、HPO42﹣和PO43﹣离子数之和为0.1NA4. (2分) (2018高一上·南宁月考) 下列混合气体中,与同温同压同体积的CO气体原子数一定相等的是()A . HCl与O3B . H2与NH3C . N2与O2D . He与NO5. (2分) (2016高三上·襄阳开学考) 设NA为阿伏伽德罗常数的值,下列叙述正确的是()A . 10gT2O含有的电子数为5NAB . 常温下,0.2L 0.5mol•L﹣1NH4NO3溶液的氮原子数小于0.2NAC . 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.4NAD . 常温常压下,5.6gC2H4和C3H6的混合气体中含氢原子数为0.9NA6. (2分) (2018高一上·南阳期中) 在标准状况下,13g某气体所含的分子数与14gCO所含的分子数相等。
高考化学二轮总复习课后习题 专题突破练2 常用化学计量与应用

专题突破练二常用化学计量与应用一、选择题1.(广西玉林统考一模)设N A为阿伏加德罗常数的值。
下列说法正确的是( )。
A.3.0 g甲醛气体中含有的质子数目为1.4N AB.标准状况下,11.2 L H2和11.2 L F2混合后所含有的分子数目为N AC.0.1 mol Cl2参与反应时,转移的电子数目一定为0.2N AD.1 mol·L-1的(NH4)2SO4溶液中含有的S O42-数目为N A2.设N A为阿伏加德罗常数的值。
下列说法错误的是( )。
A.将1 mol Cl2通入足量水中,HClO、Cl-、ClO-的粒子数之和小于2N AB.100 mL 12 mol·L-1的浓硝酸与过量Cu反应,转移的电子数大于0.6N AC.常温下,1 L 0.5 mol·L-1 CH3COONH4溶液的pH=7,溶液中的N H4+数小于0.5N AD.在铁上镀锌,当电路中通过的电子数为2N A时,电解质溶液质量减小65 g3.(广东汕头高三期末)芬顿法常用于废水的处理,反应原理为NH4OCN+3H2O2N2↑+CO2↑+5H2O,设N A为阿伏加德罗常数的值,下列有关说法正确的是( )。
A.H2O2只存在极性共价键B.18 g H2O中含有中子数目为10N AC.标准状况下,22.4 L CO2中含有σ键数目为2N AD.1 mol NH4OCN参与反应时转移电子数为3N A4.设N A表示阿伏加德罗常数的值,下列说法正确的是( )。
A.100 g含甲酸 46%的水溶液中含氧原子数为2N AB.标准状况下2.24 L Cl2完全溶于水时,转移电子数为0.1N AC.46 g C2H6O分子中含极性键数目一定是7N AD.78 g Na2S和Na2O2含有阴离子的数目为N A5.已知N A为阿伏加德罗常数的值,下列说法正确的是( )。
A.32 g Cu与S完全反应,转移电子数为0.5N AB.常温常压下,22.4 L C2H6含有电子数为18N AC.0.5 mol NaHSO4晶体中含SO42-数为0.5N AD.密闭容器中1 mol H2与1 mol I2反应,生成HI的分子数为2N A6.(广东汕尾高三期末)中国的酒文化源远流长,酿酒的转化过程如下:淀粉葡萄糖乙醇。
高考化学二轮复习训练:专题二 化学用语及常用计量 含答案

专题二化学用语及常用计量1.对下列化学用语的理解正确的是()A.原子结构示意图:可以表示12C,也可以表示14CB.比例模型:可以表示二氧化碳分子,也可以表示水分子C.电子式:可以表示羟基,也可以表示氢氧根离子D.分子式C2H4O2:可以表示乙酸,也可以表示乙二醇2.下列微粒中,对水的电离平衡不产生影响的是() A. B.C.26R3+D.3.下列化学用语或名称正确的是()A.S原子的结构示意图:B.乙酸乙酯的结构简式:CH3CH2COOCH2CH3C.CH4Si的结构式:D.的名称:2-甲基乙醇4.下列有关化学用语,表达正确的是()A.Na2S的电子式:B.铯-137:137CsC.O2-的结构示意图:D.乙烯分子的球棍模型:5.设N A为阿伏加德罗常数的数值,下列说法正确的是(相对原子质量:H 1 C 12)() A.常温下,30 g C2H6中含有4N A个C—H键B.1 mol Cl2与足量NaOH溶液反应,转移2N A个电子C.0.1 mol·L-1 Na2CO3溶液中含有0.2N A个Na+D.标准状况下,22.4 L CO和CO2的混合气体中含有N A个碳原子6.设N A为阿伏加德罗常数的数值,下列说法正确的是() A.常温常压下,22.4 L CH4中含有4N A个C—H键B.0.5 mol·L-1 FeCl3溶液中含有1.5N A个Cl-C.20 g重水(D2O)所含的电子数为8N AD.48 g O3气体含有3N A个O原子7.N A表示阿伏加德罗常数,下列叙述正确的是() A.等物质的量的N2和CO所含分子数均为N AB.3.4 g NH3中含N—H键数目为0.2N AC.标准状况下的22.4 L辛烷完全燃烧,生成CO2分子数为8N AD.Na2O2与足量H2O反应生成0.2 mol O2,转移电子的数目为0.4N A8.设N A为阿伏加德罗常数,下列说法不正确的是() A.1.5 mol NO2与足量的H2O反应,转移的电子数为N AB.常温常压下,0.5N A个CO2分子质量为22 gC.28 g氮气所含的原子数目为N AD.在标准状况下,0.5N A个氯气分子所占体积是11.2 L9.设N A为阿伏加德罗常数的值,下列叙述正确的是() A.0.5 mol过氧化钠含有N A个阴离子B.16 g O2和O3的混合气体中含有的原子数为N AC.在1 L 0.1 mol·L-1碳酸钠溶液中,CO2-3总数等于0.1N AD.58.5 g的氯化钠固体中含有N A个氯化钠分子10.(Ⅰ)在室温下,向某一容积固定的真空容器内充入丁烷(气)和氧气,使容器内混合气的总压强达到p1,点火燃烧,氧气反应完全,冷却至室温后容器内气体的总压强为p2。
高考化学二轮复习 专题二 化学计量配套作业

专题二化学计量1 2 3 4 5 6 7 8一、单项选择题1.设N A为阿伏加德罗常数,下列叙述正确的是( )A.24 g镁的最外层电子数为N AB.1 L 0.1 mol·L-1乙酸溶液中H+数为0.1N AC.1 mol甲烷分子所含质子数为10N AD.标准状况下,22.4 L乙醇的分子数为N A解析:A项,镁的最外层电子数为2,故错;B项,乙酸为弱电解质,部分电离,H+小于0.1N A,故错;C项,CH4的质子数为10,故正确;D项,乙醇标准状况下不是气体,故错。
答案:C2.设N A代表阿伏加德罗常数(N A)的数值,下列说法正确的是( )A.1 mol硫酸钾中阴离子所带电荷数为N AB.乙烯和环丙烷(C3H6)组成的28 g混合气体中含有3N A个氢原子C.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为N AD.将0.1 mol氯化铁溶于1 L水中,所得溶液含有0.1N A Fe3+解析:K2SO4中阴离子为硫酸根,1 mol硫酸根所带电荷为2 mol,A项错误。
乙烯和C3H6的最简式相同均为CH2,28 g混合气体有2 mol CH2,所以含4 mol H原子,B项错误。
Fe3+在溶液中发生水解,0.1 mol FeCl3+的物质的量要小于0.1 mol,D项错误。
3溶液中,Fe答案:C3.设N A代表阿伏加德罗常数(N A)的数值,下列说法正确的是( )A.22.4 L Cl2中含有N A个Cl2分子B.1 L 0.1 mol·L-1Na2SO4溶液中有0.1N A个Na+C.1 mol H2与1 mol Cl2反应生成N A个HCl分子D.1 mol Ca变成Ca2+时失去的电子数为2N A解析:A选项没有指出条件是否为标准状况;B选项中Na+的物质的量为0.2 mol,因此Na+应为0.2N A个;C选项中H2和Cl2反应的化学方程式为H2+Cl2===2HCl,因此1 mol H2与1 mol Cl2反应生成2N A个HCl分子;D选项中Ca失电子的反应为Ca-2e-===Ca2+,因此1 mol Ca失去2N A个电子数变成Ca2+,故D项正确。
高考化学二轮复习限时集训 专题2化学常用计量练习卷
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
③请计算需用托盘天平称取固体NaOH的质量为________g。某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图中可以看出,烧杯的实际质量为________g。
C.分液操作时,由于分液漏斗下端已沾满下层液体,故上层液体要从上口倒出
D.用托盘天平称量11.74 g氯化钠晶体
E.用结晶法分离硝酸钾和氯化钠的混合物
(2)实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
①如图所示的仪器中配制溶液肯定不需要的是________(填序号);配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
B.标准状况下,22.4 L四氯化碳中所含有的共价键数目为4NA
C.将1 mol FeCl3转化为氢氧化铁胶体,得到的氢氧化铁胶体粒子数小于NA
D.常温常压下,33.6 L氯气与56 g铁充分反应,转移的电子数为3NA
详细信息
8. 难度:中等
设NA表示阿伏加德罗常数的值,下列说法正确的是()
A.46 g有机物C2H6O中含有的H—O键的数目为NA
(1)实验Ⅰ中,“一系列操作”依次为________、________和过滤,要检验FeSO4溶液中是否含有Fe3+常用的试剂是________。
(2)实验Ⅱ中,选择的装置是A接________接________(填代号),A装置中未使用分液漏斗的理由是____________________________________________________________
高考化学二轮总复习课后习题版 专题二 化学计量及其应用
专题二化学计量及其应用A组基础巩固练1.(四川南充适应性考试)N A是阿伏加德罗常数的值,下列说法正确的是( )A.相同条件下,质量相等的CO和CO2所含的氧原子数目之比为11∶7B.1 mol Li3N与过量水反应收集的气态氨分子数目为N AC.Na2CO3溶液中Na+和C O32-个数比为2∶1D.标准状况下,1 mol N2和O2的混合气体的总体积约为22.4 L2.(贵州遵义二模)设N A是阿伏加德罗常数的值,下列说法错误的是( )A.1 mol C5H12含有极性共价键的数目为12N AB.标准状况下,4.48 L NO2中原子数为0.6N AC.标准状况下,0.2 mol D2O与HF的混合物中电子数为2N AD.1 L 0.1 mol·L-1的Na2CO3溶液中Na+有0.2N A个3.(北京石景山一模)下列说法正确的是( )A.室温下,pH相同的盐酸和醋酸溶液的溶质的物质的量浓度相同B.等物质的量的Na2O和Na2O2含有相同数目的离子C.同温同压下,O2和O3的密度相同D.0.5 mol·L-1 Na2SO4溶液中约含有3.01×1023个Na+4.(福建四地市第一次质检)火箭采用偏二甲肼和四氧化二氮作为推进剂,发生如下反应:(CH3)2N—NH2+2N2O42CO2+4H2O+3N2。
设N A表示阿伏加德罗常数的值,下列叙述正确的是( )A.60 g偏二甲肼中含有的共价键数目为10N AB.44 g C18O2所含质子数为22N AC.上述反应生成1 mol CO2转移的电子数为8N AD.22.4 L N2所含分子数为N A5.(安徽师大附中月考)下图是配制450 mL 1.00 mol·L-1 NaOH溶液的一般步骤示意图,下列说法正确的是( )A.图①中应称得NaOH 18.0 gB.未进行④和⑤的操作,所配溶液浓度将偏大C.定容后把容量瓶倒置摇匀,正立后发现液面低于刻度线不必再加水至刻度线D.步骤②后应将溶液立即转移到容量瓶中,防止药品变质6.(辽宁抚顺一模)设N A表示阿伏加德罗常数的值,下列说法正确的是( )A.6.4 g CH4O中含有的碳氢键数目为0.8N AB.过氧化钠与水反应时,每生成0.1 mol氧气转移的电子数为0.2N AC.标准状况下,2.24 L HCl气体中含有的H+数目为0.1N AD.1 mol硅中含有的共价键数目为4N A7.(辽宁抚顺一模)常温下,向100 mL 1.0 mol·L-1 Na2C2O4溶液中加入足量pH=1的稀硫酸,再加入20 mL KMnO4溶液恰好完全反应。
高考化学二轮复习提分训练 专题2化学常用计量练习卷
高考化学二轮复习提分训练专题2化学常用计量练习卷一、选择题详细信息1.难度:中等下列说法中正确的是()A.2 mol CH4的质量和O2的摩尔质量都是32 gB.1 mol任何气体中都含有相同的原子数C.0.5 mol NaCl约含有6.02×1023个离子D.1 mol·L-1 KCl溶液中含有溶质1 mol详细信息2.难度:中等下列说法正确的是()。
A.分子数不同的CO与N2的体积一定不等B.体积相同的CO与N2的质量一定相等C.质量相同、密度不同的CO与N2所含的原子数目一定相等D.质量不同、密度相同的CO与N2所含分子数可能相同详细信息3.难度:中等)。
设NA为阿伏加德罗常数的值,下列说法正确的是(A.某温度下,1 L pH=8的纯水中含OH-为10-8N AB.14 g分子通式为C n H2n的链烃中含有的C=C键数目为N AC.标准状况下,22.4 L Cl2与足量Fe反应,转移的电子数为3N AD.常温下,1 L 0.1 mol·L-1 CH3COONa溶液中含有的Na+和CH3COO-总数为0.2N A详细信息4.难度:中等设N)。
A表示阿伏加德罗常数的值,下列叙述正确的是(A.10 g氖气中所含的原子数为N AB.9 g重水含有的电子数为5 N AC.标准状况下,将22.4 L氯化氢气体溶于足量水中,溶液中含有的氯化氢分子数为N AD.常温常压下,22 g CO2中含有N A个C=O键详细信息5.难度:中等某溶液中大量存在以下浓度的五种离子:0.2 mol·L-1 Cl-、0.4 mol·L-1 SO42-、0.1 mol·L-1 Al3+、0.3 mol·L-1 H+、M,则M及其物质的量浓度可能为()。
A.Na+0.3 mol·L-1 B.Zn2+0.2 mol·L-1C.CO32-0.2 mol·L-1 D.Ca2+0.1 mol·L-1详细信息6.难度:中等)。
高考化学二轮复习技能强化专练二化学常用计量
项,乙烯的结构式为,28
如图,抽去右图所示装置中的玻璃片,使两种气本充分反应(整个过程中认为装置气密性良好
)。
(5)
项符合题意;转移时部分溶液溅出容量瓶,使溶质损项符合题意;加水时溶液凹液面高于容量瓶刻度线,说明所配溶液体积偏大、浓
.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器.容量瓶用蒸馏水洗净后,要烘干才能用于溶液的配制
来配制可能会导致结果偏低
143 g
pH________7(填“>”“<”或“=”)。
________ g。
________氯化钠的溶解度(
H2-3+
50 g。
(3)根据溶解度曲线,大于
的溶解度受温度的影响很大,
点剩余固体的化学成分为______(填化学式)。
试写出
________________________________________________________________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
精校Word文档,欢迎下载使用!
1
考向一 有关阿伏加德罗常数的多角度判断
1.(2018·全国卷Ⅱ)NA代表阿伏加德罗常数的值。下列说法正确
的是( )
A.常温常压下,124 g P4中所含P—P键数目为4NA
B.100 mL 1 mol·L-1 FeCl3溶液中所含Fe3+的数目为0.1NA
C.标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D.密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为
2NA
[解析] A项,124 g P
4是1 mol,所含P—P键的数目是6NA
;B
项,由于Fe3+水解,所含Fe3+数目小于0.1NA;C项,一个甲烷和
一个乙烯分子中都含有4个H原子,标准状况下11.2 L混合气体为
0.5 mol,故混合气体中的氢原子数为2N
A;D项,SO2与O2
的反应
属于可逆反应,生成的SO3不是2 mol。
[答案] C
2.(2017·全国卷Ⅱ)阿伏加德罗常数的值为NA。下列说法正确的
是( )
A.1 L 0.1 mol·L-1 NH4Cl溶液中,NH+4的数量为0.1NA
B.2.4 g Mg与H2SO4完全反应,转移的电子数为0.1NA
C.标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA
D.0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总
数为0.2NA
[解析] A项,因铵根离子水解,其数量小于0.1N
A
,错误;B
精校Word文档,欢迎下载使用!
2
项,2.4 g Mg为0.1 mol,与硫酸完全反应后转移的电子数为0.2NA,
错误;C项,标准状况下,2.24 L任何气体所含有的分子数都为0.1NA,
错误;D项,H
2(g)+I2
(g)2HI(g),反应前后气体物质的量不变,
正确。
[答案] D
3.(2017·全国卷Ⅲ)NA为阿伏加德罗常数的值。下列说法正确的
是( )
A.0.1 mol的11B中,含有0.6NA个中子
B.pH=1的H3PO4溶液中,含有0.1NA个H+
C.2.24 L(标准状况)苯在O2中完全燃烧,得到0.6NA个CO2分
子
D.密闭容器中1 mol PCl3与1 mol Cl2反应制备PCl5(g),增加
2NA个P—Cl键
[解析] A项,硼原子的质子数为5,11B的中子数为6,故0.1 mol
的11B中含有中子数为0.6NA,正确;B项,未指明溶液体积,无法
计算H+的个数,错误;C项,标准状况下苯为液体,故2.24 L(标准
状况)苯的物质的量不为0.1 mol,生成的CO2分子也不是0.6NA,错
误;D项,PCl3+Cl2PCl5,这是一个可逆反应,1 mol PCl3与1 mol
Cl
2不可能完全反应生成1 mol PCl5
,故增加的P—Cl键数目小于
2N
A
,错误。
[答案] A
4.(2016·全国卷Ⅰ)设NA为阿伏加德罗常数值。下列有关叙述
精校Word文档,欢迎下载使用!
3
正确的是( )
A.14 g乙烯和丙烯混合气体中的氢原子数为2NA
B.1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C.1 mol Fe溶于过量硝酸,电子转移数为2NA
D.标准状况下,2.24 L CCl4含有的共价键数为0.4NA
[解析] A项,乙烯和丙烯的最简式均为CH2,14 g乙烯和丙烯混
合气体中相当于含有1 mol CH2,则其氢原子数为2NA,正确;B项,
合成氨的反应是可逆反应,则1 mol N2与4 mol H2反应生成的NH
3
分子数小于2NA,错误;C项,铁和过量硝酸反应生成硝酸铁,故1 mol
Fe溶于过量硝酸,电子转移数为3N
A,错误;D项,标准状况下CCl4
为液态,故2.24 L CCl4的物质的量不是0.1 mol,则其含有的共价键
数不是0.4NA,错误。
[答案] A
考向二 溶液配制过程中仪器使用及过程分析
5.判断下列说法是否正确,正确的打“√”,错误的打“×”
(1)(2017·全国卷Ⅲ改编)取20.00 mL盐酸,可在50 mL酸式滴定
管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形
瓶( )
(2)(2016·浙江卷)为准确配制一定物质的量浓度的溶液,定容过
程中向容量瓶内加蒸馏水至接近刻度线时,改用胶头滴管滴加蒸馏水
至刻度线( )
(3)(2016·海南卷)向容量瓶转移液体时,引流用的玻璃棒可以接
触容量瓶刻度线以下内壁( )
精校Word文档,欢迎下载使用!
4
[答案] (1)× (2)√ (3)√
考向三 以物质的量为中心的计算
6.(1)(2017·全国卷Ⅱ)草酸钙沉淀经稀H2SO4处理后,用KMnO
4
标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为:
MnO-4+H++H2C2O4―→Mn2++CO2↑+H2O。实验中称取0.400 g
水泥样品,滴定时消耗了0.0500 mol·L-1的KMnO4溶液36.00 mL,
则该水泥样品中钙的质量分数为________。
(2)(2016·全国卷Ⅰ)“有效氯含量”可用来衡量含氯消毒剂的消
毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的
氧化能力。NaClO2的有效氯含量为________。(计算结果保留两位小
数)
(3)(2016·全国卷Ⅱ)联氨可用于处理高压锅炉水中的氧,防止锅
炉被腐蚀。理论上1 kg的联氨可除去水中溶解的O2________kg。
[解析] (1)5Ca2+~5H2C2O4~2KMnO4,n(KMnO4)=0.0500
mol/L×36.00 mL×10-3 L·mL-1=1.80×10-3 mol,n(Ca2+)=
4.50×10-3 mol,水泥中钙的质量分数为
4.50×10-3 mol×40.0 g/mol
0.400 g
×100%=45.0%。
(2)NaClO
2在杀菌消毒的过程中被还原为Cl-,则1 mol NaClO2
得到电子的物质的量为4 mol,1 mol Cl2被还原为Cl-时得到电子的物
质的量为2 mol,故1 g NaClO2得到电子的物质的量为4/90.5 mol,
根据“有效氯含量”的定义可知,NaClO2的有效氯含量为1.57。
(3)联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀,发生的
精校Word文档,欢迎下载使用!
5
反应为N2H4+O2===N2+2H
2
O,理论上1 kg的联氨可除去水中溶解
的氧气为1 kg÷32 g·mol-1×32 g·mol-1=1 kg。
[答案] (1)45.0% (2)1.57 (3)1
题型特点:选择题 填空题
考向评析:阿伏加德罗常数主要考查判断分子、原子、离子、电
子等微粒数目,如物质所含粒子数目、转移电子数目、水解或电离造
成离子浓度改变或数目变化等,形式灵活、范围广泛;溶液的配制主
要考查仪器的使用及误差分析;而Ⅱ卷中的计算则以含量的测定、化
学式的确定等,主要是通过方程式(一个或多个)完成计算。
答题启示:二轮复习时,对于阿伏加德罗常数判断类题目应注意
隐含条件的挖掘,而Ⅱ卷计算应注重计算技巧(如关系式法)的灵活运
用,加强计算能力的培养。
